直链淀粉/大豆卵磷脂包合物的制备及其性质研究
2017-01-13王萍萍罗志刚
王萍萍,李 弘,谭 森,罗志刚
(华南理工大学食品科学与工程学院,广东广州 510640)
直链淀粉/大豆卵磷脂包合物的制备及其性质研究
王萍萍,李 弘,谭 森,罗志刚*
(华南理工大学食品科学与工程学院,广东广州 510640)
目的:为了制备直链淀粉-大豆卵磷脂包合物并优化包合工艺以及对制得的直链淀粉包结络合大豆卵磷脂样品的结构性质进行分析研究。方法:本文以木薯淀粉为原料,加入普鲁兰酶酶解制备直链淀粉;在酶解后的淀粉中加入大豆卵磷脂溶液,制备直链淀粉-大豆卵磷脂包合物;通过单因素实验考察大豆卵磷脂的添加量、反应时间、反应温度对直链淀粉包结络合大豆卵磷脂反应效率的影响,采用X-射线衍射(XRD)、傅立叶变换红外光谱(FT-IR)、13C固体核磁共振谱(13C CP/MAS NMR)和差示扫描量热法(DSC)表征其结构。结果:直链淀粉-大豆卵磷脂包合工艺的最佳条件为:每克木薯干基淀粉添加0.16 g大豆卵磷脂,反应时间2 h,反应温度60 ℃。在最佳条件下得到包合物中大豆卵磷脂的含量为116.28 mg/g,包合率达到63.02%。XRD、FT-IR、DSC结果表明直链淀粉与大豆卵磷脂发生了包结络合作用,13C CP/MAS NMR结果表明是与大豆卵磷脂上的脂肪酸烃基发生了包结络合,大豆卵磷脂分子的其他基团位于直链淀粉螺旋空腔的外部。
直链淀粉,大豆卵磷脂,酶解,包合物
直链淀粉是以α-1,4糖苷键连接α-D-吡喃葡萄糖形成直线链状分子,外观表现为右手螺旋结构,每个节距由6个葡萄糖单元组成,螺旋内部只含氢原子,表现为亲油性,具有疏水性作用,同时在螺旋空腔的外侧含有羟基结构,表现为亲水性[1]。直链淀粉含有一个内侧疏水的螺旋腔体结构,螺旋空腔具有捕获客体分子的能力,在一定程度上可以和许多其他的分子如醇类、配合物[2]、芳香类化合物或者表面活性剂形成复合物。直链淀粉在溶液中形成单螺旋链,并作为一种主体分子通过疏水相互作用与各种疏水性客体分子发生包结络合作用。根据研究报道,直链淀粉可以和正辛醇、正己醇[3]、萘酚[4]、单甘酯[5]、硬脂酸[6]、油酸[7-8]等形成配合物结构,利用直链淀粉包结络合作用制备各种新材料如生物材料、光学材料、物理交联凝胶、自组装膜等,是一个新兴的、值得关注的研究领域。
大豆卵磷脂具有延缓衰老[9]、健脑益智、提高脑活力[10]、调血脂[11]、防动脉硬化、美容养颜等功能,广泛应用于食品、化妆品等其他行业中。卵磷脂产品具有易吸潮、易被氧化、不易溶解、粘结、不易分散的缺点,因此将大豆卵磷脂包埋,能够使之与不良的外界环境隔绝,最大限度地保持其原有的色、香、味、性能和生理活性,防止其营养物质的破坏和损失。徐井水[12]等以大豆分离蛋白、明胶和麦芽糊精为壁材采用喷雾干燥法制备大豆卵磷脂微胶囊,前人有用过-环糊精、多孔淀粉-明胶和麦芽糊精-大豆分离蛋白[13]等壁材包埋大豆卵磷脂,但是会存在包埋率不高、实验过程所用试剂不环保等问题。本研究采用脱支酶酶解木薯淀粉制备直链淀粉,利用其特殊的结构包结络合大豆卵磷脂,没有用到二甲基亚砜等有毒试剂,系统探讨各相关因素如反应温度、底物配比、反应时间等对包合物中大豆卵磷脂含量及包埋率的影响规律,并对其结构进行鉴定,为工业化应用提供理论指导。
1 材料与方法
1.1 材料与仪器
木薯淀粉 泰华集团;普鲁兰酶 酶活力1000 ASPU/g,杰能科生物工程有限公司;大豆卵磷脂 上海源聚生物科技有限公司;盐酸 广州市东红化工厂;磷酸盐缓冲液 北京生物制品研究所;浓硝酸 广州市东红化工厂;高氯酸 天津市鑫源化工有限公司;硫酸 广州市东红化工厂;钼酸钠 天津市化学试剂四厂;磷酸二氢钾 天津市科密欧化学试剂有限公司;抗坏血酸 国药集团化学试剂有限公司。实验过程中用到的试剂都是分析纯。
PHS-25型数显酸度计 上海精科仪器有限公司;HH-2型数显恒温水浴锅 常州澳华仪器有限公司;JB90-D型强力电动搅拌机 上海标本模型厂;BC/BD-519HAN型冷柜 青岛海尔集团;DL-50型离心机 上海安亭科学仪器厂;DHG-9140A型电热鼓风干燥箱 上海一恒科学仪器有限公司;FW-100型万能粉碎机 天津市泰斯特仪器有限公司;TU-1901型紫外可见分光光度计 北京普析通用仪器有限公司;DL-50型离心机 上海安亭科学仪器厂;VECTOR 33型傅立叶变换红外光谱仪 德国Bruke公司;D8 ADVANCE型X-射线衍射仪 德国Bruke公司;AVANCE AV 400型傅立叶变换核磁共振谱仪 德国Bruker公司。
1.2 实验方法
1.2.1 木薯淀粉的酶解 称取50 g木薯淀粉(干基量),加入定量去离子水配成10%(g/g)淀粉乳。然后用0.4 mol/L HCl溶液把pH调到4.5,用玻璃棒搅拌均匀,在99.9 ℃下恒温搅拌1 h。淀粉完全糊化之后将温度降到60 ℃,加入0.5 g普鲁兰酶(10 ASPU/g),酶解4 h后,再将温度升到99.9 ℃保持10 min,使酶失活,即得到未包合的木薯直链淀粉溶液。
1.2.2 木薯直链淀粉包结络合大豆卵磷脂 称取一定大豆卵磷脂,用磷酸缓冲液将其配制成浓度为10%的溶液,然后将其与1.2.1中制备得到的木薯直链淀粉溶液混合均匀。一定温度下恒温搅拌反应一定时间;缓慢冷却到室温,在4 ℃的冰箱中冷藏18 h,在500 r/min条件下离心10 min、用75%乙醇对底物进行洗涤、冷冻干燥48 h、称重、粉碎后过100目筛,即可得淡黄色粉末状样品。同时按上述方法做空白实验(空白实验除了没有加入大豆卵磷脂,其余条件同上),制得未包合木薯直链淀粉(URCA)。在进行优化工艺实验时,为了探究大豆卵磷脂添加量对大豆卵磷脂含量和包合率的影响,控制反应温度为60 ℃,反应时间2 h,大豆卵磷脂添加量6、8、10、12 g(每50 g干基木薯淀粉中的添加量);为了探究反应时间对包合物中大豆卵磷脂含量和包合率的影响,控制反应温度为60 ℃,大豆卵磷脂添加量8 g,反应时间1、2、3、4 h;为了探究反应温度对包合物中大豆卵磷脂含量和包合率的影响,控制反应时间为2 h,大豆卵磷脂添加量8 g,反应温度50、60、70、80 ℃。
1.2.3 包合物中大豆卵磷脂含量的测定 采用钼蓝分光光度法测大豆卵磷脂含量[14-15]。实验原理以及溶液配制参照文献,包合物中卵磷脂含量以及大豆卵磷脂包合率计算公式如下。
卵磷脂含量X=(C1×V3×V1×N×25)/(m0×V2)
式(1)
式中:X-每克样品中的大豆卵磷脂含量(mg/g);C1-从标准曲线计算出样品液中的磷含量(mg/mL);V3-样品显色定容后的总体积(mL);V1-样品消化定容后的总体积(mL);N-消化液定容后的稀释倍数;m0-样品质量(g);V2-从V1中吸取的样品体积(mL);25-指磷换算成大豆卵磷脂的系数。
大豆卵磷脂的包合率
Y=(m1×X×100%)/(m2×1000)
式(2)
式中:Y-大豆卵磷脂包合率(%);m1-包合物的质量(g);X-每克样品中大豆卵磷脂的含量(mg/g);m2-反应时加入大豆卵磷脂的质量(g)。
1.2.4 X-射线衍射(XRD)测试条件 测试方法采用粉末衍射法,测试条件:铜靶,入射线波长0.15418 nm,Ni滤波片,管压40 kV,管流40 mA,扫描步长0.02度,扫描速度19.2 s/步;狭缝DS=1°;RS=8 mm(对应LynxExe阵列探测器)[16]。
1.2.5 傅立叶变换红外光谱(FT-IR)测试条件 测试方法采用KBr压片法,制样方法及测试条件:称取约2 mg样品,在红外灯下,加入少量干燥的KBr粉末混匀并研磨,装入压片模具中抽真空压制成片,进行红外光谱扫描;测试条件:分辨率2 cm-1,扫描范围400~4000 cm-1[17]。
1.2.6 固体核磁共振(13C CP/MAS NMR)测试条件 测试采用4 mm MAS探头,测试条件:使用频率400 MHz,转速6000 r/min,脉冲序列为cptoss,采样时间为17 ms,延迟时间2 s,谱宽为295.8 ppm,温度为室温[15]。
1.2.7 差示扫描量热(DSC)测试条件 测试条件:气氛N2,测试范围30~400 ℃,升温速率10 ℃/min[18]。
1.3 数据处理
用软件Origin8.0进行绘图,用SPSS软件分析数据,采用Duncan’s法进行方差分析。每组数据测定三次取其平均值。
2 结果与分析
2.1 大豆卵磷脂添加量对包合物中大豆卵磷脂的含量和包合率的影响
由图1可知,大豆卵磷脂含量随着大豆卵磷脂添加量的增加而增加,而当大豆卵磷脂的添加量高于8 g时,包合物中大豆卵磷脂含量趋于稳定;当大豆卵磷脂的添加量为8 g时,大豆卵磷脂的包合率为63.02%,继续增加大豆卵磷脂添加量为10 g时,大豆卵磷脂包合率大幅度降低。综合考虑大豆卵磷脂含量和包合率变化情况,大豆卵磷脂的最适添加量为8 g。
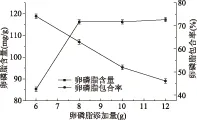
图1 大豆卵磷脂添加量对大豆卵磷脂含量和包合率的影响Fig.1 The influence of soy lecithin addition to soybean lecithin content and the inclusion rate
2.2 反应时间对包合物中大豆卵磷脂含量和包合率的影响
由图2可知,在反应2 h之前的阶段,包合物中大豆卵磷脂的含量及包合率随着反应时间延长迅速升高,当反应的时间超过2 h后,包合物中大豆卵磷脂的含量及包合率随着反应时间的延长反而有所降低,这可能是直链淀粉与环糊精包埋客体分子相似,都能作为一种主体分子,与客体分子发生作用,直链淀粉包结络合客体分子的作用,也是其中的客体分子“进”、“出”主体分子直链淀粉的动态过程,反应时间超过2 h,会导致卵磷脂的含量和包合率降低。综上所述,选择2 h为最佳反应时间。

图2 反应时间对包合物中大豆卵磷脂含量和包合率的影响Fig.2 The influence of reaction time to soy lecithin content and inclusion rate
2.3 反应温度对包合物中大豆卵磷脂含量和包合率的影响
由图3可知,反应温度对大豆卵磷脂含量及包合率的影响很大。当反应温度低于60 ℃时,大豆卵磷脂含量及包合率随着反应温度的升高迅速增加,当反应温度升高到60 ℃时达到最大,大豆卵磷脂含量和包合率分别为116.28 mg/g和63.02%。这可能是因为,反应体系内分子随着反应温度的升高扩散速度加快,从而促进了直链淀粉包结络合大豆卵磷脂。当温度超过60 ℃后,大豆卵磷脂含量和包合率随着温度的升高而明显降低。这是因为,当反应温度超过60 ℃后,由于大豆卵磷脂不耐高温,一部分的大豆卵磷脂被氧化而分解,Wang等[18]在环糊精和大豆卵磷脂的包结络合研究中发现了类似的实验结果。
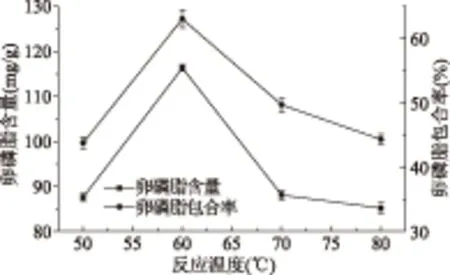
图3 反应温度对包合物中大豆卵磷脂含量和包合率的影响Fig.3 The influence of reaction temperature to soy lecithin content and inclusion rate
2.4 X-射线衍射光谱分析
如图4所示URCA在2θ为5.6°、17.2°、22.0°和24.0°处存在明显衍射峰,为典型的B型结晶结构。大豆卵磷脂的X-射线衍射图谱仅在2θ为20.0°附近出现一个很宽的圆晕峰,说明大豆卵磷脂是以一种无定型态存在[19]。URCA/大豆卵磷脂物理混合物(大豆卵磷脂含量11.628%)的X-射线衍射图谱为URCA和大豆卵磷脂的简单叠加,在保留URCA的B型结晶结构的同时,也显现出大豆卵磷脂X-射线衍射图谱的特征。在木薯直链淀粉/大豆卵磷脂包合物(大豆卵磷脂含量11.628%)的X-射线衍射图谱中,在2θ为7.1°、13.0°、19.8°处出现明显衍射峰,为直链淀粉典型的V型结构[16,20-21],说明大豆卵磷脂被木薯直链淀粉包结络合。
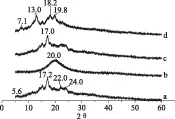
图4 X-射线衍射图谱 Fig.4 X ray diffractionatlas注:(a)未包合木薯直链淀粉(URCA);(b)大豆卵磷脂;(c)URCA/大豆卵磷脂物理混合物;(d)木薯直链淀粉/大豆卵磷脂包合物。
2.5 红外光谱分析
如图5所示,在URCA的红外光谱图中3439 cm-1处是O-H的伸缩振动峰,2927 cm-1处是饱和C-H的伸缩振动峰,1649 cm-1处是O-H的弯曲振动峰,在1159、1081、1019 cm-1处的三个吸收峰分别是伯醇、仲醇、叔醇的C-O伸缩振动和C-C骨架振动吸收峰。在大豆卵磷脂的红外光谱中,在1739 cm-1处有个明显的C=O伸缩振动峰。在URCA/大豆卵磷脂物理混合物(大豆卵磷脂含量11.628%)中也出现这一明显伸缩振动峰[15]。在木薯直链淀粉/大豆卵磷脂包合物(大豆卵磷脂含量11.628%)中,在1739 cm-1处的吸收峰消失,说明大豆卵磷脂被木薯直链淀粉包结络合。
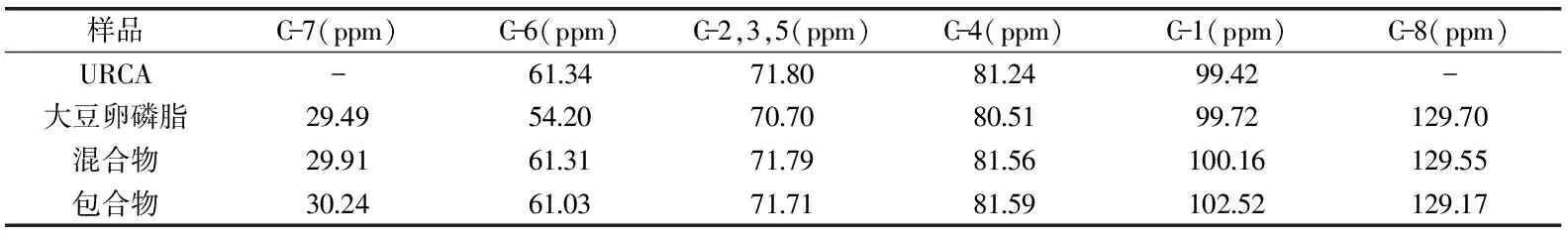
表1 13C固体核磁共振数据
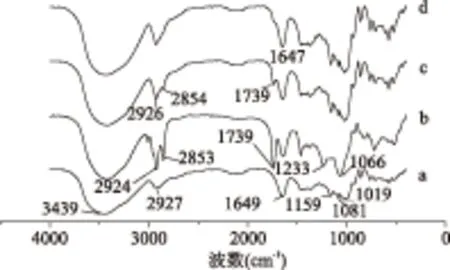
图5 红外光谱Fig.5 FT-IR注:(a)URCA;(b)大豆卵磷脂;(c)URCA/大豆卵磷脂物理混合物;(d)木薯直链淀粉/大豆卵磷脂包合物。
2.613C固体核磁共振谱分析
图6是直链淀粉与大豆卵磷脂的分子结构图,表1中的数据是图6中各吸收峰的位置。

图6 13C固体核磁共振图谱Fig.6 13C solid state nuclear magnetic resonance(CP/MAS NMR)注:(a)URCA;(b)大豆卵磷脂;(c)URCA/大豆卵磷脂物理混合物(大豆卵磷脂含量11.628%);(d)木薯直链淀粉/大豆卵磷脂包合物(大豆卵磷脂含量11.628%)。
由表1和图6可知,在图6(a)URCA曲线上,木薯直链淀粉葡萄糖单元上的C-1,C-4,C-2,3,5和C-6的吸收峰分别在99.42、81.24、71.80、61.34 ppm处[22-23]。在混合物的NMR图谱中在29.91 ppm和129.55 ppm处对应的是大豆卵磷脂的烃基C和羰基C[24-25]。包合物的NMR图是明显的V型结晶结构[22,26],其中包合物的C-4吸收峰的强度相对于未包合直链淀粉明显向低场移动了0.35 ppm,相对于混合物C-4吸收峰也向低场移动了0.03 ppm,C-1吸收峰相对于混合物变的尖锐且向低场移动了2.36 ppm。C-1峰位和峰型与C-4位的峰位和峰型都发生了明显变化,由于直链淀粉是以α-1,4键连接到一起的,C-1和C-4的变化进一步说明直链淀粉的分子构象发生变化和扭曲[22]。在包合物的NMR图谱中的30.24 ppm和129.17 ppm处出现烃基碳和羰基碳吸收峰,然而与物理混合物相比包合物中的C-7烃基碳吸收峰向高场移动0.33 ppm。Snape等[26]在直链淀粉包结络合大豆卵磷脂一文中也发现类似结果,这是由于直链淀粉与客体分子发生包结络合作用使客体分子构象发生变化。根据Snape等[26]的实验结果,所有比羧基基团更大的极性基团一定位于螺旋空腔外部,因此,可以推断直链淀粉的螺旋空腔将大豆卵磷脂的脂肪酸烃基络合在里面,其他部分位于外面。
2.7 差示扫描量热法
URCA的热降解主要有两个阶段,在URCA的DSC曲线上90~110 ℃的吸热峰对应脱水吸热峰,在250~350 ℃是淀粉的热降解[27]。在图7(b)大豆卵磷脂DSC曲线中大豆卵磷脂的热降解在280~300 ℃[28-29]。在图7(c)URCA/大豆卵磷脂物理混合物(大豆卵磷脂11.628%)的DSC曲线是(a)和(b)的简单叠加。在图7(d)包合物曲线上融合了两者的吸收峰,URCA在278 ℃处淀粉的分解峰转移到283 ℃处,说明木薯直链淀粉和大豆卵磷脂发生相互作用,直链淀粉将客体分子大豆卵磷脂包结络合。
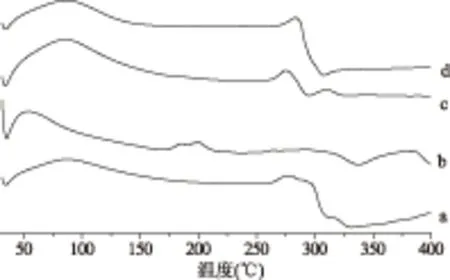
图7 差示扫描量热法图谱Fig.7 Differential scanning calorimetry注:(a)URCA;(b)大豆卵磷脂;(c)URCA/大豆卵磷脂物理混合物(大豆卵磷脂含量11.6279%);(d)木薯直链淀粉/大豆卵磷脂包合物(大豆卵磷脂含量11.6279%)。
3 结论
通过研究卵磷脂的添加量、反应时间和反应温度对木薯直链淀粉包结络合大豆卵磷脂的影响,得出最适包合率的反应条件为:大豆卵磷脂添加量为8 g,反应时间为2 h,反应温度为60 ℃。在最适包合率的条件下制得的木薯直链淀粉/大豆卵磷脂包合物中,大豆卵磷脂的含量为116.28 mg/g,卵磷脂的包合率达63.02%。并且采用X-射线衍射、傅立叶变换红外光谱、固体核磁共振和激光共聚焦显微镜检测技术对包合物的结构进行了研究。其结果共同表明,大豆卵磷脂确实已经被木薯直链淀粉包合,并且大豆卵磷脂只有部分基团被包合在螺旋空腔内。
[1]李本刚,张黎明. 直链淀粉包结络合作用[J]. 化学进展,2010,22(6):1161-1168.
[2]Biais B,Bail P L,Robert P,et al. Structural and stoichiometric studies of complexes between aroma compounds and amylose. Polymorphic transitions and quantication in amorphous and crystalline areas[J]. Carbohydrate Polymers,2006,66(3):306-315.
[3]刘延奇,吴史博,秦令祥,等. 配体对淀粉晶型结构的影响[J]. 粮食与饲料工业,2009,31(5):26-42.
[4]袁贵英,杨留枝,秦令祥,等. V-型直链淀粉-油酸复合物的制备及影响因素研究[J]. 食品科技,2011,36(6):262-268.
[5]刘延奇,郑苗苗,肖欣欣,等. 结晶温度对V-型直链淀粉-单甘酯复合物结构的影响研究[J]. 粮食与饲料工业,2011,33(10):22-25.
[6]刘延奇,肖欣欣,郑苗苗,等. V型直链淀粉-醇类复合物定性定量分析[J]. 食品工业科技,2012,33(4):132-134.
[7]Yamashita Y,K M O. Single crystals of amylase-V complexes Ⅱ. Crystals with 81 helical conguration[J]. Journal of Polymer Science,1971,9(8):1471-1481.
[8]林若慧,柴向华,吴克刚,等. 硬脂酸-直链淀粉复合物的制备工艺的研究[J]. 食品科技,2011,36(4):207-210.
[9]葛玉卿. 大豆磷脂酰胆碱的提取纯化研究[D]. 长沙:中南大学,2004.
[10]王成涛. 大豆磷脂制备高纯度磷脂酰胆碱的研究[D]. 郑州:河南工业大学,2010.
[11]罗珍. 磷脂酰胆碱的提取、纯化和分析研究[D]. 南昌:南昌大学,2006.
[12]徐井水,熊华,彭地纬,等. 微胶囊化大豆卵磷脂的制备[J]. 南昌:南昌大学,2010.
[13]陈昊,王英男,许慧,等. 几种微胶囊壁材对大豆卵磷脂包埋方法的对比研究[J]. 大豆通报,2007(5):24-26.
[14]张丽. 超临界二氧化碳精制大豆卵磷脂[D]. 沈阳:东北大学,2006.
[15]刘延奇,徐银龙. 直链淀粉磷脂复合物的制备及表征[J]. 食品科学,2013,34(22):336-340.
[16]Putseys J A,Lamberts L,Delcour J A. Amylose-inclusion complexes:formation,identity and physico-chemical properties[J]. Journal of Cereal Science,2010,51(3):238-247.
[17]Lu X,Luo Z,Yu S,et al. Lipase-catalyzed synthesis of starch palmitate in mixed ionic liquids[J]. Journal of Agricultural and Food Chemistry,2012,60(36):9273-9279.
[18]Wang X G,Luo Z G,Xiao Z G. Preparation,characterization,and thermal stability ofβ-cyclodextrin/soybean lecithin inclusion complex[J]. Carbohydrate Polymers,2014,101:1027-1032.
[19]Formariz T P,Chiavacci L A,Sarmento V,et al. Structural changes of biocompatible neutral microemulsions stabilized by mixed surfactant containing soya phosphatidylcholine and their relationship with doxorubicin release[J]. Colloids and Surfaces B:Biointerfaces,2008,63(2):287-295.
[20]Zabar S,Lesmes U,Katz I,et al. Structural characterization of amylose-long chain fatty acid complexes produced via the acidification method[J]. Food Hydrocolloids,2010,24(4):347-357.
[21]Lesmes U,Cohen S H,Shener Y,et al. Effects of long chain fatty acid unsaturation on the structure and controlled release properties of amylose complexes[J]. Food Hydrocolloids,2009,23(3):667-675.
[22]Gidley M J,Bociek S M. Carbon-13 CP/MAS NMR studies of amylose inclusion complexes,cyclodextrins,and the amorphous phase of starch granules:relationships between glycosidic linkage conformation and solid-state carbon-13 chemical shifts[J]. Journal of the American Chemical Society,1988,110(12):3820-3829.
[23]Lorentz C,Pencreac H G,Soultani-Vigneron S,et al. Coupling lipophilization and amylose complexation to encapsulate chlorogenic acid[J]. Carbohydrate Polymers,2012,90(1):152-158.
[24]Zabar S,Lesmes U,Katz I,et al. Studying different dimensions of amylase-long chain fatty acid complexes:Molecular,nano and micro level characteristics[J]. Food Hydrocolloids,2009,23(7):1918-1925.
[25]Morrison W R,Law R V,Snape C E. Evidence for inclusion complexes of lipids with V-amylose in maize,rice and oat starches[J]. Journal of Cereal Science,1993,18(2):107-109.
[26]Snape C E,Morrison W R,Maroto-Valer M M,et al. Solid state 13C NMR investigation of lipid ligands in V-amyloseinclusion complexes[J]. Carbohydrate Polymers,1998,36(2):225-237.
[27]Guinesi L S,Da Róz A L,Corradini E,et al. Kinetics of thermal degradation applied to starches from different botanical origins by non-isothermal procedures[J]. Thermochimica Acta,2006,447(2):190-196.
[28]Wang X,Luo Z,Xiao Z. Preparation,characterization,and thermal stability ofβ-cyclodextrin/soybean lecithin inclusion complex[J].Carbohydrate Polymers,2014,101:1027-1032.
[29]Cirri M,Maestrelli F,Mennini N,et al. Influence of the preparation method on the physical-chemical properties of ketoprofen-cyclodextrin-phosphatidylcholine ternary systems[J]. Journal of Pharmaceutical and Biomedical Analysis,2009,50(5):690-694.
Preparation and properties of amylose/soy lecithin inclusion complex
WANG Ping-ping,LI Hong,TAN Sen,LUO Zhi-gang*
(School of Food Science and Engineering,South China University of Technology,Guangzhou 510640,China)
Objective:In order to prepare amylose-soybean lecithin complex,optimize the inclusion process and study the structure and properties of the amylose-soybean lecithin complex. Method:This paper produced amylose by adding pullulanase with cassava starch as raw material. Soybean lecithin solution was added to the amylose,and the solution was stirred for preparing amylose soybean lecithin inclusion complexes at a certain temperature for certain time. Through the single factor experiment,the effects of soybean lecithin concentration,reaction time and temperature on reaction efficiency of amylose-soybean lecithin complex were studied and using XRD,FT-IR,13C CP/MAS NMR,DSC to characterize the structure. Result:The result showed that the optimum conditions for preparing amylose/soybean lecithin inclusion complexes were soybean lecithin 0.16 g per 1 g amylose,reaction time 2 h,and reaction temperature 60 ℃. Under the optimum conditions,the content of soybean lecithin in amylose soybean lecithin inclusion complexes was 116.28 mg/g and the rate of the inclusion was 63.02%. The result of13C CP/MAS NMR suggested that the amylose/soybean lecithin inclusion complexes was formed by the hydrophobic interactions between alkyl chain of soybean licithin and helical cavity of amylose,with rest groups of soybean lecithin lie outside the helix cavity.
amylose;soybean lecithin;enzymatic hydrolysis;inclusion complex
2016-04-18
王萍萍(1993-),女,硕士研究生,研究方向:功能碳水化合物,E-mail:18144879987@163.com。
*通讯作者:罗志刚(1975-),男,博士,教授,研究方向:功能碳水化合物化学,E-mail:zhgluo@scut.edu.cn。
国家自然科学基金(21576098,21376097);广东省科技计划项目(2015A020209015,2014A020208016,2016A050502005);广州市科技计划项目(201508020082,2014J4500012);中央高校基本科研业务费(2015ZZ043);国家大学生创新性实验计划项目(201510561085);华南理工大学百步梯项目(DA20716040)。
TS236.3
B
1002-0306(2016)22-0254-06
10.13386/j.issn1002-0306.2016.22.041
