高比例角蛋白/PEO纳米纤维的有机溶剂法制备与性能表征
2017-01-13雷通达王永恒曹福源
李 佳,雷通达,王永恒,曹福源,刘 雍,范 杰
(1. 辽东学院 辽宁省功能纺织材料重点实验室,辽宁 丹东 118001;2. 天津工业大学 纺织学院,天津 300387;3. 华北理工大学 冀唐学院医学实验中心,河北 唐山063300)
高比例角蛋白/PEO纳米纤维的有机溶剂法制备与性能表征
李 佳1,2,雷通达2,王永恒3,曹福源3,刘 雍2,范 杰2
(1. 辽东学院 辽宁省功能纺织材料重点实验室,辽宁 丹东 118001;2. 天津工业大学 纺织学院,天津 300387;3. 华北理工大学 冀唐学院医学实验中心,河北 唐山063300)
采用还原法提取人发角蛋白,将角蛋白与聚环氧乙烷(PEO)共混溶于碱性有机溶剂中配制纺丝液,静电纺制备角蛋白质量分数为95%的角蛋白/PEO共混纳米纤维,而后用乙二醇二缩水甘油醚(EGDE)蒸气对纳米纤维进行交联处理,以提高其在水中的稳定性.采用扫描电子显微镜、傅里叶变换红外光谱、X射线衍射光谱、热重分析等方法对纳米纤维的形貌及结构进行测试.研究结果表明,采用有机溶剂作为纺丝溶剂可在碱性条件下制备出形貌特征良好的高比例角蛋白/PEO共混纳米纤维,交联处理能够提高共混纳米纤维的耐水性和结晶度,但对共混纳米纤维的形貌和热稳定性略有影响.
静电纺丝; 角蛋白; 聚环氧乙烷(PEO); 有机溶剂; 交联
角蛋白是一种来源丰富、应用价值高的生物蛋白,主要存在动物毛发、羽毛和蹄中.角蛋白具有独特的生物相容性、低免疫排异性以及生物降解性等特性,是一种具有良好应用前景的生物医用材料,可与其他生物相容性高分子材料共混后制备医用敷料和生物支架材料[1-4].角蛋白的再生利用对新型生物材料的研发具有实际意义.
目前,国内外研究报道的提取角蛋白的方法主要有:氧化法、还原法、碱性法、铜氨溶液法和金属盐法等.其中,采用还原法获得的角蛋白提取率较高,且对角蛋白主链的破坏最小[5].
角蛋白力学性能差,无法单独纺丝.文献[6]以水为溶剂,将角蛋白与聚环氧乙烷(PEO)共混以提高角蛋白的可纺性能,但静电纺丝获得角蛋白/PEO最佳质量比仅为70∶30的纳米纤维.文献[7]采用乙二醇二缩水甘油醚(EGDE)对角蛋白进行交联处理以提高角蛋白的可纺性,以水为溶剂制备出角蛋白/PEO质量比为90∶10,且丝条光滑的静电纺纳米纤维,这在很大程度上提高了共混纤维中活性组分的质量比例,并通过后交联的方法提高了纳米纤维在水中的稳定性,但以水为溶剂进行纺丝时再进一步提高角蛋白的含量还是存在较大难度.文献[8]以三氟乙醇为溶剂,将碘乙酸改性角蛋白与PEO共混,静电纺制备出角蛋白/PEO质量比为90∶10的纳米纤维膜,但碘乙酸改性角蛋白成本较高,且共混纤维中的角蛋白含量也难以提升.
本文采用碱性三氟乙醇为溶剂,利用静电纺丝技术制备角蛋白/PEO质量比为95∶5的共混纳米纤维膜,并通过EGDE蒸气交联后处理,提高纳米纤维膜的耐水性,并利用扫描电子显微镜、热重分析、傅里叶变换红外光谱、X射线衍射光谱对角蛋白/PEO共混纳米纤维的形态以及结构进行测试分析.
1 试验部分
1.1 试验材料
人发纤维(理发店随机取样);PEO(40 kDa,上海联胜化工有限公司 );85%石油醚(天津市赢达稀贵化学试剂厂);尿素(AR级,天津光复科技发展有限公司),十二烷基硫酸钠(AR级,天津光复精细化工研究所);偏重亚硫酸钠(AR级,天津市科密欧化学试剂有限公司);EGDE(99.5%,徐州惠盛电子材料有限公司);NaOH(天津市风船化学试剂科技有限公司);三氟乙醇(99.5%,萨恩化学技术有限公司).
1.2 试验方法
1.2.1 人发角蛋白粉末的提取
(1) 人发预处理.将人发纤维用石油醚溶剂洗涤3次(15 min/次)、蒸馏水反复清洗后室温晾干,剪断为5 mm左右纤维段备用.
(2) 人发角蛋白粉末提取.称取6 g人发纤维,放入250 mL三颈瓶中,加入由尿素(80 g)、十二烷基硫酸钠(2 g)、偏重亚硫酸钠(10 g)、蒸馏水(106 g)配制的溶解液中,在水浴温度为95 ℃条件下搅拌4 h,经100目筛网过滤,去除未溶解人发,而后用蒸馏水透析3 d,每12 h换水一次,透析后分别经400和800目筛网过滤后,经旋转蒸发干燥器浓缩(60 ℃)后得到角蛋白溶液,再经真空冷冻干燥(24 h)获得人发角蛋白粉末.
1.2.2 高比例角蛋白/PEO纳米纤维的制备
(1) 角蛋白/PEO共混纺丝液的配制.在室温条件下,称取一定量角蛋白粉末溶于蒸馏水中,搅拌溶解后加入一定量的三氟乙醇(99.5%)和NaOH粉末,搅拌溶解后按照角蛋白/PEO质量比为95∶5称取定量PEO粉末加入到上述溶液中,室温搅拌溶解并脱泡后,制备不同溶质质量分数的角蛋白/PEO共混纺丝溶液,具体配制如表1所示.

表 1 角蛋白/PEO共混纺丝液配制
(2) 角蛋白/PEO纳米纤维的制备.将表1所示不同溶质质量分数的角蛋白/PEO共混纺丝液分别吸入带有金属针头的5 mL注射器内,并将注射器固定在微量注射推力泵上,与高压电源正极相连,将接收装置覆盖铝箔并与地线连接.纺丝液在电场力的作用下形成射流,射流在喷射过程中溶剂挥发、固化沉积在铝箔上,形成高比例角蛋白/PEO纳米纤维.静电纺丝条件:外加电压为10 kV,接收距离为15 cm,注射速度为0.5 mL/h.
(3) 角蛋白/PEO纳米纤维的蒸气交联后处理.称取5 mL 纯EGDE溶液滴入直径为9 cm的培养皿中,并在培养皿上覆盖一层金属网,将角蛋白/PEO纳米纤维膜(5 cm×5 cm)置于金属网上,盖上培养皿盖,80 ℃蒸气交联处理12 h.
1.3 测试方法
1.3.1 扫描电子显微镜观察
采用TM-1000型扫描电子显微镜(SEM,日本日立公司)观察EGDE蒸气交联前后的角蛋白/PEO纳米纤维形态结构.
1.3.2 水接触角测试
采用JY-80型接触角测试仪(河北承德试验机有限责任公司)测试EGDE蒸气交联前后角蛋白/PEO纳米纤维膜的耐水性.将各个样品(2 cm×2 cm)置于玻璃片上,在室温和相对湿度为(65±2)%条件下进行测试.
1.3.3 傅里叶变换红外光谱分析
采用TENSOR 37型红外线光谱分析仪(德国BRUKER公司)测试EGDE蒸气交联前后角蛋白/PEO纳米纤维的分子结构,测量波数范围为400~4 000 cm-1.
1.3.4 热重分析
采用STA409PC型热重分析仪(德国NETZSCH公司)测试EGDE蒸气交联前后角蛋白/PEO纳米纤维的热稳定性能,升温速度为10 ℃/min,测试温度为40~600 ℃.
1.3.5 X射线衍射光谱分析
采用D8DISCOVER型X射线衍射光谱仪(美国BRUKER AXS)测试经EGDE蒸气交联前后角蛋白/PEO纳米纤维的结晶结构.测试条件:氮气保护条件下,Cu靶(λ=0.154 6 nm),2θ扫描范围为5°~40°,操作电压为40 kV,电流为40 mA.
2 结果与讨论
2.1 角蛋白/PEO纳米纤维表面形态
角蛋白/PEO质量比为95∶5,纺丝液中溶质质量分数分别为2%,3%,5%的静电纺丝角蛋白/PEO纳米纤维表面形态,如图1(a)~(c)所示.在80 ℃条件下,利用EGDE对纺丝液中溶质质量分数为3%的角蛋白/PEO纳米纤维膜进行蒸气交联,获得纳米纤维表面形态如图1(d)所示.

(a) 溶质质量分数为2%

(c) 溶质质量分数为5%

(d) EGDE蒸气交联
由图1 (a)可知,当纺丝液的溶质质量分数为2%时,获得的角蛋白/PEO纳米纤维直径较小,粗细较均匀,但纤维表面有较多珠节,这是由于溶质质量分数较低所致.增大角蛋白/PEO共混纺丝液的溶质质量分数至3%时,获得的角蛋白/PEO纳米纤维形貌良好,纤维粗细均匀且表面光滑,以及无珠节(如图1 (b)所示).继续增大共混纺丝液的溶质质量分数至5%时,获得的角蛋白/PEO纳米纤维粗细不匀,这可能是由于纺丝液溶质质量分数过高所致(如图1 (c)所示).由此可见,当纺丝液的溶质质量分数为3%时,获得的角蛋白/PEO纳米纤维形貌最佳.经EGDE蒸气交联后的纳米纤维表面出现明显溶胀现象,纤维之间发生明显粘连(如图1 (d)所示),这是由于交联过程中分子热运动变强,纤维软化,流动性增加所致.
2.2 角蛋白/PEO纳米纤维膜耐水性
利用接触角测量仪对经EGDE蒸气交联处理前后的角蛋白/PEO纳米纤维膜进行水接触角测试,测试结果如图2所示.

(a) 未交联

(b) 经EGDE蒸气交联处理
由图2可知,未经EGDE蒸气交联处理的角蛋白/PEO纳米纤维膜的水接触角接近0°,经EGDE蒸气交联处理的角蛋白/PEO纳米纤维膜的水接触角升至53°,由此说明EGDE蒸气交联有助于改善角蛋白/PEO纳米纤维膜在水中的稳定性.
2.3 傅里叶变换红外光谱分析
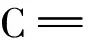

(a) 未交联

(b) 经EGDE蒸气交联处理

角蛋白/PEO纳米纤维β折叠结构α螺旋结构特征吸收峰波数/cm-1峰高/%含量/%特征吸收峰波数/cm-1峰高/%含量/%未交联162012.726.6165022.951.8经EGDE蒸气交联处理162712.421.5165121.545.5
由表2可知,与未交联角蛋白/PEO纳米纤维相比,经EGDE蒸气交联后的角蛋白/PEO纳米纤维对应于β-折叠结构和α-螺旋结构的特征吸收峰向高波数方向移动,且角蛋白β-折叠结构和α-螺旋结构的含量略有降低,这表明EGDE蒸气交联处理对角蛋白的β-折叠结构和α-螺旋结构可能具有一定的破坏作用.
文献[9-10]研究表明,PEO的C—O—C伸缩振动吸收峰出现在1 094 cm-1处,当PEO与角蛋白混合,且混合物中角蛋白含量达到60%时,C—O—C吸收峰会移动到1 102 cm-1处.经EGDE蒸气交联处理前后的角蛋白/PEO纳米纤维的红外光谱在1 000~1 300 cm-1的放大图如图4所示.由图4可知,曲线a位于1 099 cm-1处的吸收峰是对应于PEO的C—O—C吸收峰,经EGDE蒸气交联处理后,该吸收峰向高波数偏移至1 112 cm-1处(见曲线b).这主要是由于EGDE中的环氧基团发生开环反应所致,表明EGDE与人发角蛋白发生了交联反应.

图4 角蛋白/PEO纳米纤维红外光谱在 1 000~1 300 cm-1波段放大图Fig.4 Spectra (1 000-1 300 cm-1) of the keratin/PEO blend nanofiber
此外,图4中位于854和913 cm-1的吸收峰是对应于EGDE环氧基团的特征吸收峰[11],与未交联的角蛋白/PEO纳米纤维红外光谱相比,交联处理后纳米纤维的红外图谱中该两处吸收峰未发生明显的强度变化,这表明EGDE与角蛋白充分发生交联反应,反应后无EGDE残留.
2.4 热重分析
对经EGDE蒸气交联前后的角蛋白/PEO纳米纤维进行热重分析,结果如图5所示.由图5可知,交联处理后纳米纤维的热稳定性有所下降.角蛋白/PEO纳米纤维的失重过程可分为4个阶段,如表3所示.

图5 角蛋白/PEO纳米纤维的TG图谱Fig.5 The TG curves of the keratin/PEO blend nanofiber
第1阶段为失重率最小的阶段,发生在112℃以下,两种试样均出现微量失重现象,失重率小于5%,这是由于试样中水分子气化吸热所致.第2阶段,EGDE蒸气交联的角蛋白/PEO纳米纤维失重温度为100~235 ℃,未交联角蛋白/PEO纳米纤维失重温度为112~259 ℃,该阶段的失重是因为角蛋白α-螺旋结构熔融所致[12].第3阶段,EGDE蒸气交联角蛋白/PEO纳米纤维失重温度在235~368 ℃,最大失重率时温度为253 ℃,未交联角蛋白/PEO纳米纤维的失重温度为259~385 ℃,最大失重率时温度为304 ℃,该阶段失重主要是由于角蛋白碳链降解所致.第4阶段失重是由于角蛋白/PEO纳米纤维的热分解所致.角蛋白/PEO纳米纤维经EGDE蒸气交联处理后,α-螺旋结构和β-折叠结构含量降低,导致其开始快速失重的温度有所下降.

表3 经EGDE蒸气交联前后角蛋白/PEO纳米纤维的失重温度范围和失重率
2.5 X射线衍射光谱分析
采用X射线衍射光谱对经EGDE蒸气交联前后角蛋白/PEO纳米纤维的结晶结构进行分析,结果如图6所示.由图6可知,两试样的X衍射图谱上角蛋白位于2θ=10°的α-螺旋特征衍射峰较为微弱.经EGDE蒸气交联的角蛋白/PEO纳米纤维的X衍射图谱在2θ=5°和7°处出现两个明显的衍射峰,此外该图谱还出现了多处小的结晶峰. 这表明EGDE交联处理对角蛋白/PEO纳米纤维的结晶结构产生了较为明显的影响,交联剂与角蛋白之间的开环交联反应形成了新的结晶.
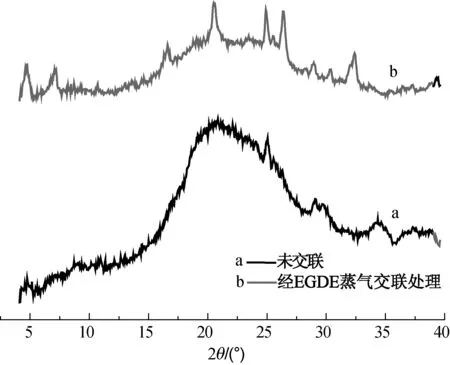
图6 经EGDE蒸气交联前后角蛋白/PEO纳米纤维的X射线衍射图谱Fig.6 X-ray diffraction curves of the keratin/PEO blend nanofiber before and after crosslinked by EGDE
通过高斯函数对角蛋白/PEO纳米纤维的X衍射图谱进行分峰处理,结果如图7所示.由图7可知,位于2θ=20°处范围较宽的峰为非晶峰,位于2θ=10°和20°处的衍射峰分别对应于角蛋白的α-螺旋结构和β-折叠结构[13-14],计算得到试样的结晶度如表4所示.
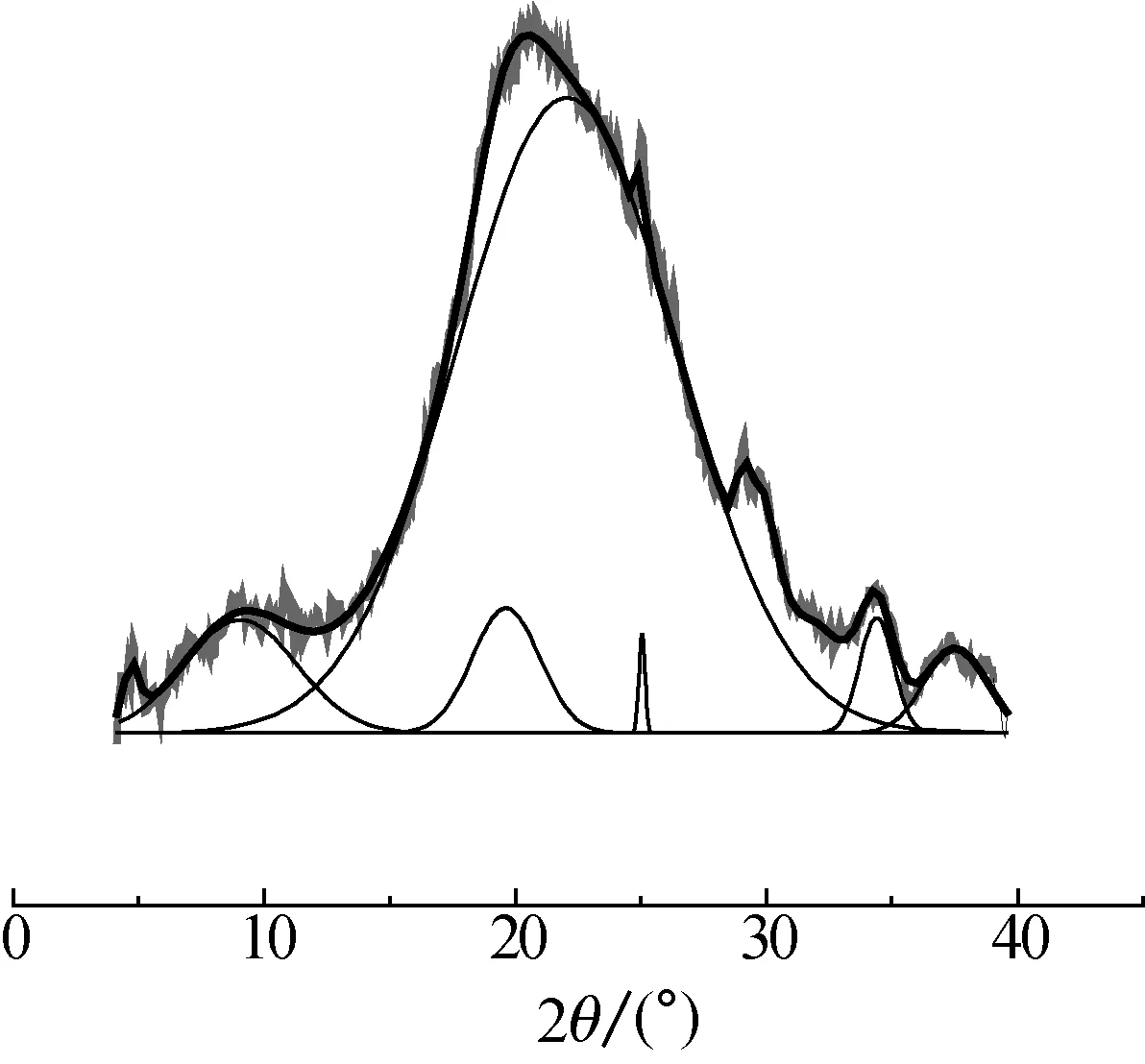
(a)未交联

(b) 经EGDE蒸气交联处理

角蛋白/PEO纳米纤维总结晶度/%α螺旋结构β折叠结构结晶度/%占总结晶百分比/%结晶度/%占总结晶百分比/%未交联22731421经EGDE蒸气交联处理3131215
由表4可知,未交联角蛋白/PEO纳米纤维结晶度低于EGDE蒸气交联处理角蛋白/PEO纳米纤维结晶度,但EGDE蒸气交联后的角蛋白/PEO纳米纤维中角蛋白的α-螺旋结构和β-折叠结构结晶度以及两种结构所占总结晶的百分比均减少.这表明经EGDE蒸气交联处理对角蛋白的α-螺旋结构和β-折叠结构具有明显的破坏作用,与红外测试结果相符.
3 结 语
本文采用还原法提取人发角蛋白,以碱性三氟乙醇为纺丝溶剂,成功制备高比例角蛋白/PEO静电纺纳米纤维,角蛋白/PEO质量比为95∶5,纤维粗细均匀且表面光滑.研究表明,以EGDE为交联剂对角蛋白/PEO纳米纤维膜进行蒸气交联处理,能够改善纳米纤维的耐水性和结晶度,有助于提高角蛋白/PEO纳米纤维的应用性能,但EGDE与角蛋白的交联反应会破坏角蛋白的α-螺旋结构和β-折叠结构,导致角蛋白/PEO纳米纤维的热稳定性略有下降.
[1] MICHAELIS L. A study of keratin[J]. Journal of the American Leather Chemists Association, 1935, 30(11): 557-568.
[2] YAMAUCHI K, YAMAUCHI A, KUSUNOKI T, et al. Preparation of stable aqueous solution of keratins, and physiochemical and biodegradational properties of films[J]. Journal of Biomedical Materials Research, 1996 (31): 439-444.
[3] JIANG Y, ZHI C X, PARK S W, et al. Fabrication of PHBV/keratin composite nanofibrous mats for biomedical applications[J]. Macromolecular Research, 2009, 17(11): 850-855.
[4] 胡继文,杨玉芹.人发角蛋白溶液成膜的结构与性能[J].高分子材料科学与工程, 2002, 18(2): 131-133.
[5] 张恒,李戎,菅应凯.还原法提取角蛋白及角蛋白/PEO 纳米纤维的制备[J].印染, 2014(15): 5-8.
[6] ALUIGI A, VINEIS C, VARESANO A, et al. Structure and properties of keratin/PEO blend nanofibres[J]. European Polymer Journal, 2008, 44(8): 2465-2475.
[7] LIU Y, YU X, LI J, et al.Fabrication and properties of high-content keratin / poly (ethylene oxide) blend nanofibers using two-step cross-linking process[J]. Journal of Nanomaterials, 2015, Article ID 803937.
[8] CHAE W P,KANG I K,KIM S Y. Keratin nanofibers as a biomaterial[C]// Proceedings of International Conference on Nanotechnology and Biosensors.2010.
[9] TONIN C, ALUIGI A, VINEIS C, et al. Thermal and structural characterization of poly (ethylene-oxide)/keratin blend films[J]. Journal of Thermal Analysis and Calorimetry, 2007, 89(2): 601-608.
[10] LI X, HSU S. An analysis of the crystallization behavior of poly (ethylene oxide)/poly (methyl methacrylate) blends by spectroscopic and calorimetric techniques[J]. Journal of Polymer Science (Polymer Physics Edition), 1984, 22(7): 1331-1342.
[11] HUANG D, PENG Z, HU Z, et al. A new consolidation systemfor aged silk fabrics: Effect of reactive epoxide-ethylene glycol diglycidyl ether [J]. Reactive and Functional Polymers, 2013, 73(1): 168-174.
[12] ESLAHI N, DADASHIAN F, NEJAD N H. Optimization of enzymatic hydrolysis of wool fibers for nanoparticles production using response surface methodology[J]. Advanced Powder Technology, 2013, 24(1): 416-426.
[13] CAO J. Melting study of the α-form crystallites in human hair keratin by DSC[J]. Thermochimica Acta, 1999, 335(1): 5-9.
[14] CAO J, BILLOWS C A. Crystallinity determination of native and stretched wool by X-ray diffraction[J]. Polymer International, 1999, 48(10): 1027-1033.
Preparation and Characterization of High-Content Keratin/PEO Nanofiber Using Organic Solvent
LIJia1,2,LEITong-da2,WANGYong-heng3,CAOFu-yuan3,LIUYong2,FANJie2
(1. Liaoning Provincial Key Laboratory of Functional Textile Materials,Eastern Liaoning University, Dandong 118001, China;2. School of Textiles, Tianjin Polytechnic University, Tianjin 300387, China;3. Medical Experimental Center, Jitang College, North China University of Science and Technology, Tangshan 063300, China)
Reduction method is employed to extract keratin from human hair. Then the extracted keratin and poly (ethylene oxide)(PEO) are blended and dissolved in the basic organic solvent to prepare the keratin/PEO blend electrospun nanofiber with the keratin mass fraction of 95%. The prepared nanofiber is subsequently crosslinked by ethylene glycol diglycidyl ether (EGDE) to improve its stability in water. Morphology and configuration of the blend nanofiber are tested using scanning electron microscope, Fourier transform infrared spectroscopy, X-ray diffraction and thermogravimetric analysis. The investigation results suggest that the keratin/PEO blend nanofiber with high keratin content and excellent morphology features can be successfully prepared by using basic organic solvent under alkaline condition. The crosslinking post processing can improve the water tolerance and crystallinity of the blend nanofiber, but has slight influence on the morphology and heat stability of the blend nanofiber.
electrospun; keratin; poly (ethylene oxide)(PEO); organic solvent; corsslinking
1671-0444 (2016)06--
2015-08-31
国家自然科学基金面上资助项目(51573133);教育部新世纪优秀人才支持计划资助项目(NCET-12-1063);国家级大学生创新训练资助项目(201510058056);全国优博作者专项基金资助项目(201255);天津市自然科学基金面上资助项目(14JCYBJC17600)
李 佳(1987—),女,吉林长春人,硕士,研究方向为天然蛋白质纳米纤维的制备及性能. E-mail: 407031195@qq.com 范 杰(联系人),女,副教授,E-mail: fanjie@tjpu.edu.cn
TS 101.4
A
