干细胞移植对扩张型心肌病模型兔心肌胶原及血管影响
2017-01-12徐洁曹桂秋
徐洁 曹桂秋
[摘 要] 目的:分析骨髓间充质干细胞(Marrow mesenchymal stem cells,MSCs)移植对扩张型心肌病(Dilated cardiomyopathy,DCM)模型兔心肌胶原及血管影响,探讨该方案治疗DCM的可行性。方法:选取60只新西兰大白兔,按照随机数字表法分为正常对照组、模型对照组、模型移植组,各20只,正常对照组不接受特殊处理,模型对照组、模型移植组均建立兔DCM模型,模型移植组接受MSCs处理。评价三组心功能变化,并比较其移植治疗4周后心肌胶原及心肌微血管密度(MVD)差异,总结MSCs移植的作用效果与机理。结果:移植治疗4周后,正常对照组、模型移植组实验兔均存活,模型对照组实验兔存活率为70.00%,低于其他两组;与造模前相比,模型对照组、模型移植组移植治疗4周后LVEDD、LVESD均升高,LVEF均下降,模型对照组变化更为明显,差异有统计学意义(P<0.05)。移植治疗4周后,模型移植组MVD高于正常对照组,模型对照组MVD低于正常对照组;模型对照组心肌Ⅰ型胶原、Ⅲ型胶原及其比值均高于正常对照组,差异有统计学意义(P<0.05),模型移植组上述指标与正常对照组比较,差异无统计学意义(P>0.05)。结论:MSCs移植能够抑制DCM模型实验兔心功能恶化进程,其作用机理与提高心肌胶原水平、促进心肌微血管生成有关。
[关键词] 骨髓间充质干细胞;移植;扩张型心肌病;心肌胶原;微血管密度
中图分类号:R394 文献标识码:A 文章编号:2095-5200(2016)06-009-03
DOI:10.11876/mimt201606004
扩张型心肌病(Dilated cardiomyopathy,DCM)预后差 [1]。药物治疗对于DCM患者临床症状的控制具有一定作用,但仅可延缓严重心力衰竭发生时间,无法逆转心室扩张进程 [2]。行心脏移植供体较为缺乏,加之排斥反应、价格昂贵、术后并发症发生风险高等弊端,均限制了心脏移植的临床应用。近年来,大量学者开始关注骨髓间充质干细胞(Marrow mesenchymal stem cells,MSCs)移植治疗DCM的可行性,MSCs具有高度扩增、多向分化潜能[3],本研究分析实验兔模型,探讨MSCs移植治疗DCM机制。
1 材料与方法
1.1 实验动物
普通级新西兰大白兔60只,雌雄不拘,月龄3个月,体质量(2.26±0.37)kg,均由浙江大学实验动物中心提供,按照随机数字表法将其分为正常对照组、模型对照组、模型移植组,各20只。
1.2 试剂与仪器
主要试剂:盐酸阿霉素粉针剂(深圳万乐药业股份有限公司);羊抗兔Ⅰ、Ⅲ型胶原抗体(上海瑞齐生物科技有限公司);免疫组化EliVisionTMplus广谱试剂盒(福州迈新生物技术开发有限公司)。
主要仪器:iE-33多普勒彩色超声诊断仪(荷兰飞利浦公司)。
1.3 实验方法
1.3.1 分组及造模 60只实验兔均在相同条件下饲养,模型对照组、模型移植组均建立兔DCM模型,耳缘静脉注射2 mg/kg盐酸多柔比星(阿霉素),每周1次,持续8周[4]。每周记录实验兔体质量,观察其毛色、运动量、进食量及腹水等状态。模型移植组接受MSCs处理。
1.3.2 MSCs移植 造模8周后,抽取兔股骨骨髓4 mL,参照文献方法实施MSCs分离纯化、培养、鉴定[5-6]。
将MSCs用0.25%的胰蛋白酶消化、吹打形成单细胞悬液,低速离心收集细胞,将浓度为106的MSCs装入微量注射器准备移植。取模型移植组兔,于左心室游离壁分5点注入制备好的骨髓干细胞悬液,每点约30~50 μL,深度4 mm,共1.0×108 个细胞。注射位置以6/0丝线作标记。注射器与心脏呈30℃进针,注射前回抽,防止细胞注入心腔。注射过程中需密切注意实验兔心率、呼吸,防止心律失常和急性左心衰的发生,模型对照组按同样方式于对应时间点注入等量DMEM 培养液[7]。检查无活动性出血后逐层关胸。胸穿抽出胸腔气体,使左肺复张。
1.3.3 观察指标 记录各组实验兔造模成功后(移植治疗后)生存率,并分别于造模前、于移植治疗4周后,对三组实验兔心功能进行检测,检测指标包括左室收缩末期内径(LVEDD)、左室舒张末期内径(LVESD)及左室射血分数(LVEF);于模型移植组移植治疗4周后同时处死各组实验兔,取其左心室心肌组织,参照文献方法检测其心肌微血管密度(MVD)及心肌Ⅰ、Ⅲ型胶原平均光密度值[8-9]。
1.4 统计学分析
SPSS20.0统计软件,计数资料以(n/%)表示,并采用χ2检验,计量资料以(x±s)表示,三组间比较采用F检验,以P<0.05为差异有统计学意义。
2 结果
2.1 生存情况
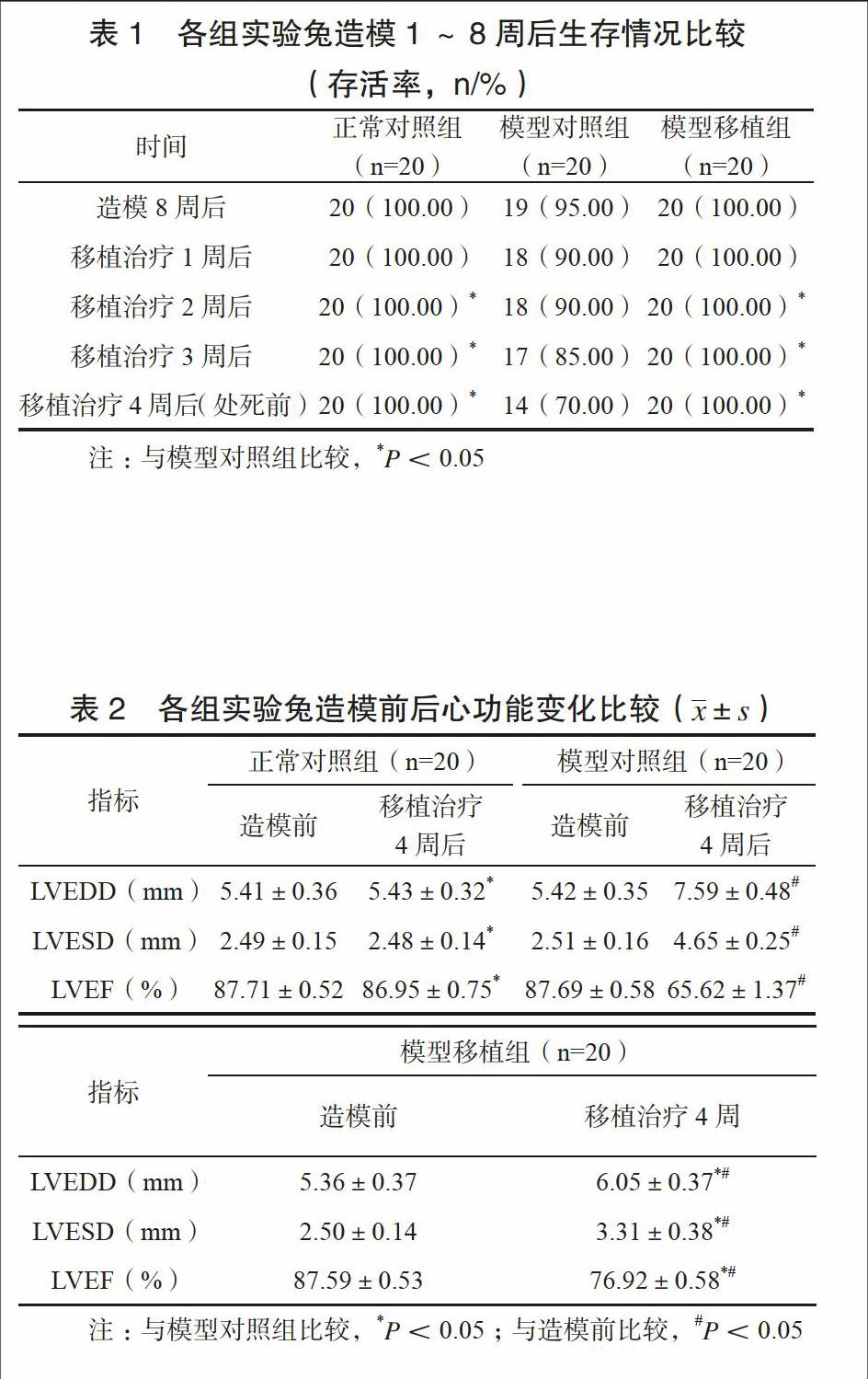
移植治疗4周后正常对照组、模型移植组实验兔均存活,模型对照组实验兔存活率为70.00%,低于其他两组,差异有统计学意义(P<0.05)。见表1。
2.2 心功能变化
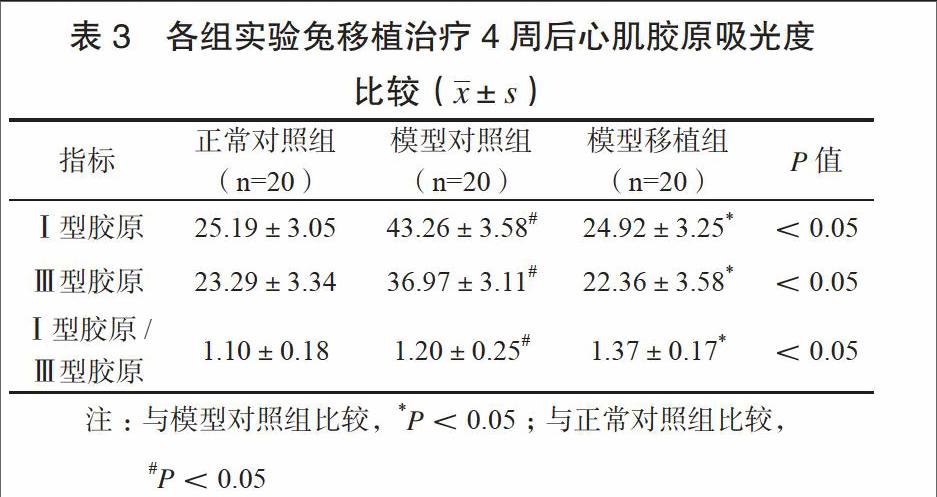
移植治疗4周后模型对照组、模型移植组LVEDD、LVESD均较造模前升高,LVEF均下降,模型对照组变化更为明显,差异有统计学意义(P<0.05)。见表2。
2.3 微血管密度及心肌胶原
正常对照组、模型对照组、模型移植组MVD分别为(26.27±4.39)、(14.36±4.42)、(39.05±5.87),模型移植组MVD高于正常对照组,模型对照组MVD低于正常对照组,差异有统计学意义(P<0.05)。
移植治疗4周后模型对照组心肌Ⅰ型胶原、Ⅲ型胶原及其比值均高于正常对照组,差异有统计学意义(P<0.05),模型移植组上述指标与正常对照组比较,差异无统计学意义(P>0.05)。见表3。
3 讨论
DCM病理改变以心肌细胞数量减少与功能减退为主要病理改变,当心肌细胞数量减少到一定程度所致残存心肌细胞代偿功能受损时,心脏泵血功能难以有效维持,即可导致心力衰竭等严重症状,威胁患者生存 [10]。近年来,干细胞移植治疗心血管疾病文献报道增多[11-12]。
本研究采取经典耳缘静脉注射阿霉素的方法建立兔DCM模型,就干细胞移植的治疗效果及机制进行探讨。
可以发现,与造模前相比,移植治疗4周后模型对照组、模型移植组LVEDD、LVESD均呈现上升趋势且LVEF明显下降,符合DCM的临床表现[13],而模型对照组心功能变化更为明显,说明MSCs移植在延缓心功能恶化方面发挥了积极作用,与Zhang等[14]大鼠DCM模型实验结果一致。
为进一步明确MSCs移植治疗DCM的机理,本研究对实验兔左室心肌胶原及血管状态变化进行了检测,结果表明,移植治疗4周后模型对照组心肌Ⅰ型胶原、Ⅲ型胶原及其比值明显升高,而既往研究表明,心肌Ⅰ型胶原、Ⅲ型胶原的升高可体现肾素-血管紧张素-醛固酮系统过度活化,这一病理生理改变所致心肌细胞凋亡是造成左室重构加剧、心力衰竭发生发展的主要原因[15]。
与此同时,模型移植组心肌Ⅰ型胶原、Ⅲ型胶原及其比值与正常对照组比较,差异无统计学意义,考虑与MSCs移植后,心肌胶原mRNA稳定性增加、胶原纤维降解减少有关,这一机制能够有效抑制心肌及间质细胞增生,延缓心肌肥大与纤维化进程,降低心肌重塑风险[16]。
在MVD的观察中可以发现,移植治疗4周后DCM模型兔心肌MVD明显下降,说明心肌细胞的大量丢失与功能受损可影响血管新生能力,加之纤维化、再生功能及各类生长因子生成障碍,共同造成DCM病程进展[17]。而MSCs移植能够补充丢失的心肌细胞,促进生长因子分泌、改善血管内皮功能,从而改善心肌内微循环障碍状态,达到恢复心功能的目的。Lin等[18]发现,MSCs还可与血管内皮生长因子2受体发挥交联作用,在发挥促血管生成作用的同时,还具有保护心肌、抗凋亡、促细胞分裂、抗纤维化等多种效应,有望推广于其他缺血性疾病的治疗。
综上所述,MSCs移植能够降低DCM模型兔心肌胶原水平、上调MVD,对于局部心肌血流的恢复与心功能的改善具有积极意义,为DCM临床治疗策略的选择提供了新的方向,值得进一步探索。
参 考 文 献
[1] Mushtaq M, DiFede D L, Golpanian S, et al. Rationale and Design of the Percutaneous Stem Cell Injection Delivery Effects on Neomyogenesis in Dilated Cardiomyopathy (The POSEIDON-DCM Study)[J]. J Cardiovasc Transl Res, 2014, 7(9): 769-780.
[2] 姜艳杰, 毛成刚, 宁险峰, 等. 肌肉注射脐带间充质干细胞对扩张型心肌病大鼠相关细胞因子的影响[J]. 中国组织工程研究, 2015, 19(14): 2179-2185.
[3] Yu Q, Li Q, Na R, et al. Impact of repeated intravenous bone marrow mesenchymal stem cells infusion on myocardial collagen network remodeling in a rat model of doxorubicin-induced dilated cardiomyopathy[J]. Mol Cell Biochem, 2014, 387(1-2): 279-285.
[4] 吕腾, 武璞, 肖思源, 等. 阿霉素诱导建立扩张型心肌病大鼠和家兔模型的研究[J]. 中药药理与临床, 2015, 31(2): 120-123.
[5] Gong X, Wang P, Wu Q, et al. Human umbilical cord blood derived mesenchymal stem cells improve cardiac function in cTnT R141W transgenic mouse of dilated cardiomyopathy[J]. Eur J Cell Biol, 2016, 95(1): 57-67.
[6] Bolli R, Ghafghazi S. Current status of cell therapy for non-ischaemic cardiomyopathy: a brief overview[J]. Eur Heart J, 2015, 36(42): 2905-2908.
[7] 张宁坤, 陈宇, 王志国, 等. 华通胶源间充质干细胞经冠状动脉移植治疗慢性缺血性心肌病的实验研究[J]. 解放军医学杂志, 2015, 40(11): 885-891.
[8] Yu Q, Fang W, Zhu N, et al. Beneficial effects of intramyocardial mesenchymal stem cells and VEGF165 plasmid injection in rats with furazolidone induced dilated cardiomyopathy[J]. J Cell Mol Med, 2015, 19(8): 1868-1876.
[9] 傅丽云. 自发性高血压大鼠左室心肌胶原与心肌力学特征关系的探讨[D]. 福州:福建医科大学, 2014.
[10] Kelkar A A, Butler J, Schelbert E B, et al. Mechanisms Contributing to the Progression of Ischemic and Nonischemic Dilated Cardiomyopathy: Possible Modulating Effects of Paracrine Activities of Stem Cells[J]. J Am Coll Cardiol, 2015, 66(18): 2038-2047.
[11] Roura S, Gálvez-Montón C, Bayes-Genis A. Umbilical cord blood-derived mesenchymal stem cells: New therapeutic weapons for idiopathic dilated cardiomyopathy?[J]. Int J Cardiol, 2014, 177(3): 809-818.
[12] 侯永兰, 杨东伟. 静脉移植骨髓间充质干细胞对心肌病心力衰竭心功能的影响[J]. 中国组织工程研究, 2016, 20(23): 3413-3418.
[13] Li L, Xia Y. Study of adipose tissue-derived mesenchymal stem cells transplantation for rats with dilated cardiomyopathy[J]. Annals of Thoracic and Cardiovascular Surgery, 2014, 20(5): 398-406.
[14] Zhang Y, Yu Z, Jiang D, et al. iPSC-MSCs with High Intrinsic MIRO1 and Sensitivity to TNF-α Yield Efficacious Mitochondrial Transfer to Rescue Anthracycline-Induced Cardiomyopathy[J]. Stem Cell Rep, 2016, 7(4): 749-763.
[15] Ezquer F, Gutiérrez J, Ezquer M, et al. Mesenchymal stem cell therapy for doxorubicin cardiomyopathy: hopes and fears[J]. Stem Cell Res Ther, 2015, 6(1): 1.
[16] Premer C, Blum A, Bellio M A, et al. Allogeneic mesenchymal stem cells restore endothelial function in heart failure by stimulating endothelial progenitor cells[J]. EBioMedicine, 2015, 2(5): 467-475.
[17] 王悦喜, 阿荣, 张迎军, 等. 自体骨髓单个核细胞移植治疗心肌病疗效及安全性评估[J]. 中华老年医学杂志, 2014, 33(2): 134-137.
[18] Lin Y H, Chen X M, Zhang J W, et al. Preclinical study on induction of pluripotent stem cells from urine of dilated cardiomyopathy patients[J]. Eur Rev Med Pharmacol Sci, 2016, 20(8): 1450-1457.