无脉苔草根际优良促生菌鉴定及其作用研究
2017-01-03刘婷姚拓陈建纲马文彬刘欢马骢毓蒋永梅
刘婷,姚拓,陈建纲,马文彬,刘欢,马骢毓,蒋永梅
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
无脉苔草根际优良促生菌鉴定及其作用研究
刘婷,姚拓*,陈建纲,马文彬,刘欢,马骢毓,蒋永梅
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
采用钼蓝比色法(molybdenum blue colorimetry, MBC)、乙炔还原法(acetylene reduction assay, ARA)及高效液相色谱法(high performance liquid chromatography, HPLC)测定了分离自无脉苔草根际的6株根际促生菌溶磷、固氮及分泌激素的特性,并利用16S rDNA序列分析技术对筛选出的2株优良促生菌进行鉴定。结果表明,6株促生菌的溶磷量在298.17~554.67 mg/L之间,其中菌株TPRS3的溶磷能力最强(554.67 mg/L);6株促生菌中有4株具有固氮能力,固氮酶活性在170.19~456.87 nmol C2H4/(mL·h)之间,菌株TPRS19的固氮能力最强,固氮酶活性为456.87 nmol C2H4/(mL·h),菌株TRPS3和TPRS12无固氮能力;6株促生菌均具有分泌植物激素的能力,其中3-吲哚乙酸(IAA)分泌量在8.20~86.36 mg/L范围内,赤霉素(GA3)在26.36~135.90 mg/L范围内,反-玉米素(t-Z)在9.55~141.68 mg/L范围内,菌株TPRS19分泌IAA的能力最强,为86.36 mg/L,菌株TPRS5分泌GA3的能力最强,为135.90 mg/L,菌株TPRS2分泌t-Z的能力最强,为141.68 mg/L,菌株TPRS3、TPRS5、TPRS12和TPRS19兼具分泌3种激素能力。经鉴定,菌株TPRS5为枯草芽孢杆菌(Bacillussubtilis),菌株TPRS19为阴沟肠杆菌(Enterobactercloacae),这2株菌有望作为研制微生物肥料的优良菌株。
无脉苔草;植物根际促生菌;溶磷;固氮;分泌激素;菌株鉴定
无脉苔草(Carexenervis)属于莎草科苔草属(Carex)植物,其草质较为柔软,蛋白质和无氮浸出物含量较高,马、牦牛和绵羊均喜采食,为优等牧草,同时由于其返青早、生长季长及耐干旱等特点在草坪草的开发利用中具有较大价值。此外,苔草属植物因其具有顽强的生命力、极强的营养繁殖能力及特殊的生理整合作用而生长在极其脆弱的生态环境中[1],如高寒草原、高寒冰缘等地[2-3],对维持脆弱的生态环境起着举足轻重的作用。甘肃省天祝县地处河西走廊东端,位于青藏高原、黄土高原和内蒙古高原的交汇地带,苔草属植物是此地典型的高寒草甸牧草。近年来,受自然气候以及过度放牧的影响,使得高寒草甸生态系统退化严重,为了缓解这种现象,大量使用化肥已成为提高草产量的必要手段,但是环境污染、肥效降低等问题也随之产生,使之陷入恶性循环当中,这势必危及高原的生态平衡[4]。因此,探索新的环保高效肥源,以期部分替代甚至完全替代工业化肥已经迫在眉睫。
植物根系与土壤间进行着复杂而频繁的物质交换,是植物吸收水分和养分的重要组织器官,受根系生长及分泌物影响,根系范围环境的土壤水分、养分、通气性和pH值等不断发生变化,明显区别于非根系土壤,而植物根际微生物数量和种群结构也显著不同于非根际土壤[5]。自1904年德国生物学家Lorenz Hiltner提出了根际(rhizosphere)一词(指植物根系周围、受植物根系生长影响的土壤),带动了许多学科对植物根际微生态领域的研究,尤其对植物根际促生菌(plant growth promoting rhizobacteria, PGPR)的研究较为深入[6]。PGPR是指能够促进植物生长的根际微生物的总称,是指生长在土壤中或定殖在植物体内的一类有益微生物,这类微生物通过显著改变土壤中一些不可利用元素的形态,使之成为更有利于植物吸收的形式,从而改善植物对某些矿质元素的吸收状况来促进植物生长(如固氮菌、溶磷菌、解钾菌等),或其自身可以分泌某种化学物质(如激素、有机酸等)来促进植物生长[7]。利用PGPR研制的微生物菌肥更是由于其成本低、效果好、防止土壤污染、保证食品安全等方面有着巨大的发展潜力。
目前,对于微生物菌肥的研制以及应用已得到广泛的研究[8-9],如优良促生菌种的筛选、促生机理的研究及促生特性的测定等方面[10],但是在促生菌分泌激素的研究中,大多只研究菌株分泌IAA能力,对于其他激素的报道较少,此外,对于无脉苔草根际微生物的研究鲜有报道。为此,本研究以无脉苔草为对象,从根际分离促生菌,对其进行促生特性测定,并利用16S rDNA序列分析技术对筛选出的优良促生菌种进行鉴定,为进一步开发利用微生物资源提供物质和理论依据,对于微生物肥料的菌种选育和实践生产以及农业可持续发展具有重要的指导意义。
1 材料与方法
1.1 材料和样地
2015年7月在甘肃省武威市天祝藏族自治县抓喜秀龙乡甘肃农业大学天祝高山草原试验站(37°40′ N,102°32′ E,海拔2960 m)内的不同地点随机挑选3株长势良好的无脉苔草植株。保持植株地上部分的完整,掘出面积为10 cm×10 cm、深度为20 cm的地下部分,装入无菌的自封袋中,迅速带回实验室并保存在4 ℃冰箱中[11]。在24 h之内进行菌株的分离和筛选工作。
1.2 优良PGPR菌株的分离
抖掉植株根系上附着的虚土,将根系周围1 cm范围内(根际)的土壤抖落在灭菌的培养皿中。称取1 g根际土壤加入到装有9 mL 0.85%生理盐水(121 ℃、30 min灭菌)的试管中,即为10-1梯度稀释液。将试管在1000 r/min的漩涡振荡器上振荡5 min,静置20 min后取上清液1 mL重复上述步骤继续稀释,一直到10-5。将10-3、10-4和10-5的样品稀释液用刮刀均匀涂布于PKO(Pikovaskaia’s)[12]固体培养基上,1个梯度3个重复,28 ℃培养10 d。挑取在PKO固体培养基上出现明显透明圈的菌落进行纯化并保存。
1.3 菌株溶磷特性测定
挑取菌落生长饱满、溶磷圈明显的单菌落点接种于PKO固体培养基上,每菌株3个重复,28 ℃培养10 d,期间记录菌株的生长情况。10 d后测量溶磷圈直径(D)与菌落直径(d),通过对比D/d的值,筛选出能稳定产生透明圈的菌株。将上述筛选出的菌株接种在PKO液体培养基中,每菌株设置3个重复,以未接种菌株的PKO液体培养基为对照,在28 ℃、180 r/min的摇床上培养10 d。10 d后将菌株发酵液在4 ℃、10000 r/min的条件下离心10 min,弃去菌体保留上清液,采用钼蓝比色法测定上清液中的有效磷增量[13]。通过比较溶磷量筛选出溶磷特性较好的菌株,并用LB(Luria-Bertani)[12]斜面培养基保存在4 ℃冰箱中,每个菌株至少保存5株。
1.4 菌株固氮酶活性测定
将保存的菌株活化并接种于盛有5 mL半固体NFM(nitrogen free medium)[12]培养基的15 mL血清瓶中,每个菌株3个重复,以不接菌的等量培养基为对照。28 ℃培养2 d后利用乙炔还原法,在无菌条件下将血清瓶上的棉花塞换成橡胶塞,同时用无菌注射器吸出瓶内的1 mL混合气体并快速注入等量的C2H2气体并密封。继续培养2 d后用50 μL的微量进样器从血清瓶中抽取混合气体并注入气相色谱仪(Thermo GC7890F)的进样柱中,记录结果并计算菌株的固氮酶活性[14]。
1.5 菌株分泌激素能力测定
1.5.1 试剂 标准品3-吲哚乙酸(3-indoleacetic acid, IAA)、赤霉素(gibberellin acid, GA3)和反-玉米素(trans-zeatin, t-Z)(均为分析标准品,纯度大于98%)购自上海阿拉丁生化科技股份有限公司,甲醇为色谱纯,购自山东禹王实业有限公司化工分公司,冰乙酸为色谱纯,购自天津市光复精细化工研究所,实验用水为超纯水。所有试剂在使用前均用0.45 μm微孔滤膜过滤。
1.5.2 仪器与设备 Agilent 1260高效液相色谱仪(G2171BA),752PC型紫外可见分光光度计(上海光谱仪器有限公司),QF-3800氮气吹干仪,Agilent Bond Elut C18固相萃取柱(500 mg,6 mL),0.45 μm亲水PTFE针式滤器。
1.5.3 样品前处理 将活化好的菌株接种于50 mL的LB液体培养基中,每个菌株设置3个重复,在避光条件下置于28 ℃、180 r/min的摇床中培养。3 d后将培养好的菌株发酵液在4 ℃、10000 r/min的条件下离心10 min,弃去菌体收集上清液。结合参考文献[15]的方法并改进,将收集的上清液用C18固相萃取柱富集纯化,小柱分别用6 mL甲醇溶液和6 mL 10%甲醇溶液进行活化,然后将上清液缓慢注入小柱内,上样速度控制在1 mL/min。待上样完成,用5 mL 10%甲醇溶液淋洗两次,最后用5 mL 80%甲醇溶液洗脱2次并收集洗脱液。将洗脱液在室温下氮气吹干,再用甲醇溶解定容在2 mL离心管中,保存于4 ℃培养箱。
1.5.4 色谱条件 固定相采用Agilent ZORBAX Eclipse Plus C18色谱柱(4.6 mm×250 mm,5-Micron),流动相采用体积比为2∶3的甲醇-水(含0.2%冰乙酸)二元混合溶剂,检测波长为210 nm,柱温为30 ℃,流速为1 mL/min,进样量为20 μL。
1.5.5 标准溶液的配制 结合参考文献[15]的方法并改进,准确称取IAA、GA3和t-Z标准品各10.00 mg左右,分别用流动相溶解并定容至10.00 mL,配成1.00 g/L的储备液。将3种储备液按1∶1∶1混合后,再用流动相逐级稀释,配制成系列标准溶液,于4 ℃下存放(保质期1个月)。
1.6 菌株鉴定
从常规鉴定和分子生物学鉴定2个方面来筛选优良PGPR菌株。
常规鉴定包括形态特征和生理生化特性2个方面,参照《伯杰细菌鉴定手册(第八版)》[16]和《常见细菌系统鉴定手册》[17]进行鉴定。
分子生物学鉴定是指利用细菌16S rDNA序列测序的方法对细菌进行种属鉴定。总DNA的提取采用离心柱型细菌基因组DNA提取试剂盒(购自美国OMEGA公司)。扩增引物选取16S rDNA扩增的通用引物27F-1492R,其序列为27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′(由华大基因合成)。DNA扩增及测序工作均由华大基因组完成。将测得的序列在NCBI数据库中用megablast进行相似性搜索,并与已报道细菌菌株的16S rDNA序列进行同源性比较,并利用MEGA 5.0生物学软件构建进化距离树图,用Neighbor-Joining法进行系统发育分析。
2 结果与分析
2.1 优良PGPR菌株筛选
通过PKO培养基筛选,从3株苔草根际分离出21株溶磷菌株。对比D/d的值,进而筛选出能稳定产生透明圈的菌株13株,最后通过钼蓝比色法筛选出溶磷特性较好的菌株6株并编号。菌株编号依次为:TPRS2、TPRS3、TPRS5、TPRS10、TPRS12、TPRS19(表1)。
2.2 优良PGPR菌株溶磷及固氮特性测定
对筛选出的PGPR菌株进行溶磷及固氮特性的测定(表1)。6株PGPR菌株的溶磷量范围在298.17~554.67 mg/L之间,各菌株溶磷量差异显著(P<0.05),其中菌株TPRS3的溶磷能力最强,溶磷量达554.67 mg/L;菌株TPRS5和TPRS19的溶磷量次之,但均在500 mg/L以上。菌株TPRS19的固氮酶活性最高,达456.87 nmol C2H4/(mL·h);TPRS5次之, 为395.26 nmol C2H4/(mL·h);菌株TPRS3和TPRS12未检测到固氮酶活性。综合分析,菌株TPRS5和TPRS19溶磷和固氮特性都较好,TPRS10次之,TPRS2最低。菌株TPRS3和TPRS12虽然溶磷量较高,但是它们不具备固氮特性。
2.3 优良PGPR菌株分泌激素特性测定
表1 优良促生菌株溶磷及固氮特性
Table 1 Phosphate solubilization and nitrogenase activity of tested plant growth promoting rhizobacteria
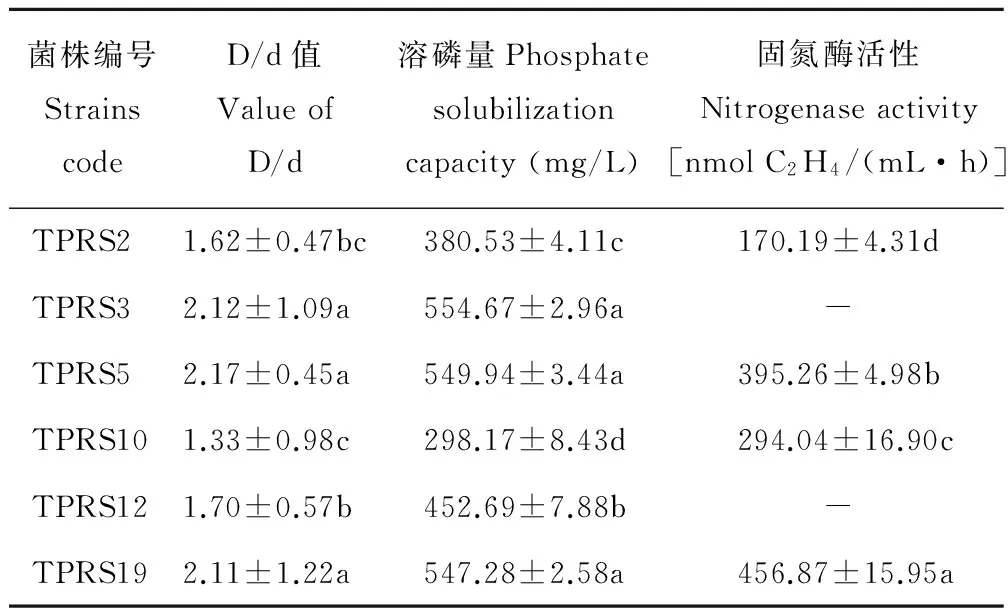
菌株编号StrainscodeD/d值ValueofD/d溶磷量Phosphatesolubilizationcapacity(mg/L)固氮酶活性Nitrogenaseactivity[nmolC2H4/(mL·h)]TPRS21.62±0.47bc380.53±4.11c170.19±4.31dTPRS32.12±1.09a554.67±2.96a-TPRS52.17±0.45a549.94±3.44a395.26±4.98bTPRS101.33±0.98c298.17±8.43d294.04±16.90cTPRS121.70±0.57b452.69±7.88b-TPRS192.11±1.22a547.28±2.58a456.87±15.95a
注:同列不同小写字母表示差异显著(P<0.05),下同。
Note: Different miniscules letters in the same column mean significant differences among different stains at the 0.05 level, the same below.
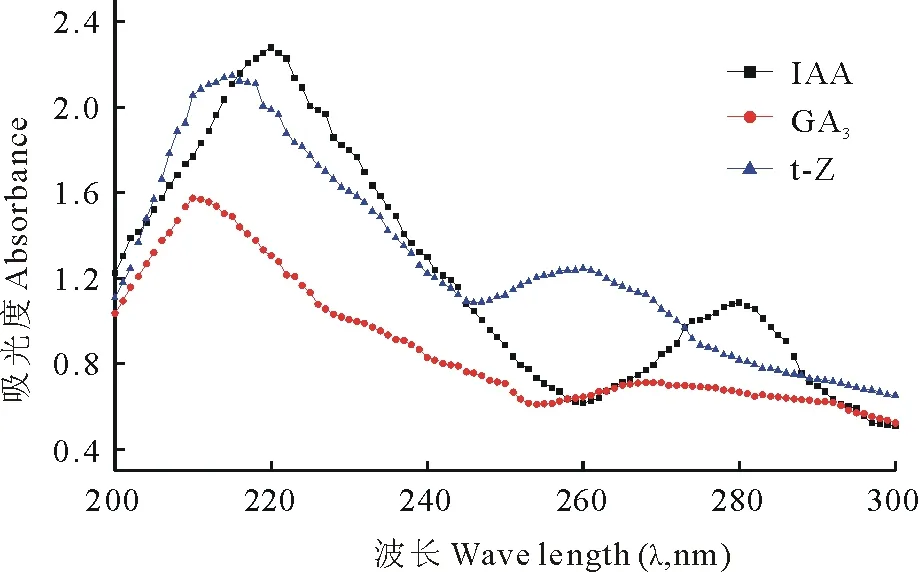
图1 混合激素标准品的紫外光谱图Fig.1 The ultraviolet spectrogram of the mixture of hormones standards
2.3.1 检测波长的选择 在190~400 nm的范围内,用紫外可见分光光度计扫描混合标准品溶液。3种植物激素的最大吸收波长分别为IAA:220、280 nm;GA3:210 nm;t-Z:215、260 nm。以吸光度为纵坐标,波长λ(nm)为横坐标,绘制紫外光谱图(图1)。可见3种组分在波长为210 nm处都具有比较大的吸收,因此,为了简化测定方法,并得到较为理想的检测结果,实验选择了210 nm作为测定波长。
2.3.2 流动相的选择 实验采用甲醇—水为流动相。有研究表明,以甲醇—水为流动相,在水相中不添加任何添加剂时,无论怎样改变甲醇和水的比例,其色谱图峰形不好且拖尾严重,如果在此基础上加入一定量的乙酸,就可以抑制溶质的离子化,使分离得到改善[18]。实验选择了体积比为2∶3的甲醇-水(含0.2%冰乙酸)二元混合溶剂作为流动相。
2.3.3 色谱柱柱温的选择 将柱温分别设定为20、25、30、35、40 ℃,分析3种标准品储备液的色谱图。结果表明,柱温对色谱图峰型的影响不大,主要影响分离度和保留时间。温度升高,色谱峰前移,保留时间缩短。综合考虑激素的适宜保存温度并避免分析时间过长,本实验选择30 ℃作为检测柱温。
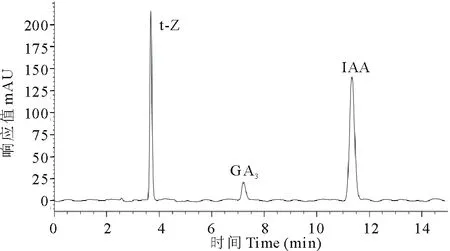
图2 混合激素标准品的色谱图Fig.2 Chromatogram of the mixture of hormones standard
在上述选定的色谱条件下,对混合标准样品进行检测(图2)。从图2可以看出,3种植物激素可以较好地分离和检出。
2.3.4 线性关系考察及检出限、定量限的测定 配制不同浓度梯度的系列标准溶液在已建立好的色谱条件下进样分析。以峰面积为纵坐标(Y),质量浓度(mg/L)为横坐标(X),绘制标准曲线,计算各标准曲线的回归方程、相关系数和线性范围。配制混合标准溶液并逐步稀释,以信噪比(RS/N)为3时所对应的化合物浓度为检出限(LOD),以信噪比(RS/N)为10时所对应的化合物浓度为定量限(LOQ)。以上结果均见表2。由表2可知,3种植物激素在各自的线性范围内与峰面积呈线性关系;3种激素的检出限为0.08~0.12 mg/L,定量限为0.13~0.21 mg/L,说明该方法有较高的灵敏度。
表2 植物激素标准曲线的回归方程、相关系数、线性范围、检出限和定量限
Table 2 Regression equations, correlation coefficients, linear range, limit of detection (LOD) and limits of quantification (LOQ) of the plant hormones
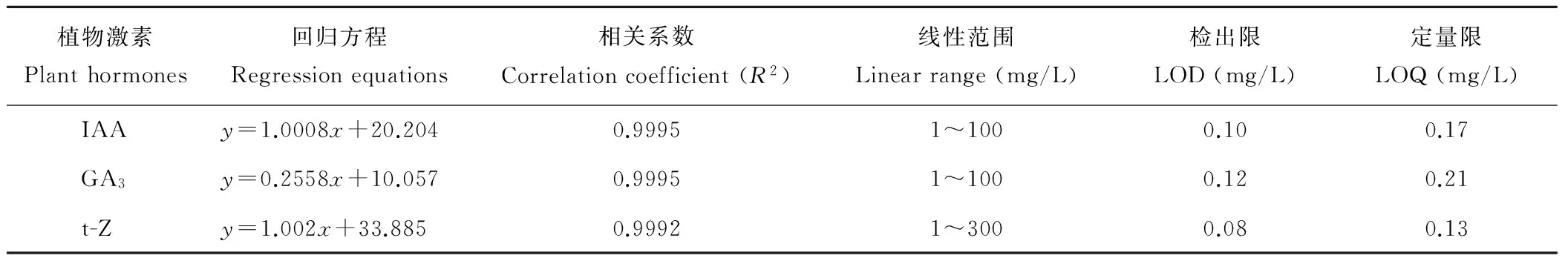
植物激素Planthormones回归方程Regressionequations相关系数Correlationcoefficient(R2)线性范围Linearrange(mg/L)检出限LOD(mg/L)定量限LOQ(mg/L)IAAy=1.0008x+20.2040.99951~1000.100.17GA3y=0.2558x+10.0570.99951~1000.120.21t-Zy=1.002x+33.8850.99921~3000.080.13
2.3.5 加标回收率试验 通过向菌株发酵产物中添加激素标准品来计算回收率。精确量取已知3种激素含量的发酵液各6份,向其中定量添加混合标准溶液,并按1.5.4的色谱条件进行分析,根据测定结果中3种激素的测得量计算相应的回收率和相对标准偏差,结果见表3。菌株发酵产物中的植物激素回收率比较稳定,为96.65%~105.77%,相对标准偏差为1.00~2.19。结果表明上述试验方法准确度较高,能应用于细菌发酵产物中激素的同时检测分析。
2.3.6 优良PGPR菌株3种激素含量测定 对6株PGPR菌株进行3种植物激素含量测定,结果如表4所示。由表4可知,3种激素含量差异显著。菌株TPRS2的t-Z含量最高,达141.68 mg/L,但未能检测出GA3。菌株TPRS10只检测出GA3,t-Z和IAA均未检测出。其余4株菌均能检测出3种激素,其中菌株TPRS3的GA3含量最低,且t-Z和IAA的含量都比TPRS5和TPRS19低;菌株TPRS12的t-Z和IAA含量均是最低;菌株TPRS5分泌GA3能力最强;菌株TPRS19分泌t-Z能力仅次于TPRS2,分泌IAA能力最强。综合分析,菌株TPRS5和TPRS19分泌3种激素的能力均较强,TPRS3和TPRS12次之,TPRS2分泌t-Z和IAA能力较强,但没有分泌GA3能力,TPRS10分泌激素能力最差。菌株TPRS5和TPRS19的色谱图如图3所示。
2.4 优良PGPR菌株的鉴定
通过对筛选出的6株优良PGPR菌株溶磷、固氮及分泌激素特性的测定和分析,选取促生特性相对较好的菌株TPRS5和TPRS19进行菌种鉴定。
菌株TPRS5和TPRS19的形态特征和生理生化特性测定结果见表5和6。将测得的2株PGPR菌株的16S rDNA序列与相近种属的16S rDNA序列进行对比,用MEGA 5.0软件进行系统进化分析,系统发育树如图4所示。经Blast相似性分析,菌株TPRS5序列与Bacillussubtilisstrain BCRC 10058(DQ993674)的同源性达100%,菌株TPRS19序列与EnterobactercloacaestrainRN2(KC990822)的同源性达100%。
表3 3种植物激素回收率测定
Table 3 Recovery tests for 3 plant hormones (n=6)
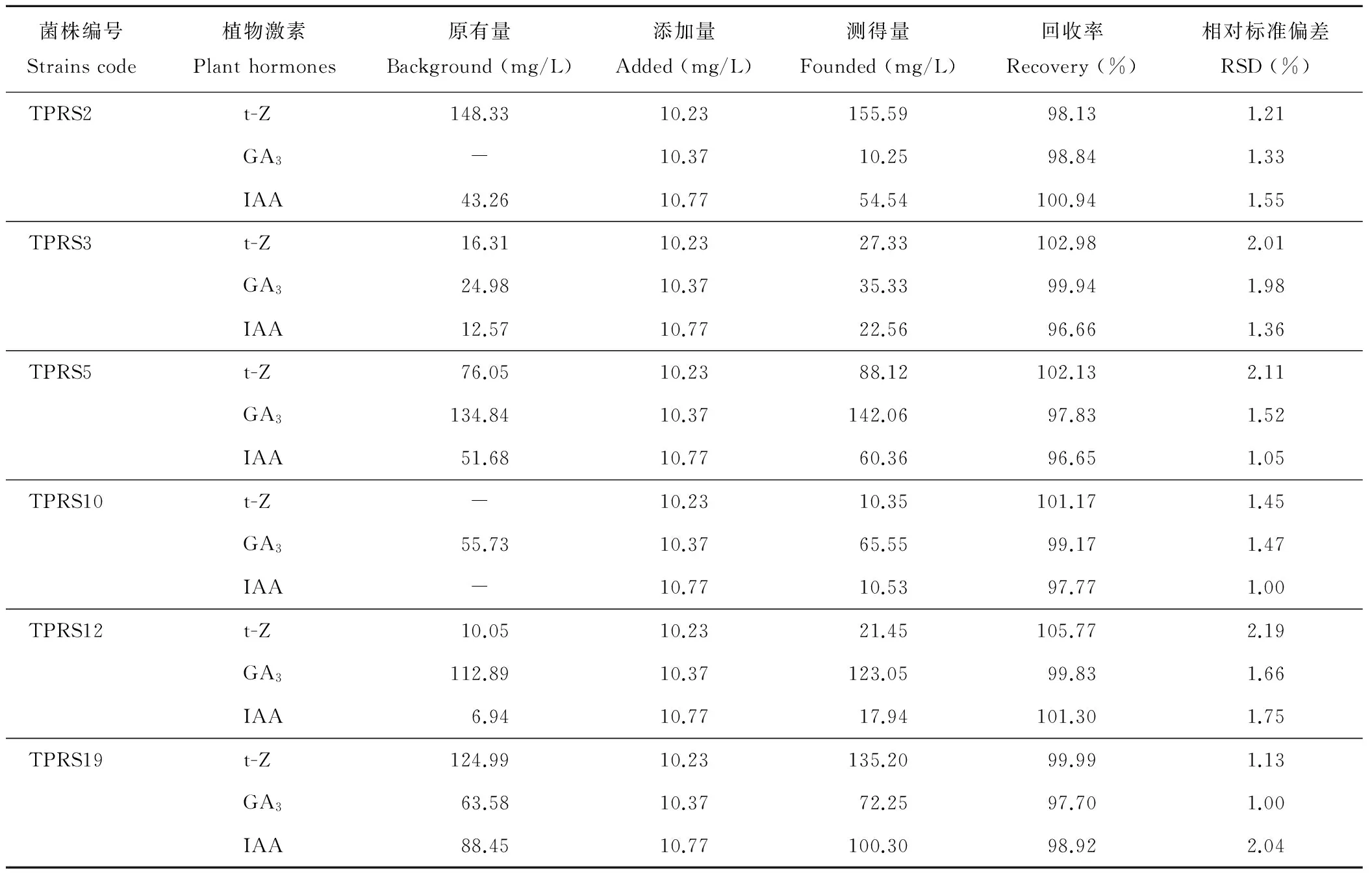
菌株编号Strainscode植物激素Planthormones原有量Background(mg/L)添加量Added(mg/L)测得量Founded(mg/L)回收率Recovery(%)相对标准偏差RSD(%)TPRS2t-Z148.3310.23155.5998.131.21GA3-10.3710.2598.841.33IAA43.2610.7754.54100.941.55TPRS3t-Z16.3110.2327.33102.982.01GA324.9810.3735.3399.941.98IAA12.5710.7722.5696.661.36TPRS5t-Z76.0510.2388.12102.132.11GA3134.8410.37142.0697.831.52IAA51.6810.7760.3696.651.05TPRS10t-Z-10.2310.35101.171.45GA355.7310.3765.5599.171.47IAA-10.7710.5397.771.00TPRS12t-Z10.0510.2321.45105.772.19GA3112.8910.37123.0599.831.66IAA6.9410.7717.94101.301.75TPRS19t-Z124.9910.23135.2099.991.13GA363.5810.3772.2597.701.00IAA88.4510.77100.3098.922.04
将形态特征、生理生化特性及分子生物学鉴定三者结合起来,就可以弥补任何一种单一方法的不足,最终可以准确确定菌株的种属。综合分析,确定菌株TPRS5为枯草芽孢杆菌(Bacillussubtilis),菌株TPRS19为阴沟肠杆菌(Enterobactercloacae)。
3 讨论
土壤中磷素水平是影响植物生长发育的重要因素,我国土壤耕层的全磷含量很高,但由于存在磷固定现象,土壤中95%以上的磷为无效磷,植物很难利用[19-20]。如何有效利用土壤中被固定的无效态磷,并提高磷肥的使用效率,对减少农牧业生产中磷肥的使用和磷矿资源的消耗有着重要意义。在植物根际存在一类特殊的微生物类群,能将土壤中难溶性磷转化为植物可吸收利用的可溶性磷[21]。研究表明,在植物根际存在不同种类的溶磷菌,且溶磷菌溶磷能力差异较大。辛桢凯等[22]研究了溶磷菌的溶磷能力,菌株XH1和XH2溶解磷酸钙的能力很强,液培7 d后溶磷量为267.08和415.69 mg/L。冯瑞章等[23]测定苜蓿(Medicagosativa)根际溶磷细菌菌株Lx191,培养8 d后,溶磷量为154.3 mg/L。刘小玉等[24]从油茶(Camelliaoleifera)根际分泌的溶磷菌株6-Y-09溶磷能力最强,溶磷量为201.38 mg/L。造成溶磷菌溶磷能力差异的主要原因是菌株本身的特性,此外,溶磷机理的多样性以及培养条件等也是影响溶磷菌溶磷能力的因素。本研究从苔草根际分离出21株溶磷菌株,利用定性和定量的方法最终筛选出6株溶磷量较高的菌株,溶磷量为298.17~554.67 mg/L,并且利用乙炔还原法测定溶磷菌株的固氮能力,有4株菌株兼具溶磷和固氮特性,其中菌株TPRS5和TPRS19的溶磷和固氮能力均较强,在后期研制微生物肥料中具有巨大潜力,这与姚拓[25]和李显刚等[26]的研究结果相似。
表4 优良PGPR菌株3种植物激素含量
Table 4 The contents of 3 plant hormones in tested plant growth promoting rhizobacteria mg/L
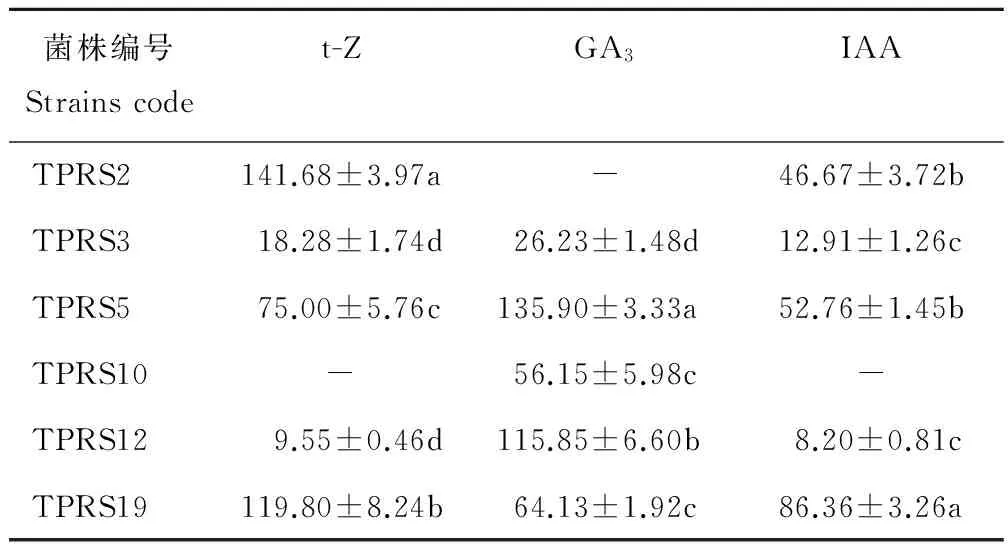
菌株编号Strainscodet-ZGA3IAATPRS2141.68±3.97a-46.67±3.72bTPRS318.28±1.74d26.23±1.48d12.91±1.26cTPRS575.00±5.76c135.90±3.33a52.76±1.45bTPRS10-56.15±5.98c-TPRS129.55±0.46d115.85±6.60b8.20±0.81cTPRS19119.80±8.24b64.13±1.92c86.36±3.26a
注:标准偏差(n=3)。
Note: Data presented are in means±standard deviation (n=3).
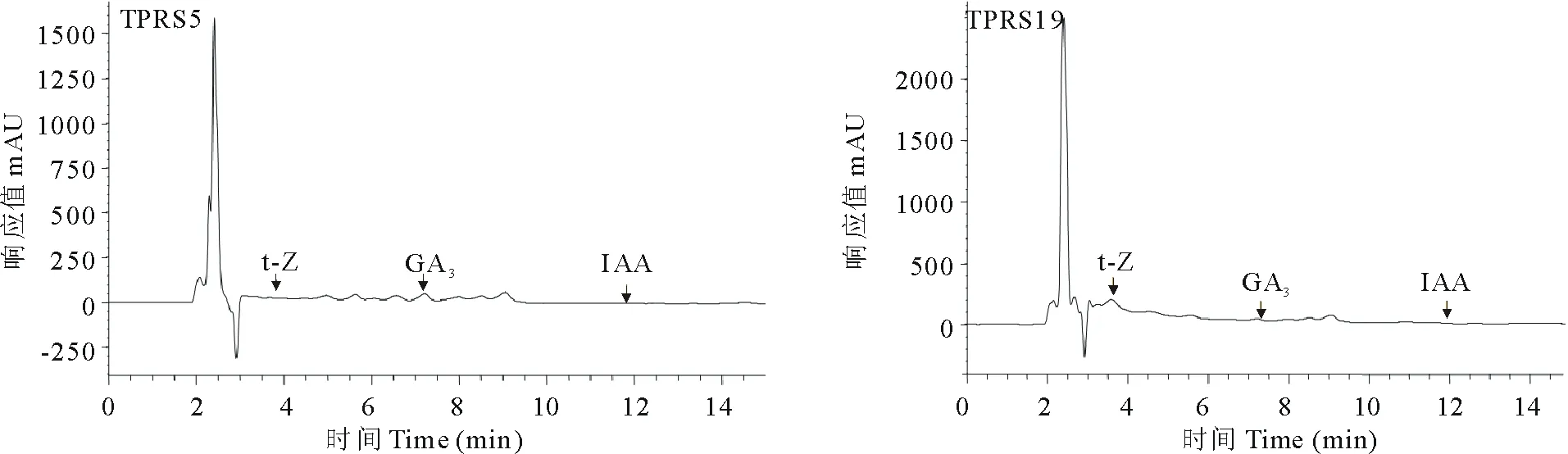
图3 优良根际促生菌的色谱图Fig.3 Chromatograms of tested plant growth promoting rhizobacterias
表5 菌株的表型特征及革兰氏染色情况
Table 5 The phenotypic characteristic and gram stain of strains
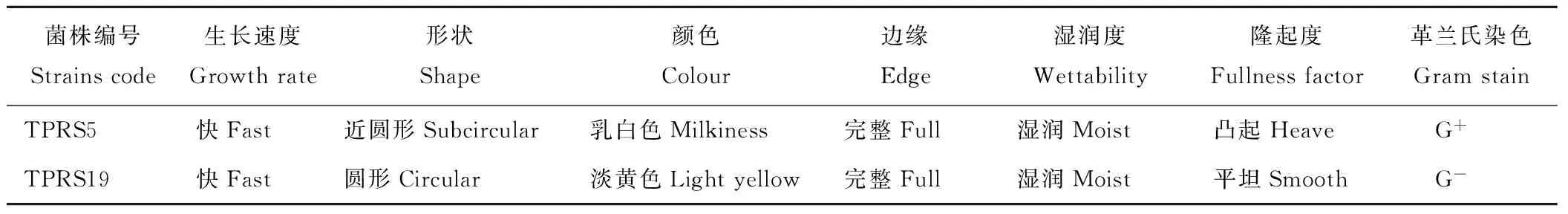
菌株编号Strainscode生长速度Growthrate形状Shape颜色Colour边缘Edge湿润度Wettability隆起度Fullnessfactor革兰氏染色GramstainTPRS5快Fast近圆形Subcircular乳白色Milkiness完整Full湿润Moist凸起HeaveG+TPRS19快Fast圆形Circular淡黄色Lightyellow完整Full湿润Moist平坦SmoothG-
表6 菌株的生理生化特性
Table 6 The physiological-biochemical characteristic of strains

菌株编号Strainscode接触酶Catalase氧化酶Oxidase葡萄糖产酸Glucoseproductingacid木糖产酸Xyloseproductingacid木聚糖产酸Xylanproductingacid葡萄糖产气Glucoseproductinggas明胶水解Gelatinhydrolysis酪朊水解Caseinatehydrolysis淀粉水解Starchhydrolysis柠檬酸盐利用CitrateutilizationV-P测定V-Ptest吲哚产生IndoleproducingTPRS5+++++-+++++-TPRS19--+++--++++-
“+”阳性Positive;“-”阴性Negative.
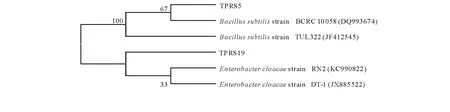
图4 菌株的系统发育树Fig.4 Phylogenetic tree of strains
PGPR中的多数细菌具有分泌激素的能力,但分泌量差异较大。李显刚等[27]利用Salkowski比色法测定了PGPR菌株分泌IAA的能力,11株溶磷菌株中只有1株没有分泌激素能力,菌株LC20分泌IAA含量为42.39 mg/L。雷学军等[28]同样利用比色法测定了甜高粱根际溶磷菌的分泌IAA能力,结果表明供试的5株溶磷菌都具有分泌IAA的能力,菌株WD20分泌能力最强,分泌量为27.79 mg/L。目前植物激素的测定方法主要可以分为生物鉴定法、免疫分析法和色谱分析法三大类[29]。生物鉴定法是一种非常经典的检测分析法,但它只是一种半定量检测法,而且耗时长,对检测条件要求严格,一般化学分析实验室难以实现。免疫分析法虽然显示出较低的检测限,但是其制备抗体的交叉反应问题仍未得到解决。目前,色谱法应用最广,可同时检测多种植物激素,且定量准确[30]。本研究利用HPLC同时测定IAA、GA3和t-Z 3种植物激素含量,菌株TPRS19分泌IAA能力最强,菌株TPRS5分泌GA3能力最强,分泌t-Z能力最强的为菌株TPRS2,但是其不具备分泌GA3的能力。造成菌株分泌激素能力差异的原因较多,如菌株种类、生理特性以及培养条件等都会影响其分泌激素的能力。
16S rDNA序列分析技术是分类鉴别微生物菌种的有效方法之一,被应用于各类菌株遗传特性和分子差异的分析研究中。应用16S rDNA序列分析鉴定技术可以简便、快速、标准地完成菌株鉴定。目前报道的PGPR的种类达15个属,主要有芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、固氮螺菌属(Azospirillum)、固氮菌属(Azotobacter)、肠杆菌属(Enterobacter)、克雷伯氏菌属(Klebsiella)、产碱菌属(Alcaligens)、节杆菌属(Arthobacter)、沙雷氏菌属(Serratia)、伯克霍尔德氏菌属(Burkholderia)、拜叶林克氏菌属(Beijerinckia)、农杆菌属(Agrobacterium)、埃文氏菌属(Eriwinia)、黄杆菌属(Flavobacterium)和巴斯德氏芽菌属(Pasteuria)[31-33]。本研究中鉴定的兼具溶磷、固氮和分泌激素能力的2个PGPR菌株分别是枯草芽孢杆菌和阴沟肠杆菌,这2个种属于常见的PGPR菌株种类,在PGPR研究中具有重要地位。Paul等[34]在1989年就发现枯草芽孢杆菌具有良好的溶磷能力。Anyakwo等[35]通过研究枯草芽孢杆菌对铁矿石的溶磷作用发现其还具备很强的固氮能力。Selvaraj等[36]通过对PGPR菌株的促生特性的研究,证实了枯草芽孢杆菌除了有溶磷固氮的能力外,还兼具分泌IAA和生防的功能。1991年,Koga等[37]研究了从苜蓿根际分离得到阴沟肠杆菌,并证明其具有溶磷和固氮的能力。顾金刚[38]在2000年从烟草(Nicotianatabacum)根际筛选出一株PGPR菌株RB-59,经过鉴定为阴沟肠杆菌。覃姚红[39]通过对玉米(Zeamays)种子内生固氮菌的研究发现,菌株5和2-7均为阴沟肠杆菌,将菌株接种小麦(Triticumaestivum)盆栽发现菌株2-7对小麦的促生作用最显著。本研究仅测定了PGPR菌株的溶磷、固氮和分泌激素能力,对其生防功能有待进一步研究。
4 结论
筛选出2株无脉苔草根际优良促生菌株TPRS5和TPRS19,兼具溶磷、固氮和分泌激素特性,经16S rDNA序列分析,确定菌株TPRS5为枯草芽孢杆菌,菌株TPRS19为阴沟肠杆菌,为微生物菌肥的研制提供了菌种资源。
[1] Ma W L, Han L B, Luo J C. A new lawn plant resource: genusCarexL. Pratacultural Science, 2001, 18(2): 43-45.
[2] Yang L J, Li X L, Shi D J,etal. Study on the bio-diversity of alpine plant communities in the higher altitude area of south Qinghai. Grassland and Turf, 2000, (2): 32-35.
[3] An L Z, Liu Y H, Feng G N,etal. Studies on ecological properties of altifrigetic subnival vegetation at the source area of Urumqi river. Acta Botanica Boreali-Occidentalia Sinica, 2000, 20(1): 98-105.
[4] Yu X J, Xu C L, Jing Y Y,etal. Effects of stratification in the winter on the seed germination characteristics of 5 alpine meadow plant species. Pratacultural Science, 2015, 32(3): 427-432.
[5] Adesemoye A O, Torbert H A, Kloepper J W. Enhanced plant nutrient use efficiency with PGPR and AMF in an integrated nutrient management system. Canadian Journal of Microbiology, 2008, 54(10): 876-886.
[6] Zhang Y. Screening Plant Growth Promoting Rhizobacteria Resources and their Promotion Mechanisms from Rhizosphere of Four Forages in Ali Alpine Grassland of Tibet[D]. Lanzhou: Gansu Agricultural University, 2013.
[7] Oliveira C A, Alves V M C, Marriel I E,etal. Phosphate solubilizing microorganisms isolated from rhizosphere of maize cultivated in an oxisol of the Brazilian Cerrado Biome. Soil Biology and Biochemistry, 2009, 41(9): 1782-1787.
[8] Ma W B, Yao T, Wang G J,etal. Assessment of rhizobacteria strains forViciasativa. Acta Prataculturae Sinica, 2014, 23(5): 241-248.
[9] Rong L Y, Chai Q, Yao T,etal. Partial replacement of chemical fertilizer by compound microbial inoculant and potential for promoting growth of intercroppedZeamaysandPisumsativum. Acta Prataculturae Sinica, 2015, 24(2): 22-30.
[10] Hafeez F Y, Yasmin S, Ariani D,etal. Plant growth-promoting bacteria as biofertilizer. Agronomy for Sustainable Development, 2006, 26(2): 143-150.
[11] Xu G H, Zheng H Y. Manual on Soil Microbial Analysis[M]. Beijing: Agricultural Press, 1986: 176-178.
[12] Hafeez F Y, Malik K A. Manual on Biofertilizer Technology[M]. Pakistan: NIBGE, 2000.
[13] Ma W W. Screening Plant Growth Promoting Rhizobacteria (PGPR) from Rhizosphere of Grasses and Estabilshing their Database Management System[D]. Lanzhou: Gansu Agricultural University, 2014.
[14] Yao T, Zhang D G, Hu Z Z. Associative nitrogen-fixing bacteria in the rhizosphere ofAvenasativain an alpine regionⅠIsolation and identification. Acta Prataculturae Sinica, 2004, 13(2): 106-111.
[15] Wang S L, Wang P, Wang C Y. Determination of endogenous hormones in (PinusmassonianaLamb.) using solid phase extraction-high performance liquid chromatography. Journal of Analytical Science, 2010, 26(5): 547-550.
[16] Buchanan R E, Gibbons N E. Bergey’s Manual of Systemaic Bacteriology[M]//Compiled by Institute of Microbiology Chinese Academy of Sciences. 8th ed. Beijing: Science Press, 1984.
[17] Dong X Z, Cai M Y. Manual of Common Bacterial System Identification[M]. Beijing: Science Press, 2001.
[18] Chen J H, Cao Y, Li C Z. High-efficient liquid chromatographic determination of the internal hormones inCastaneamollissimaBlume. Journal of Central South Forestry University, 2004, (5): 39-41.
[19] Lin B, Lin J X, Li J K. The change of yield and soil fertility with long-term fertilizer application. Plant Nutrition and Fertilizer Science, 1994, (1): 6-18.
[20] Xu J B. Distribution of soil organic matter, available phosphorus and available potassium in soils of Yangzhou. Soils, 2004, 36(1): 99-103.
[21] Zhao X R, Lin Q M. Phosphobacteria distribution in rhizophere and nonrhizosphere soil of Corn. Chinese Journal of Ecology, 2001, 20(6): 62-64.
[22] Xin Z K, Gong W Q, Hu C,etal. Study on screening of phosphate-solubilizing microbes and their ability of phosphorus removal. Journal of Wuhan University of Technology, 2011, 33(1): 121-124.
[23] Feng R Z, Yao T, Zhou W H,etal. Studies on the interactions between phosphate-solubilizing bacteria and nitrogen-fixing bacteria in rock phosphate solubilization. Acta Ecologica Sinica, 2006, 26(8): 2764-2769.
[24] Liu X Y, Fu D Q, Chen L Q,etal. Isolation, identification and phosphate-solubilizing capacity of phosphate-solubilizing bacteria from the rhizosphere of Camellia. Biotechnology Bulletin, 2015, 31(7): 169-173.
[25] Yao T. Associative nitrogen-fixing bacteria in the rhizosphere ofAvenasativain an alpine regionⅡPhosphate-solubilizing power and auxin production. Acta Prataculturae Sinica, 2004, 13(3): 85-90.
[26] Li X G, Yao T, Wang X L,etal. Characteristics and identification of a dissolving phosphate bacteria strain isolated from rhizosphere ofPuerarialobata. Soil and Fertilizer Sciences in China, 2012, (2): 87-91.
[27] Li X G, Wang X L, Yao T,etal. Characters of solubilizing phosphate, secreting IAA and organic acids of phosphorus-solubilizing bacteria from rhizosphere ofLotuscorniculatus. Chinese Journal of Soil Science, 2012, 43(6): 1385-1390.
[28] Lei X J, Wu Y, Huang X,etal. Phosphate dissolving capability and the affect of phosphate-dissolving bacteria in the rhizosphere onSorghumbicolor. Acta Prataculturae Sinica, 2014, 23(6): 274-278.
[29] Fu J H, Sun X H, Wang J D,etal. Progress in quantitative analysis of plant hormones. Chinese Science Bulletin, 2011, 56(4): 355-366.
[30] Wu Q, Wang L, Wu D P,etal. Recent advances in sample preparation methods of plant hormones. Chinese Journal of Chromatography, 2014, 32(4): 319-329.
[31] Hu J C, Xue D L, Ma C X,etal. Research advances in plant growth-promoting rhizobacteria and its application prospects. Chinese Journal of Applied Ecology, 2004, 15(10): 1963-1966.
[32] Kang Y J, Cheng J, Mei L J,etal. Screening and identification of plant growth-promoting-rhizobacteria. Acta Microbiologica Sinica, 2010, 50(7): 853-861.
[33] Li W, Liu M, Zhang B X,etal. Research progress and application status of plant growth promoting rhizobacteria. Chinese Agriculutral Science Bulletin, 2014, 30(24): 1-5.
[34] Paul E A, Clark F E. Soil Microbiology and Biochemistry[M]. San Diego, California: Academic Press, 1989.
[35] Anyakwo C N, Obot O W. Laboratory studies on phosphorus removal from Nigeria’s Agbaja iron ore byBacillussubtilis. Journal of Minerals & Materials Characterization & Engineering, 2011, 10(9): 817-825.
[36] Selvaraj T, Sumithra P. Effect ofGlomusaggregatumand plant growth promoting rhizomicroorganisms on growth, nutrition and content of secondary metabolites inGlycyrrhizaglabraL.Indian Journal Applied & Pure Biology, 2011, 26(2): 283-290.
[37] Koga J, Adachi T, Hidaka H. IAA biosynthetic pathway from tryptophan via Indole-3-pyruvic acid inEnterobactercloacae. Agricultural and Biological Chemistry, 1991, 55(3): 701-706.
[38] Gu J G. Antagonistic Tobacco Growth-promoting Rizobaeteria Against Black Shank[D]. Beijing: Chinese Academy of Agricultural Sciences, 2000.
[39] Qin Y H. Identification of Endophytic Diazotroph Bacteria from Maize Seeds and Research of its Effects on Wheat Growth and Drought Resistance[D]. Yangling: Northwest A & F University, 2014.
[1] 马万里, 韩烈保, 罗菊春. 草坪植物的新资源——苔草属植物. 草业科学, 2001, 18(2): 43-45.
[2] 杨力军, 李希来, 石德军, 等. 青南高海拔地区高寒草甸植物群落多样性的研究. 草原与草坪, 2000, (2): 32-35.
[3] 安黎哲, 刘艳红, 冯国宁, 等. 乌鲁木齐河源区高寒冰缘植被的生态特征研究. 西北植物学报, 2000, 20(1): 98-105.
[4] 鱼小军, 徐长林, 景媛媛, 等. 冬季层积处理对 5 种高寒草甸植物种子萌发特性的影响. 草业科学, 2015, 32(3): 427-432.
[6] 张英. 西藏阿里高寒草原四种牧草根际促生菌资源筛选及促生机理研究[D]. 兰州: 甘肃农业大学, 2013.
[8] 马文彬, 姚拓, 王国基, 等. 根际促生菌筛选及其接种剂对箭筈豌豆生长影响的研究. 草业学报, 2014, 23(5): 241-248.
[9] 荣良燕, 柴强, 姚拓, 等. 复合微生物接种剂替代部分化肥对豌豆间作玉米的促生效应. 草业学报, 2015, 24(2): 22-30.
[11] 许光辉, 郑洪元. 土壤微生物分析方法手册[M]. 北京: 农业出版社, 1986: 176-178.
[13] 马文文. 禾草根际促生菌资源筛选及其数据库管理系统构建[D]. 兰州: 甘肃农业大学, 2014.
[14] 姚拓, 张德罡, 胡自治. 高寒地区燕麦根际联合固氮菌研究Ⅰ固氮菌分离及鉴定. 草业学报, 2004, 13(2): 106-111.
[15] 王水良, 王平, 王趁义. 固相萃取-高效液相色谱法测定马尾松组织中内源激素. 分析科学学报, 2010, 26(5): 547-550.
[16] 布坎南 R E, 吉本斯 N E. 伯杰细菌鉴定手册(第八版)[M]. 中国科学院微生物研究所《伯杰系统鉴定手册》编译组译. 北京: 科学出版社, 1984.
[17] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[18] 陈建华, 曹阳, 李昌珠. 板栗内源激素的高效液相色谱测定方法. 中南林学院学报, 2004, (5): 39-41.
[19] 林葆, 林继雄, 李家康. 长期施肥的作物产量和土壤肥力变化. 植物营养与肥料学报, 1994, (1): 6-18.
[20] 徐俊兵. 扬州市土壤有机质和速效磷钾的分布研究. 土壤, 2004, 36(1): 99-103.
[21] 赵小蓉, 林启美. 玉米根际与非根际解磷细菌的分布特点. 生态学杂志, 2001, 20(6): 62-64.
[22] 辛桢凯, 龚文琪, 胡纯, 等. 溶磷微生物的选育及除磷研究. 武汉理工大学学报, 2011, 33(1): 121-124.
[23] 冯瑞章, 姚拓, 周万海, 等. 溶磷菌和固氮菌溶解磷矿粉时的互作效应. 生态学报, 2006, 26(8): 2764-2769.
[24] 刘小玉, 付登强, 陈良秋, 等. 油茶根际溶磷菌的分离、鉴定及溶磷能力研究. 生物技术通报, 2015, 31(7): 169-173.
[25] 姚拓. 高寒地区燕麦根际联合固氮菌研究Ⅱ固氮菌的溶磷性和分泌植物生长素特性测定. 草业学报, 2004, 13(3): 85-90.
[26] 李显刚, 姚拓, 王小利, 等. 一株分离自葛藤根际高效溶磷细菌特性研究及菌株鉴定. 中国土壤与肥料, 2012, (2): 87-91.
[27] 李显刚, 王小利, 姚拓, 等. 溶磷菌的溶磷、分泌 IAA 及有机酸特性研究. 土壤通报, 2012, 43(6): 1385-1390.
[28] 雷学军, 吴毅, 黄馨, 等. 甜高粱根际溶磷菌溶磷能力及菌株特性研究. 草业学报, 2014, 23(6): 274-278.
[30] 吴倩, 王璐, 吴大朋, 等. 植物激素样品前处理方法的研究进展. 色谱, 2014, 32(4): 319-329.
[31] 胡江春, 薛德林, 马成新, 等. 植物根际促生菌(PGPR)的研究与应用前景. 应用生态学报, 2004, 15(10): 1963-1966.
[32] 康贻军, 程洁, 梅丽娟, 等. 植物根际促生菌的筛选及鉴定. 微生物学报, 2010, 50(7): 853-861.
[33] 李琬, 刘淼, 张必弦, 等. 植物根际促生菌的研究进展及其应用现状. 中国农学通报, 2014, 30(24): 1-5.
[38] 顾金刚. 烟草根际促生细菌的分离、筛选及防治黑胫病研究[D]. 北京: 中国农业科学院, 2000.
[39] 覃姚红. 玉米种子内生固氮菌的鉴定及其对小麦生长及抗旱能力影响的研究[D]. 杨凌: 西北农林科技大学, 2014.
Identification and study on the effects of plant growth promoting rhizobacteria ofCarexenervis
LIU Ting, YAO Tuo*, CHEN Jian-Gang, MA Wen-Bin, LIU Huan, MA Cong-Yu, JIANG Yong-Mei
CollegeofPrataculturalScience,GansuAgriculturalUniversity,KeyLaboratoryofGrasslandEcosystem,MinistryofEducation,PrataculturalEngineeringLaboratoryofGansuProvince,Sino-U.S.CenterforGrazinglandEcosystemSustainability,Lanzhou730070,China
Six plant growth-promoting rhizobacteria were isolated fromCarexenervis. We analyzed the six strains to evaluate their phosphate solubilization (by molybdenum blue colorimetry), nitrogen fixation (by the acetylene reduction assay), and hormone secretion (by high performance liquid chromatography). The two strains with the strongest P solubilization and N fixation abilities were identified by analyses of their 16S rDNA sequences. The results showed that the phosphate solubilization capacity of the six strains ranged from 298.17 to 554.67 mg/L (in strain TPRS3). Four strains were able to fix nitrogen, with nitrogenase activity ranging from 170.19 to 456.87 nmol C2H4/(mL·h) (in strain TPRS19), while strains TPRS3 and TPRS12 lacked nitrogenase activity. All six strains secreted hormones (indole acetic acid (IAA), ranging from 8.20 to 86.36 mg/L; gibberellin (GA3) ranging from 26.36 to 135.90 mg/L; and trans-zeatin (t-Z), ranging from 9.55 to 141.68 mg/L). Strain TPRS19 secreted the largest amount of IAA (86.36 mg/L), strain TPRS5 secreted the largest amount of GA3(135.90 mg/L), and TPRS2 secreted the largest amount of t-Z (141.68 mg/L). Strains TPRS3, TPRS5, TPRS12, and TPRS19 could secrete all three hormones simultaneously. Strain TPRS5 was identified asBacillussubtilisand TPRS19 was identified asEnterobactercloacae. These strains have the potential for use as microbial fertilizers.
Carexenervis; plant growth promoting rhizobacteria; phosphate solubilization; nitrogen fixation; hormone secretion; strain identification
10.11686/cyxb2016026
http://cyxb.lzu.edu.cn
2016-01-20;改回日期:2016-03-08
国家自然科学基金项目(31360584)资助。
刘婷(1989-),女,甘肃武威人,在读硕士。E-mail: 651885541@qq.com*通信作者Corresponding author. E-mail: yaotuo@gsau.edu.cn
刘婷, 姚拓, 陈建纲, 马文彬, 刘欢, 马骢毓, 蒋永梅. 无脉苔草根际优良促生菌鉴定及其作用研究. 草业学报, 2016, 25(12): 130-139.
LIU Ting, YAO Tuo, CHEN Jian-Gang, MA Wen-Bin, LIU Huan, MA Cong-Yu, JIANG Yong-Mei. Identification and study on the effects of plant growth promoting rhizobacteria ofCarexenervis. Acta Prataculturae Sinica, 2016, 25(12): 130-139.
