大麦醇溶蛋白的制备及其理化性质研究
2016-12-26管骁赵欣殷婷
管 骁 赵 欣 殷 婷
(上海理工大学医疗器械与食品学院,上海 200093)
大麦醇溶蛋白的制备及其理化性质研究
管 骁 赵 欣 殷 婷
(上海理工大学医疗器械与食品学院,上海 200093)
以大麦粉为原料制备大麦醇溶蛋白,并对其理化性质进行了系统研究。结果显示粗蛋白质量分数高达92.63%,且主要以醇溶蛋白B组分(相对分子质量36~43 k)与C组分(相对分子质量45~60 k)为主。大麦醇溶蛋白的红外光谱图呈现典型的蛋白谱图特征,1 650、1 535及1 448 cm-1处的吸收峰,分别反映了蛋白质酰胺Ι、酰胺Ⅱ、酰胺Ⅲ的特征结构。蛋白中游离巯基的含量为4.27 μmol/g,总巯基含量为24.1 μmol/g,二硫键含量为9.9 μmol/g,表面疏水性为283.93,蛋白中主要氨基酸组成包括谷氨酸与脯氨酸,氨基酸模式不理想。原子力显微镜结果显示大麦醇溶蛋白分子呈椭球状,尺寸大小约5.1 nm。
大麦醇溶蛋白 制备 理化性质
大麦胚乳蛋白质可分为清蛋白、球蛋白、醇溶蛋白和谷蛋白,其中醇溶蛋白质占大麦总蛋白的40%~60%,是种子蛋白的重要组成部分[1]。,大麦醇溶蛋白相对分子质量约30 000~50 000 u[2],并具有一些独特的功能性质,包括水不溶性、流变性、延伸性、膨胀性、成膜性和胶凝性等,可用乙醇-水混合溶液、异丙醇-水混合溶液及乙酸等作为溶剂进行提取。大麦醇溶蛋白的来源非常丰富,随着大麦淀粉加工、啤酒行业的发展,其副产物大麦醇溶蛋白未能得到充分利用。因此,在节约型环保社会发展进程中,这一巨大潜在蛋白资源的回收和综合开发利用成为当务之急,同时也可为大麦醇溶蛋白的生产提供新途径。
从大麦粉中提取大麦醇溶蛋白,并分析大麦醇溶蛋白的理化性质,包括相对分子质量、分子巯基与二硫键含量、表面疏水性及其氨基酸组成、分子表面形态等,为大麦醇溶蛋白的开发利用提供参考。
1 材料与方法
1.1 试验材料
大麦粉:市售。
1.2 主要设备
傅里叶红外光谱仪:美国珀金埃尔默仪器(上海)有限公司;氨基酸自动分析仪:安捷伦公司;S-3000N型扫描电子显微镜:日立仪器有限公司。
1.3 试验方法
1.3.1 大麦醇溶蛋白提取[3]
称取一定量大麦粉(过40目筛),按1∶6(m/V)的比例加入正己烷,室温条件下浸泡脱脂,离心后风干待用。按1∶6(m/V)的比例往脱脂大麦粉中加入1 mol/L NaCl溶液,55 ℃磁力搅拌30 min,离心(转速4 000 r/min,15 min)除去上清液,如此反复2次;然后按1∶6(m/V)的比例往沉淀中加入蒸馏水,55 ℃磁力搅拌30 min,离心分离洗涤沉淀,如此反复3次;最后按1∶10(m/V)的比例往沉淀中加入55%的异丙醇溶液,60 ℃磁力搅拌1 h(密封防止异丙醇挥发),离心分离(6 500 r/min,15 min)收集上清液保存于4 ℃过夜,低温高速离心(4 ℃,12 000 r/min,15 min)得到蛋白沉淀,并用55%异丙醇溶液复溶,冻干得到大麦醇溶蛋白。
1.3.2 聚丙烯酰胺凝胶电泳分析(SDS-PAGE)
参照朱广廉等[4]的方法进行。
1.3.3 傅里叶变换红外光谱分析(FTIR)
对大麦醇溶蛋白粉末用傅里叶变换红外光谱仪进行透射扫描,扫描范围为400~4 000 cm-1,扫描次数为25次,分辨率为4 cm-1。
1.3.4 大麦醇溶蛋白巯基与二硫键分析
巯基含量测定参考文献[6],稍作改动。
游离巯基含量测定:将20 mg大麦醇溶蛋白溶解于10 mL的0.2 mol/L Tris-HCl,pH 8.0的缓冲液A(含8 mol/L尿素、3 mmol/L EDTA和l%SDS)中后,取出溶解液3 mL,然后加入0.2 mol/L Tris-HC1、pH 8.0的缓冲液B(含10 mmol/L DTNB)0.3 mL,避光条件下磁力搅拌30 min,412 nm测定吸光度。
总巯基含量测定:(i) NTSB 的制备:100 mg的Ellman试剂溶解到10 mL 1 mol/L的亚硫酸钠溶液中,在38 ℃下通入氧气直到亮红色溶液变成淡黄色,表明 NTSB 已经生成。(ii)将20 mg大麦醇溶蛋白溶解于10 mL 0.2 mol/L Tris-HCl,pH 8.0的缓冲液(含8 mol/L尿素,3 mmol/L EDTA,l%SDS与0.1 mol/L Na2SO3)中,取溶解液3 mL,然后加入0.2 mol/L Tris-HCl,pH 9.5的缓冲液(含8 mol/L尿素,3 mmol/L EDTA,l% SDS,0.1 mol/L Na2SO3与10 mL/L NTSB)0.3 mL,避光条件下磁力搅拌30 min,412 nm测定吸光度。
-SH(μmol/g) = 73.53×A412×D/C
-S-S-(μmol/g)=(总巯基含量-游离巯基含量)/2
式中:A412为样品吸光度;D为稀释倍数;C为样品固形物含量。
1.3.5 大麦醇溶蛋白表面疏水性测定
将大麦醇溶蛋白溶解于0.01 mol/L,pH为7.0的PBS缓冲液中,配置成0.01~1 mg/mL的蛋白溶解液。分别取样品液2 mL,加入15 μL、8 mmol/L的荧光探针试剂ANS震荡,室温下静止15 min。选择激发波长390 nm,发射波长470 nm测定荧光强度。以荧光强度对蛋白溶液浓度作图并进行线性回归,以线性回归斜率作为蛋白表面疏水性指数。
1.3.6 蛋白质氨基酸分析
参照GB/T 5009.124—2003方法测定。取一定量的大麦醇溶蛋白,用6 mol/L HCl溶液于110 ℃水解24 h,烘干,然后加入标准缓冲液溶解,稀释到合适的氨基酸浓度,用氨基酸自动分析仪在338 nm检测波长下测定样品氨基酸组成。
1.3.7 原子力显微镜分析(AFM)
称取大麦醇溶蛋白,按1 mg/mL的浓度完全溶解于55%乙醇溶液中。取一定量溶液悬滴于干净云母片表面,室温下浸润1 h后,倾倒风干后即可上机测试[5]。利用NanoScope ⅢA Multimode型原子力显微镜(Veeco Instruments Inc., Santa Barbara, CA),采用轻敲模式(Tapping Mode)成像。所有图像在分析前进行平滑处理。利用AFM自带软件Nanoscope 5.30中的截面形状分析(section analysis)功能对蛋白形态进行定量分析。
2 结果与讨论
2.1 大麦醇溶蛋白SDS-PAGE分析
大麦醇溶蛋白属于大麦贮存蛋白,主要存在于大麦的淀粉胚乳层中,约占籽粒总蛋白含量的30%~50%。本试验所用大麦粉原料蛋白质质量分数为10.7%,采用此蛋白提取工艺蛋白提取率为20.62%,提取率不高的原因可能是此原料中醇溶蛋白所占比例较低。根据相对分子质量大小,大麦醇溶蛋白可分为4个组分,B组分(36~43 k)、C组分(45~60 k)、D组分(80~90 k)和γ组分(12~16 k),其中组分B约占大麦醇溶蛋白总量的70%~80%;组分C约占10%~20%,组分D和γ含量较低,约占总量的5%[7-8]。本试验制备的大麦醇溶蛋白的SDS-PAGE图谱如图1所示。从图1可看出,通过该工艺制备的大麦醇溶蛋白主要包括2簇蛋白带,分别为相对分子质量30~40 k与45~50 k,对应于大麦醇溶蛋白B组分与C组分。同时可发现在低分子质量处(小于30 k)有微量其他蛋白组分存在,这可能是由于提取过程中微量的非醇溶性蛋白同时溶出造成的。凯氏定氮结果表明所提取大麦醇溶蛋白中粗蛋白质量分数为92.63%。
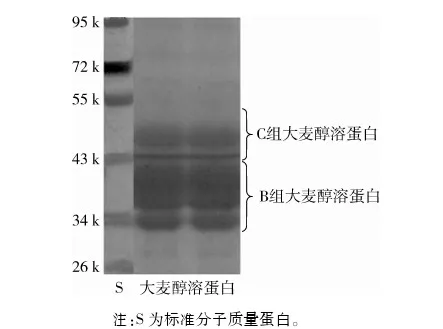
注:S为标准分子质量蛋白。
2.2 傅里叶变换红外光谱分析(FTIR)
大麦醇溶蛋白的红外光谱图如图2所示,呈现典型的蛋白谱图特征。1 650 cm-1、1 535 cm-1及1 448 cm-1处的吸收峰,分别反映了蛋白质酰胺Ι、酰胺Ⅱ、酰胺Ⅲ的特征结构。1 240 cm-1吸收峰主要由蛋白分子间氢键与β-折叠结构所引起[9-10],3 300 cm-1处吸收峰反映了-OH与-NH2的伸缩振动,2 962 cm-1处吸收峰是因蛋白质中-CH2-的对称伸缩所引起。由此可进一步证实采用本研究提取大麦醇溶蛋白是有效的。

图2 大麦醇溶蛋白红外光谱图
2.3 大麦醇溶蛋白巯基与二硫键含量
分子中的巯基与二硫键一直被视为蛋白质结构中重要的功能基团[13]。经测定,大麦醇溶蛋白中游离巯基的含量为4.265 μmol/g,总巯基的含量为24.118 μmol/g,二硫键的含量为9.927 μmol/g。同时,大麦醇溶蛋白分子中含有大量的疏水性氨基酸残基,而疏水氨基酸残基更容易围绕二硫键形成局部疏水中心,拒绝水分子进入蛋白分子的内部破坏氢键,更利于形成稳定的高级结构区域[14-15]。
2.4 大麦醇溶蛋白表面疏水性
ANS与蛋白质分子中芳香族氨基酸残基结合后, 390 nm激发波长下在470 nm处发生最大吸收,且荧光强度与蛋白表面疏水性成正相关[16]。如图3所示,大麦醇溶蛋白的表面疏水性高达283.93,高于大多数常见的食物蛋白,这主要是由于大麦醇溶蛋白中疏水性基团含量较高的缘故。
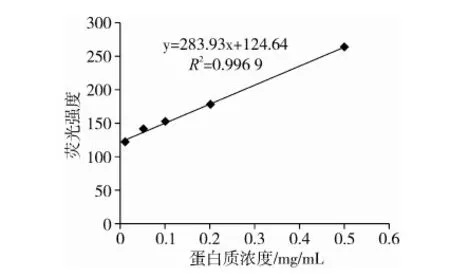
图3 大麦醇溶蛋白表面疏水性测定
2.5 大麦醇溶蛋白氨基酸组成分析
表1所示为大麦醇溶蛋白的氨基酸组成分析结果,由于蛋白样品在强酸条件下水解,因此色氨酸、天冬酰胺和谷氨酰胺遭到破坏无法检测。由表1可看出,大麦醇溶蛋白中谷氨酸含量最高,达到36.9%,次之为脯氨酸(15.6%),其后依次为苯丙氨酸、亮氨酸、缬氨酸。根据FAO/WHO建议的理想蛋白模式,质量较好的蛋白质其必需氨基酸与总氨基酸(E/T)的比值在36%以上,必需氨基酸与非必需氨基酸(E/N)的比值在60%以上[16]。从表1可知,大麦醇溶蛋白的E/T为25.8%,E/N为34. 7%,特别是谷物蛋白第一限制氨基酸—赖氨酸的质量分数仅占0.56%,说明大麦醇溶蛋白的营养价值较低,并非是一种理想的膳食蛋白。然而,谷物醇溶蛋白具有特殊的氨基酸模式,具有特殊黏结性、延伸性,并应用于食品保鲜、缓释材料载体等[8]。

表1 大麦醇溶蛋白氨基酸组成
2.6 原子力显微镜分析
图4所示为大麦醇溶蛋白的高度图(与表面形态相关)与相图(与机械强度差异相关)。图中显示大部分大麦醇溶蛋白呈单个分子分布状态,同时也存在少量蛋白聚集体。由图中还可看出,大麦醇溶蛋白分子在干态环境下基本呈椭球状,其尺寸大小可通过AFM的截面形态分析软件给出。本试验中,基于AFM的悬臂式探针的敲击原理,考虑将从蛋白颗粒顶部至基底表面的垂直高度作为蛋白椭球颗粒的度量尺寸,对所有单个蛋白分子进行测定并平均后可知,大麦醇溶蛋白分子大小约为5.1 nm(如图4c)。在此需指出的是,尽管测定蛋白分子流体动力学半径的常用方法是动态光散射方法(DLS),然而主要也是限于球状蛋白分子。应用DLS方法测定大麦醇溶蛋白尺寸存在以下两方面的限制:1)大麦醇溶蛋白分子主要是椭球状而非规则的球形;2)在溶液状态下蛋白分子之间容易发生相互作用呈结合状态,很难通过DLS方法去测定单个大麦醇溶蛋白分子的大小。
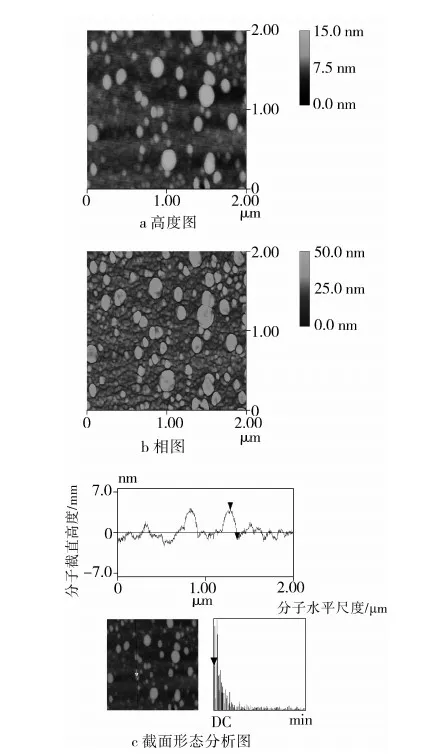
图4 大麦醇溶蛋白原子力显微镜图谱
3 结论
考察了以大麦粉为原料制备大麦醇溶蛋白的技术方案,测试结果显示获得的大麦醇溶蛋白纯度高达92.63%,主要包括组分B与组分C,说明该方案是可行的。对大麦醇溶蛋白的理化性质进行了测定,结果表明蛋白中游离巯基的含量为4.27 μmol/g,总巯基的含量为24.1 μmol/g,二硫键的含量为9.9 μmol/g,表面疏水性为283.93,蛋白中主要的氨基酸为谷氨酸与脯氨酸,氨基酸模式并不理想。原子力显微镜结果直观显示了大麦醇溶蛋白分子在干态环境中呈椭球状,椭球体直径约5.1 nm。
[1]Slack P T, Baxter E D, Wainwright T. Inhibition by hordein of starch degradation[J]. Journal of the Institute of Brewing, 1979, 85(2): 112-114
[2]Zhao J, Tian Z, Chen L. Effects of deamidation on the molecular structures and functional properties of barley hordein[J]. Journal of Agriculture and Food Chemistry, 2010, 58, 11448 -11455
[3]Wang C, Tian Z, Chen L, Temelli F, et al. Functionality of barley proteins extracted and fractionated by alkaline and alcohol methods[J]. Cereal Chemistry, 87(6):597-606
[4]朱广廉, 杨中汉.SDS-聚丙烯酰胺凝胶电泳法测定蛋白质的分子量[J]. 植物生理学通讯, 1982, 2: 43-47
[5]Morris, V J, Mackie, A R, Wilde, P J, et al. Atomic force microscopy as a tool for interpreting the rheology of food biopolymers at the molecular level[J]. Lebensmittel-Wissenschaft and-Technologie, 2001, 34:3-10
[6]罗明江, 罗春霞, 吴赣香.Ellman’s 试剂比色法测定食品中蛋白质的巯基和二硫键[J]. 郑州粮食学院学报, 1986, 23(1):92-95
[7]Shewry P R, Kreis M, Parmar S, Lew E J L. and Kasarda D D. Identication of γ-type hordeins in barley[J]. FEBS Letters 190,1985:61-64
[8]Howard K A, Gayler K R, Eagles H A, Halloran G M. The relationship between D hordein and malting quality in barley[J]. Journal of Cereal Science,1996,24:47-53
[9]Li Y, Jiang Y, Liu F, et al. Fabrication and characterization of TiO2/whey protein isolate nano-composite film[J]. Food Hydrocolloids, 2011, 25(5): 1098-1104
[10]Xia Y, Wang Y, Chen L. Molecular structure, physicochemical characterization, and in vitro degradation of barley protein films[J]. Journal of Agriculture and Food Chemistry, 2011, 59(24): 13221-13229
[11]郭云昌, 刘钟栋, 安宏杰, 等. 基于 AFM 的玉米醇溶蛋白的纳米结构研究[J]. 郑州工程学院学报,2004, 25(4):8-11
[12]Guo Y, Liu Z, An H, et al. Nano-structure and properties of maize zein studied by atomic force microscopy[J]. Journal of Cereal Science, 2005, 41(3): 277-281
[13]Ou S, Kwok K C, Wang Y, et al. An improved method to determine SH and-S-S-group content in soymilk protein[J]. Food Chemistry, 2004, 88(2): 317-320
[14]Wedemeyer W J, Welker E, Narayan M, et al. Disulfide bonds and protein folding[J]. Biochemistry, 2000, 39(15): 4207-4216
[15]Hogg P J. Disulfide bonds as switches for protein function[J]. Trends in Biochemical Sciences, 2003, 28(4):210-214
[16]Alizadeh-Pasdar N, Li-chan, E C Y. Comparison of protein sur face hydrophobicity measured at various pH values using three different fluo-rescent probes[J]. Journal of Agriculture and Food Chemistry, 2000, 48:328-334
[17]孔祥珍,周惠明.小麦面筋蛋白去酰胺改性的研究[J].食品科学, 2003, 24(12):47-49.
Preparation and Physicochemical Properties of Hordein
Guan Xiao Zhao Xin Yin Ting
(School of Medical Instruments and Food Engineering,University of Shanghai for Science and Technology, Shanghai 200093)
In this paper, hordein was prepared using barley as raw material, and its physicochemical properties were studies thoroughly. The results demonstrated that the crude protein content in hordein was up to 92.63%, and mainly consisted of hordein B(Mw 36~43 k) and hordein C(Mw 45~60 k).The FTIR of hordein presented typical protein spectrum. The absorption peak of 1 650 cm-1, 1 535 cm-1and 1 448 cm-1, respectively, reflecting the characteristic structure of protein amide Ι , amide Ⅱand amide Ⅲ. The content of free sulfhydryl group in hordein was 4.27 μmol/g; the total sulfhydryl content was 24.1 μmol/g; the two disulfide bond content was 9.9 μmol/g; and the surface hydrophobicity was 283.93. The main amino acid in protein included glutamic acid and proline, and the amino acid pattern was not ideal. Atomic force microscopy results showed that the shape of hordein molecular was ellipsoidal with the size of about 5.1 nm.
hordein, preparation, physicochemical properties
TQ432.2
A
1003-0174(2016)04-0047-05
国家自然科学基金(31101348),上海市自然科学基金(14ZR1419200)
2014-07-17
管骁,男,1979年出生,副教授,博士,食品科学
