煤矿污染土壤降解苯并(a)芘微生物多样性及降解能力研究
2016-12-24费莹莹曾献春郑李娟杜为军
费莹莹, 曾献春*, 郑李娟, 杜为军
(1.新疆师范大学 生命科学学院,新疆 乌鲁木齐 830054;2.新疆师范大学 化学与化工学院,新疆 乌鲁木齐 830054)
煤矿污染土壤降解苯并(a)芘微生物多样性及降解能力研究
费莹莹1, 曾献春1*, 郑李娟1, 杜为军2
(1.新疆师范大学 生命科学学院,新疆 乌鲁木齐 830054;2.新疆师范大学 化学与化工学院,新疆 乌鲁木齐 830054)
以苯并(a)芘(50 mg/L)为唯一碳源,对新疆芦草沟煤矿开采区土壤微生物进行3代胁迫培养(每代60 d);采用PCR-DGGE方法了解不同污染程度土样中降解苯并(a)芘的微生物类群和多样性特点;利用高效液相色谱(HPLC)测定胁迫培养每代培养物混合菌群对苯并(a)芘的降解能力。PCR-DGGE结果显示:不同污染程度原始样品与苯并(a)芘胁迫培养第3代培养物的微生物香浓指数(H)、丰度(S)和均匀度(E)有所不同,其中重度污染培养物降解苯并(a)芘的微生物类群最丰富。对优势条带进行克隆,其主要归属于变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)。经HPLC检测发现重度污染样品中的群体微生物对苯并(a)芘的降解率明显高于轻度和中度污染样品,达到78.4%。研究表明新疆芦草沟煤矿开采区污染的土壤中可能蕴藏着降解苯并(a)芘的微生物资源。
煤炭污染;苯并(a)芘;微生物多样性;生物降解
新疆的自然生态环境具有复杂性和脆弱性特点[1]。煤炭开采过程对生态环境、土地资源、水体及大气环境等造成不良影响,致使本就脆弱的干旱区生态系统进一步被破坏。新疆煤炭资源主要分布在新疆北部和东部,很大一部分煤矿分布在山区,地处河流上游,如乌鲁木齐河、头屯河、库车河、伊犁河等上游都有一定数量的煤矿分布[2]。多环芳烃类(Polycyclic Aromatic Hydrocarbons, PAHs)化合物是自然环境中最常见的有机污染物,分布广,多产生于石油开采、煤炭开采和煤炭焦化过程。目前新疆煤炭开采区的PAHs主要来源于煤和煤矸石的自燃[3-4],可通过土壤、水体、空气等进入环境,对开采区域的环境造成较大污染[5]。多环芳烃类物质(PAHs)主要有苯并(a)芘、萘、蒽等。苯并(a)芘结构稳定,难溶于水,是一种强致癌物和诱变剂,能引起多器官的癌变,被认为是多环芳烃环境致癌物的标志物,对人类健康造成潜在的威胁[6-7]。煤炭开采矿区产生的苯并(a)芘可以造成土壤和水体的污染,影响到整个生态系统。长时间的污染将对生态环境中的生物和环境周围的人类产生较严重后果。本研究立足于新疆煤炭开采环境中多环芳烃类化合物对生态环境的不良影响,对煤炭开采区污染的土壤样品,以苯并(a)芘为唯一碳源胁迫培养,获得可降解苯并(a)芘的微生物类群,利用PCR-DGGE在微生物多样性应用的成熟技术[8],了解新疆煤炭开采区降解苯并(a)芘的微生物组成,并对其群体降解能力进行研究,以获得来源于新疆煤炭开采区,可降解苯并(a)芘的微生物,为煤炭开采区环境保护与治理提供参考。
1 材料与方法
1.1 材料
1.1.1 样品采集 采集新疆芦草沟煤矿开采区(80°59′~80°52′ E,44°13′~44°14′ N)污染的土样。煤矿开采出口为重度污染区(W),距离开采出口20~40 m处为中度污染区(M),40 m以外为轻度污染区(L)。在不同程度污染区分别选择10个位点取表层0~20 cm土壤样品,用无菌袋收集混匀,做好标记带回实验室置于4 ℃保存,备用。
1.1.2 培养基 胁迫培养基:Na2HPO30.6 g, KH2PO30.4 g, CaCl·2H2O 0.02 g, MgSO4·7H2O 0.2 g,MnSO4·7H2O 0.02 g, FeSO4·7H2O 0.01 g, NH4NO31 g,苯并(a)芘标准品50 mg(Sigma公司),蒸馏水1 000 mL,pH 7.0,121 ℃灭菌20 min。
1.1.3 仪器 PCR仪(加拿大 BBI公司);凝胶成像系统(Gene Genius公司);U-3010紫外-可见分光光度计(Hitachi公司);旋涡混合器(XW-80A,上海医大仪器厂),超声波清洗器(上海超声波仪器厂),高效液相色谱仪(Agilent 1200) 等。
1.2 方法
1.2.1 胁迫培养 相同污染区域的土样混合,无菌称取来源于不同污染的土样10 g转入90 mL加玻璃珠无菌水中震荡3 h,静置30 min。移取10 mL静置的上清液接种到90 mL含有苯并(a)芘终浓度为50 mg/L的胁迫培养基中,28 ℃,150 r/min避光培养,每一种污染程度设置3个平行,每隔60 d移取10 mL培养物转接到上述新鲜的培养基,培养3代,共180 d。
1.2.2 培养物基因组DNA的提取 称取3不同污染区原始土样各10 g,分别转入90 mL无菌水中震荡3 h后,离心收集原始土样中菌体(L-0、M-0、W-0)和第3代胁迫培养物中菌体(L-3、M-3、W-3),采用十六烷基三甲基溴化铵法(Hexadecyltrimethy Ammonium Bromide,CTAB)提取各样品总DNA[9]。
1.2.3 变性梯度凝胶电泳(Denaturing Gradient Gel Electrophoresis, DGGE) 将3种不同污染程度的原始土样和胁迫培养第3代培养物的总DNA送至北京亿鸣复兴生物技术有限公司进行DGGE分析,根据结果进行多样性分析。
1.2.4 DGGE条带的序列测定及系统发育树的构建 对胁迫培养第3代样品中清晰可见的22个条带(图1)进行克隆、测序。将测序结果用DNAstar和Cluster软件进行序列分析,采用MEGA软件,Neighbor-joining法构建系统发育树,自展数(bootstrap)为1 000。
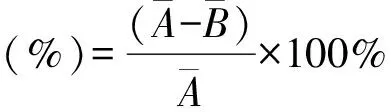
2 结果与分析
2.1 PCR-DGGE分析降解苯并(a)芘微生物的多样性
2.1.1 PCR 产物的变性梯度凝胶电泳(DGGE) 新疆煤炭开采区不同污染程度原始土壤样品(L-0、M-0、W-0)以及以苯并(a)芘胁迫培养第3代(L-3、M-3、W-3)的微生物PCR-DGGE指纹图谱如图1所示,根据图谱中的条带数目、迁移率和灰度等信息可以看出:不同污染程度的土壤样品中微生物丰富性均较高,随着胁迫培养代数增加,微生物原有类群减少,但特异性类群富集。
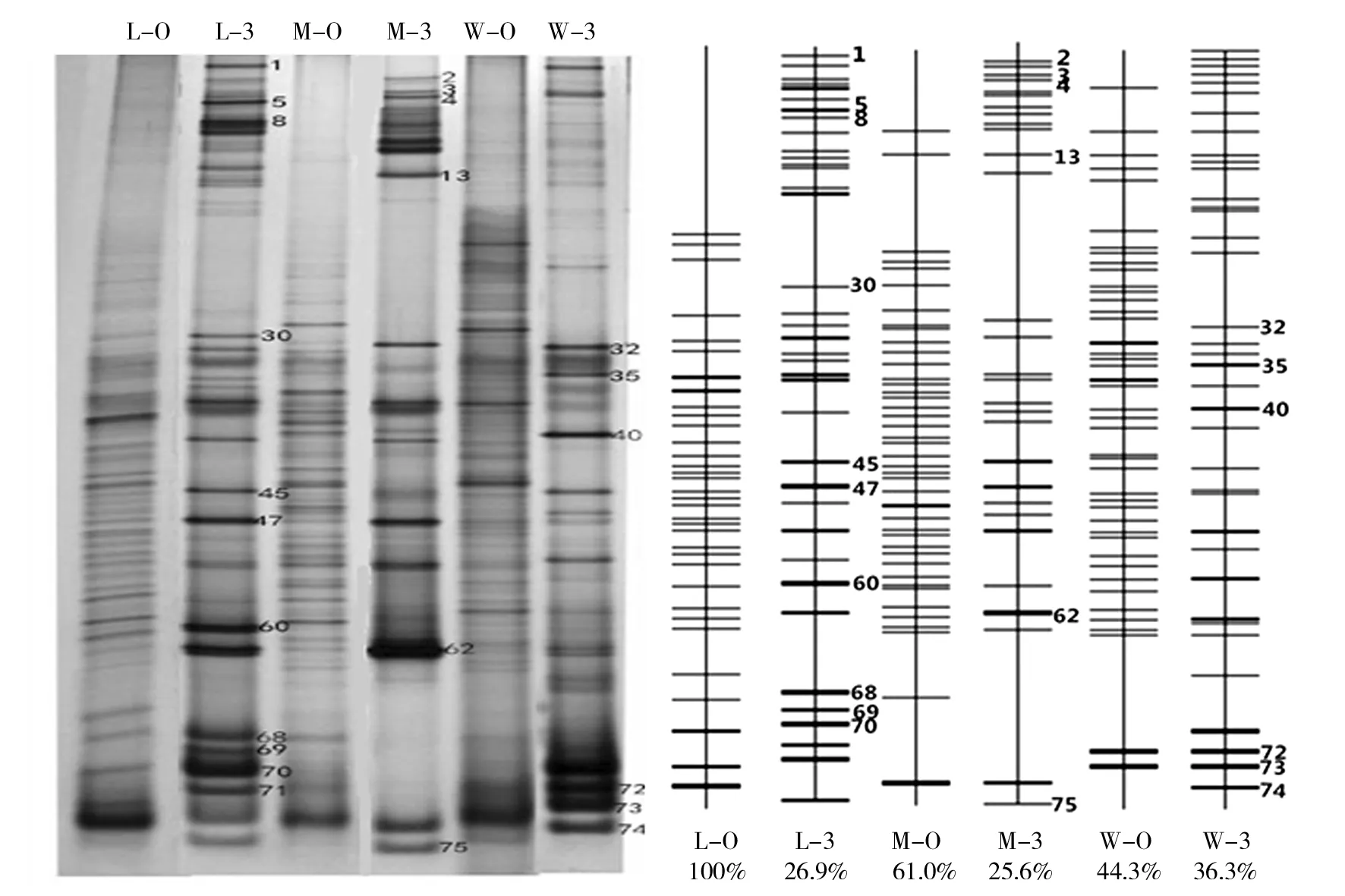
图1 PCR产物的DGGE电泳图和模式图Fig.1 PCR-DGGE electrophoresis diagram and schematic diagramL-0:轻度污染土壤样品;M-0:中度污染土壤样品;W-0:重度污染土壤样品;L-3、M-3、W-3:对应胁迫培养第3代样品Lightly, moderate, severe pollution of soil samples were marked as L-0,M-0,W-0,and corresponding stress training samples of the third generation were marked as L-3,M-3,W-3
通过计算戴斯系数可以得到群落之间细菌种类差异的信息,如图2所示,6个样品中污染程度相同的L-0与L-3、M-0与M-3、W-0与W-3的细菌群落结构相似性分别是42%、40%、67%,但3个污染程度不同的样品之间微生物群落结构相似性比较低,最低为28%。由此可知,煤炭污染程度不同,可降解苯并(a)芘的微生物类群有所不同。

图2 依据样品间的相似系数构建聚类图(UPGMA)Fig.2 According to the similarity coefficient between the sample cluster diagram
2.1.2 降解苯并(a)芘微生物的遗传多样性 根据电泳图谱中每条条带的信息,对各样品中的细菌香浓指数(H)、丰度(S) 和均匀指数(E) 等指标进行综合分析,结果如表1 所示,实验中始终以高浓度苯并(a)芘(50 mg/L)作为唯一碳源,胁迫培养3代后,一些不能够耐受苯并(a)芘的微生物数量逐渐减少,甚至消失。重度污染区的样品中,降解苯并(a)芘微生物多样性比中度和轻度污染区微生物更为丰富。说明随着煤炭污染程度的增加,能够降解苯并(a)芘的微生物种类增多。
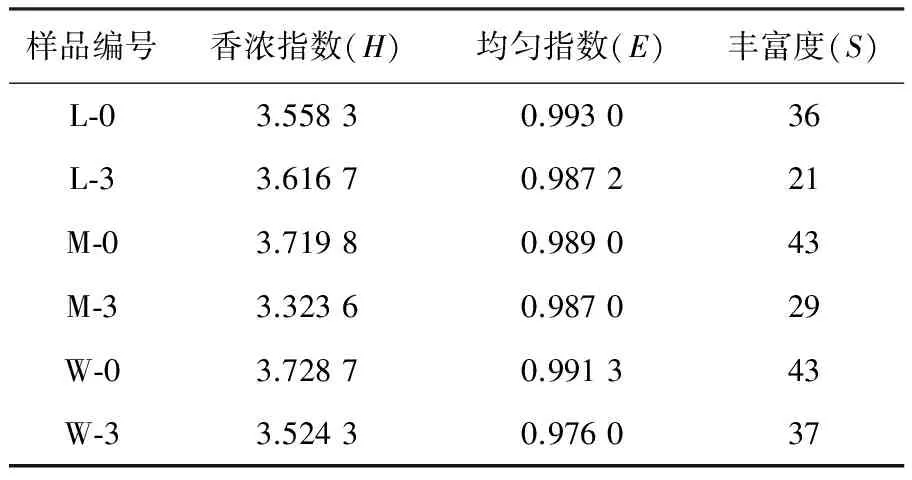
表1 各样品之间的微生物多样性分析
2.1.3 样品降解苯并(a)芘优势条带序列的系统发育分析 将胁迫培养第3代样品中22个优势电泳条带回收、克隆、测序,结果与GenBank中的序列进行比对,得到条带所代表的细菌类型,每个回收条带选取3个克隆进行了序列测定,结果如表2。采用MEGA5软件,Neighbor-joining法构建系统发育树,自展数(bootstrap)为1 000,系统发育树见图3。
由表2结果分析可知,新疆芦草沟煤矿出口污染区土壤样品中能够降解有机污染物苯并(a)芘的微生物主要归属于变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)。其中优势菌为变形菌门(Proteobacteria),主要有中华根瘤菌属、发菌属、布氏杆菌属、甲基营养菌属、斯氏假单胞菌属、猪布鲁士杆菌属、贪铜菌属、无色杆菌属、固氮氏螺菌属,占克隆条带的68%;属于放线菌门(Actinobacteria)的有小单胞菌属、分枝杆菌属、中华单胞菌属,占克隆条带的23%;属于拟杆菌门(Bacteroidetes)的包括发菌属、鞘氨醇菌属,占克隆条带的9%。
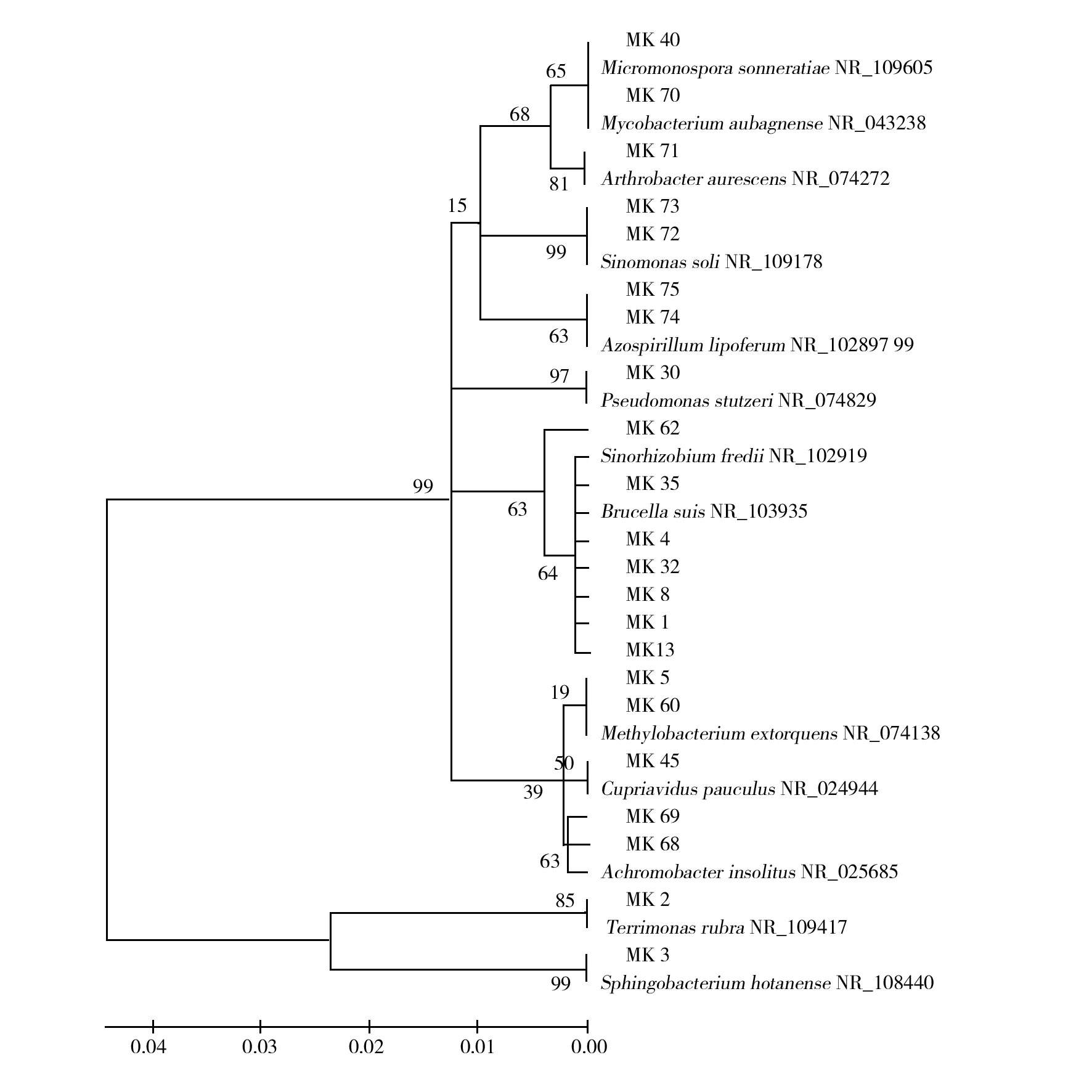
图3 基于V3区序列构建的煤矿降解菌的系统发育树Fig.3 Phylogenetic tree based on the V3 sequence of colliery degrading bacteria and related species
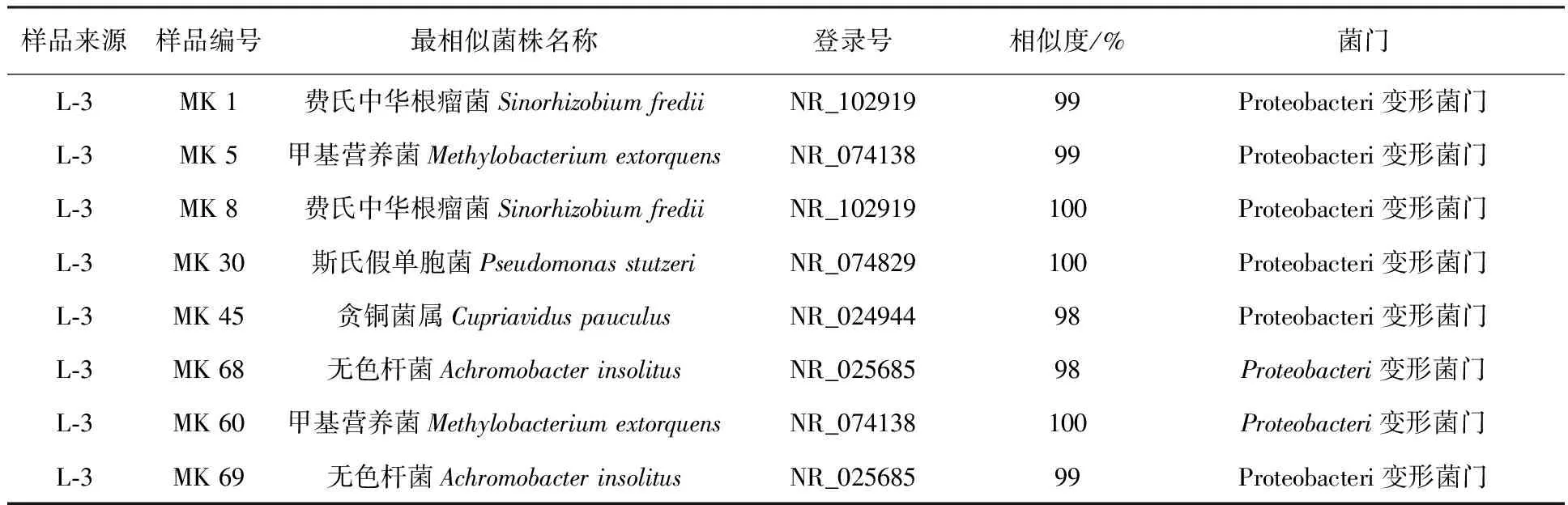
样品来源样品编号最相似菌株名称登录号相似度/%菌门L⁃3MK1费氏中华根瘤菌SinorhizobiumfrediiNR_10291999Proteobacteri变形菌门L⁃3MK5甲基营养菌MethylobacteriumextorquensNR_07413899Proteobacteri变形菌门L⁃3MK8费氏中华根瘤菌SinorhizobiumfrediiNR_102919100Proteobacteri变形菌门L⁃3MK30斯氏假单胞菌PseudomonasstutzeriNR_074829100Proteobacteri变形菌门L⁃3MK45贪铜菌属CupriaviduspauculusNR_02494498Proteobacteri变形菌门L⁃3MK68无色杆菌AchromobacterinsolitusNR_02568598Proteobacteri变形菌门L⁃3MK60甲基营养菌MethylobacteriumextorquensNR_074138100Proteobacteri变形菌门L⁃3MK69无色杆菌AchromobacterinsolitusNR_02568599Proteobacteri变形菌门
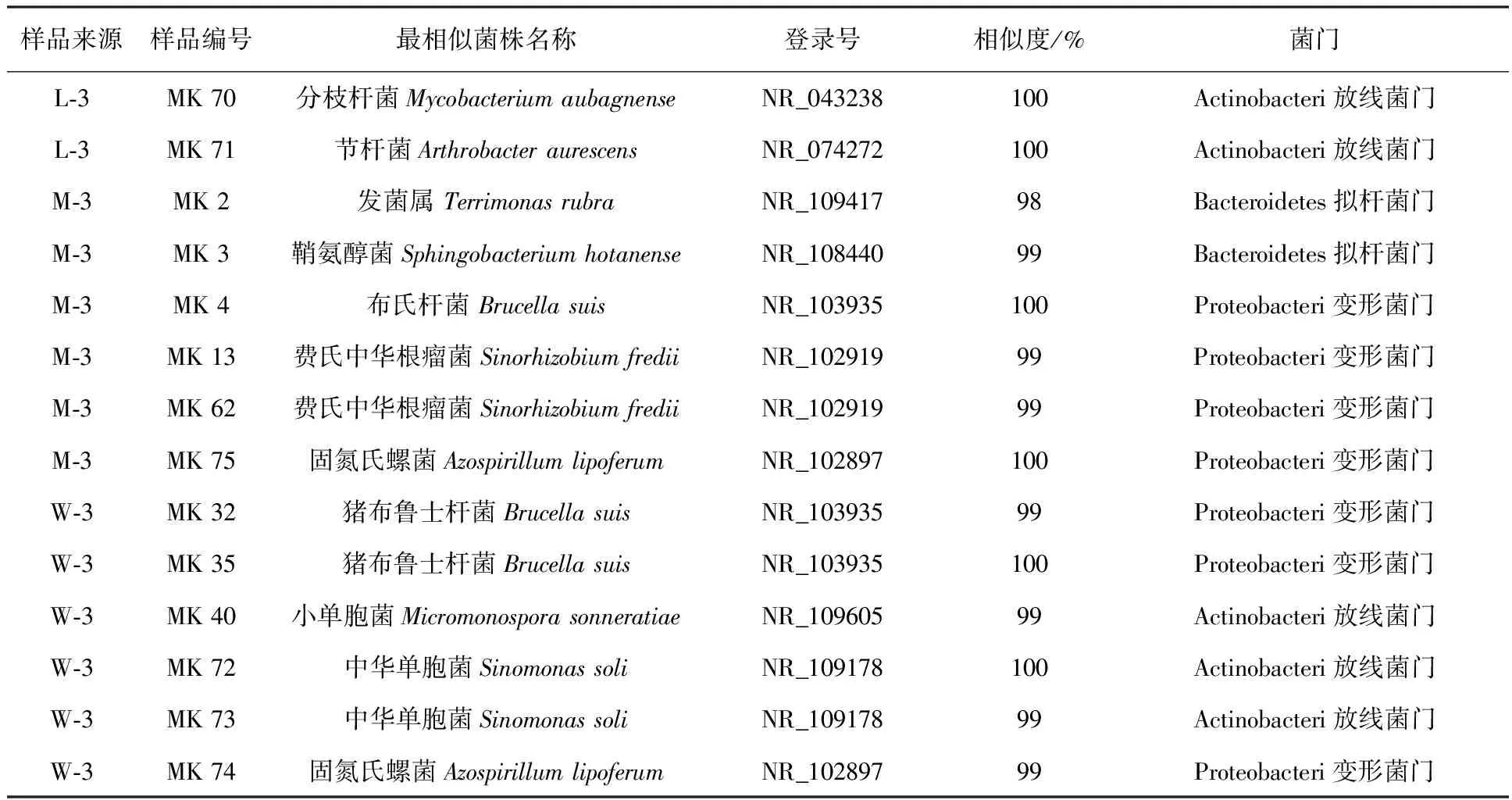
续表2
2.2 HPLC测定混合菌对苯并(a)芘降解能力的分析
经高效液相色谱法分析,以峰面积(y)为纵坐标、浓度(x)为横坐标,得到苯并(a)芘含量在10~60 mg/L的线性回归方程为y=117.16x+871.85,相关系数R=0.999,结果表明,在此浓度范围内所得苯并芘的峰面积与浓度线性关系良好。以标样加入法测定该萃取方法的回收率,结果如表3所示,该方法萃取苯并(a)芘的回收率在80.2%~91.6%。
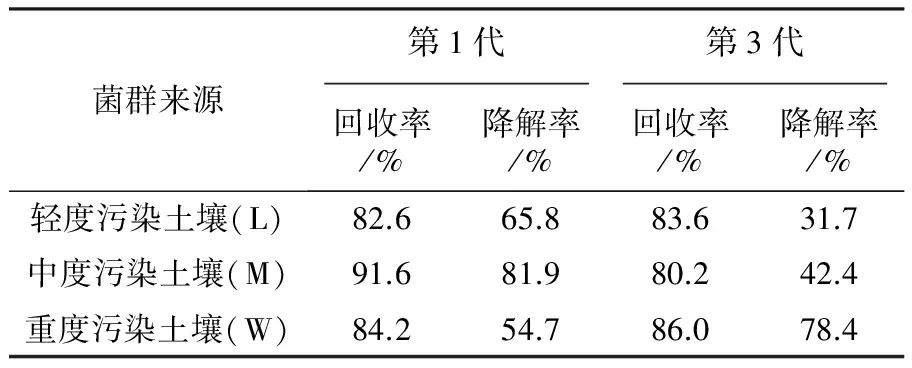
表3 不同污染程度样品中苯并(a)芘的回收率与降解率
煤矿不同污染程度的土壤微生物菌群对苯并(a)芘的降解率,经HPLC测定结果如表3所示,计算出降解率如图4所示,轻度(L)、中度(M)、重度(W)煤炭污染土样菌群在胁迫培养第1代后,对苯并(a)芘的降解率达到65.8%、81.9%、54.7%。
经第三代胁迫培养,轻度污染和中度污染的样品降解能力减弱为31.7%、42.4%,而重度污染的样品降解能力增长为78.4%。样品通过180 d胁迫培养,群体微生物活力和数量都受到抑制,其中低污染度和中污染度的样品在苯并(a)芘长时间胁迫培养中菌群数量减少,群体降解率下降。重度污染样品胁迫第3代后对苯并(a)芘的降解率稳定保持在78.4%,说明重度污染土壤中可降解苯并(a)芘的微生物类群较多,可适应长时间、高浓度苯并(a)芘的培养环境,能较好利用和转化苯并(a)芘,因此其降解能力明显高于轻度和中度污染区。
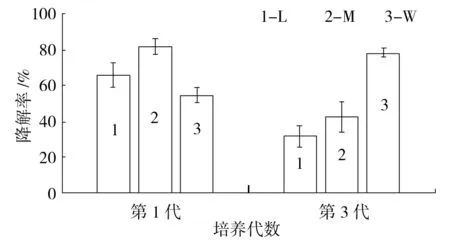
图4 不同污染程度煤矿土壤微生物对苯并(a)芘的降解Fig.4 Benzo(a)pyrene biodegradation by Microorganisms from different microbial
3 讨 论
近年来, 国内外对苯并(a)芘污染土壤的微生物降解报道较多[10-14]。从水体、海洋的水样和沉积物、被石油污染的土壤中均分离到能够降解苯并(a)芘的微生物,它们主要归属于分枝杆菌属(Mycobacterium)[15-17]。本实验从新疆煤矿污染区土壤样品中分离出能够降解有机污染物苯并(a)芘的微生物,主要归属于变形菌门(Proteobacteria) 、拟杆菌门( Bacteroidetes)和放线菌门(Actinobacteria),其中优势菌主要归属于变形菌门(Proteobacteria)。采用PCR-DGGE对污染程度不同的样品中可降解苯并(a)芘的微生物类群进行研究,可以发现不同污染程度的环境中降解苯并(a)芘的微生物类群的数量和种类有一定的差异。污染严重的环境中降解菌的种类和数量都较多,随着污染程度的不断减弱,降解菌的类群和数量也随之减少。说明在长期受污染严重的环境中的微生物为了适应不良条件,能够利用污染物作为营养物质进行能量代谢,微生物与污染物在自然环境中相辅相助,可以帮助受污染土壤进行自身修复,也促进了苯并(a)芘的有效降解[18-19]。
目前国内外关于煤矿污染区土壤微生物对苯并(a)芘的降解少有研究,主要集中在石油土壤和海洋微生物对苯并(a)芘的降解研究。如郑天凌等[20]从九龙江口凤林湾红树林区、厦门近海海域、热带太平洋中部和东部的多金属结核区深海沉积物中分离得到39株能利用苯并(a)芘作为唯一碳源和能源的混合菌,对苯并(a)芘的降解率在5.15%~52.43%。本实验中,重度污染样品经长期胁迫培养后,群体微生物对苯并(a)芘的降解率明显高于轻度和中度污染样品,达到78.4%。本研究后期将进一步完成降解单菌的分离、纯化、鉴定和降解能力的研究,希望能够获得来源于新疆煤炭开采区可降解苯并(a)芘的微生物资源。
[1] 周海魂,黄新兰.新疆煤炭资源开发与生态环境保护[J].中国煤炭,2011, 37(6):16-19.
[2] 谢东营.新疆煤矿项目竣工环保验收工作现状、问题及对策[J].干旱环境监测, 2010, 24(2):76-80.
[3] 吴坤.营养与食品卫生学(第5版)[M].北京:人民卫生出版社, 2003:260-266.
[4] 杜华.抚顺西露天煤矿开采矿坑对环境污染的调查分析[J].当代化工, 2006, 35(3):218-221.
[5] 潘志刚,姚艳斌,黄文辉.煤矸石的污染危害与综合利用途径分析[J].资源与产业, 2005, 7(1):46-49.
[6] Hvraery, Coombs M M, Ashby J, et al. Polycyclic aromatic hydrocarbons: chemistry and carcinogenicity[M]. Cambridge Monographs on Cancer Research. Cambridge: Cambridge University Press, 1991: 396.
[7] 申松梅,曹先仲,宋艳辉,等.多环芳烃的性质与危害[J].贵州化工, 2008, 33(3):61-63.
[8] 刘鹏飞,赵丹,宋刚,等.变性梯度凝胶电泳技术在微生物多样性研究中的应用[J].微生物学杂志, 2013, 33(6):88-92.
[9] 萨姆布鲁克,拉塞尔.黄培堂,等译.分子克隆实验指南精编版[M].北京:化学工业出版社, 2008:142-144.
[10]Wilson S C, Jones K C. Bioremediation of soil contaminated with polycyclic aromatic hydrocarbons (PAHs): a review [J]. Environmental Pollution, 1993, 81: 229-249.
[11]骆苑蓉,胡忠,郑天凌,等.红树林沉积物中的微生物对苯并[a]芘的降解研究[J].厦门大学学报(自然科学版), 2005, 44(Z1):75-79.
[12]李培军,许华夏,张春桂,等.污染土壤中苯并(a)芘的微生物降解[J].环境污染治理技术与设备, 2001, 2(5): 37-40.
[13]Cerniglia C E, Gibson DT. Oxidation of benzo[a]pyrene by the filament ousfungus Cunning hamellaelegans[J]. J. Biol. Chem., 1979, 254:12174-12180.
[14]James P. Freeman, Carl E. Cerniglia, Peter P. Fu, et al. Degradation of benzo[a]pyrene by Mycobacterium vanbaalenii PYR-1[J]. Applied and Environmental Microbiology, 2004,70(1): 340-345.
[15]Haravama S. Polycyclic aromatic hydrocarbon bioremediation design[J].Current Opinion in Biotechnol, 1997, 8(3):268-273.
[16]Jong-Su Seo, Young-Soo Keum, Qing X. Li. Bacterial Degradation of Aromatic Compounds[J]. Int. J. of Environ. Res and Public Health, 2009, 6(1):278-309.
[17]Dalal, Panigrah, Randhawaa, et al. Molecular characterisation of high-strength polycyclic aromatic hydrocarbon (PAH)-degrading and phenol-tolerant bacteria obtained from thermal power plant wastewater[J].Chemistry and Ecology,2012, 28(2):187-192.
[18]Nie M., Yin X., Ren C., et al. Novel rhamnolipid biosurfactants produced by a polycyclic aromatic hydrocarbon-degrading bacteriumPseudomonasaeruginosastrain NY3[J].Biotechnology Advances, 2010, 28:635-643.
[19]C. Balachandran, V. Duraipandiyan, K. Balakrishna. Petroleum and polycyclic aromatic hydrocarbons (PAHs) degradation and naphthalene metabolism inStreptomycessp. (ERI-CPDA-1) isolated from oil contaminated soil[J].Bioresource Technology, 2012, 112: 83-90.
[20]郑天凌,骆苑蓉,曹晓星,等.高分子量多环芳烃——苯并[a]芘的生物降解研究进展[J].应用与环境生物学报, 2006, 12(6):884-890.
Benzo(a)pyrene-Degrading Microbial Diversity &Degradation Ability in Coal Mine Polluted Soil
FEI Ying-ying1, ZENG Xian-chun1, ZHENG Li-juan1, DU Wei-jun2
(1.Coll.ofLifeSci., 2.Coll.ofChem. &Chem.Engin.,XinjiangNormalUni.,Urumqi, 830054)
Soil microbes from coal mining areas of Lucaogou coal mine in Xinjiang was studied with medium supplemented with benzo(a)pyrene (50 mg/L) as the sole carbon source training for three generations (60 days per generation); PCR-DGGE approach was adopted to understand benzo(a)pyrene-degrading microbial taxa features and diversity from the different level of polluted soil samples collected from the mining areas; High performance liquid chromatography (HPLC) was used to measure degradation ability of benzene(a)pyrene of every generation of stress training microbial group. The PCR-DGGE results showed that: there are differences in microbial aroma and thickness index (H), abundance (S), and evenness (E) from different pollution levels of the original samples and the third generation of stress culture samples with benzo(a)pyrene. Among them the culture of heavily polluted soil had the most abundant benzo(a)pyrene degradable microbial cluster. Clones of dominant bands mainly belong to Proteobacteria, Bacteroidetes, and Actinobacteria. It was found through HPLC determination that the degradation rate of benzo(a)pyrene by cluster microbe from heavily polluted sample obviously higher than those from lightly and/or moderate polluted samples, the gap was as high as 78.4%. The studies suggested that the polluted soil in coal extractive area in Lucaogou coal mine in Xinjiang may store benzo(a)pyrene degradable microbial resources.
coal pollution; benzo(a)pyrene; microbial diversity; biodegradation
新疆维吾尔自治区自然科学基金项目(2011211A032)
费莹莹 女,硕士研究生。研究方向为应用微生物。E-mail:124021518@qq.com
* 通讯作者。女,硕士生导师,教授。研究方向为应用微生物。Tel:0991-4351488,E-mail:zengxc2004@163.com
2014-10-29;
2015-01-26
Q939
A
1005-7021(2016)01-0069-07
10.3969/j.issn.1005-7021.2016.01.012
