细菌产生的活性氧及其功能
2016-12-24刘武康吴淑燕陈国薇
刘武康, 吴淑燕, 陈国薇, 张 超, 吴 嫚, 李 森, 刘 箐
(上海理工大学 医疗器械与食品学院,上海 200093)
细菌产生的活性氧及其功能
刘武康, 吴淑燕, 陈国薇, 张 超, 吴 嫚, 李 森*, 刘 箐*
(上海理工大学 医疗器械与食品学院,上海 200093)
活性氧(Reactive Oxygen Species,ROS)是需氧生物有氧代谢和专一酶类产生的含氧的、化学活性极强的一类小分子物质。按照其产生机理可分为两大产生途径,其一是呼吸作用中发生的单电子转移产生的ROS,通常认为此途径产生过量的ROS对生物大分子具有极强的氧化损伤,与多种疾病密切相关;其二是由专一酶类产生的少量ROS,一般认为此途径产生的ROS具有杀灭入侵的外来微生物的作用,但近年来大量研究表明,此途径产生的ROS可行使信号分子和基因开关等多种生理功能。同时,生物体自身的抗氧化系统也可直接调控ROS的水平。本文综合分析近年来对细菌中的ROS的研究成果,并对目前存在的问题和未来的发展进行评述。
细菌;活性氧;抗氧化系统;功能
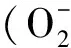
1 细菌活性氧及其功能研究进展
1.1 ROS在细菌中的产生途径及其抗氧化体系
当ROS在生物体中被发现后,立即引起了关注。首先,需要研究的问题就是ROS在机体中是如何产生的,包括其产生的途径、相关反应、相关酶类等;其次,由于机体内积累大量的ROS会产生多种损害,机体如何保持ROS胁迫下的氧化还原平衡同样是受到广泛关注的问题。
1.1.1 细菌中ROS的产生 细菌是一种原核生物,原核生物的呼吸作用主要发生在细胞膜上,由细胞膜上相关的酶催化反应的进行,因此细菌中ROS主要产生部位是细胞膜。细菌中ROS大部分是在呼吸链上的酶催化的氧分子连续单价电子的传递反应产生的,例如大肠埃希菌(Escherichiacoli),呼吸链中所产生的过氧化氢能够占到总量的87%左右[12]。此外,生长的环境也对细菌ROS的产量有影响,例如电离、UV辐射以及环境中某些小分子物质等的作用[13-14]。
Nox最早在高等动植物中发现,被认为是可以专一催化产生ROS的酶类,现在已有很多研究关注细菌中Nox。Nox的反应底物为O2和NADH或NADPH,根据所查阅的文献,关于Nox的具体分类方法目前未有明确的定义。综合各类文献表述,以NADH为底物的Nox根据其产物一般分为两类:Nox1的反应产物主要为过氧化氢;Nox2的反应产物为水,即狭义的NADH氧化酶[15]。Nox1一般存在于需氧型细菌的膜上或胞内,而Nox2一般存在于厌氧或兼性厌氧菌的胞内,其中大部分为乳酸菌[16]。Nox2由于产物为水,其主要作用一般是清除厌氧或兼性厌氧菌胞内过量的分子氧以获得更适宜的生长条件。也有研究指出在某些抗氧化能力较弱的细菌中,如双歧杆菌(Bifidobacterium),由于Nox1催化的产物为氧化性较强的过氧化氢,会激发细菌超氧化物歧化酶(SOD)等酶类发挥作用,以此作为清除胞内过量氧的一种手段[17]。而以NADPH为底物的Nox一般存在于高等动植物中,该种Nox种类较多,包含NADPH 氧化酶催化亚基gp91phox(NOX2) 及其同源物NOX1、NOX3、NOX4、NOX5、DUOX1 和DUOX2 ,它们被统称为NOX 家族[18],但目前已有研究发现细菌中存在以NADPH为底物的Nox相关基因序列。
目前已发现的与细菌中ROS产生的相关途径及相关酶类大多集中在呼吸链上,但呼吸链中生成的ROS多数都会进入连续的单电子转移途径,无法向外扩散,也不易在其他位置发挥作用,而对于专一催化产生ROS的酶类的研究目前也基本集中在Nox。目前对细菌中ROS产生途径的了解仍不全面,也导致对ROS在细菌中的功能的研究有一定的局限性,因此关于细菌中ROS的产生途径还有待深入研究,获得的重要研究成果也将为后续的研究打下坚实的基础。
1.1.2 细菌中的抗氧化体系 生物体中的ROS水平超过自身承受能力时,就会出现氧化应激,对机体造成损伤,因此生物体中都存在一系列调控机制用以维持ROS的稳态[19]。生物体中与维持ROS稳态相关的物质均为具有较好还原性的抗氧化物质,一般分为非酶类与酶类两种。常见的非生物酶类抗氧化物质有维生素C(Vc)、维生素E(Ve)、谷胱甘肽(Glutathione,GSH)、β-胡萝卜素和黄酮类物质、多酚类物质等,它们的优点是在生物体内可以快速扩散,可以作用于细胞膜,甚至直接在细胞外发挥作用,但缺点是不易进入细胞内。然而,由于多数非酶类的抗氧化物不能在机体内合成,所以这些物质大多是由高等动物从食物中获得,细菌中非酶类抗氧化剂发挥的作用较少[10]。
微生物中发挥抗氧化作用的主要是酶类物质,最常见的有超氧化物歧化酶(SOD)和过氧化氢酶(Catalase),超氧化物歧化酶催化超氧负离子发生歧化反应生成氧和过氧化氢,过氧化氢酶则催化过氧化氢生成水和氧气,这两种酶在微生物抗氧化系统中至关重要,维持了机体内的氧化还原平衡[20]。在细菌中,存在两个氧化还原调控子,一个是对过氧化氢敏感的转录激活子 OxyR,它可以控制谷胱甘肽还原酶、NADPH-依赖的烷基氢过氧化物还原酶等基因的表达,这些物质主要用来清除机体中过量的过氧化氢;另一个转录调控子是二级 SoxRS系统,它用来抵御过量的超氧阴离子,调控的基因有 SOD、葡萄糖-6-磷酸脱氢酶、铁氧还原蛋白等[21-22]。 由此可见,细菌中的ROS水平很大程度上取决于细菌的抗氧化系统的活跃程度,大部分情况下细菌体内ROS水平激增都伴随着体内抗氧化系统活力的减弱,没有足够的还原性物质和还原性酶活力降低均导致细菌中ROS的大量产生并在体内不断积累。
细菌中ROS的产生和ROS稳态的保持有多种酶、蛋白质、核酸和小分子物质的参与,涉及的反应种类多、过程复杂,许多机理目前仍不明确。关注细菌中产生ROS的相关基因和酶类,以及细菌的抗氧化系统,不仅对研究细菌的生命活动有重要意义,也对高等动物乃至人类的衰老、疾病等问题的研究有着促进作用。
1.2 ROS在细菌中的功能
1.2.1 ROS对细菌的氧化损伤 ROS被认为参与了细胞的衰老、凋亡或者癌变,其产生危害主要是由于ROS会造成细胞中的各种生物大分子快速氧化,对细胞危害极大[23-25]。已有的研究成果表明,生物体中的DNA、RNA、脂质和蛋白质等对ROS都很敏感,过量的ROS对这些物质都会造成损伤。其中,脂类物质是氧胁迫损伤的主要对象,自由基直接与细胞膜上的多不饱和脂肪酸反应,引起脂质的过氧化,造成细胞膜流动性的降低,改变了细胞膜的特性,进而破坏细胞膜蛋白[26-27]。除此之外,DNA也是ROS的主要攻击对象,ROS可损伤DNA中的碱基和糖组分,进而破坏了DNA的双链结构,影响了DNA的正常复制,增加了突变的发生概率[28-29]。细菌中过量生成ROS后与体内重要生物大分子发生的反应,无一例外都是对细胞有毒性的,都会影响细菌的正常生存。
1.2.2 细菌中ROS的信号分子作用 由于ROS对于细胞的毒性,过量的ROS必然会引起细菌生长减缓,很多文献报道也验证了这一点。Yesilkaya等[30]研究了肺炎双球菌(Streptococcuspneumoniae)在较高ROS环境下的生存状况,发现当环境中氧胁迫压力产生时,细菌的增殖会明显减缓,但将环境中的氧胁迫撤去后,细菌自身的活力会很快恢复,致病性也没有明显下降,因此认为环境中少量的ROS会激发细菌的防御体系,增殖减缓并非细菌本身受到杀伤,而可能是细菌的主动行为,目的是为了减少突变的发生和原发性损伤,这一观点提醒我们在研究ROS对细菌生长的影响时,不能只关注ROS对细菌生长的影响,还要对细菌本身生理机能的变化进行观察。Huang等[31-32]的研究发现,单核细胞增生性李斯特菌4b G(Listeriamonocytogenes4b G)中存在抗氧胁迫基因gltB和gltC,该基因的缺失菌株在氧胁迫条件下增殖能力下降明显,且菌膜生成能力同时下降。菌膜作为细菌的一种特殊的应对外界不利环境的生存方式,其生成能力受ROS的影响也验证了ROS与细菌的生长状况有直接关系[33-35]。ROS作为一种信号分子,探究其影响细菌生长状况过程中的具体作用,有利于研制和开发新型、高效的杀菌剂和抑菌剂,控制微生物污染,对临床医学、食品安全等方面都有着积极意义。
1.2.3 ROS与病原菌致病力 对于致病细菌,ROS与其致病力的关系倍受关注,而根据文献的报道,ROS对致病菌致病力一般有上调或是下调两种影响,根据细菌的种类不同其影响程度和作用方式也有所不同。邹海杰[36]以大肠埃希菌(Escherichiacoli)为模型研究了革兰阴性菌外膜蛋白OmpW在抗宿主氧化应激中的作用,结果表明,在致病菌入侵人体的过程中,非特异性免疫中由二价铁离子引发的芬顿反应释放羟自由基是一种高效的免疫手段,然而游离态的铁离子增多会增加革兰阴性菌铁离子的摄入,同时过量的羟自由基损伤人体自身细胞,使得致病菌致病力增加,而外膜蛋白OmpW在这一过程中起到了抗氧化胁迫并增加细菌铁离子摄入的作用。Corcionivoschi等[37]在研究ROS与空肠弯曲菌(Campylobacterjejuni)致病力时发现,黏膜免疫过程中释放的ROS会扰乱磷酸酪氨酸信号,从而下调了该细菌的致病力。Derr等[38]则在以变异链球菌(Streptococcusmutans)为对象研究NADH氧化酶在该细菌引起口腔疾病的致病机理时发现,NADH氧化酶可以加快糖代谢效率,在其黏附牙齿形成菌膜时造成局部的酸性环境,从而引发龋齿。可见,由于机体自身的免疫过程和细菌自身的代谢均有ROS的生成,因此ROS对病原细菌的致病力有直接影响。
1.2.4 ROS与肠道益生菌对肠道保护作用 婴幼儿的肠道在未发育成熟的阶段,极易产生急性肠炎,目前常见的治疗方法就是增加肠道益生菌的摄入,深入研究发现肠道益生菌在保护肠道的过程中,ROS可能起到了关键的作用。Lin等[39]的研究发现对出生后肠道发育未成熟的小鼠使用鼠李糖乳杆菌(Lactobacillusrhamnosus)灌胃可以明显降低感染性肠炎的发病率,其机理是该种益生菌可以使肠道上皮细胞局部的ROS产量增加,使与炎症信号产生相关的酶类被氧化后失活,大大降低炎症发生的概率,并认为这可能就是许多益生菌能明显降低新生儿和幼儿肠炎发生概率的原因。Jones等[40]研究发现,肠道中的乳酸菌由Nox介导释放的ROS可以促进小鼠和果蝇肠道上皮细胞的增殖和分化,从而起到保护肠道、防止肠炎发生等益生作用。益生菌和致病菌在人体中往往是相互制约的关系,而ROS可能在二者相互拮抗的过程中起到关键作用,了解益生菌在体内发挥作用的机理,探究ROS在这一过程中的具体作用,则可以从源头上控制某些由致病菌引起的健康问题。
1.2.5 ROS与细菌耐药性 除了上述几个方面,还有研究关注了ROS与细菌抗生素耐药性的关系。多数研究认为,很多抗生素或抗菌剂的作用机制是诱导细菌自身产生过量的ROS而造成氧化损伤以起到杀菌作用[41-43]。Boles等[44]的研究发现绿脓杆菌(Pseudomonasaeruginosa)在四环素、利福平、庆大霉素等抗生素胁迫下形成菌膜,菌膜中的氧化胁迫造成的DNA断裂在修复后形成突变体,从而产生具有耐药性的菌株,但文献中未提及ROS产生途径。Aiassa等[45]的研究发现,奇异变形杆菌(Proteusmirabilis)在菌膜或游离状态下,通过提高自身的抗氧化防御能力,来提高自身抵抗抗生素环丙沙星的杀菌作用,在环丙沙星作用下该菌的多种调控抗氧化相关酶类的基因大量表达。因此可以假设,多种抗生素的作用机制是引发细菌自身产生氧化损伤,而自身抗氧化能力较强或是氧化损伤造成的抗氧化能力增强的突变体则会具有更强的耐药性,长期使用抗生素类药物可能增加细菌的突变概率,使强耐药性菌株产生的概率增加。研究ROS与细菌耐药性之间的关系及其作用机制,对研发新型抗生素、控制抗生素滥用有着积极作用。
综上所述,ROS在生物体中的作用不是单一的、绝对的,在研究时,应全面分析其在生物体中的积极作用和消极作用,且应更多地关注ROS的积极作用。细菌往往会通过某些途径主动生成较低水平的ROS,这些ROS在细菌中起到信号或是调节的作用,激发细菌某些特殊机制,如进入防御状态、辅助细菌入侵宿主细胞、抑制环境中其他竞争者等。在以细菌为对象对ROS进行研究时,应将ROS与细菌生长状况、致病能力、相关基因表达水平等方面变化综合分析,并深入研究ROS参与各种生命活动的具体作用通路。
2 细菌活性氧研究中存在的问题
虽然ROS已经受到广泛关注,但由于其本身的许多特殊性质,造成了研究过程中的许多困难[46]。在研究细菌中的ROS时,存在的主要问题有:由于ROS较高的活性和较低的稳定性,这对观测细菌中ROS含量的趋势变化造成了一定的困难;ROS本身可以参与的反应是多种多样的,因此在研究细菌中的ROS时,很难同时对不同的反应进行分析,难以分析ROS发挥作用的具体途径;ROS在细胞内和细胞外的时间、空间上的分布复杂,在不同部位ROS的产生途径和作用机制都不相同,目前的技术还难以做到针对细菌中某个准确的时间点和部位的ROS进行观测和分析;ROS在生物体内的存在情况很大程度上取决于生物体本身的状态,细菌自身的生理状态会很大程度影响ROS的产生,使实验的偶然性很大,而动物实验的不确定因素则更多;目前还是缺乏可靠的技术方法测定ROS在生物体内的绝对浓度,即使测定相对浓度也有困难,测定细菌中的ROS时,通常使用荧光探针进行检测[47],常见的有DCFH-DA,一般使用96孔板培养后用DCFH-DA孵育于酶标仪中检测荧光值[48],也有报道使用流式细胞仪对单个细胞ROS水平进行观测[49],但是这些检测方法都存在无法测定绝对或相对浓度、无细节分辨能力等问题。
3 展 望
近年来,大量的研究都在关注ROS与生物体的衰老、疾病、细胞凋亡之间的关系,试图寻找ROS的具体作用通路,并推动医学的发展,探寻许多疾病的新的诊断、治疗方法。细菌种类多,在自然界中广泛存在,增殖快,环境适应能力强,细菌的各项生命活动也与动植物及人类紧密相关,例如人体中的细菌数量、种类以及生长状况在某种程度上反映了机体的健康状况。因此,研究细菌中的ROS是ROS相关研究领域的重要组成部分,获得的研究成果也对其他领域的研究有促进作用。
对于细菌中ROS产生的途径和方式,呼吸链途径研究得较为深入,但是呼吸链上ROS的产量虽大,时间空间上的分布却较为有限,产生后脱离呼吸链作用于其他部位的可能性较小。多数研究构建与呼吸链中ROS产生相关的基因缺失菌株,可以达到使细菌ROS水平激增的效果,同时也会观测到细菌各方面生命活动的变化,但是这种手段也有一定的局限性,呼吸链中的关键基因缺失,虽然促使ROS的大量生成,但是呼吸作用可能也会受到影响,因此细菌各方面的变化并不一定是ROS激增造成的氧损伤,也有可能是呼吸作用受到阻碍造成的。因此,若要深入研究ROS在细菌中的具体作用,寻找未知的ROS产生的途径和场所,还需发现类似Nox蛋白可以在特殊部位针对性地产生ROS的物质。虽然细菌体内的ROS只在固定的部位产生且具有强氧化性,难以从产生部位向外部扩散,但是经ROS氧化的脂质生成的醛类物质却能够较稳定地存在,并扩散至外部,损伤其他部位。因此可以假设,很多情况下ROS造成的损伤并非是其直接造成的,而是由ROS氧化某些生物大分子生成的具有一定氧化性的醛、酸等物质间接作用造成的,对于这些ROS的氧化产物在细菌中的作用,在研究时不可忽视。此外,目前的研究对象多数为常见的、需氧型的菌种,还需关注一些在极端条件下生存的或是完全厌氧的细菌,这些细菌自身的抗氧化系统如何应对外界的氧胁迫、ROS对其生长的影响不应忽视。
目前,针对细菌中ROS的研究涉及生物化学、分子生物学、微生物学、医学等多个学科,取得了很多重要的成果,但是多数集中在研究ROS与细菌生长、致病性、抗逆性之间的相关性,很多ROS具体的作用方式和作用通路尚不明确。同时,对ROS的研究还要依靠先进的技术方法,解决目前ROS研究时不易观察、实验结果偶然性大、ROS浓度难以测定等方面的问题,这些则涉及物理、化学、材料学、工程机械和计算机等领域。
[1] Storz G,Imlayt JA.Oxidative stress[J].Current Opinion in Microbiology,1999,2(2):188-194.
[3] Griguer CE,Oliva CR,Kelley EE,et al.Xanthine Oxidase-Dependent Regulation of Hypoxia-Inducible Factor in Cancer Cells[J].Cancer Research,2006,66(4):2257-2263.
[4] Nanduri J,Vaddi D, Khan S,et al.Xanthine Oxidase Mediates Hypoxia-Inducible Factor-2a Degradation by Intermittent[J]. PLoS ONE,2013,8(10):1-9.
[5] Briggs RT,Karnovsky ML,Karnovsky MJ.Hydrogen peroxide production in chronic granulomatous disease: a cytochemical study of reduced pyridine nucleotide oxidases[J].Journal of Clinical Investigation,1977,59(6):1088.
[6] Nakanishi A,Wada Y, Kitagishi Y,et al.Link between PI3K/AKT/PTEN Pathway and NOX Proteinin Diseases[J]. Aging and Disease,2014,5(3):203-211.
[7] Miller JW,Selhub J,Joseph JA.Oxidative damage caused by free radicals produced during catecholamine autoxidation: protective effects of O-methylation and melatonin[J].Free Radical Biology and Medicine,1996,21(2):241-249.
[8] Saller S,Merz-Lange J,Raffael S,et al.Norepinephrine, active norepinephrine transporter, and norepinephrine-metabolism are involved in the generation of reactive oxygen species in human ovarian granulosa cells[J].Endocrinology,2012,153(3):1472-1483.
[9] Ott M,Gogvadze V,Orrenius S, et al.Mitochondria, oxidative stress and cell death[J].Apoptosis,2007,12(5):913-922.
[10]Lushchak VI.Free radicals, reactive oxygen species, oxidative stress and its classification[J]. Chemico-Biological Interactions,2014,224:164-175.
[11]Semchyshyn HM,Lozinska LM.Fructose protects baker’s yeast against peroxide stress: potential role of catalase and superoxide dismutase[J].FEMS Yeast Research,2012,12(7):761-773.
[12]González-Flecha B,Demple B.Metabolic sources of hydrogen peroxide in aerobically growingEscherichiacoli[J].Journal of Biological Chemistry,1995,270(23):13681-13687.
[13]Santos AL,Gomes NC,Henriques I,et al.Contribution of reactive oxygen species to UV-B-induced damage in bacteria[J].Journal of Photochemistry and Photobiology B-Biology,2012,117:40-46.
[14]Subramanian M,Goswami M,Chakraborty S,et al.Resveratrol induced inhibition ofEscherichiacoliproceeds via membrane oxidation and independent of diffusible reactive oxygen species generation[J].Redox Biology,2014,2:865-872.
[15]卿三红,方柏山.NADH氧化酶的研究进展[J].华侨大学学报:自然科学版,2011,32(5):554-559.
[16]李林波,罗宇,屈凌波,等.NADH氧化酶研究进展[J].河南工业大学学报:自然科学版,2010,31(4):80-88.
[17]桂仕林,孟祥展,张久龙.双歧杆菌的耐氧机制[J].食品工业科技,2008,(7):280-283.
[18]韩晓燕,高丽萍,刘箐.NOX家族蛋白的研究进展[J].生命科学,2012,24(6):568-577.
[19]Finkel T,Holbrook NJ.Oxidants,oxidative stress and the biology of ageing[J].Nature,2000,408(6809):239-247.
[20]Pacello F,Ceci P,Ammendola S,et al.Periplasmic Cu,Zn superoxide dismutase and cytoplasmic Dps concur in protectingSalmonellaentericaserovar Typhimurium from extracellular reactive oxygen species[J]. Biochimica et Biophysica Acta: General Subjects,2008,1780(2):226-232.
[21]Lushchak V.Oxidative stress and mechanisms of protection against it in bacteria[J].Biochemistry (Moscow),2001,66(5):476-489.
[22]索玉娟.单核细胞增生李斯特菌超氧化物歧化酶在菌膜形成中的功能解析[D].上海:上海交通大学,2013.
[23]马淇,刘垒,陈佺.活性氧,线粒体通透性转换与细胞凋亡[J].生物物理学报,2012,28(7):523-536.
[24]张超,陈国薇,杨玉萍,等.食源性致病菌诱导细胞凋亡机理研究进展[J].食品科学,2014,35(5):234-238.
[25]王兴华,刘慧,仪慧兰.活性氧和钙离子参与镉诱导的酵母细胞死亡过程调节[J].环境科学学报,2014,34(7):1869-1873.
[26]Humphries KM,Szweda LI.Selective inactivation of α-ketoglutarate dehydrogenase and pyruvate dehydrogenase: reaction of lipoic acid with 4-hydroxy-2-nonenal[J]. Biochemistry,1998,37(45):15835-15841.
[27]Cabiscol E,Tamarit J,Ros J.Oxidative stress in bacteria and protein damage by reactive oxygen species[J]. International Microbiology,2010,3(1):3-8.
[28]Sies H,Menck CF.Singlet oxygen induced DNA damage[J].Mutation Research/DNAging,1992,275(3):367-375.
[29]DeFedericis H-C,Patrzyc HB,Rajecki MJ,et al.Singlet oxygen-induced DNA damage[J].Radiation Research,2006,165(4):445-451.
[30]Yesilkaya H,Andisi VF,Andrew PW,et al.Streptococcuspneumoniaeand reactive oxygen species: an unusual approach to living with radicals[J].Trends in Microbiology,2013,21(4):187-195.
[31]Huang Y,Suo Y,Shi C,et al.Mutations ingltB andgltC reduce oxidative stress tolerance and biofilm formation inListeriamonocytogenes4b G[J]. International Journal of Food Microbiology,2013,163(2):223-230.
[32]黄艳燕.单核细胞增生李斯特菌菌膜状态下的抗氧胁迫分子机制[D].上海:上海交通大学,2013.
[33]张超,陈国薇,杨玉萍,等.活性氧调节单核细胞增生李斯特菌菌膜形成[J].食品科学,2013,34(23):189-193.
[34]Yujuan Suo,Yanhong Liu,Chunlei Shi,et al.The Expression of Superoxide Dismutase (SOD) and aPutative ABC Transporter Permease Is InverselyCorrelated during Biofilm Formation inListeriamonocytogenes4b G[J].PloS one,2012,7(10):e48467.
[35]Cáp M,Váchová L,Palková Z.Reactive oxygen species in the signaling and adaptation of multicellular microbial communities[J]. Oxidative Medicine and Cellular Longevity,2012:976753.
[36]邹海杰.铁离子调节革兰氏阴性菌外膜蛋白OmpW抗宿主氧化应激作用及机制的研究[D].杭州:浙江理工大学,2012.
[37]Corcionivoschi N,Alvarez LA,Sharp TH,et al.Mucosal reactive oxygen species decrease virulence by disruptingCampylobacterjejuniphosphotyrosine signaling[J]. Cell Host&Microbe,2012,12(1):47-59.
[38]Derr AM,Faustoferri RC,Betzenhauser MJ,et al.Mutation of the NADH oxidase gene (nox) reveals an overlap of the oxygen-and acid-mediated stress responses inStreptococcusmutans[J].Applied and Environmental Microbiology,2012,78(4):1215-1227.
[39]Lin PW,Myers LE, Ray L,et al.Lactobacillusrhamnosusblocks inflammatory signaling in vivo via reactive oxygen species generation[J]. Free Radical Biology and Medicine, 2009, 47(8): 1205-1211.
[40]Jones RM,Luo L,Ardita CS,et al.Symbioticlactobacillistimulate gut epithelial proliferation via Nox-mediated generation of reactive oxygen species[J]. The EMBO Journal, 2013, 32(23): 3017-3028.
[41]张亚妮,段康民.活性氧在细菌耐抗生素机制中的作用[J].中国药理学通报,2010,26(9):1129-1131.
[42]Libardo MD,Nagella S,Lugo A,et al.Copper-binding tripeptide motif increases potency of the antimicrobial peptide Anoplin via Reactive Oxygen Species generation[J]. Biochemical and Biophysical Research Communications, 2015, 456(1): 446-451.
[43]Battán PC,Barnes AI,Albesa I.Resistance to oxidative stress caused by ceftazidime and piperacillin in a biofilm ofPseudomonas[J].Luminescence,2004,19(5):265-270.
[44]Boles BR,Singh PK.Endogenous oxidative stress produces diversity and adaptability in biofilm communities[J].Proceedings of the National Academy of Sciences,2008,105(34):12503-12508.
[45]Aiassa V,Barnes AI,Albesa I.Resistance to ciprofloxacin by enhancement of antioxidant defenses in biofilm and planktonicProteusmirabilis[J].Biochemical and Biophysical Research Communications,2010,393(1):84-88.
[46]Halliwell B,Gutteridge JMC.Free radicals in biology and medicine[M]. NY:Oxford University Press.1999.
[47]齐文学.细胞内活性氧自由基检测的荧光探针的设计合成及应用[D].济南:山东师范大学,2012.
[48]张鑫,王旗.细胞中活性氧的荧光探针检测法研究进展[J].现代预防医学,2010,37(22):4316-4318.
[49]肖安风,孙亮先,倪辉,等.毕赤酵母发酵过程胞内活性氧的定量分析[J].泉州师范学院学报,2009,27(4):87-90.
The Reactive Oxygen Species Generated by Bacteria and its Functions
LIU Wu-kang, WU Shu-yan, CHEN Guo-wei, ZHANG Chao, WU Man, LI Sen, LIU Qing
(Schl.ofMed.Instrum't&FoodEngin.,ShanghaiUni.forSci. &Technol.,Shanghai200093)
Reactive Oxygen Species (ROS) is a kind of oxygenous small molecular substance with extremely strong chemical activity generated during aerobic metabolism of aerobe and specific enzymes. It has two major generation approaches according to its production mechanism. The first one is ROS generated by single electron transfer in respiration. Generally the superfluous ROS generated from this approach has great oxidative damage to biomacromolecule and is closely related to many diseases. The second one is the small amount of ROS generated by specific enzymes. Usually believing, the ROS generated by this approach has the effect of killing invasive foreign microorganism. However, recently a large number of studies have shown that the ROS generated by this approach have multiple physiological functions such as signal molecular and genetic switch. Simultaneously, antioxidant system of organisms also can directly regulate the level of ROS. This paper observed on the research achievement of ROS in bacteria recently and the existing problems and the future development.
bacterium; reactive oxygen species; antioxidant system; function
国家自然科学基金项目(31371776)
刘武康 男,硕士研究生。研究方向为食源性致病菌致病机理。E-mail:liu_wukang@126.com
* 通讯作者。李森 女,博士,讲师。研究方向为食源性致病菌致病机理。E-mail:lisen_1027@126.com
2015-03-23;
2015-05-06
Q936;Q505;Q507
A
1005-7021(2016)01-0089-07
10.3969/j.issn.1005-7021.2016.01.015
刘箐 男,博士,教授,博士生导师。研究方向为食源性致病菌致病机理及快速检测技术研究。Tel:021-65710369,
E-mail:liuq@usst.edu.cn
