当归补血汤对大鼠肾缺血-再灌注损伤后T L R4/N F- B信号通路的影响
2016-12-21刘福和倪文娟王国康徐权毅
刘福和,倪文娟,王国康,徐权毅
(1.浙江医药高等专科学校药学院,浙江 宁波 315100; 2.华东宁波医药有限公司,浙江 宁波 315806)
当归补血汤对大鼠肾缺血-再灌注损伤后T L R4/N F- B信号通路的影响
刘福和1,倪文娟2,王国康1,徐权毅1
(1.浙江医药高等专科学校药学院,浙江 宁波 315100; 2.华东宁波医药有限公司,浙江 宁波 315806)
目的 探讨当归补血汤对大鼠肾缺血-再灌注损伤(RIRI)后TLR4/NF- B信号通路的影响,为RIRI的作用机制及其干预提供参考。方法 将45只SD大鼠随机分为假手术组(Sham组)、缺血-再灌注模型对照组(IR组)、当归补血汤预处理组(IR+DG组),每组15只。实验前5 d,Sham组和IR组以生理盐水10 mL/(kg·d)每天灌胃1次,IR+DG组以当归补血汤10 mL/(kg·d)每天灌胃1次。所有大鼠均切除右肾,Sham组仅游离左肾蒂,不夹闭左肾动脉;IR组和IR+DG组均行RIRI模型制备。比较各组血清肌酐(Cr)、尿素氮(BUN)水平,行肾脏组织形态学检查及肾小管评分,检测肾组织TLR4,NF- B p65 mRNA水平。结果 各组均按预定方案完成手术,IR组、IR+DG组大鼠均顺利完成RIRI模型制备;IR组、IR+DG组血清Cr,BUN水平及肾组织中TLR4 mRNA和NF- B p65 mRNA的表达水平均高于Sham组(t=3.72~7.05,P<0.05或 P<0.01),IR+DG组血清Cr,BUN水平及肾组织中TLR4 mRNA和NF- B p65 mRNA的表达水平均低于IR组(t=4.16~5.37,P<0.05);Sham组肾脏呈正常的组织结构,IR组、IR+DG组均呈程度不一的炎性反应,但 IR+DG组炎性程度轻于 IR组;IR组、IR+DG组肾小管评分均高于 Sham组水平(tIR=9.02,tIR+DG=6.21,P<0.01),IR+DG组肾小管评分低于IR组(tIR=5.15,P<0.05)。结论 大鼠RIRI后可能通过TLR4/NF- B信号通路介导下游级联炎症免疫反应,当归补血汤预处理可能通过抑制TLR4/NF- B信号通路而缓解RIRI损伤过程中的炎性反应,对大鼠RIRI损伤具有积极的保护作用。
缺血-再灌注损伤;信号转导;免疫炎性反应;当归补血汤;干预;大鼠
肾脏是哺乳动物的高灌注器官,对缺血及缺血-再灌注均比较敏感,肾缺血-再灌注损伤(RIRI)是临床常见的病理现象[1]。免疫炎性反应在RIRI的发病机制中可能有重要作用[2]。近年来发现的一类细胞表面信号传导跨膜受体,即Toll样受体(TLRs)是参与非特异性免疫的一类重要蛋白质分子,可通过激活核因子-κB(NF-κB)上调炎症介质表达,进而介导下游的级联炎症免疫反应[2-3]。前期实验研究[4]及临床实践表明,当归补血汤对肾脏具有较好的保护作用,但其作用机制尚未完全阐明。基于此,笔者探讨了当归补血汤对大鼠肾RIRI后 Toll样受体4(TLR4)/NF-κB信号通路的影响,旨在为阐述当归补血汤对RIRI的可能的保护机制提供参考,现报道如下。
1 材料与方法
1.1 动物、试药及引物
动物:健康雄性SD大鼠45只,体质量230~260 g,鼠龄8~12周,SPF级,由浙江中医药大学动物实验中心提供,实验前常规分笼饲养至少7 d。
试药:当归(河南省宛西制药股份有限公司,批号为080303)6 g,黄芪(河南省宛西制药股份有限公司,批号为090203)30 g,加蒸馏水煎煮至100 mL(质量浓度为0.36 g/mL)备用。
引物:TRIzol试剂(美国Invitrogen公司);逆转录及定量聚合酶链式反应(PCR)试剂盒(美国Fermentas)。
目的基因及内参所用引物为(5′-3′)β-actin:正向GAAGTACCCCATTGAACACG,反向CAGGTCCAGACGCAGGATGG;TLR4:正向AGACATCCAAAGGAATACAGCAA,反向GCCTTCATGTCTATAGGTGATGC;NF-κB p65:正向GAGAGCCCTTGCATCCTTTA,反向CTTCCCTTTGGTCTTTCTGT,由上海生物工程公司设计及合成。
1.2 方法
按随机数字表法将大鼠分为3组,即假手术组(Sham组)、缺血再灌注模型对照组(IR组)、当归补血汤预处理组(IR+DG组),每组15只。试验前5 d,Sham组和IR组以生理盐水10 mL/(kg·d)每天灌胃1次,IR+DG组以当归补血汤10 mL/(kg·d)每天灌胃1次。大鼠试验前12 h禁食,自由饮水。予以3.5%水合氯醛10 mL/kg经腹腔注射麻醉,沿正中线打开腹腔。所有大鼠均切除右肾,其中Sham组仅游离左肾蒂,不夹闭左肾动脉;IR组和IR+DG组均使用无创动脉夹夹闭左肾动脉45 min,松开动脉夹再灌注2 h,若肾脏经紫黑色变为红色,则提示RIRI模型制作成功[4],造模不成功的实验大鼠均予以剔除。
1.3 观察指标
1.3.1 肾功能生化指标
试验结束后,抽取下腔静脉血5 mL,采用日本Hitachi7170A型自动化生化分析仪测定血清肌酐(Cr)、尿素氮(BUN)。
1.3.2 肾脏组织形态学及肾小管评分
抽取静脉血后,切除左肾,纵向剖开,分成2段,一段置-70℃保存备用;另一段置中性福尔马林液固定24 h,常规石蜡包埋制备病理切片,苏木精-伊红(HE)染色,光镜下观察肾小球、肾小管、肾间质变化及炎性细胞浸润情况。采用Paller法[5]进行肾小管评分以评估肾小管损伤程度,×400倍光镜下在肾脏皮质与髓质交界部位随机选取10个视野,每个视野再随机选取10条肾小管进行评分,其中皮质、髓质各取1/2。统计100个肾小管计分,计算平均分值。分值越高肾小管损伤越严重。
1.3.3 肾组织TLR4,NF-κB p65 mRNA检测
取保存的另一侧肾组织 80 mg,组织匀浆后采用Trizol法提取肾脏总RNA;依据逆转录试剂盒说明书配制反应体系,逆转录合成cDNA;以cDNA为模板,按照QRT-PCR试剂盒说明书配制反应体系,采用半定量RT-PCR法扩增TLR4 mRNA,NF-κB mRNA。以目的基因与内参β-actin表达量为参照进行相对定量分析。RT-PCR反应条件:94℃5 min,94℃30 s,TLR4 mRNA 60℃,NF-κB mRNA 55℃30 s,72℃1 min,72℃5 min,36个循环。扩增后产物进行1.5%琼脂糖凝胶电泳,用凝胶成像分析仪于紫外光下采集图像。
1.4 统计学处理
采用 SPSS 19.0统计学软件进行分析,计量资料用均数±标准差(s)表示,正态分布的计量资料两组间比较采用配对样本的LSD-t检验,检验水准为α=0.05。P<0.05为差异有统计学意义。
2 结果
2.1 血清Cr及BUN
各组均按预定方案完成手术,IR组、IR+DG组大鼠均顺利完成肾缺血-再灌注模型制备。IR组、IR+DG组Cr和BUN水平均高于Sham组(t=3.72~7.05,P<0.05或 P<0.01),IR+DG组血清Cr和BUN水平均低于IR组(tCr=4.16,tBUN=5.37,P<0.05),见表1。
表1 各组大鼠血清Cr及BUN水平比较(s,例,n=15)

表1 各组大鼠血清Cr及BUN水平比较(s,例,n=15)
注:与 Sham组比较,aP<0.05,bP<0.01;与 IR组比较,cP<0.05。表2同。
组别Sham组IR组IR+DG组Cr( mol/L) 25.92±3.76 45.75±4.90b34.21±3.50acBUN(mmol/L) 6.67±0.45 14.95±0.76b10.27±0.53ac
2.2 肾脏组织形态学及肾小管评分
经HE染色后,光镜下可见:Sham组肾小球、肾小管呈正常的肾脏组织学结构,间质内未见充血水肿,亦没有炎性细胞浸润,见图1 A;IR组程度不一的肾小球与肾间质呈充血像,肾小管上皮细胞不同程度的肿胀、坏死和脱落,管腔扩张,肾间质水肿、炎性细胞浸润明显,见图1 B;IR+DG组肾小球结构无明显变化,肾小管上皮细胞肿胀、坏死及肾间质的水肿轻于IR组,有少量炎性细胞浸润,见图1 C。Sham组、IR组、IR+DG组肾小管评分分别为(85.27±16.50)分、(381.31± 52.32)分、(215.78±30.37)分,可见IR组、IR+DG组肾小管评分均高于 Sham组(tIR=9.02,tIR+DG=6.21,P<0.01),IR+DG组肾小管评分低于IR组(tIR=5.15,P<0.05)。
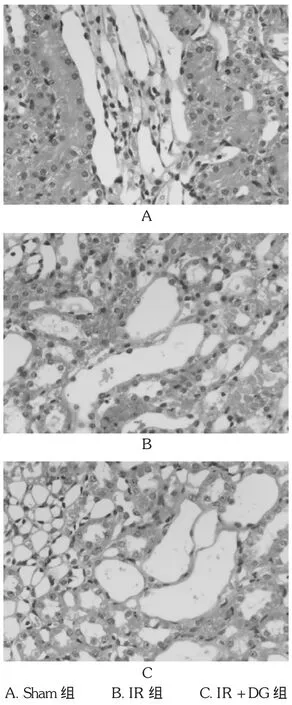
图1 HE染色(×400)
2.3 肾组织中TLR4和NF- B p65 mRNA表达
以β-actin为内参,检测各组肾组织中TLR4 mRNA和NF-κB p65 mRNA的表达,IR组、IR+DG组肾组织中TLR4 mRNA和NF-κB p65 mRNA的表达水平均高于 Sham组(t=4.59~8.05,P<0.05或 P<0.01),IR+DG组肾组织中TLR4 mRNA和NF-κB p65 mRNA的表达水平均低于 IR组(tTLR4=4.37,tNF-κBp65=5.36,P<0.05)。详见表2。
3 讨论
缺血-再灌注损伤是一种多因素、多途径的复杂病理生理过程[6],可能涉及复杂的发生进展机制,但目前仍未完全阐明该发生机制,相关学者和学说试图阐释该发生机制,有细胞内Ca2+超载、氧自由基增加、免疫炎症因子作用、高能磷酸化合物缺乏、细胞凋亡及无复流现象等[1-2],其中免疫炎性反应介导的损伤作用被认为是缺血-再灌注损伤的关键环节[2]。
表2 各组大鼠肾组织中TLR4,NF- B p65 mRNA表达水平比较(s,n=15)

表2 各组大鼠肾组织中TLR4,NF- B p65 mRNA表达水平比较(s,n=15)
组别Sham组IR组IR+DG组TLR4(×10-3) 0.51±0.09 2.60±0.17b1.43±0.21acNF- B p65(×10-3) 0.61±0.13 2.81±0.36b1.12±0.23ac
TLR4/NF-κB信号通路在介导下游级联炎症免疫反应中具有重要作用。有学者认为缺血-再灌注损伤是以补体成分错误攻击自身抗原(Ag)为特征的先天性免疫应答[7]。TLR4是目前研究较为成熟的一种TLRs,能特异性识别病原体相关分子模式(PAMP)[8],通过跨膜结构将病原相关分子刺激信号转导入细胞内,诱导NF-κB等转录因子活化激活NF-κB,激活下游的信号转导,引起一系列的炎症应答,促成炎症的发生和发展。阻断TLR4/NF-κB信号传导通路有望成为干预缺血-再灌注损伤的一个重要的治疗靶点[9]。
近年来,在缺血-再灌注损伤的干预研究中,缺血预处理备受关注并彰显出诸多优势。缺血预处理[10]是指于可能缺血出现前即对组织器官进行短暂、轻微的缺血-再灌注,从而提高细胞、组织和器官对缺血缺氧的耐受程度,一般认为这是经启动组织、细胞自身内源性的保护机制而发挥效应的[11]。目前,缺血预处理的保护作用已被不同的动物及不同的器官模型所证实为可降低缺血-再灌注损伤的有效方法。本研究中,IR+DG组于大鼠造模前经腹腔注入当归补血汤即为缺血预处理,该方选自金元时期李东垣所著《内外伤辨惑论》[12],仅由当归、黄芪组方,其中重用黄芪以大补脾肺之气,以资生血之源,与当归并用,养血和营,则阳生阴长,气血两旺。两药配伍,共著补气、生血、活血之功,临床主要用于劳倦内伤、气弱血虚之证。
本研究结果表明,IR组、IR+DG组血清Cr和BUN水平,肾小管评分,肾组织中TLR4 mRNA和NF-κB p65 mRNA的表达水平均高于Sham组,肾脏组织形态学也呈现出类似的变化,这提示IR组、IR+DG组肾脏组织形态、功能出现损伤,TLR4及NF-κB转录增加,其原因在于造模所致的缺血-再灌注损伤。与IR组比较,IR+DG组血清Cr和BUN水平、肾小管评分、肾组织中TLR4 mRNA和NF-κB p65 mRNA的表达均较低,提示IR+DG组缺血-再灌注损伤较轻,分析其原因在于当归补血汤预处理减轻了缺血-再灌注损伤的程度,这与文献[12]研究结果一致,某些中药成分可以阻断TLR4/NF-κB信号通路(包括降低其下游关键因子表达)[13-14],对机体起保护作用。
综上所述,大鼠肾RIRI后可能通过TLR4/NF-κB信号通路介导下游级联炎症免疫反应,当归补血汤预处理可能通过抑制 TLR4/NF-κB信号通路而缓解缺血-再灌注损伤过程中的炎性反应,对大鼠肾RIRI具有积极的保护作用。
[1]石 旦,何小舟,徐海燕,等.肾缺血再灌注损伤及其保护的研究进展[J].医学综述,2009,15(18):2 802-2 806.
[2]梁永会,文志勇,詹鸿静,等.肾缺血再灌注损伤后炎症因子和触发信号的研究进展[J].海南医学,2012,23(5):115-118.
[3]陈 超.Toll样受体4与肾缺血再灌注损伤关系研究进展[J].国际泌尿系统杂志,2014,34(2):295-298.
[4]吕长江,刘福和,王国伟,等.当归补血颗粒对大鼠肾缺血再灌注损伤的保护机制研究[J].中国现代应用药学,2014(6): 666-671.
[5]Paller MS.Free radical-mediated postischemic injury in renal transplantation[J].Ren Fail,1992,14(3):257-260.
[6]阮丽君,赵 明,黄清松.参麦对大鼠肾缺血再灌注损伤中TLR4/NF- B信号通路的影响[J].中国现代医学杂志,2013,23(7):11-14.
[7]杨 楠,唐金荣.Toll样受体4与脑缺血再灌注损伤的关系研究进展[J].山东医药,2015,59(12):103-105.
[8]Rodriguez-Osorio CA,Lima G,Herrera-Caceres JO,et al.Genetic variations in toll-like receptor 4 in Mexican-Mestizo patients with intra-abdominal infection and/or pneumonia[J].Immunol Lett,2013,153(1-2):41-46.
[9]Wang C,Sun H,Song Y,et al.Pterostilbene attenuates inflammation in rat heart subjected to ischemia-reperfusion:role of TLR4/NF- B signaling pathway[J].Int J Clin Exp Med,2015,8(2):1 737-1 746.
[10]缪亦锋,邱永明,张晓华,等.缺血预处理通过减轻内质网应激保护全脑缺血大鼠[J].国际脑血管病杂志,2013,21(8):618-623.
[11]王红霞,李世英,李 峥,等.缺血预处理对局灶性脑缺血再灌注大鼠缺血侧海马CA1区低氧诱导因子-1 及存活素表达的影响[J].临床神经病学杂志,2015,38(2):121-124.
[12]田树云.补中益气汤应用举隅[J].实用中医内科杂志,2011,25(10):75-76.
[13]路小光,战丽彬,刘伟光,等.大黄附子汤对重症急性胰腺炎肺损伤大鼠肺组织Toll样受体4/核转录因子- B的影响[J].中国中西医结合急救杂志,2009,16(1):14-17.
[14]闫曙光,惠 毅,周永学,等.乌梅丸拆方对溃疡性结肠炎大鼠结肠TLR4/NF- B信号通路的影响[J].时珍国医国药,2013,24(6):1 386-1 388.
Influence of Danggui Buxue Decoction on TLR4/NF-κB Signal Pathway of Rats after Renal Ischemia Reperfusion Injury
Liu Fuhe1,Ni Wenjuan2,Wang Guokang1,Xu Quanyi1
(1.Pharmacy Faculty of Zhejiang Pharmaceutical College,Ningbo,Zhejiang,China 315100;
2.Huadong Ningbo Medicine Co.,Ltd.,Ningbo,Zhejiang,China 315806)
Objective To investigate the influence of Danggui Buxue Decoction on TLR4/NF-κB signal pathway of rats after renal ischemia reperfusion injury(RIRI),to provide reference for interpretation of its mechanism and intervention.M ethods 45 SD rats were randomly divided into the Sham group,IR group,and IR+DG group,15 rats in each group.5 d before experiment,rats in Sham group and IR group were orally once a day with normal saline by 10 mL/(kg·d),and rats in IR+DG group were orally once a day with Danggui Buxue Decoction by 10 mL/(kg·d).All rats were resected right kidney,rats in Sham group were dissociated left renal pedicle,without clamping left renal artery,and rats in IR group and IR+DG group were all given RIRI model preparation.After experiment,serum creatinine(Cr)and urea nitrogen(BUN),renal histology and renal tubule score,TLR4 mRNA and NF-κB p65 mRNA in renal tissue were compared.Results All groups completed operation according to predetermined plan;IR group and IR+DG group successfully completed RIRI model preparation.Serum Cr and BUN level,TLR4 mRNA and NF-κB p65 mRNA in renal tissue of IR group and IR+DG group were both higher than that in sham group(t=3.72-7.05,P<0.05 orP<0.01),and serum Cr and BUN level,TLR4 mRNA and NF-κB p65 mRNA in renal tissue of IR+DG group were lower than that in IR group(t=4.16-5.37, P<0.05).Sham group′s kidney showed normal structure,and there were some inflammatory reactions in IR group and IR+DG group, yet IR+DG group′s inflammatory reaction were slighter than that in IR group.Renal tubules score in IR group and IR+DG group were both higher than that in sham group(tIR=9.02,tIR+DG=6.21,P<0.01),yet IR+DG group′s renal tubules score were lower than that in IR group(tIR=5.15,P< 0.05).Conclusion It may mediate downstream cascade inflammatory immune response by TLR4/NF-κB signal pathway after RIRI in rats.Danggui Buxue Decoction pretreatment may relieve inflammatory response during RIRI process by inhibiting LR4/NF-κB signal pathway,thus has positive protection to RIRI.
ischemia reperfusion injury;signal transduction;inflammatory immune response;Danggui Buxue Decoction;intervention;rat
R285.5;R289.5
A
1006-4931(2016)21-0007-04
2016-07-13)
浙江省教育厅科研项目,项目编号:Y201534611。
