新生儿B组链球菌败血症的临床特点与诊治
2016-12-21郑露艳华春珍罗巧二卢洪萍李建平
郑露艳 华春珍 罗巧二 卢洪萍 李建平
新生儿B组链球菌败血症的临床特点与诊治
郑露艳 华春珍 罗巧二 卢洪萍 李建平
B组链球菌(group B streptococcus,GBS)亦称无乳链球菌[1-2],能引起牛乳房炎,严重危害畜牧业。研究发现GBS也是一种威胁新生儿生命的主要致病菌,可引起新生儿败血症、肺炎及脑膜炎,临床病死率高,有颅内感染的幸存者可有神经系统后遗症[2-4]。GBS从20世纪70年代起已受到全世界的关注,近年来关于GBS导致母婴感染的病例逐年增加[1-3,5-7]。笔者收集3家医院近几年收治的GBS败血症患儿的临床资料,分析新生儿GBS败血症的临床特点、治疗及转归,为该病的诊治提供参考。
1 资料和方法
1.1 一般资料 2009年1月1日至2015年12月31日浙江大学医学院附属儿童医院、宁波妇女儿童医院和台州医院收治的经细菌培养证实为GBS感染的新生儿58例,其中男29例,女29例。发病时出生0.13h~28d,平均(9.30±8.99)d;胎龄189~287(268.57± 18.26)d;其中早产儿11例(19.0%),胎龄中位数为0.56d;出生体重750~4 400(3 146.12±639.60)g,其中低体重儿7例(12.1%),极低体重儿1例(1.7%);适于胎龄儿42例(72.4%),小于胎龄儿6例(10.4%),大于胎龄儿10例(17.2%);自然分娩44例(75.9%),剖宫产14例(24.1%);第1胎31例(53.5%),第2胎 18例(31.0%),第2胎以上9例(15.5%);第1产44例(75.9%),第2产14例(24.1%)。母亲健康状况:母亲在分娩前出现胎膜早破(1~17h)10例(17.2%),其中1例合并胎儿宫内窘迫,1例羊水过少;羊水I~Ⅲ度污染4例;产程中,2例患儿母亲合并发热,1例体温>39℃,另1例体温为38.8℃;母亲产前血培养发现有GBS 1例,患妊娠期糖尿病1例,妊娠期高血压1例,携带乙型肝炎病毒3例,结核病1例,贫血1例。2例患儿乳母罹患乳腺炎且乳汁培养无乳链球菌生长。
1.2 方法 通过医院实验室信息管理系统查找细菌培养结果为无乳链球菌的新生儿,剔除非无菌标本来源者和发病时年龄超过28d者。GBS的鉴定根据细菌在血平板形成灰白色、表面光滑、有乳光、圆形、β溶血的菌落;革兰染色证实为阳性球菌后经细菌自动鉴定系统VITEK的GPI卡进行鉴定;菌株的药敏试验采用AST-GP67卡,个别药敏失败者采用纸片扩散法补充检测,药敏结果的判读按照美国临床和实验室标准协会的指南,肺炎链球菌ATCC49619为质控菌株。临床资料的收集内容包括患儿的病史特点、体格检查要点、血常规、C反应蛋白(CRP)、治疗药物和转归等。
1.3 统计学处理 采用SPSS 11.5统计软件;计量资料以或中位数表示,组间比较采用t检验或Z检验;计数资料组间比较采用χ2检验。
2 结果
2.1 临床表现 新生儿感染GBS后常见症状为气促呻吟、发热、喂养困难等。58例患儿中早发型GBS败血症27例(46.6%),晚发型GBS败血症31例(53.4%)。27例早发型者均在出生3d内发病,生后24h内发病者22例(81.5%)。早发型者首发症状为气促呻吟或呼吸
困难16例,发热3例,皮肤黄染2例,发绀1例,抽搐惊厥1例,呕吐2例,无症状早产儿2例。31例晚发型者发病时日龄(16.74±5.45)d。晚发型者首发症状为发热22例(71.0%),其中9例伴少吃、少哭、少动,2例伴抽搐;另9例患儿以少吃为首发者2例,惊厥发绀2例,皮疹2例,气促呻吟1例,皮肤黄染1例,会阴硬肿1例。新生儿早发型和晚发型GBS败血症临床资料比较见表1。
2.2 实验室检查
2.2.1 血常规 入院时患儿WBC为(1.20~45.65)×109/L,其中>20×109/L共11例,病程中患儿WBC最高值达(21.55±12.21)×109/L。治愈好转的患儿WBC恢复正常的时间为0~30(6.31±5.99)d。患儿入院时中性粒细胞计数(N)为(0.82~39.35)×109/L,中位数6.39×109/L,其中N减少者有8例,病程中N最高值为(13.24±10.57)×109/L。入院时PLT为(54~630)×109/L,平均(280.45±121.46)× 109/L,<100×109/L者2例,>300×109/L者23例,病程中患儿PLT最高值达(420.8±182.3)×109/L;49例好转或治愈患儿出院时PLT为(71~709)×109/L,平均(329.82±144.24)×109/L,<100×109/L者2例,>300× 109/L者25例。新生儿早发型和晚发型GBS败血症患儿WBC、N和PLT变化情况比较见表2。
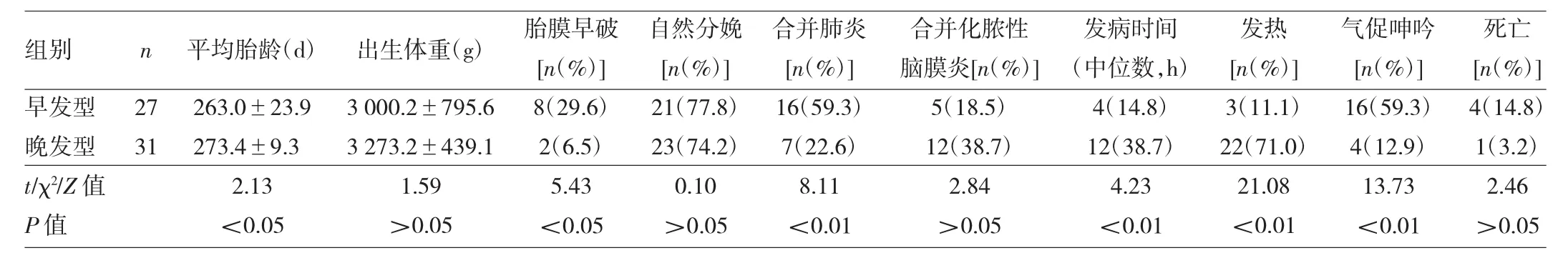
表1 新生儿早发型和晚发型GBS败血症临床资料比较
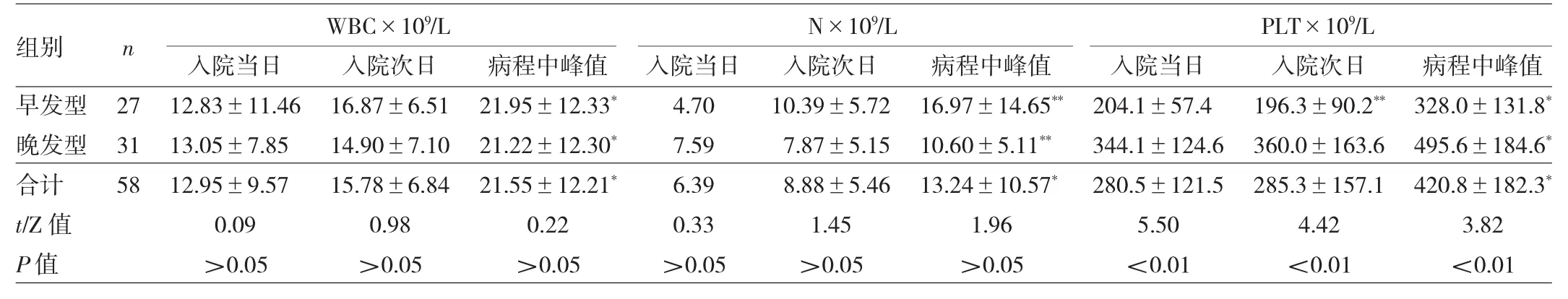
表2 新生儿早发型和晚发型GBS败血症患儿WBC、N和PLT变化情况比较
2.2.2 CRP 患儿入院时CRP为0~161mg/L,中位数16.4mg/L,其中高于正常者36例(62.1%),有5例未进行CRP检测。入院次日CRP为0~171mg/L,中位数25mg/L,其中高于正常者仍为36例。所有患儿病程中CRP始终正常者11例(19.0%),曾高于正常者45例(77.6%),与入院时比较差异有统计学意义(χ2=6.10,P<0.05),但在早发型中比较差异无统计学意义(χ2= 1.88,P>0.05),在晚发型中比较差异有统计学意义(χ2=10.35,P<0.01)。入院后有2例患儿始终未进行CRP检测。
2.2.3 脑脊液检查 入院后有32例患儿行腰椎穿刺检查。15例脑脊液常规WBC明显高于正常,WBC为(0.024~27)×109/L,中位数2.34×109/L,其中WBC>1.0×109/L者10例,(>0.1~1.0)×109/L者3例,(0.01~ 0.1)×109/L者仅2例。蛋白质定量范围0.10~3.29g/L,平均(1.52±1.20)g/L,>1.2g/L者8例。糖为0.1~7.29mmol/L,平均(2.05±1.99)mmol/L,<3.9mmol/L者14例。氯化物为101.7~122.3mmol/L,平均(113.13±6.51)mmol/L,<117mmol/L者10例。脑脊液WBC恢复正常时间为3~ 59d,中位数13d;蛋白质恢复正常时间为0~59d,中位数1.5d;糖指标恢复较慢,仅2例出院时恢复正常;氯化物恢复正常时间为0~34d,中位数为3d。出院时WBC仍未降至正常者4例,蛋白质未降至正常者4例。
2.2.4 病原学检查和药敏试验 58例患儿均在未使用抗生素前行血培养或无菌体腔培养GBS阳性,其中26例行脑脊液标本培养,结果显示6例脑脊液GBS阳性,且血培养也均为阳性。6例患儿中有3例脑脊液和血培养的药敏结果相同;另3例中1例血培养对青霉素G、氨苄西林和四环素均敏感,而脑脊液培养均耐药;1例血培养对环丙沙星、左氧氟沙星和莫西沙星均耐药,但脑脊液培养敏感;余下1例血培养对环丙沙星敏感而脑脊液培养中介。58株GBS对常用抗生素的药敏情况见表3。
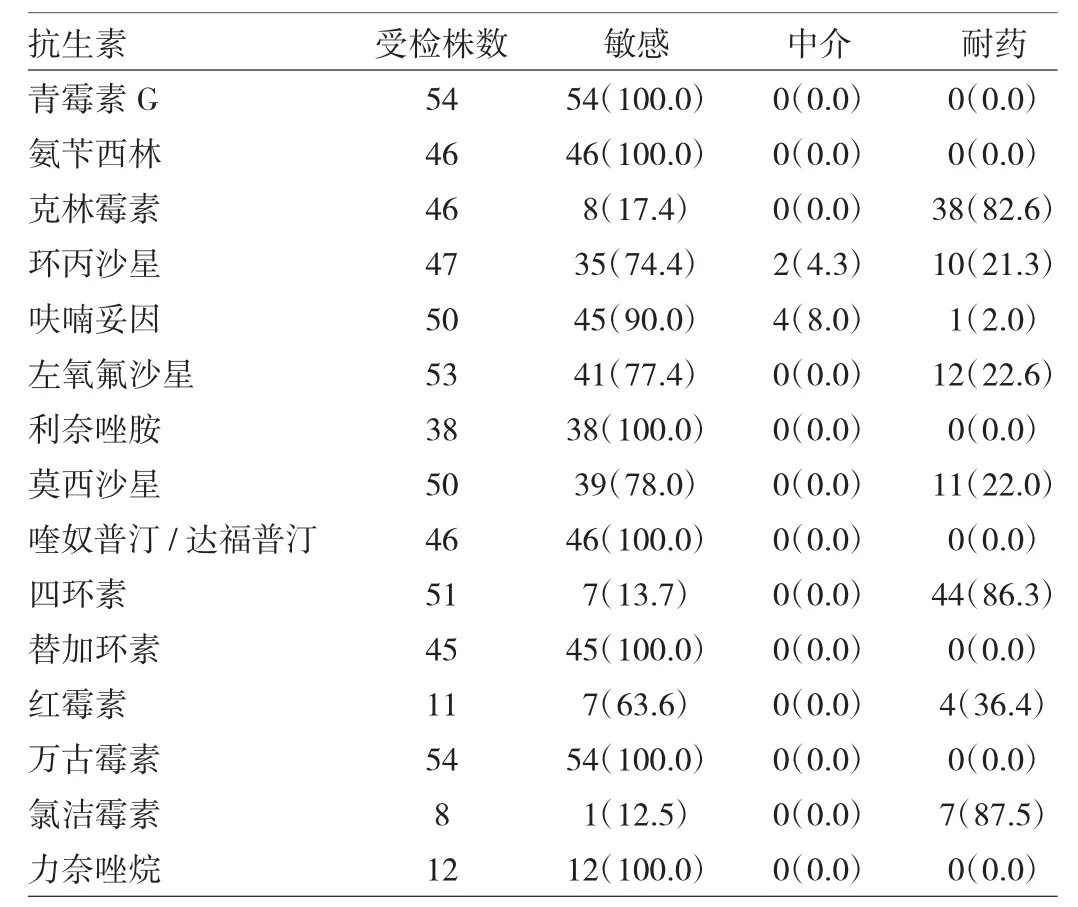
表3 58株GBS对常用抗生素的药敏情况[例(%)]
2.3 颅脑B超 17例化脓性脑膜炎患儿有13例行颅脑B超检查,其中4例提示硬膜下积液,2例双侧脑室稍扩大,1例颅内出血,1例显示颅内散在高信号,5例无异常。
2.4 治疗及转归 58例患儿(含转外院4例)有35例采用青霉素类联合头孢菌素类抗感染,其中13例加用万古霉素;另14例单用青霉素类,9例单用头孢菌素类抗生素,其中各有1例联合万古霉素抗感染。患儿住院时间为1~98d,平均(17.93±16.97)d。53例治愈或好转;5例死亡,其中1例为晚发型合并化脓性脑膜炎,4例为早发型败血症。
3 讨论
GBS是一种条件致病菌,常寄居于女性生殖道,是孕产妇胎膜早破、羊膜腔感染的主要发病因素,也是造成新生儿败血症的重要原因之一[8]。新生儿败血症感染根据发病时间早晚,分为早发型(生后7d内发病)与晚发型(生后7d后发病)两种类型。本资料中早发型患儿占46.6%,晚发型占53.4%。早发型者合并胎膜早破的比例较高,且部分母亲产前血培养GBS阳性,少数母亲患有乳腺炎,所以新生儿受GBS感染既可由垂直传播引起,也可由水平传播途径造成。医院应积极开展孕妇的产前筛查,根据美国疾病预防控制中心制定的《围产期无乳链球菌预防指南》[9],对所有妊娠35~37周孕妇进行无乳链球菌筛查,降低母婴传播感染率,同时注意新生儿所用餐具和食用食品的卫生,从而降低感染率。
临床表现和病史是诊断病情的首要根据。本资料显示,早发型患儿合并肺炎的比例高,多以气促、呻吟为首发症状就诊,其中早产儿有8例,考虑与新生儿呼吸系统的健全程度有关,因GBS感染后常先侵入新生儿肺部,造成细胞的直接损伤和宿主的炎症反应,再由此经血流侵袭其他组织和器官[10],所以早发型多以肺部症状为主。因GBS也具有穿过脑细胞屏障的能力,且其对血脑屏障内皮细胞具有特殊黏附性,可直接造成脑细胞溶解[11],所以晚发型新生儿或早发型进展后期多合并化脓性脑膜炎,以发热、原始反射减弱、少吃、少动为主要临床表现,也可出现惊厥抽搐、脑膜刺激征等症状[12]。本资料中化脓性脑膜炎患者有17例,多以发热为首发症状就诊(58.8%)。因此,对临床症状异常者应早发现、早诊断,减少后遗症的发生。
辅助检查是确诊疾病的重要依据,血培养或脑脊液培养找到致病菌是诊断的金标准。本资料显示早发型和晚发型患儿WBC、N、PLT病程中峰值明显高于入院当日。考虑GBS感染后,炎症反应加强,造成支气管黏膜和肺泡壁充血、水肿,肺泡内充满炎性渗出物,实验室炎性指标异常增高,影像学上可见肺纹理的改变;因新生儿前囟未闭,渗出液也可积聚在颅骨与脑组织之间,且吸收较慢[13],也常可看到硬膜下积液表现。CRP为常用的炎症反应指标,其可随炎症的进行而持续增高,感染控制后可迅速下降[14-15],所以CRP的正常与否是判断病情转归的重要依据。除此之外,化脓性脑膜炎患儿脑脊液常规中WBC和蛋白质的升高,糖和氯化物的降低是确诊的重要依据。本资料15例脑脊液常规检查异常者中有14例诊断为化脓性脑膜炎,其中4例合并脑脊液培养GBS阳性。脑脊液培养GBS阳性率低,考虑与疾病前期的抗感染治疗有关,因多数患儿于入院2~ 3d后才行腰椎穿刺,抗生素的使用影响了培养的准确性,其次穿刺部位、所取脑脊液量、样品送检时间等也可影响培养结果。因此,排除干扰因素,病原学检查有利于病因诊断,实验室检查有助于对疾病进展和预后的把握,对后期疾病治疗提供有效帮助。
国内外均有报道GBS对青霉素敏感性高、耐药率低[16-17]。本资料也显示所有患儿的血培养对青霉素和万古霉素均敏感,这为病因未明的疑诊患儿提供了经验性用药治疗的指导方向。患儿入院后多采用β内酰胺类抗感染,其作用机制主要是抑制细菌细胞壁的合成,使菌体失去渗透屏障而膨胀裂解,且细菌本身可产生自溶酶溶解菌体,从而产生抗菌作用。治疗中以青霉素类联合头孢菌素类为主,部分加用万古霉素,药敏实验提示这3类抗生素敏感性均较高。部分临床治疗欠佳的患儿需考虑个体差异性及药物的效用等多方面的综合因素,调整用药方案。用药过程中还要考虑药物的不良反应,尤其是万古霉素的联合治疗,虽然其敏感性高且易透过血脑屏障,临床疗效较好,但其耳毒性、肾损害等不良反应大,且与剂量大小有关,所以临床治疗中仍需慎用。
本资料中58例患儿有5例死亡,其中4例为早发型,主要由呼吸窘迫综合征或胎粪吸入综合征伴持续肺动脉高压引起呼吸衰竭而死亡;1例为晚发型合并化脓性脑膜炎,最终因伴发多脏器功能损害而死亡。由此可见,新生儿死亡与GBS感染并非直接相关,预防呼吸衰竭和多脏器功能衰竭是降低死亡的关键所在。新生儿出生后首先清理气道异物,保证呼吸道通畅;对早产儿在出生前促胎肺成熟,出生后积极使用肺表面活性物质替代治疗,以防因肺顺应性下降、气道阻力增加等引起呼吸障碍;对晚发型患儿要预防和控制化脓性脑膜炎,及时给予各器官支持治疗,防止多器官功能衰竭。当细菌感染未控制时易引起一系列并发症,不利于预后,所以尽早应用抗生素治疗,因GBS耐药现象不严重,在药敏结果未出来之前,可经验性使用青霉素治疗[18]。
综上所述,GBS败血症的病死率高,部分患儿有永久的神经系统后遗症。因此,医院应加强孕妇产前GBS的监测和预防,降低新生儿感染率;对确诊的患儿应立刻对因治疗,未确诊的患儿应早期经验性用药,足量、足疗程使用β内酰胺类药物抗感染,降低病死率,减少后遗症。
[1] Johri A K,Paoletti L C,Glaser P,et al.Group B Streptococcus: global incidence and vaccine development[J].Nature Reviews Microbiology,2006(4):932-942.
[2] Ohlsson A,Shah V S.Intrapartum antibiotics for known maternal group B streptococcal colonization[J].Cochrane Database of Systematic Reviews,2009,1(3):CD007467.
[3] Scholl J,Nasioudis D,Boester A,et al.Group B streptococcus alters properties of vaginal epithelial cells in pregnant women[J]. American Journal of Obstetrics and Gynecology,2016,214(3): 383.
[4] TaziA,Bellais S,Tardieux I,et al.Group B Streptococcus surface proteins as major determinants for meningeal tropism[J].Current Opinion in Microbiology,2012,15(1):44-49.
[5] 戴怡蘅,曾立军,高平明.新生儿B族链球菌败血症16例临床分析[J].中国新生儿科杂志,2012,27(1):44-46.
[6] 吴明法.新生儿B族链球菌败血症20例临床分析[J].当代医学,2012, 18(16):70-71.
[7] 安晓霞.新生儿无乳链球菌感染的研究进展[J].临床和实验医学杂志,2012,11(20):1670-1673.
[8] Solt I,Herskovitz S,Ophir E,et al.Sepsis in newborns due to group Bstreptococcus in Western Galilee Hospital Nahariya during the years 1996 to 2007 is there a place for universalscreening in Israel[J].Harefuah,2008,147(10):770-773.
[9] Verani J R,McGee L,Schrag S J,et al.Prevention of perinatal group B streptococcal disease-revised guidelines from CDC[J]. MMWR Recommendations and Reports,2010,59(10):1-36.
[10] Rodriguez B F,Mascaraque L R,Fraile L R,et al.Streptococcus pneumoniae:the forgotten microorganism in neonatal sepsis[J]. Fetaland Pediatric Pathology,2015,34(3):202-205.
[11] 王爱华,沈叙庄.新生儿B族链球菌感染分子机制研究进展[J].国际儿科学杂志,2008,35(2):134-136.
[12] 赵宁,王萍,魏谋.无乳链球菌致新生儿脑膜炎的临床特点分析[J].中国小儿急救医学,2015,22(3):177-179.
[13] 蔡湛,刘学永,蔡可胜.小儿化脓性脑膜炎合并硬膜下积液80例分析[J].中华神经外科杂志,2007,23(1):20-21.
[14] 亚娟,石磊,张志昱.全程C反应蛋白用于儿童急性细菌性脑膜炎诊断价值研究[J].中国实用儿科杂志,2013,28(8):620-621.
[15] Peltola H,Pelkonen T,Roine I,et al.Predicting Outcome of Childhood Bacterial Meningitis with a Single Measurement of C-Reactive Protein[J].Pediatric Infectious Disease Journal,2016, 35(6):617-621.
[16] 钟汇,成玲,邱华红.254株无乳链球菌的临床分布和药敏分析[J].海峡药学,2013,25(7):167-168.
[17] Al-Sweih N,Jamal M,Kurdia M,et al.Antibiotic susceptibility profile of group B streptococcus(Streptococcus agalactiae)at the Maternity Hospital,Kuwait[J].Medical principles and practice,2005,14(4):260-263.
[18] Cockerill F R.Performance standards for antimicrobial susceptibility testing:twenty-first informational supplement[S].Clinical and Laboratory Standards Institute,2011:93-95.
2016-06-27)
(本文编辑:陈丽)
310003 杭州,浙江大学医学院附属儿童医院感染病科(郑露艳、华春珍,郑露艳现在浙江大学城市学院医学院本科就读),实验检验中心(李建平);宁波妇女儿童医院(罗巧二);台州医院(卢洪萍)
郑露艳,E-mail:846391949@qq.com
