中药提取物对鸡大肠杆菌病预防性干预及其机理研究
2016-12-20张瀚元张秀英施路一
张瀚元,张秀英*,施路一
(1.东北农业大学动物医学学院,哈尔滨 150030;2.黑龙江省野生动物研究所,哈尔滨 150081)
中药提取物对鸡大肠杆菌病预防性干预及其机理研究
张瀚元1,张秀英1*,施路一2
(1.东北农业大学动物医学学院,哈尔滨 150030;2.黑龙江省野生动物研究所,哈尔滨 150081)
以四种中药提取物(连翘酯苷提取物、苦参提取物、苍术提取物以及硫酸小檗碱)饱和水溶液混合物对鸡大肠杆菌发病模型预防性干预,检测鸡大肠杆菌病模型标志性炎症因子mRNA表达水平。结果表明,四种中药提取物饱和水溶液混合物对鸡大肠杆菌病发病过程具有较明显预防性干预作用(P<0.05);鸡大肠杆菌病发病模型中NF-κb、TNF-α mRNA表达水平经中药提取物饱和水溶液混合物干预后均明显低于阳性对照组(P<0.05),但仍高于空白对照组(P<0.05);IL-10 mRNA表达水平在中药提取物混合水溶液作用下较阳性对照组升高(P<0.05)。四种中药提取物饱和水溶液可能通过干预感染鸡炎症进程预防鸡大肠杆菌病。
中药;大肠杆菌病;抗炎;抑菌作用
张瀚元,张秀英,施路一.中药提取物对鸡大肠杆菌病预防性干预及其机理研究[J].东北农业大学学报,2016,47(5):54-61.
Zhang Hanyuan,Zhang Xiuying,Shi Luyi.Preventive intervention and mechanism of traditional Chinese medicine in avian Escherichia colibacillosis[J].Journal of Northeast Agricultural University,2016,47(5):54-61.(in Chinese with English abstract)
鸡大肠杆菌病的病理基础是广泛性渐进性炎症。致病性大肠杆菌在局部大量繁殖产生毒素进入血液引起脓毒败血症导致宿主动物死亡[1]。凌育燊研究表明,在试验性鸡大肠杆菌病猝死病例中,多见肝、脾、肾和肺等实质器官充血淤血及接种部位炎灶[2]。Cheville研究发现,感染48 h后,大肠杆菌自血液循环和直接接触途径扩散至机体各器官,宿主鸡主要呈现急性败血症[3]。徐福南研究发现,各器官可见细菌团块,组织充血出血以及水肿[4],弥漫性纤维素性浆膜炎,表现从局部到整体渐进性多器官炎性病理基础[2]。大肠杆菌对宿主实质器官致炎作用表现为内毒素致各脏器血管充血、淤血、出血、透明血栓形成,中性粒细胞和淋巴细胞聚集。Schumann研究表明,微血管内皮细胞是内毒素主要靶细胞,内毒素激活血管内皮细胞,致其损伤[5]。1991年,美国医师学会(ACCP)、危重病医学会(SCCM)联席会议委员会提出全身性炎症反应综合症(Systemic inflammatory response syndrome,SIRS)概念,是指因感染或非感染因素作用于机体引发失控,自我持续放大和破坏性全身性炎症反应,用来替代原有的菌血症、脓毒症、脓毒性休克等概念[6]。SIRS可导致多器官功能衰竭(Multiple organ dysfunction syndrome,MODS),以至个体死亡[7]。
鸡大肠杆菌病诱发因素多,多表现为继发或混合感染,具有重要的公共卫生意义,防治工作不容忽视。长期应用抗生素防治鸡大肠杆菌病使感染菌耐药性问题愈发严重,大肠杆菌在抗生素选择压力下进化,耐药机理复杂,多重耐药、交叉耐药、耐药谱广[8]。鉴于不断提高的药残标准、生物食品安全规范及抗生素破坏土壤微生态等问题,抗生素应用规制越来越严格[9]。抗生素治疗后,感染菌释放大量内毒素,引起相关疾病[10]。大肠杆菌血清型多,抗原复杂,区域差异大,无法统一有效免疫。另外疫苗接种主要依赖动物体反应,免疫效果与结局依赖动物体反应性。干预炎症发生与发展,从发病角度防治鸡大肠杆菌病有重要意义。
研究表明中药可干预炎症进程,对疾病转归具有积极作用。苦参碱能抑制PLA2活性,表现抗炎作用[11]。苦参苍术口服液可抵抗炎性物质刺激,减轻炎症反应[12]。黄芩苷可降低脂多糖(LPS)诱导核因子-κB(NF-κB)活化和肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)表达[13]。炎症反应一旦启动,则无法逆转,炎症控制主要集中在预防性干预[14]。
综上,本试验以大肠杆菌感染造成宿主鸡体内发生SIRS,导致MODS作为鸡大肠杆菌病发生发展的基本假设。通过连翘、小檗碱、苍术以及苦参四种中药提取物对鸡大肠杆菌病模型实施预防性干预,检验鸡大肠杆菌病炎症假设,为鸡大肠杆菌病防治提出新思路。
1 材料与方法
1.1 材料
1.1.1 试验药物
连翘提取物(生药比1 ϑ 10)、硫酸小檗碱(生药比1 ϑ 10)、苍术提取物(生药比1 ϑ 20)、苦参提取物(生药比1 ϑ 15),以上药品均由东北农业大学动物医学院兽医药理教研室提供。
药液配制:取室温下无菌蒸馏水中上述中药提取物最大溶解度配制,浓度分别为连翘提取物50 mg·mL-1、硫酸小檗碱33 mg·mL-1、苍术提取物40 mg·mL-1、苦参提取物50 mg·mL-1贮存药液。4℃条件下保存备用。
1.1.2 试验菌种
O2型鸡源大肠杆菌:由东北农业大学动物医学院药理教研室提供。为消除上述中药提取物抑菌作用对试验结果影响,试验前对该株大肠杆菌开展体外抑菌试验,表明其对上述中药提取物不敏感,对该株大肠杆菌不存在体外抑菌作用。
菌液制备:将大肠杆菌菌株接种于MH液体培养基,37℃下摇床孵育过夜。通过麦氏比浊仪调整菌液浓度半数致死量,并在15 min内接种完毕。
1.1.3 试验动物
1日龄雏鸡:为AA商品鸡,购自哈尔滨市先锋种鸡场。购入后隔离饲养15日,未见异常后分组试验。
1.1.4 qRT-PCR引物
根据NCBI提供序列设计引物,qRT-PCR方法扩增5个鸡基因NF-κB、TNF-α、IL-10、β-Actin。引物序列由深圳华大基因科技有限公司合成。引物序列见表1。
1.2 方法
1.2.1 中药提取物毒性试验
以中药提取物水溶液贮存液浓度为毒性试验高剂量组,分别取高剂量组试验浓度2/3、1/3倍浓度为中剂量组和低剂量组。取15日龄AA商品鸡24只,随机分为高、中、低剂量组与对照组,四个试验组试验药物及相应浓度情况见表2。
以中药提取物水溶液供各组试验鸡自由饮水。连续给药7日,观察各剂量组试验鸡饮水量、饲料消耗量、生理状况及精神表现等变化。以各观察指标无变化试验组给药浓度为试验浓度C。
1.2.2 半数致死量测定
取O2型鸡源大肠杆菌试验菌株接种于MH液体培养基中,37℃150 r·min-1条件下过夜,MH液体培养基稀释试验菌株培养物,通过麦氏比浊仪调制,获得浓度为1×106、1×107、1×108和1×109cfu·mL-1半数致死量测定用菌液。
取15日龄AA商品鸡50只,随机分为五组,分别为A、B、C、D及对照组,取上述半数致死量测定用菌液与生理盐水攻毒,测定O2型鸡源大肠杆菌半数致死量,攻毒途径为皮下注射,攻毒物及浓度见表3。
观察记录试验鸡发病症状、死亡数量,死亡鸡只及时剖检,在无菌条件下于死亡鸡肝脏切面刮取样品,无菌保存。鉴定分离菌株,验证死亡鸡确系攻毒O2型鸡源大肠杆菌致死,建立鸡大肠杆菌发病模型标准。
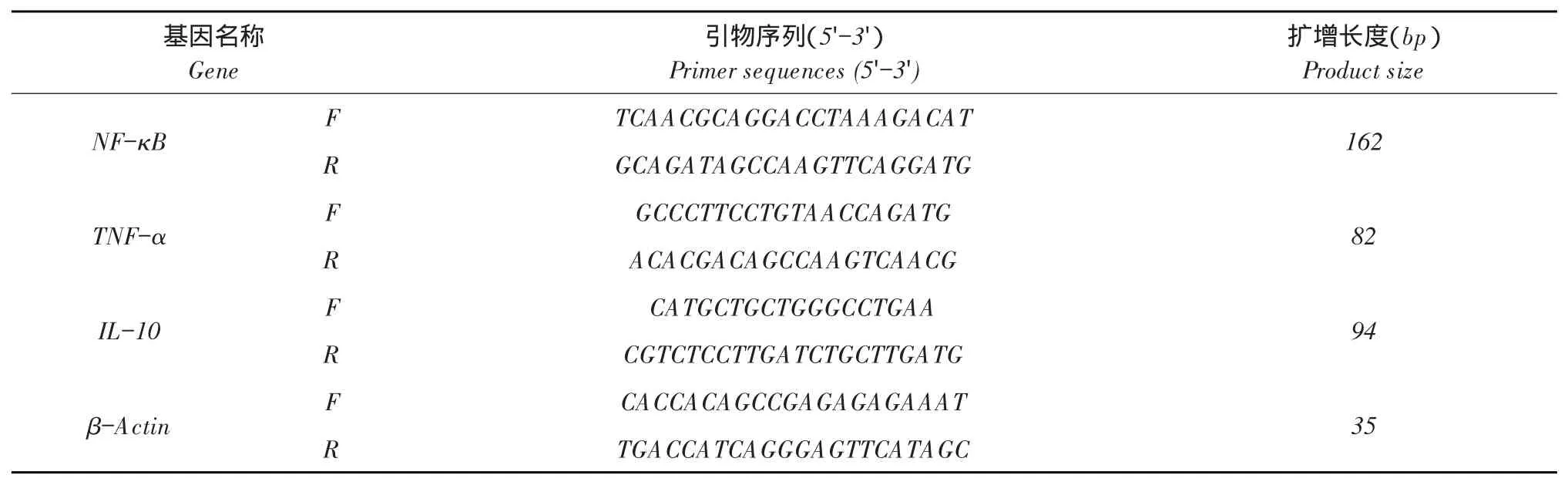
表1 实时荧光定量PCR引物所用序列Table 1Primer sequences of target gene for real-time PCR
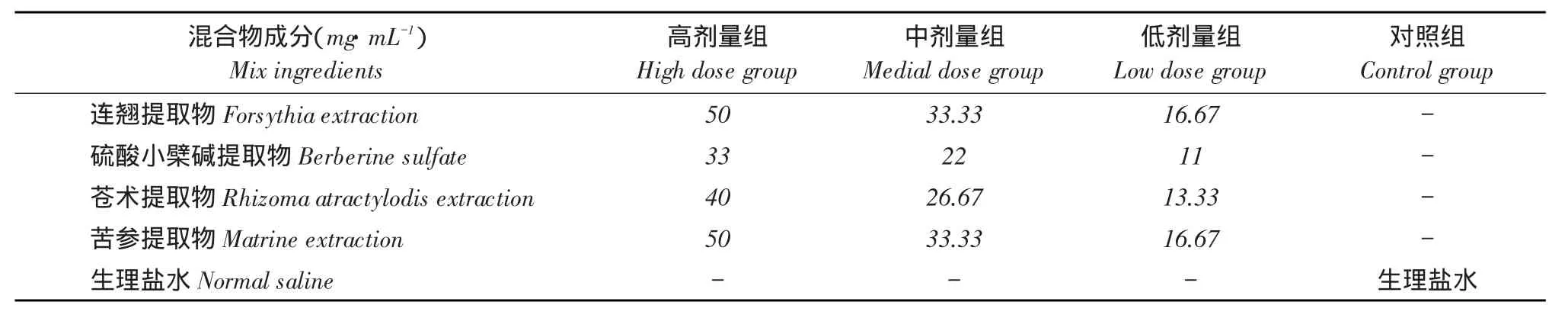
表2 各试验分组试验药物及相应浓度(N=6)Table 2Experimental drugs and corresponding concentrations
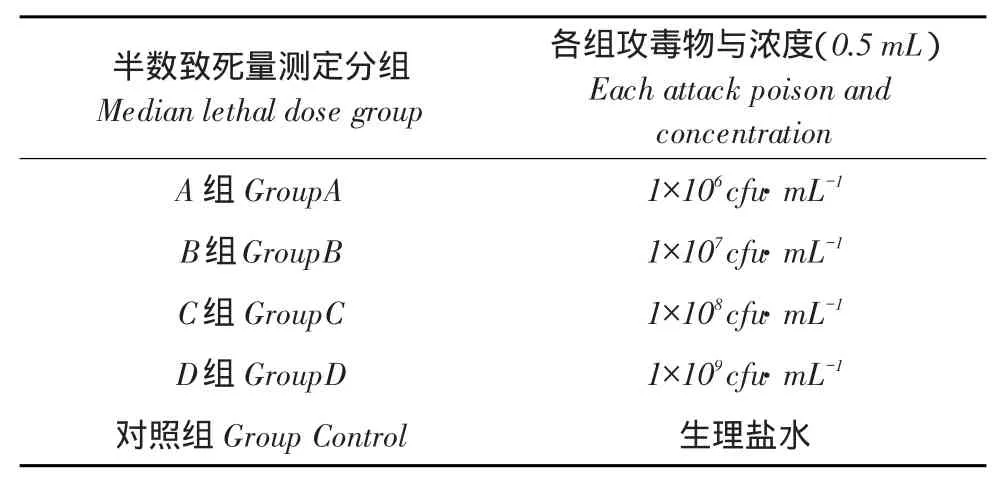
表3 O2型鸡源大肠杆菌半数致死量测定Table 3Median lethal dose determination of O2type avian Escherichia coli
鉴定方法:无菌采集发病鸡全血样品,接种于麦康凯培养基,37℃下过夜培养,挑取粉红色、光滑、单个菌落接种于伊红美蓝培养基,37℃条件下过夜,若出现具有金属光泽菌落则鉴定分离菌株为接种O2型鸡大肠杆菌。试验组中发病鸡、死鸡确系攻毒O2型鸡源大肠杆菌所致。根据72 h内试验结果计算半数致死量。
1.2.3 预防试验
将15日龄AA商品鸡90只随机分成3组,每组30只,即阳性对照组、空白对照组,中药干预组,试验分组设置见表4。
将中药提取物水溶液代替饮水,通过自由饮水方式,对中药干预组试验鸡连续给药7日,空白对照组与阳性对照组正常饮水。第8日以O2型鸡源大肠杆菌ID50经皮下途径对中药干预组与阳性对照组试验鸡攻毒,空白对照组生理盐水攻毒。攻毒后正常饲养,观察并记录72 h内感染情况。
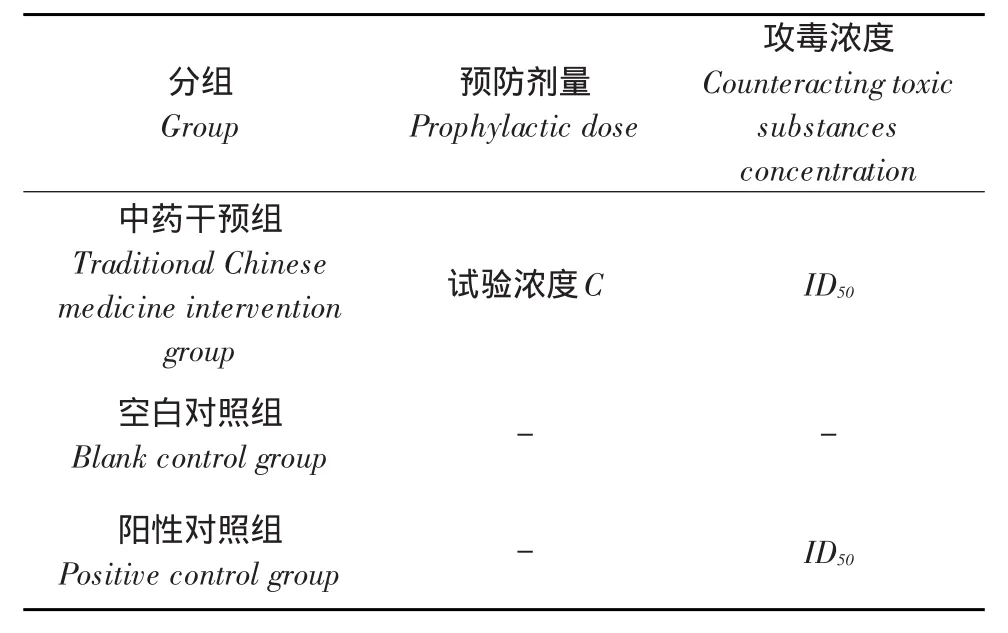
表4 中药提取物预防试验(N=30)Table 4Prevention trial of traditional Chinese medicine extract
于48 h后每试验组取3只发病试验鸡,心脏采集全血样本,并不计算在统计各试验组结果内。
1.2.4 炎症相关因子基因鉴定以及表达水平检测
1.2.4.1 样品总RNA提取及质量鉴定
提取全血总RNA,操作按照Trizol试剂操作说明书进行,自然条件下干燥,加DEPC溶解,紫外可见分光光度计测定RNA样品在260和280 nm处光密度值(OD),鉴定RNA提取质量。
1.2.4.2 反转录反应
将提取的RNA定量为10 μg(20 μL),置于无菌EP管中,按照反转录试剂盒操作说明操作,EP管中加入引物2 μL,加DEPC-H2O至总体积22 μL,加dNTP 4 μL,70℃水浴5 min,取出后立即放在冰块中,依次加入5×buffer 8 μL、DTT 4 μL、Rnase inhibitor 1 μL、M-MLV 1 μL,使反转录总体积为40 μL,充分混合后离心,37℃下水浴2 h。
1.2.4.3 PCR扩增目的基因
取反转录产物1 μL置于0.5 mL无菌EP管中,依次加入相对应上下游引物各0.3 μL、dNTP 1.5 μL、10×buffer 2.5 μL、rTaq酶0.3 μL,加灭菌双蒸水补足至25 μL。
反应条件:95℃预变性5 min,94℃变性30 s,所有基因60℃退火30 s,72℃延伸45 s,经35个循环,72℃延伸10 min,4℃终止反应。琼脂糖凝胶电泳检测PCR产物,鉴定引物特异性及炎症相关因子存在情况。
1.2.4.4 qRT PCR检测炎症相关因子表达水平
取反转录产物1.2 μL,加入相对应上下游引物各0.6 μL,FastStart DNA Master SYBR Green I 10 μL,ddH2O 7.6 μL,组成20 μL反应总体系。避光条件下,将反应总体系加入实时荧光定量反应板中。加样过程注意避免污染,每加样孔操作中均要更换移液器枪头,样品加入反应孔底部,加完样品封膜平整、密封,避免接触加样孔顶部,封膜完成后,离心使所有液体充分接触混合,使泡沫破碎。
将实时荧光定量板放到LightCycler®96中,调整反应条件,使熔解曲线呈单峰曲线。反应条件为95℃预变性10 min,95℃变性15 s,60℃退火60 s,72℃延伸20 s,经40个循环,72℃再延伸10 min,4℃终止反应。
1.2.4.5 qRT-PCR结果数据分析
利用LightCycler®96 SW 1.1软件,内参基因β-Actin的Threshold Cycle(CT)值归一目标基因CT值,用校准样本的ΔCT值归-试验样本的ΔCT值,分别计算各组表达水平比率即表达水平比值:2-ΔΔCT值。

2 结果与分析
2.1 中药提取物毒性试验
通过饮水途径给予各试验组相应试验浓度四种中药提取物混合物后,观察各组试验鸡生理表现。结果显示各组试验鸡饮水量、饲料消耗量、生理状况及精神表现与对照组比较差异不显著(P> 0.05),说明高、中、低三个试验浓度的四种中药提取物混合物对试验鸡均未造成影响,中药提取物混合水溶液对15日龄AA商品鸡未表现急性毒性。
为保证中药提取物抗炎作用充分有效,结合毒性试验结果,本试验确定中药提取物水溶液混合物试验浓度为连翘提取物50 mg·mL-1、硫酸小檗碱提取物33 mg·mL-1、苍术提取物40 mg·mL-1、苦参提取物50 mg·mL-1。给药剂量为15日龄健康AA商品鸡日常饮水量。
2.2试验菌株半数致死量
用浓度依次为1×106、1×107、1×108和1×109cfu·mL-1四种菌液分别攻毒试验,各攻毒试验组鸡只在攻毒2 h后出现精神萎靡、饮食废绝、拖翅耷尾、缩颈扎堆等临床症状,随时间推进,症状愈发明显,发病数量逐渐增加。剖检发病鸡只可见广泛纤维素渗出性,脾脏、肝脏淤血、肿大,初步诊断为大肠杆菌感染所致。
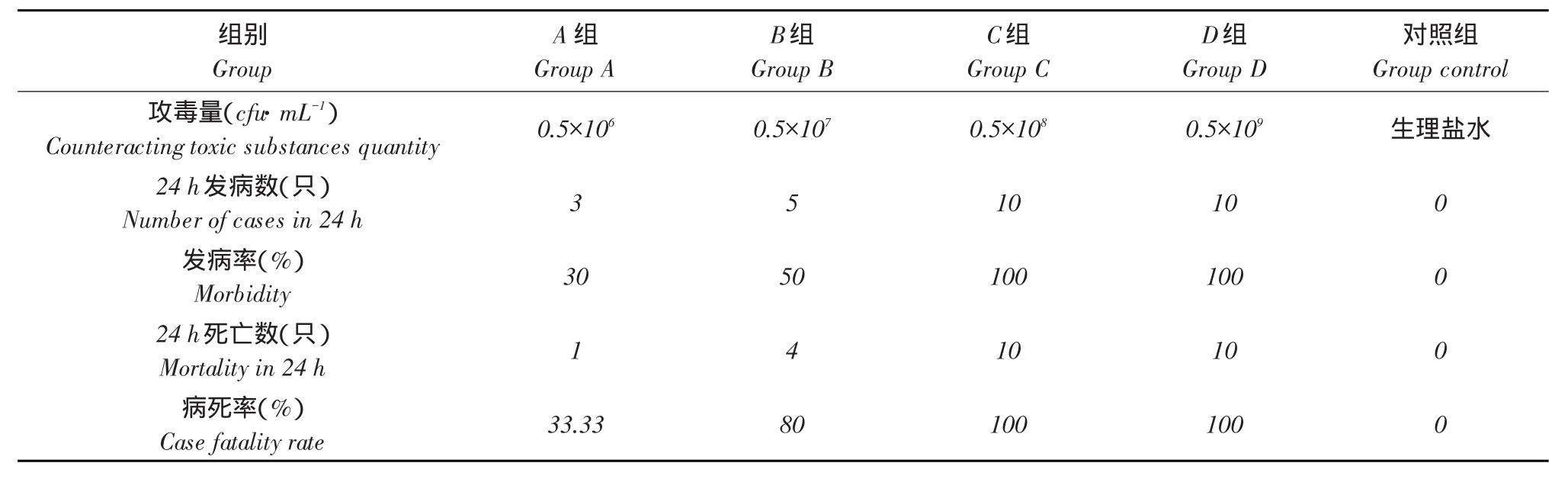
表5 鸡大肠杆菌O2型ID50测定(N=10)Table 5ID50determination of O2type avian Escherichia coli
攻毒8 h后,攻毒试验组鸡只出现死亡,且在随后24 h内A组(浓度为1×106cfu·mL-1)3只发病,1只死亡,B组(浓度为1×107cfu·mL-1)5只发病,4只死亡,C组(浓度为1×108cfu·mL-1)与D组(浓度为1×109cfu·mL-1)全部死亡。
通过麦康凯与伊红美蓝培养基筛选,分离菌株在麦康凯琼脂培养基上呈圆形,稍隆起的粉红色菌落光滑湿润,边缘整齐。伊红美蓝平板上呈现带有金属光泽紫黑色菌落。说明该分离菌株为鸡大肠杆菌,结合接种物与无菌采样,确定致病原为O2型鸡大肠杆菌。
试验中O2型鸡源大肠杆菌对试验鸡的半数致死量为每只0.5×106cfu·mL-1,以此作为试验浓度。
2.3 发病模型建立结果
应用0.5 mL浓度为1×106cfu·mL-1菌液作为鸡大肠杆菌病人工建模接种物,试验鸡表现精神沉郁、饮食废绝、耷尾拖翅、缩颈扎堆等鸡大肠杆菌病的典型症状。剖检死亡鸡只,分离鉴定致病菌。肝脏细菌分离物经鉴定与接种物相同。人工接种O2型鸡源大肠杆菌建立发病模型成功。死亡鸡表现出明显心包炎、肝周炎等鸡大肠杆菌病典型病理特征。
2.4 中药提取物对鸡大肠杆菌病预防作用
应用四种中药提取物水溶液混合物干预人工感染建立的鸡大肠杆菌病模型试验,统计分析各试验组试验鸡发病数和死亡数。
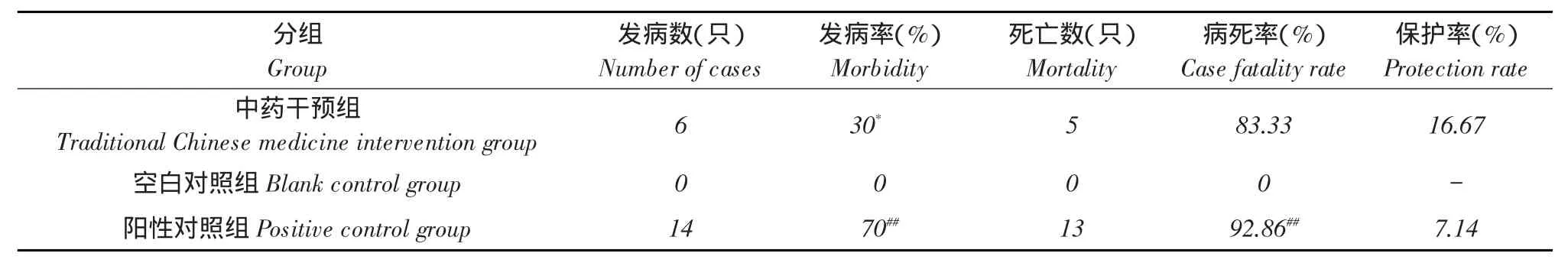
表6 中药提取物对鸡大肠杆菌病预防作用(N=30)Table 6Prevention of traditional Chinese medicine extract on the avian colibacillosis
SPSS软件对各试验组试验鸡发病率和死亡率χ2检验,结果表明中药干预组发病数低于阳性对照组发病数,二组发病率之间存在统计学差异,差异显著(P<0.05),说明试验中四种中药提取物水溶液混合物能够降低鸡群感染鸡大肠杆菌后发病率,预防鸡大肠杆菌病。但是中药干预组与阳性对照组两组病死率之间不存在统计学差异(P> 0.05),说明鸡大肠杆菌病一旦发生,四种中药提取物水溶液混合物无法扭转其转归。
2.5 炎症相关因子基因鉴定
鉴定结果表明引物设计成功,为qRT-PCR做好试验准备。
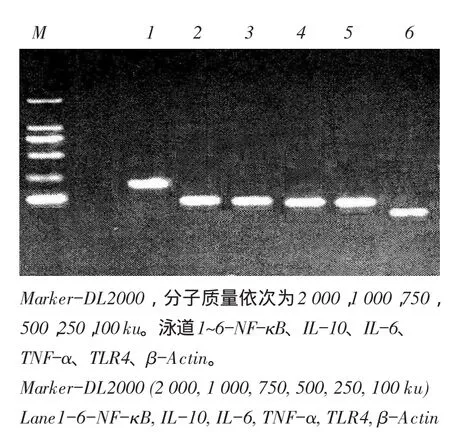
图1 炎症因子基因鉴定Fig.1Aim gene of inflammatory factor
2.6 炎因子水平检测结果
2.6.1 外周血中TNF-α mRNA表达水平检测结果
外周血中TNF-α mRNA表达水平检测结果见图2。
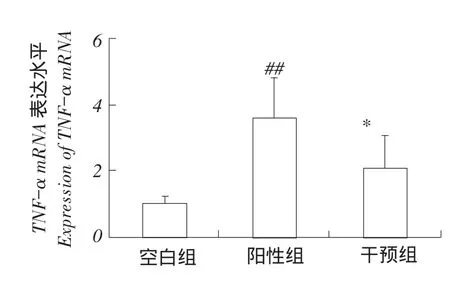
图2 TNF-α mRNA表达水平Fig.2Expression of TNF-α mRNA
结果显示在感染O2型鸡大肠杆菌后,阳性对照组TNF-α相对于空白对照组表达水平显著升高,二者差异极显著(P<0.01)。在中药提取物混合水溶液干预下,中药干预组TNF-α表达水平低于阳性对照组,二者差异显著(P<0.05),中药干预组TNF-α表达水平高于空白对照组,二者差异极显著(P<0.01)。
2.6.2 外周血中NF-κb mRNA表达水平检测结果
外周血中NF-κb mRNA表达水平检测结果见图3。
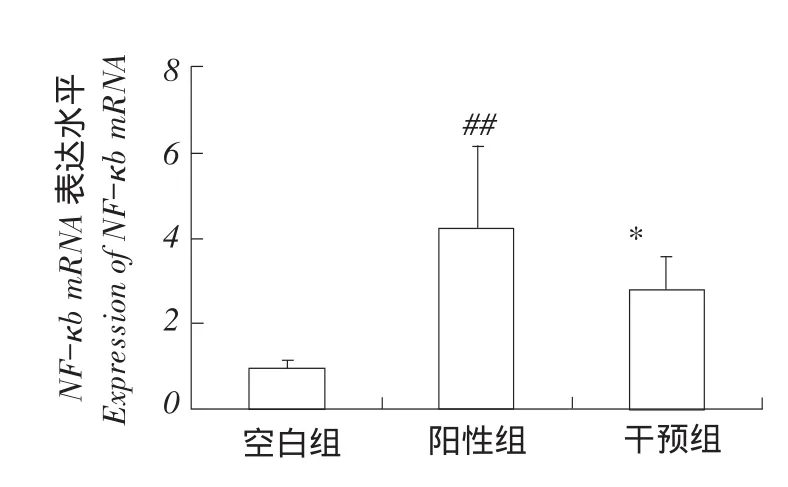
图3 NF-κb mRNA表达水平Fig.3Expression of NF-κb mRNA
结果显示在感染O2型鸡大肠杆菌后,阳性对照组NF-κb相对于空白对照组表达水平显著升高,二者差异极显著(P<0.01)。在中药提取物混合水溶液干预下,中药干预组NF-κb表达水平低于阳性对照组,二者差异显著(P<0.05),中药干预组NF-κb表达水平高于空白对照组,二者差异极显著(P<0.01)。
2.6.3 外周血中IL-10 mRNA表达水平检测结果
外周血中IL-10mRNA表达水平检测结果见图4。
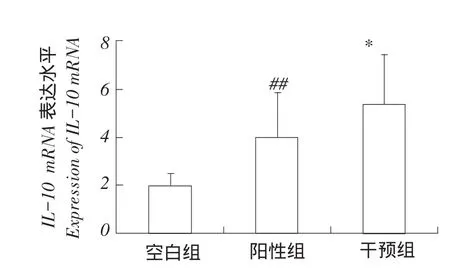
图4 IL-10 mRNA表达水平Fig.4Expression of IL-10 mRNA
结果显示在感染O2型鸡大肠杆菌后,阳性对照组IL-10相对于空白对照组表达水平显著升高,二者差异极显著(P<0.01)。在中药提取物混合水溶液干预下,中药干预组IL-10表达水平低于阳性对照组,二者差异显著(P<0.05),中药干预组IL-10表达水平高于空白对照组,二者差异极显著(P< 0.01)。
3 讨论与结论
3.1 影响鸡大肠杆菌病模型建立因素
鸡大肠杆菌病模型建立受多种因素影响。宿主鸡生理状态直接影响鸡大肠杆菌病发生,处于混合感染状态下宿主鸡发病更早、更重、恢复更慢[15]。菌毛是大肠杆菌重要毒力因子,与大肠杆菌定植有关,影响大肠杆菌致病力和鸡大肠杆菌病模型建立[16]。蔡玉梅、李国喜、王丽平等研究表明108cfu·mL-1是常见攻毒剂量级[17-19]。在感染途径方面,胸肌注射致病性最强,其次是皮下注射。肌肉注射更利于大肠杆菌进入血液循环系统增殖引发疾病[20]。在宿主鸡的感染年龄方面,国内研究者常用1~28日龄鸡,较少用35周龄以上;国外研究以1日龄居多,2~3周龄次之[21]。
本试验中O2型鸡源大肠杆菌菌株为强毒株,接种量为0.5×106cfu·只-1,试验鸡群为15日龄健康AA商品鸡,皮下注射接种途径成功建模。
3.2 鸡大肠杆菌病模型干预
中药提取物混合水溶液在试验前期体外抑菌试验中对O2鸡大肠杆菌株无明显抑制作用,但可降低鸡大肠杆菌感染鸡发病率,表明该中药提取物混合水溶液对鸡大肠杆菌病保护存在抑菌外机制。
本研究认为鸡大肠杆菌病病理本质是大肠杆菌感染导致全身广泛性炎症,炎症发生发展过程与感染鸡发病表现密切相关。
在发病率方面,感染O2型鸡大肠杆菌2 h后,试验鸡群出现临床症状。阳性对照组发病率与空白对照组差异极显著(P<0.01)。中药干预组中,试验鸡也出现大肠杆菌病临床症状,发病率大于空白对照组,差异极显著(P<0.01),但与阳性对照组相比,中药干预组发病率不足前者50%,差异显著(P<0.05)。O2型鸡源大肠杆菌能引起试验鸡群爆发鸡大肠杆菌病,但是中药干预组试验鸡群在中药提取物混合水溶液作用下,发病率明显降低,中药提取物混合水溶液具有一定抑制炎症爆发作用。
在病死率方面,试验鸡群首例死亡出现在阳性对照组感染O2型鸡大肠杆菌8 h后,72 h后统计各试验组病死率结果表明:阳性对照组病死率对比空白对照组差异极显著(P<0.01)。而阳性对照组与中药干预组病死率无显著差异。说明中药提取物混合水溶液对于已暴发炎症无扭转及抑制作用,与威廉·B·科尔曼提出“一旦炎症爆发,便无法扭转”论述[14]基本一致。
于攻毒24 h后采集各组发病鸡外周血,通过qRT-PCR方法检测三种炎症相关因子表达水平。结果表明阳性对照组外周血样本中炎症因子NF-κb、TNF-α与IL-10表达水平明显升高,与空白对照组比较差异极显著(P<0.01),说明在鸡大肠杆菌作用下,核转录因子NF-κb表达水平增加,细胞开始转录各种炎症因子与活性分子,炎症反应启动。作为NF-κb下游的炎症因子TNF-α表达水平增加,产生各种促炎效应,协同其他炎症因子促使发病鸡表现典型鸡大肠杆菌病症状。同时抑炎效应的炎症因子IL-10在炎症启动后表达水平升高,差异极显著(P<0.01),说明在促炎反应启动同时,抑炎反应启动,对抗促炎过程,防止过度炎症对机体造成损伤。中药提取物混合水溶液干预下,中药干预组中炎症因子NF-κb、TNF-α mRNA表达水平升高,明显高于空白对照组,差异显著(P<0.05),但低于阳性对照组,差异显著(P< 0.05),说明中药提取物混合水溶液能够降低促炎因子mRNA表达水平。相反,中药干预组IL-10 mRNA表达水平大幅上升,比较阳性对照组,差异显著(P<0.05),说明中药提取物混合物一方面通过降低炎症因子转录与表达,抑制炎症发生,另一方面启动抗炎因子高量表达,提高抗炎效应,降低机体炎症损伤作用。
比较临床发病率、病死率与炎症因子基因表达水平后可知,中药提取物混合水溶液能够通过干预炎症因子基因表达,降低促炎因子基因表达水平,提高抗炎因子基因表达水平,降低鸡大肠杆菌病发病率。但是炎症一旦发生后,中药提取物混合水溶液无法阻止促炎作用、逆转炎症损伤,最终各组发病鸡病死率差异不显著。
试验结果表明,鸡大肠杆菌病发病机制在于全身广泛性炎症,其发生发展决定于全身性炎症蔓延程度,降低机体炎症水平能够预防鸡大肠杆菌病发生与恶化。同时试验中中药提取物混合水溶液虽无抑菌效果,却可通过干预炎症程度,抑制鸡大肠杆菌病发生,但是无法逆转已经爆发的炎症反应,最终对病死率无明显影响。
3.3 炎症因子与炎症
本试验从SIRS与MODS发病机理探究鸡大肠杆菌病发病本质。在各种致病因素作用下,机体免疫系统发生以活化免疫细胞、表达炎症相关受体、释放大量致炎细胞因子和抗炎细胞因子的免疫防御活动,上述表现相互作用形成网络式级联放大效应,破坏促炎/抗炎平衡,过度炎性介质损害血管内皮及微环境,造成机体相应器官或全身损害,临床上呈现全身炎症反应综合征(Systemic inflammatory response syndrome,SIRS),由于众多炎症介质和细胞因子多向协同或拮抗效应,造成对其认识过程和手段的复杂化,至今尚无阻断这种炎症级联反应的有效措施[22]。干预炎症信号的细胞内传递是人为控制炎症级联反应重要途径。
大肠杆菌启动机体炎症级联反应后,存在于机体各种细胞内NF-κB作为多种促炎细胞因子、炎症介质,黏附分子和急性期反应蛋白高表达所必需转录因子,在急性炎症发生、发展中起重要作用。下调TNF-α水平,上调IL-10水平可以减轻组织器官炎症反应病理损害,避免全身炎症反应综合征进一步向MODS发展[23]。
不同疾病炎症因子体系间级联反应复杂,炎症因子种类及其相应水平各异,尤其在动物疾病领域几乎没有炎症指标体系,无法确定鸡大肠杆菌病SIRS病理过程中关键炎性因子枢纽,药物干预宽泛,无法靶向干预。本试验从动物机体自身的稳定调解入手研究动物疾病问题,对中药预混,提高机体应激时的稳态保持能力具有现实意义。
[1]崔恒敏,朱贵水,程安春,等.家养林麝大肠杆菌病的病理学观察[J].中国兽医科技,1996(9):34-35.
[2]凌育燊,郭予强,杨连楷,等.鸡大肠杆菌病的病理学观察[J].养禽与禽病防治,1986(2):24-25.
[3]Cheville N F.Coll Pathology and Ed[M].California:The Iowa staten University Press,2006.
[4]徐福南,方明生,候世忠,等.鸡大肠杆菌病的病理学研究[J].中国兽医科技,1994(4):7-9.
[5]Schumann R R,Hermannf.The macrophages,a tissue specific defense cell:Origin,tissue distribution and secretory response[J]. Focus Growth Factors,1994,3:1.
[6]Cai B,Deitch E A,et al.Novel insights for systemic inflammation in sepsis and hemorrhage[J].Mediators Inflamm,2010:642462.
[7]Abraham E,Matthay M A.Consensus conference definitions for sepsis,septic shock,acute lung injury,and acute respiratory distress syndrome:time for a reevaluation[J].Crit Care Med,2000, 28:232-235.
[8]蒋月,盛鹏飞.辽宁锦州地区三种家禽大肠杆菌耐药性研究[J].东北农业大学学报,2015,46(2):59-63.
[9]刘云,卢婷,张力国,等.牛源性E.coli O157 ϑ H7分离鉴定、耐药性及耐药基因分析[J].东北农业大学学报,2014,45(11):83-88.
[10]揭盛华.内毒素休克的特异性阻断治疗进展[J].国外医学生理病理科学与临床分册,1994,11(3):183-185.
[11]邱耕,涂植光,李晓文.苦参碱对内毒素致炎大鼠PLA-2活性影响及其抗炎机制研究[J].中草药,2002(7):57-59.
[12]高艳艳,张志伟,康慧.苦参苍术口服液的抗炎与止泻作用研究[J].中国兽药杂志,2013,47(4):26-28.
[13]李明,陈伟强,李岩,等.黄芩苷对脂多糖诱导的巨噬细胞和炎症因子表达的影响[J].现代生物医学进展,2009,9(22):4219.
[14]威廉·B·科尔曼.分子病理学:疾病的分子基础[M].北京:科学出版社,2012:49.
[15]石火英.试验性鸡大肠杆菌病试验鸡细菌的动态分布[J].中国预防兽医学报,2001,23(5):364-366.
[16]Ramirez R M,Almanza Y,Garcia S,et al.Adherence and invasion of avian pathogenic Escherichia coli to avain tracheal epithelial cells[J].World Journal of Microbiology and Botechnology,2009,25(6):1019-1023.
[17]蔡玉梅,尹逊河,柴同杰,等.人工感染鸡大肠杆菌病的研究[J].中国预防兽医学报,2006,28(3):356-358.
[18]李国喜,赵银丽.中药金银花对人工感染鸡大肠杆菌病的疗效试验[J].安微农业科学,2006,34(20):5259-5261.
[19]王丽平,江善祥,史晓丽.舒安林对鸡大肠杆菌病药效试验[J].中兽医医药杂志,2002(4):13-15.
[20]周秀红,祁克宗,张丽霞,等.不同接种途径对人工诱发鸡大肠杆菌病的影响[J].安徽农业大学学报,2005,32(4):463-466.
[21]贺常亮.治疗鸡大肠杆菌的中药方剂筛选及其作用机理研究[D].长春:吉林大学,2011.
[22]卢家凯.MAPK与内毒素诱导炎症反应的关系[J].国外医学.麻醉学与复苏分册,2000(2):65-67.
[23]孙来芳,潘利伟.乌司他丁影响严重脓毒症大鼠IL-10、TNF-α、IL-1β水平的研究[J].临床外科杂志,2005(12):770-772.
Preventive intervention and mechanism of traditional Chinese medicine in avianEscherichia colibacillosis
ZHANG Hanyuan1,ZHANG Xiuying1,SHI Luyi2
(1.School of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China; 2.Wildlife Research Institute of Heilongjiang Province,Harbin 150081,China)
This experiment intervented the establishment of the model of the aviancolibacillosis preventively by the mixture of saturated aqueous solution of the four kinds of traditional Chinese medicine extracts above as well as detecting the level of expression of inflammatory factor mRNA.There were obvious preventive intervention on the process of the aviancolibacillosisin the mixture of saturated aqueous solution of the four kinds of traditional Chinese medicine extracts(P<0.05);The expression level of the NF-κb and TNF-αmRNA of the intervention group was significantly lower than that of the positive control group in the model of the avian colibacillosis(P<0.05),but it was higher than the blank control group(P<0.05);Compared with the positive control group,the expression levels of the IL-10 mRNA in intervention group increased(P<0.05).There was preventive effect on the aviancolibacillosisin the mixture of saturated aqueous solution of the four kinds of traditional Chinese medicine extracts.The mechanism of prevention may be the intervention of the inflammatory process.
traditional Chinese medicine(TCM);E.colibacillosis;anti-inflammatory;bacteriostatic action
S859.7;S854.5+2
A
1005-9369(2016)05-0054-08
2016-03-23
东北农业大学博士启动基金(2013RFXXJ035)
张瀚元(1983-),男,博士研究生,研究方向为兽医药理毒理学。E-mail:164296076@qq.com
*通讯作者:张秀英,教授,博士生导师,研究方向为兽医药理毒理学。E-mail:zhangxiuying@neau.edu.cn
时间2016-5-27 14:15:04[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160527.1415.016.html
