光遗传技术及其在基底神经节运动调控中的应用研究进展
2016-12-08宋茹刘晓莉乔德才
宋茹 刘晓莉 乔德才
北京师范大学体育与运动学院运动生理学实验室(北京 100875)
光遗传技术及其在基底神经节运动调控中的应用研究进展
宋茹 刘晓莉 乔德才
北京师范大学体育与运动学院运动生理学实验室(北京 100875)
基底神经节是运动系统的皮层下中枢之一,通过直接和间接通路参与动作的选择、优化、整合与精确调节。基底神经节两条通路调节功能紊乱与帕金森等疾病导致的行为功能障碍有关。光遗传技术具有可对特定神经元在时间、空间上进行精确调控的优点,被广泛应用于神经环路、神经递质以及各类退行性疾病和精神疾病的研究中。本文仅就国内外光遗传技术及其在基底神经节运动调控中的应用研究进展做一综述。
光遗传技术;基底神经节;运动调控;中枢疲劳
光遗传学(optogenetics)也称光刺激基因工程(optical stimulate plus genetic engineering),是将光学技术和分子遗传学技术结合后形成的一种新兴技术。神经科学领域传统的研究方法都存在着一些不足,如电生理学方法记录到的膜电位变化并不是神经元真正的放电情况,且电刺激对神经元的操控也缺乏特异性;而药理学的方法虽然可以特异地作用于某一类型神经元,但药物作用过程需要一定的时间,常常会错过神经元的编码时段,缺乏时间准确性。光遗传技术克服了以上这些缺点,能够利用光照刺激光敏感蛋白在特定时间内实现对生物体内某一特定神经元活动及功能的毫秒级控制,因此被视为神经科学领域一种变革性的研究手段。研究人员将光遗传技术应用于神经科学基础研究、运动调控及神经病理机制等方面,取得了一系列的成果。
1 光遗传技术的发展
Crick曾于1979年提出,神经科学领域面临的最大挑战是急需开发出一种新的控制技术,该技术应该在不改变其他细胞的前提下,特定地使某一类型的所有细胞失活[1],但他并没有对其具体操作方法进行描述。其实,早在1971年就有人发现了一种微生物单成分光激活的离子泵细菌视紫红质(bacteriorhodopsin,BR)[2,3],随后人们又相继发现了更多的微生物视蛋白家族成员(包括与膜结合的离子泵和通道),如盐细菌视紫红质(halorhodopsin,HR)[4]和通道视紫红质(channelrhodopsin,ChR)[5,6],它们可在光照作用下使各种离子通过细胞膜。这些视蛋白的发现为实现Click提出的设想提供了可能。
然而,许多技术上的难题阻碍了该设想的实现,如外源性微生物膜蛋白对哺乳动物神经元会产生毒性伤害:进入细胞的光子流太弱、速度太慢,不足以发挥预期的调节作用;更重要的是微生物视蛋白需要在化学辅助因子全反式视黄醛的帮助下才能吸收光子信号。直到2005年,美国斯坦福大学Deisseroth的研究小组[7]首次将一种单成分微生物视蛋白转入哺乳动物神经元中,实现了对毫秒级动作电位稳定且持续的控制,随之相关的研究也相继出现[8-10],至此光遗传技术初具雏形。该研究小组发现,不仅胚胎组织和视网膜中存在大量类视黄醇,成熟哺乳动物大脑、脊柱中也有所表达[11,12],且包含了足够的全反式视黄醛,这为微生物视蛋白在这些组织中作为单成分光控原件调控跨膜离子转运过程奠定了基础。到2010年,多种可通透离子的微生物视蛋白如BR、HR、ChR和一种可与G蛋白耦联发挥效应的视蛋白optoXR都被用作光遗传技术的工具,大大拓展了光遗传技术的应用范围。目前,研究者可利用依赖Cre重组酶构建的视蛋白表达病毒载体以及在特定细胞内选择性表达Cre重组酶的各品系小鼠资源,用光照操控在体的各种类型细胞活动。此外,光遗传技术的应用不仅局限于神经科学,还被广泛地应用于生物学如干细胞、心肌细胞、肌肉组织等诸多研究领域中。
2 光遗传技术的基本原理与方法
光遗传技术的关键是相关基因的单基因操控,涉及到很多相关学科的技术,如光敏感蛋白技术、将光敏
感蛋白编码基因转入目的细胞的技术、定向光控技术,以及各种可稳定输出信号的方法,如荧光或编码电活动的指示器、电信号记录、功能性核磁共振成像(functional Magnetic Resonance Image,fMRI)、行为学的定量分析等(图1)。
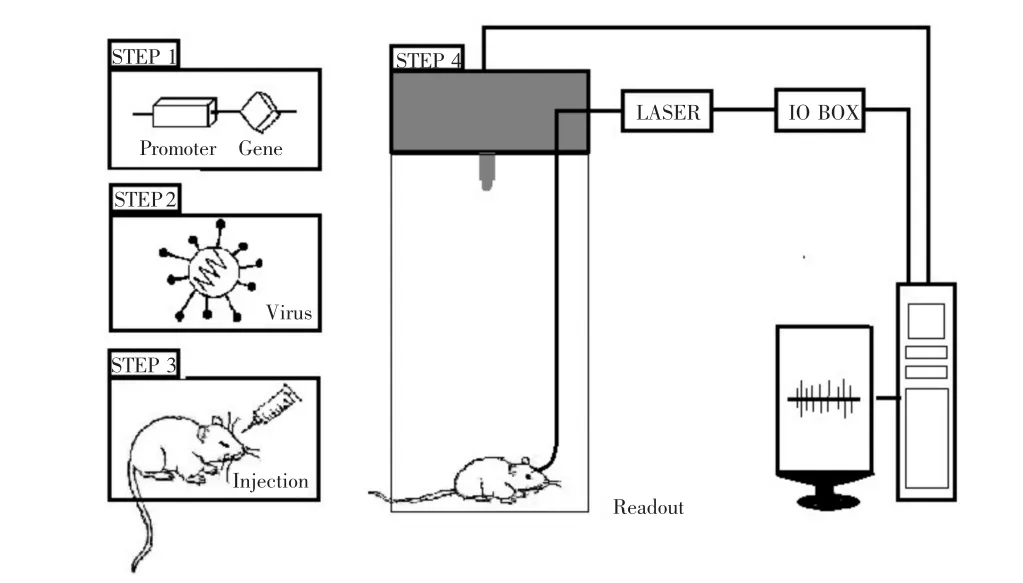
图1 光遗传技术流程示意图
光敏感蛋白是光遗传技术的工具[13](图2),根据作用原理不同可分为两种类型:I型和II型视蛋白。BR、HR、ChR都属于I型视蛋白,即光感受和离子电导均由同一分子完成。BR是迄今为止被研究最多的光敏感蛋白,可以把质子从细胞质转运到细胞外。而从盐碱古菌中分离出的抑制性光敏感蛋白NpHR,可被黄光激活开放通道,允许Cl-通过,使细胞产生超极化[14],目前已被应用于哺乳动物[15,16]。NpHR2.0和NpHR3.0是NpHR的两种变体,其对膜的靶向性和光电流幅值及在细胞膜的运输效率有所提高[17,18]。1991年ChR2在莱茵衣藻中被发现,它是一种蓝光激活的非选择性阳离子通道,其开放需要全反式视黄醛的辅助作用。蓝光照射下,全反式视黄醛辅助因子吸收光子发生构象变化,使ChR2通道打开,引起Na+内流,导致细胞膜去极化[5]。2005年Deisseroth[7]首次将ChR2表达于海马CA1/CA3区,发现光照仅使海马内神经元兴奋,且未导致神经元死亡。为提高ChR2在脑内的表达量,使其介导的光电流更加稳定并减少长时间光照导致的ChR2脱敏现象,研究者又开发出了各种各样的单成分光遗传技术工具,如ChETA、波长红移的C1V1、步态功能视蛋白(SFOs)等[19,20]。II型视蛋白optoXRs吸收光子后必须耦联到G蛋白上才能产生光所引起的效应,利用optoXRs可对细胞内信号传导过程进行光学调控[21]。另外,将多种具有不同激发波长的光敏感蛋白同时在细胞中表达,可分别控制不同类型神经元的活动;若具有兴奋性和抑制性的光敏感蛋白同时表达于同一类型的神经元中,可分别兴奋或抑制同一类型神经元的活动[14]。
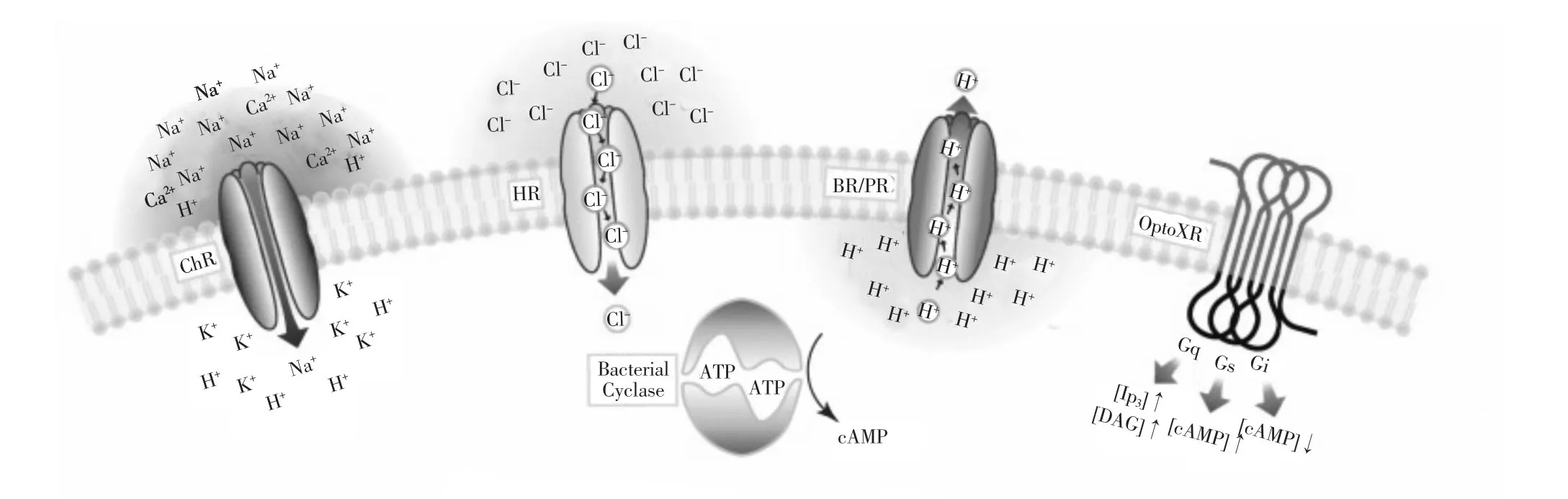
图2 各种视蛋白作用原理示意图[13]
各种类型视蛋白被开发后,如何将视蛋白运输进入体内就成了另一个需要攻克的难题。现已发明很多将光敏感基因运载至体内并有效表达成光敏感蛋白的技术,如病毒表达系统和转基因动物。病毒表达系统可以使光敏感蛋白在动物体内长期且稳定地表达,但该方法的局限性是运载的最大基因片段长度有限,所用到的启动子不能超过4kb且需具有特异性,而这样的启动子种类较少[17]。转基因动物虽然突破了病毒对于运载长度的限制,但培育转基因动物费时费力且成本较高;现大多优先使用表达Cre重组酶系统的转基因动物[22-24]。
光运输技术是光遗传技术的另一关键环节。体外实验常采用水银弧光灯、激光、发光二极管(LED)进行多位点的光照刺激;而在体实验多将光纤[25]或高能量的LED套管[26]植入到动物体内,通过激光给予清醒活动的动物以光照刺激。
研究者将光照刺激与单细胞电生理记录相结合以从被光控制的组织上获取信息。最初在动物麻醉状态下,光照刺激后由钨电极收集神经元电活动信息[27];后来的硅酮多位点电极[28]可采集在体情况下神经元的电活动;而双质子绘图技术可实现光刺激与神经元放电活动的同步记录[29]。此外,还可通过观察光照刺激后动
物的行为变化,评价神经元功能和神经网络的复杂性。光遗传技术与信息输出技术的结合极大地促进了完整且复杂的神经网络结构、功能的基础研究。
3 光遗传技术与基底神经节的运动调控
3.1 基底神经节与运动调控
基底神经节主要包括纹状体(striatum,Str)、苍白球外侧部(external globus pallidus,GPe)、苍白球内侧部/黑质网状部复合体(GPi/SNr)、黑质致密部(substantia nigra pars,SNc)和丘脑底核(subthalamic nucleus,STN)等5个部分。它们接受皮层的大量投射,将信息加工处理后,最终经丘脑(thalamus,Thal)返回皮层。其中纹状体接受大部分大脑皮层向基底神经节的谷氨酸能投射,是基底神经节的信息传入结构;而苍白球内侧部/黑质网状部复合体将各核团整合的信息统一投射向丘脑,是基底神经节的信息传出结构。皮层和基底神经节之间主要由3条通路对信息进行整合和处理,即超直接通路(Ctx-STN-GPi/SNr-Thal-Ctx)、直接通路(Ctx-Str-GPi/SNr-Thal-Ctx)和间接通路(Ctx-Str-GPe-STN-GPi/SNr-Thal-Ctx)[30]。另外,黑质与纹状体之间还存在一个多巴胺能投射的微环路,黑质向纹状体的投射主要有两条传出通路:一条作用于含多巴胺I型受体(D1DR)的纹状体中等棘状神经元(medium spiny neuron,MSNs)(D1-MSNs),对直接通路起促进作用;另一条作用于含多巴胺II型受体(D2DR)的MSNs(D2-MSNs)上,对间接通路起抑制作用。该微环路向纹状体释放多巴胺的总效应是减少基底神经节对丘脑的抑制,促进丘脑-皮层投射神经元的活动[31,32]。
基底神经节是运动系统的皮层下中枢之一,并不直接发起或执行运动功能,而是起着整合、优化、精确调节的作用,通过调节肌张力、联合运动和维持姿势,与小脑一起配合皮层完成运动功能的执行。大量研究表明[33,34],由于疾病或实验诱导致使基底神经节损伤后,会出现运动缺乏、行动迟缓或非随意运动的症状,包括舞蹈症、手足徐动症、运动障碍和肌张力障碍等,这样的结果可以从基底神经节环路的直接、间接通路角度进行解释。直接通路过度激活会导致丘脑-皮层的去抑制,从而出现不协调或非随意运动,如亨廷顿舞蹈症(Huntington’s disease,HD);而间接通路的相对过度激活将最终导致丘脑-皮层的过度抑制,从而阻止或妨碍运动、影响认知的传出过程[33],如帕金森病(Parkinson’s disease,PD)。那么,正常生理状态下基底神经节在运动的执行过程中到底起了怎样的作用呢?早期的假说支持基底神经节参与习得运动顺序的自动执行过程[35],但基底神经节是否储存运动计划,或仅负责调动存储于其他脑区的运动计划,并进行不断地转换尚无确切的研究结果。现在基本形成的假说是基于Mink的观点:基底神经节在促进随意运动发生、抑制竞争动作出现的过程中起着十分重要的作用[36]。之后的研究也一直致力于验证该假说的正确性。
3.2 光遗传技术在基底神经节运动调控机制研究中的应用
3.2.1 基底神经节直接与间接环路作用的机制
基底神经节环路的经典模型认为,基底神经节通过两条神经通路的平衡来整合和精确调节运动,但这种假设一直没有得到直接的实验证据支持。Kravitz等[37]采用光遗传技术,通过ChR2激活小鼠基底神经节的直接通路,发现小鼠的移动速率、时间、频率明显增加;而激活间接通路时,结果却相反,且小鼠做精细动作的比例减少,为上述假说提供了直接证据。Cui等[38]结合光遗传技术和时间相关单光子计数技术研究发现,动物开始运动时D1-MSNs和D2-MSNs均处于激活状态;Xin等[39]也发现快速运动序列起始和结束时D1-MSNs和D2-MSNs均被激活。但Freeze等[40]却发现,不论用蓝光激活哪条通路的MSNs,黑质网状部神经元的放电频率部分升高,部分降低,并未表现出一致的兴奋状态或抑制状态。这一研究结果支持了与经典模型不相矛盾的另一个假说,即两条通路的平衡在动作的选择过程中均起着重要作用,直接通路易化计划的运动,而间接通路抑制竞争动作的出现,两者共同调节着基底神经节信息输出的时间精确性[41]。之后,Tecuapetla等[42]在对小鼠头部同侧和对侧偏转行为进行观察时发现,抑制基底神经节其中一条通路将会损害小鼠向对侧偏转,而同侧偏转不受影响;同时抑制两条通路时,小鼠向对侧偏转的行为消失更偏向于同侧转向。这些结果充分表明,基底神经节对运动的调控功能远比我们已经认识到的更为复杂。
3.2.2 基底神经节功能紊乱与帕金森病运动障碍的关系
PD是一种神经退行性疾病,主要临床症状是静止性震颤、运动徐缓、肌肉僵直和姿势步态异常等。PD的发病机制尚未明确,但目前认为黑质致密部多巴胺神经元变性缺失及纹状体多巴胺水平降低是诱导PD发生的早期原因[43,44]。研究表明,PD动物模型的纹状体神经元自发放电频率增高[45],丘脑底核神经元高频放电与爆发式放电增多[46],因此提出了PD发病可能是由黑质-纹状体多巴胺能系统活性减弱,皮层-纹状体谷氨酸能系统活性增强所致,而调节神经系统活性的神经递质首当其冲,递质失衡可能是导致此现象发生的原因[47]。
近来有研究发现,利用光遗传技术刺激野生型小鼠纹状体D2-MSNs时出现了震颤等PD症状,而刺激
PD模型小鼠纹状体的D1-MSNs则得到缓解[37],初步证实了PD病理状态下间接通路兴奋性升高、直接通路兴奋性降低可能是导致运动功能障碍的原因,并提出激活直接通路可以作为今后PD的一种治疗方案。脑深部刺激(deep brain stimulation,DBS)近几年被用于PD患者的手术治疗以缓解其运动障碍[48],但这种治疗手段在细胞水平的机制并不清楚且存在争议。Gradinaru等[49]用光照逐个刺激或抑制自由活动PD模型小鼠的丘脑底核神经元、胶质细胞和纤维投射的不同回路,发现只有刺激丘脑底核传入纤维时震颤等症状才得以缓解,提示DBS缓解PD症状的可能机制与间接通路的活性改变有关,这为今后使用光遗传技术治疗PD疾病提供了可能性。
4 光遗传技术在运动性疲劳中枢机制研究中的应用展望
运动性疲劳长期以来一直是运动生理学研究者们关注的热点问题,人们对运动疲劳机制的认识经历了由外周到中枢的复杂过程。早期的研究多围绕循环、代谢、肌肉及营养等外周因素与运动性疲劳之间的关系展开,近年来的研究表明,运动过程中肌肉工作能力的下降是由中枢神经系统无法充分驱动运动神经元所致[50]。本实验室围绕运动疲劳中枢机制展开了一系列研究,结果发现运动疲劳时大脑皮层处于广泛抑制状态[51],纹状体高频、爆发式放电活动显著增加[52,53],苍白球外侧部神经元低频爆发式放电比例明显增加[54],丘脑底核神经元疲劳早期时过度兴奋[51],苍白球内侧部/黑质网状部复合体神经元电活动则明显增加[55,56]。由此推测,运动疲劳时基底神经节间接通路可能处于过度激活状态[57],作用的靶点可能在纹状体D2-MSNs,但由于传统研究手段无法区分纹状体MSNs两类神经元的确切功能而难以定论。未来可利用光遗传技术靶向性地操控纹状体D1-MSNs和D2-MSNs两类神经元的兴奋或抑制过程,并将光遗传技术与在体多通道电生理信号采集技术相结合,阐明直接、间接通路在运动疲劳发生、发展、恢复过程中调控作用的差异性,初步构建基底神经节相关核团对运动疲劳贡献率的神经网络模型;另外,还可以结合脑片膜片钳技术,探究运动疲劳对不同类型神经元突触可塑性的影响,从突触水平揭示运动疲劳的可能机制,为进一步阐释基底神经节在运动疲劳中枢调控中的作用提供直接的实验证据,也为寻找延缓运动疲劳产生的新靶向药物提供科学依据。
[1]Crick FH.Thinking about the brain[J].Sci Am,1979,241(3):219-232.
[2]Oesterhelt D,Stoeckenius W.Rhodopsin-like protein from the purple membrane of Halobacterium halobium[J].Nat New Biol,1971,233(39):149-152.
[3]OesterheltD,StoeckeniusW.Functionsofanew photoreceptor membrane[J].Proc Natl Acad Sci U S A,1973,70(10):2853-2857.
[4]Matsuno-YagiA,MukohataY.Two possibleroles of bacteriorhodopsin;acomparativestudy of strains of Halobacterium halobium differing in pigmentation[J].Biochem Biophys Res Commun,1977,78(78):237-243.
[5]Nagel G,Ollig D,Fuhrmann M,et al.Channelrhodopsin-1:a light-gated proton channel in green algae[J].Science,2002,296(5577):2395-2398.
[6]Nagel G,Szellas T,Huhn W,et al.Channelrhodopsin-2,a directly light-gated cation-selective membrane channel[J]. Proc Natl Acad Sci U S A,2003,100(24):13940-13945.
[7]BoydenES,ZhangF,BambergE,etal.Millisecondtimescale,geneticallytargetedopticalcontrol of neural activity[J].Nat Neurosci,2005,8(9):1263-1268.
[8]Xiang L,Gutierrez DV,Hanson MG,et al.Fast noninvasive activation and inhibition of neural and network activity by vertebrate rhodopsin and green algae channelrhodopsin[J]. Proc Natl Acad Sci U S A,2005,102(49):17816-17821.
[9]Bi A,Cui J,Ma YP,et al.Ectopic expression of a microbialtyperhodopsinrestoresvisualresponsesinmice with photoreceptor degeneration[J].Neuron,2006,50(1):23-33.
[10]Ishizuka T,Kakuda M,Araki R,et al.Kinetic evaluation of photosensitivity in genetically engineered neurons expressing green algae light-gated channels[J].Neurosci Res,2006,54(2):85-94.
[11]Deisseroth K,Feng G,Majewska AK,et al.Next-generation optical technologies for illuminating genetically targeted brain circuits[J].J Neurosci,2006,26(41):10380-10386.
[12]Zhang F,Wang LP,Boyden ES,et al.Channelrhodopsin-2 and optical control of excitable cells[J].Nat Methods,2006,3(10):785-792.
[13]Yizhar O,Fenno LE,Davidson TJ,et al.Optogenetics in neural systems[J].Neuron,2011,71(1):9-34.
[14]Zhang F,Wang LP,Brauner M,et al.Multimodal fast optical interrogation of neural circuitry[J].Nature,2007,446(7136):633-639.
[15]TyeKM,PrakashR,KimSY,etal.Amygdalacircuitry mediating reversible and bidirectional control of anxiety[J]. Nature,2011,471(7338):358-362.
[16]Witten IB,Lin SC,Brodsky M,et al.Cholinergic interneurons control local circuit activity and cocaine conditioning[J]. Science,2010,330(6011):1677-1681.
[17]GradinaruV,ThompsonKR,DeisserothK.eNpHR:a Natronomonashalorhodopsinenhanced foroptogenetic
applications[J].Brain Cell Biol,2008,36(1-4):129-139.
[18]Busskamp V,Duebel J,Balya D,et al.Genetic reactivation of cone photoreceptors restores visual responses in retinitis pigmentosa[J].Science,2010,329(5990):413-417.
[19]Gunaydin LA,Yizhar O,Berndt A,et al.Ultrafast optogenetic control[J].Nat Neurosci,2010,13(3):387-392.
[20]Berndt A,Yizhar O,Gunaydin LA,et al.Bi-stable neural state switches[J].Nat Neurosci,2009,12(2):229-234.
[21]Airan RD,Thompson KR,Fenno LE,et al.Temporally precise in vivo control of intracellular signalling[J].Nature,2009,458(7241):1025-1029.
[22]Geschwind D.GENSAT:a genomic resource for neuroscience research[J].Lancet Neurol,2004,3(2):82.
[23]GongS,DoughtyM,HarbaughCR,etal.TargetingCre recombinase to specific neuron populations with bacterial artificial chromosome constructs[J].J Neurosci,2007,27(37):9817-9823.
[24]Gong S,Zheng G,Doughty ML,et al.A gene expression atlas of the central nervous system based on bacterial artificial chromosomes[J].Nature,2003,425(6961):917-925.
[25]Heintz N.Gene expression nervous system atlas(GENSAT)[J]. Nat Neurosci,2004,7(5):483.
[26]Aravanis AM,Wang LP,Zhang F,et al.An optical neural interface:invivocontrol of rodentmotorcortexwith integrated fiberoptic and optogenetic technology[J].J Neural Eng,2007,4(3):S143-S156.
[27]Iwai Y,Honda S,Ozeki H,et al.A simple head-mountable LED device for chronic stimulation of optogenetic molecules in freely moving mice[J].Neurosci Res,2011,70(1):124-127.
[28]Royer S,Zemelman BV,Barbic M,et al.Multi-array silicon probeswithintegratedopticalfibers:light-assisted perturbation and recording of local neural circuits in the behaving animal[J].Eur J Neurosci,2010,31(12):2279-2291.
[29]Andrasfalvy BK,Zemelman BV,Tang J,et al.Two-photon single-celloptogeneticcontrolofneuronalactivityby sculpted light[J].Proc Natl Acad Sci U S A,2010,107(26):11981-11986.
[30]Graybiel AM,Aosaki T,Flaherty AW,et al.The basal ganglia and adaptive motor control[J].Science,1994,265(5180):1826-1831.
[31]Blandini F,Nappi G,Tassorelli C,et al.Functional changes of the basal ganglia circuitry in Parkinson's disease[J].Prog Neurobiol,2000,62(1):63-88.
[32]Turner RS,Desmurget M.Basal ganglia contributions to motor control:a vigorous tutor[J].Curr Opin Neurobiol,2010,20(6):704-716.
[33]Delong MR.Primate models of movement disorders of basal ganglia origin[J].Trends Neurosci,1990,13(13):281-285.
[34]Iansek R,Bradshaw J,Phillips J,et al.Review article:the functions of the basal ganglia and the paradox of stereotaxic surgery in Parkinson's disease[J].Brain,1995,118(3):1613-1617.
[35]Marsden CD.What do the basal ganglia tell premotor cortical areas[J]Ciba Found Symp,1987,132:282-300.
[36]Mink JW.Basal ganglia dysfunction in Tourette’s syndrome:a new hypothesis[J].Pediatr Neurol,2001,25(3):190-198.
[37]KravitzAV,FreezeBS,ParkerPR,etal.Regulationof parkinsonian motor behaviours by optogenetic control of basal ganglia circuitry[J].Nature,2010,466(7306):622-666.
[38]Cui G,Jun SB,Jin X,et al.Concurrent activation of striatal direct and indirect pathways during action initiation[J]. Nature,2013,494(7436):238-242.
[39]Xin J,Tecuapetla F,Costa RM.Basal ganglia subcircuits distinctively encode the parsing and concatenation of action sequences[J].Nat Neurosci,2014,17(3):423-430.
[40]Freeze BS,Kravitz AV,Hammack N,et al.Control of basal ganglia output by direct and indirect pathway projection neurons[J].J Neurosci,2013,33(47):18531-18539.
[41]ChanCS,SurmeierDJ,YungWH.Striatalinformation signaling and integration in globus pallidus:timing matters[J]. Neurosignals,2005,14(6):281-289.
[42]Tecuapetla F,Matias S,Dugue GP,et al.Balanced activity in basal ganglia projection pathways is critical for contraversive movements[J].Nat Commun,2014,5:4315.
[43]Turner RS,Desmurget M.Basal ganglia contributions to motor control:a vigorous tutor[J].Curr Opin Neurobiol,2010,20(6):704-716.
[44]Adriana G,Thomas W.Pathophysiology of parkinsonism[J]. Clin Neurophysiol,2008,119(7):1459-1474.
[45]管强,曹学兵,孙圣刚,等.帕金森病及异动症大鼠模型纹状体神经元的电生理变化的研究[J].卒中与神经疾病,2005,12(6):323-325.
[46]李文娟,席悦,张巧俊,等.大鼠丘脑背内侧核神经元在帕金森病状态下电活动的变化[J].西安交通大学学报:医学版,2013,34(5):614-619.
[47]孙作厘,贾军,虞芬,等.帕金森病基底神经节神经递质失衡的研究进展[J].生理科学进展,2011,42(6):427-430.
[48]Benabid AL.Deep brain stimulation for Parkinson’s disease [J].Curr Opin Neurobiol,2003,13(6):696-706.
[49]GradinaruV,MogriM,ThompsonKR,etal.Optical deconstruction of parkinsonian neural circuitry[J].Science,2009,324(5925):354-359.
[50]Nybo L,Secher NH.Cerebral perturbations provoked by prolonged exercise[J].Prog Neurobiol,2004,72(4):223-261.
[51]王大磊,刘晓莉,乔德才.大鼠力竭运动中丘脑底核和皮层神经元电活动的变化[J].中国应用生理学杂志,2011,27(4):427-431.
[52]乔德才,侯莉娟,何德富,等.运动疲劳对大鼠新纹状体神经元电活动的影响[J].中国运动医学杂志,2006,24(6):676-680.
[53]乔德才,李许贞,刘晓莉,等.力竭运动过程中大鼠纹状体神经元局部场电活动的动态研究[J].中国运动医学杂志,2012,31(10):855-860.
[54]侯莉娟,林然,刘晓莉,等.一次性力竭运动对大鼠苍白球外侧部神经元自发放电活动的影响[J].西安体育学院学报,2015,2:196-200.
[55]侯莉娟,胡荣光,刘晓莉,等.大鼠GPi/SNr神经元在运动性中枢疲劳发生中的调控作用[J].北京体育大学学报,2013(5):44-48.
[56]胡琰茹,乔德才,刘晓莉.力竭运动过程中大鼠苍白球内侧部对皮层的调控作用[J].中国运动医学杂志,2013,32(5):420-425.
[57]乔德才,刘军,刘晓莉.运动疲劳的中枢机制研究进展——基于基底神经节-皮层环路紊乱的视角[J].北京体育大学学报,2014(2):51-58.
2016.03.08
国家自然科学基金资助项目(31571221),北京市自然科学基金资助项目(5142012)
乔德才,Email:decaiq@bnu.edu.cn
