响应面试验优化超声波辅助水酶法提取松籽油工艺及其氧化稳定性
2016-12-06包怡红
包怡红,郭 阳
(东北林业大学林学院,黑龙江 哈尔滨 150040)
响应面试验优化超声波辅助水酶法提取松籽油工艺及其氧化稳定性
包怡红,郭 阳
(东北林业大学林学院,黑龙江 哈尔滨 150040)
以红松松籽为原料,经超声波预处理后,利用水酶法提取松籽油,通过单因素试验及响应面试验研究松籽油提取工艺,并对其氧化稳定性进行分析。结果表明,松籽油提取的优化工艺条件为超声强度0.28 W/cm2、超声时间40 min、超声温度50 ℃、料液比1∶5(g/mL)、碱性蛋白酶加酶量1 427 U/g、酶解时间4.08 h、酶解温度44 ℃,在此条件下松籽油得率可以达到73.01%。温度、光照对松籽油氧化有显著促进作用,3 ℃以下避光贮藏松籽油可使其有良好的氧化稳定性。
超声波;水酶法;响应面;松籽油
红松(Pinus koraiensis Sivb. ct Zucc),松科、松属植物,主要分布在我国东北长白山以及小兴安岭地区,红松籽是红松成熟种子去皮后得到的种仁[1]。红松籽含有丰富的营养成分,含油脂60%~69%、蛋白质13%~20%,还有多种维生素及生理活性物质等[2]。松籽油中含不饱和脂肪酸高达93.2%,包括亚麻酸、亚油酸、二十碳五烯酸、花生四烯酸及一种独特的脂肪酸-皮诺敛酸,对于便秘、风湿性关节炎的治疗有一定疗效,同时具有降低血脂、抑制食欲的功效,近一步达到减肥效果[3-4]。松籽油含有的总酚与VE使其具有较强的抗氧化能力,此外还含有角鲨烯、芝麻素、谷甾醇、虾青素等甾醇类物质,具有优良的营养价值[5-6]。松籽油的风味独特,可直接作为食用油来源,国外已将松籽油作为开发保健食品以及保健饮料等功能性食品的原料[7]。
目前常见的松籽油提取方法有压榨法、有机溶剂浸提法、超临界CO2萃取法、水酶法等。与其他提取方法
相比,水酶法的作用条件温和,操作安全,能耗低,不使用有机试剂,更加环保、经济,所提取出的油脂品质高,具有松籽的清香味[8]。水酶法是油料在机械破碎后,采用对植物细胞壁或者脂蛋白、脂多糖等复合体有水解作用的酶对油料进行酶解,使油脂易于从油料释放,利用非油成分对油和水的亲和力差异、油水密度差异将油分离[9]。已有花生、玉米胚芽、米糠、大豆等油料水酶法提油的报道[10-11]。超声波在液体中产生的空化作用可以在一定程度上使油料细胞壁遭到破坏,细胞壁内的物质得到释放,从而提高提取率[12-14]。本实验采用超声波辅助水酶法提取松籽油,利用响应面设计优化其工艺参数,旨在获得一种品质好、得率高的松籽油提取条件。
1 材料与方法
1.1 材料与试剂
红松籽 黑龙江省伊春市林业局。
木瓜蛋白酶(活力0.87×105U/g)、中性蛋白酶(活力1.35×105U/g)、碱性蛋白酶(活力1.4×105U/g)、胃蛋白酶(活力3 000 U/g)、纤维素酶(活力30 000 U/g)北京博奥拓达科技有限公司;果胶酶(活力1.0×106U/g)、高温淀粉酶(活力4000 U/g) 上海源叶生物科技有限公司;2-硫代巴比妥酸、正丁醇、冰乙酸、异辛烷、硫代硫酸钠、氢氧化钠、盐酸(均为分析纯) 天津东丽试剂公司。
1.2 仪器与设备
KQ-600GVDV超声波清洗仪 昆山市超声仪器有限公司;FW100型高速万能粉碎机 天津市泰斯特仪器有限公司;DK-8D电热恒温水浴槽、DHG-9240电热恒温鼓风干燥箱、TDL-40B-W型离心机 上海标仪仪器有限公司;磁力搅拌器 上海精科仪器公司;pH计 梅特勒-托利多仪器有限公司。
1.3 方法
1.3.1 原料基本成分的测定
水分含量的测定:参考GB 5009.3—2010《食品中水分的测定》;粗脂肪含量的测定:参考GB/T 14772—2008《食品中粗脂肪的测定》;蛋白质含量的测定:参考GB 5009.5—2010《食品中蛋白质的测定》;灰分含量的测定:参考GB 5009.5—2010《食品中灰分的测定》。
1.3.2 松籽油提取工艺
1.3.2.1 工艺流程

1.3.2.2 操作要点
将松籽置于70 ℃鼓风干燥箱中,干燥4 h后破碎过18 目筛。取10 g破碎松籽按一定料液比加入蒸馏水,混合均匀后置于超声波清洗仪中超声处理。经一定的超声条件处理后,调节混合物至最适pH值和温度,添加酶,酶解一段时间后,升温至100 ℃灭酶8 min,8000 r/min离心30 min[15],小心吸取上层清油Ⅰ,将乳状液二次离心,分离上层清油Ⅱ,将二次离心后得到乳状液置于-20 ℃冷冻24 h,油相结晶可以刺入水相,从而大幅度降低乳状液稳定性,达到破乳的目的[16]。解冻分离上层清油Ⅲ,合并三部分清油,低温烘干至质量恒定,计算松籽油得率。
1.3.2.3 松籽油得率的计算
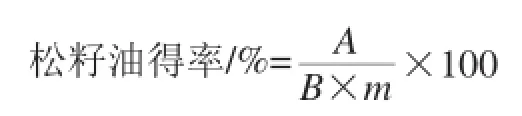
式中:A为总游离油质量/g;B为松籽质量/g;m为松籽含油量/%。
1.3.3 酶种类对松籽油得率的影响
以1∶5的料液比加入蒸馏水,分别在各种酶最适pH值、最适温度条件下,加酶量均为1 500 U/g,酶解时间3 h。按1.3.2.2节操作,计算得率。分别考察纤维素酶、高温淀粉酶、果胶酶以及胃蛋白酶、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶对松籽油得率的影响。
1.3.4 超声预处理条件对松籽油得率的影响
1.3.4.1 超声强度对松籽油得率的影响
取一定量已破碎松籽,以1∶5的料液比加入蒸馏水,超声时间30 min,超声温度50 ℃,经超声强度分别为0.07、0.14、0.21、0.28、0.35 W/cm2的条件超声预处理;调节pH 10.5,碱性蛋白酶加酶量为1500 U/g,40 ℃条件下酶解3 h,提取清油,称量并计算松籽油得率。
1.3.4.2 超声时间对松籽油得率的影响
取一定量已破碎松籽,以1∶5的料液比加入蒸馏水,超声强度0.28 W/cm2,超声温度50 ℃,经超声时间分别为10、20、30、40、50 min的条件预处理;调节pH 10.5,碱性蛋白酶加酶量为1 500 U/g,40 ℃条件下酶解3 h,提取清油,称量并计算松籽油得率。
1.3.4.3 超声温度对松籽油得率的影响
取一定量已破碎松籽,以1∶5的料液比加入蒸馏水,超声强度0.28 W/cm2,超声时间40 min,经超声温度分别为40、45、50、55、60 ℃的条件预处理;调节pH 10.5,碱性蛋白酶加酶量为1 500 U/g,40 ℃条件下酶解3 h,提取清油,称量并计算松籽油得率。
1.3.5 酶解条件对松籽油得率的影响
1.3.5.1 料液比对松籽油得率的影响
取一定量已破碎松籽,分别以1∶3、1∶4、1∶5、1∶6、1∶7的料液比加入蒸馏水,经超声强度0.28 W/cm2、超声时间40 min、超声温度50 ℃的条件预处理;调节pH 10.5,碱性蛋白酶加酶量为1 500 U/g,40 ℃条件下酶解3 h,提取清油,称量并计算松籽油得率。
1.3.5.2 加酶量对松籽油得率的影响
取一定量已破碎松籽,以1∶5的料液比加入蒸馏水,经超声强度0.28 W/cm2、超声时间40 min、超声温度50 ℃条件预处理;调节pH10.5,碱性蛋白酶加酶量分别为500、1 000、1 500、2 000、2 500 U/g,40 ℃条件下酶解3 h,提取清油,称量并计算松籽油得率。
1.3.5.3 酶解时间对松籽油得率的影响
取一定量已破碎松籽,以1∶5的料液比加入蒸馏水,经超声强度0.28 W/cm2、超声时间40 min、超声温度50 ℃条件预处理;调节pH 10.5,碱性蛋白酶加酶量为1 500 U/g,40 ℃条件下分别酶解1、2、3、4、5 h,提取清油,称量并计算松籽油得率。
1.3.5.4 酶解温度对松籽油得率的影响
取一定量已破碎松籽,以1∶5的料液比加入蒸馏水,经超声强度0.28 W/cm2、超声时间40 min、超声温度50 ℃条件预处理;调节pH 10.5,碱性蛋白酶加酶量为1 500 U/g,分别在30、35、40、45、50 ℃条件下酶解4 h,提取清油,称量并计算松籽油得率。
1.3.6 响应面试验优化松籽油提取工艺条件
在单因素试验的基础上,根据Box-Behnken试验设计原理,选择料液比、加酶量、酶解时间、酶解温度4 个因素,设计四因素三水平的响应面试验,试验因素和水平设计见表1。
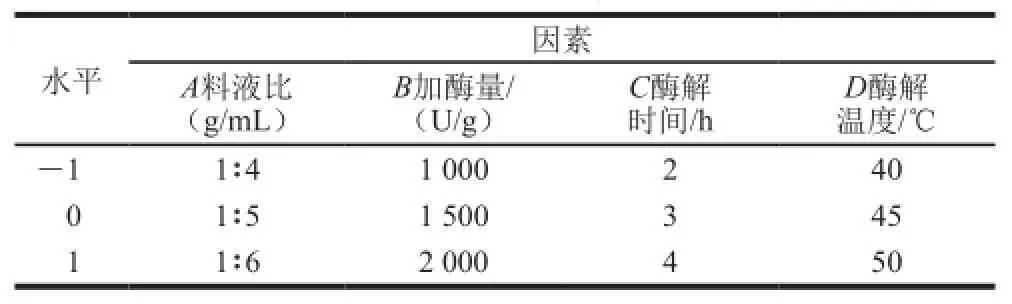
表1 响应面试验因素与水平Table1 Factors and levels used for response surface methodology
1.3.7 松籽油氧化稳定性分析
1.3.7.1 温度对松籽油氧化稳定性影响
分别取20 g松籽油置于具塞比色管中,置于-20、 3、15、25、35 ℃环境中,每隔2 d测定其过氧化值(peroxide,POV)及硫代巴比妥酸(2-thiobarbituric acid,TBA)值。研究温度对松籽油氧化稳定性的影响。
1.3.7.2 光照对松籽油氧化稳定性影响
分别取20 g松籽油置于具塞比色管中,置于室温避光(遮光纸遮挡)与室温自然光环境中,每隔2d测定其POV及TBA值。研究光照条件对松籽油氧化稳定性的影响。
1.3.8 松籽油指标测定
酸值测定:参考GB/T 5530—2005《动物油脂酸值和酸度的测定》;碘值测定:参考GB/T 5532—2008《动植物油脂:碘值的测定》;POV值测定:参考GB/T 5538—2005《动植物油脂:过氧化值的测定》;TBA值测定:参照Mohammadi等[17]的方法。
2 结果与分析
2.1 松籽主要成分
经测定,本实验所用松籽由含量高达(68.06±0.23)%的脂肪、(16.12±0.12)%的蛋白质、(4.40±0.14)%的水分及(2.62±0.25)%的灰分组成,说明松籽是适合制取油脂的植物油料。
2.2 酶种类对水酶法提取松籽油得率的影响
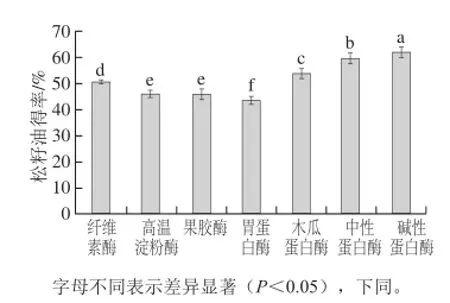
图1 酶种类对松籽油得率的影响Fig.1 Effects of enzyme type on the yield of pine nut oil
由图1可知,在加酶量相同的条件下,松籽油得率最高的为碱性蛋白酶,这是由于松籽中蛋白质被碱性蛋白酶水解成肽或者氨基酸,并且其中与蛋白相关的细胞质结构以及子叶细胞中包裹在油脂外的蛋白膜在碱性蛋白酶作用下,结构崩坏,释放出游离油脂,实现油水分离[18-19]。因此,在后续试验中选择碱性蛋白酶为试验用酶。
2.3 超声预处理对松籽油得率的影响
2.3.1 超声强度对松籽油得率的影响
由图2可知,随着超声强度的增大,松籽油得率上升趋势显著,当超声强度为0.28 W/cm2时松籽油得率达到最大69.09%,这是由于超声波产生的机械振动加速细胞壁裂解,增加细胞内容物分子碰撞概率,利于后续酶解提
取松籽油;超声强度大于0.28 W/cm2后,松籽油得率下降,这可能是因为当超声波的强度过大时,超声的空化作用加速分子运动强烈,使物料分解为极小颗粒,乳状油部分增多,不利于油脂的分离[20-21]。因此,确定超声强度为0.28 W/cm2。

图2 超声强度对松籽油得率的影响Fig.2 Effect of ultrasonic intensity on the yield of pine nut oil
2.3.2 超声时间对松籽油得率的影响
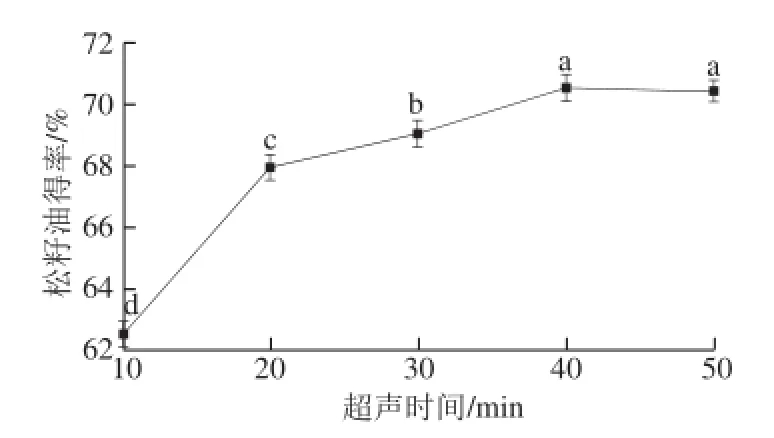
图3 超声时间对松籽油得率的影响Fig.3 Effect of ultrasonication time on the yield of pine nut oil
由图3可知,松籽油得率随着超声时间的延长而增加,当超声时间为40 min时达到最高值;继续延长超声时间,松籽油得率变化不显著。这与方芳等[22]研究超声辅助水酶提取葫芦籽油时得出结论类似,时间过长并无实际意义。因此,确定超声时间为40 min。
2.3.3 超声温度对松籽油得率的影响
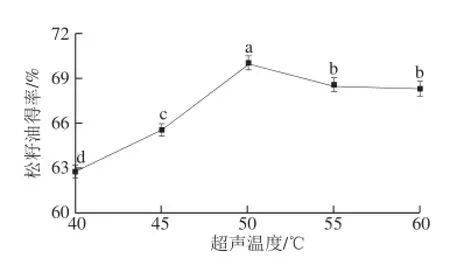
图4 超声温度对松籽油得率的影响Fig.4 Effect of ultrasonic pretreatment temperature on the yield of pine nut oil
由图4可知,随着超声温度的升高松籽油得率逐渐增大到最高点,当温度继续升高,松籽油得率逐渐下降并趋于稳定,这与物料在高温条件下发生结构变化有关。这与胡滨等[23]在超声波和微博辅助水酶法提取葡萄籽油的工艺研究中得到的结论类似。在此条件下松籽油得率达到70.5%,因此确定超声温度为50 ℃。
2.4 酶解条件对松籽油得率的影响
2.4.1 料液比对松籽油得率的影响
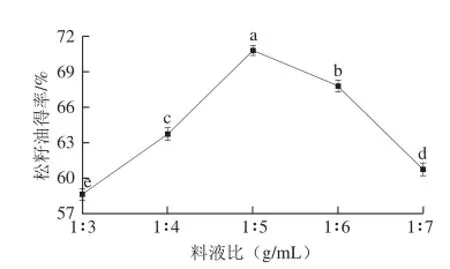
图5 料液比对松籽油得率的影响Fig.5 Effect of solid/liquid ratio on the yield of pine nut oil
由图5可知,料液比对松籽油得率有显著影响,随着溶剂用量的增大,松籽油得率升高,于1∶5时达到最大值;再增大提取液用量,得率开始下降。这可能是因为当溶剂用量低时,反应体系中底物质量浓度大,黏度高,流动性低,影响酶对底物的作用效果;当溶剂用量增多时,水量的增大降低了整个反应体系中底物质量浓度,使酶分子与底物分子的作用几率降低,酶的作用效果下降。
2.4.2 加酶量对松籽油得率的影响

图6 加酶量对松籽油得率的影响Fig.6 Effect of enzyme dosage on the yield of pine nut oil
由图6可知,随着加酶量的增大,松籽油得逐渐升高;当加酶量达到1 500 U/g时,松籽油得率最高为70.35%,当加酶量继续增加时,松籽油得率逐渐趋于稳定。这是由于酶量的增加,酶与底物作用的更加充分,酶渗透到脂质体膜内,脂蛋白脂多糖从复合体中释放出来,使蛋白酶作用效果更充分[24];当加酶量继续增加,体系中过多的酶附着在松籽表面,影响油脂的释放。
2.4.3 酶解时间对松籽油得率的影响
由图7可知,随着提取时间的延长,松籽油得率呈现
先快速上升后缓慢上升的趋势,在4 h处得率达到最大。这是由于随着酶解时间的延长细胞结构逐步被打开,酶与底物作用越来越充分,油脂的释放量相应增多,从而得率升高;当酶解时间为5 h时,松籽油得率较4 h相比稍有下降并不显著,这是由于底物逐渐减少,酶解趋于充分,随着时间延长,乳化油部分逐渐增多,影响油脂分离及品质。
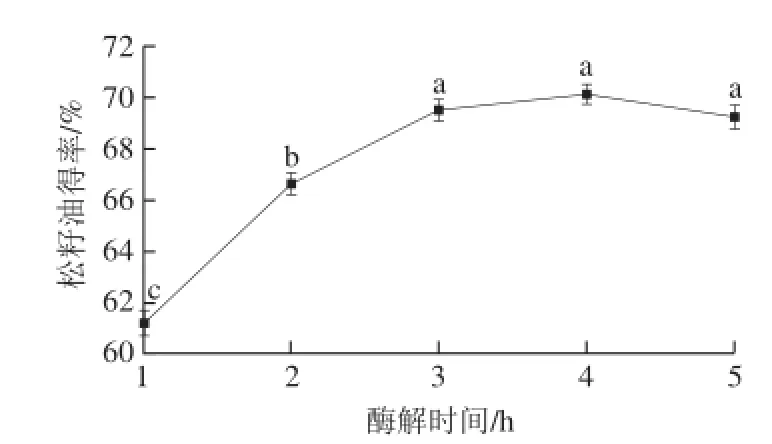
图7 酶解时间对松籽油得率的影响Fig.7 Effect of hydrolysis time on the yield of pine nut oil
2.4.4 酶解温度对松籽油得率的影响

图8 酶解温度对松籽油得率的影响Fig.8 Effect of hydrolysis temperature on the yield of pine nut oil
由图8可知,当温度较低时,酶活力不能完全发挥,不利于酶解反应的进行,随着温度的升高,逐渐接近酶的最适温度,对底物的作用效果明显,因此松籽油得率升高显著;当温度达到45 ℃时,得率达到最高;随之温度继续升高得率降低但并不显著,这是由于温度超过酶的最适温度,使酶的活性中心结构被破坏,导致酶变性或失活,不利于松籽油的提取[25]。
2.5 松籽油提取响应面试验结果
2.5.1 响应面试验设计与结果
在单因素试验的基础上,综合显著性分析确定超声预处理条件为超声强度0.28 W/cm2、超声时间40 min、超声温度50 ℃,对酶解条件进行响应面试验,模型共进行29 次试验,24 组析因试验,试验号2、9、17、18、24为5 组中心试验,用以估计试验误差。每组试验重复3 次以估计误差。响应面试验设计及结果见表2。

表2 响应面设计方案及结果Table2 Experimental program and results for response surface analysis
2.5.2 模型的建立及显著性分析
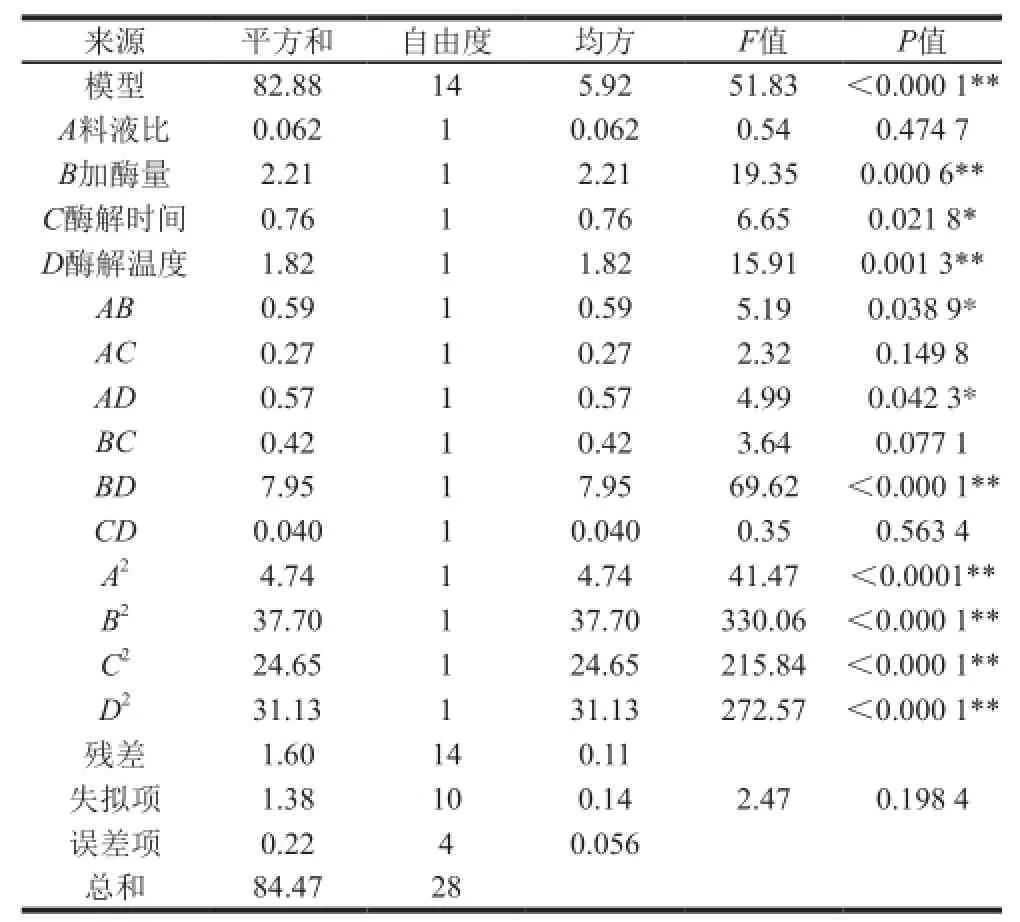
表3 二次响应面回归模型方差分析Table3 Analysis of variance for the fitted quadratic response surface regression model
运用Design-Expert 8.0得到松籽油得率(Y)对自变量料液比(A)、加酶量(B)、酶解时间(C)、酶解温度(D)的二次多项回归模型:
Y=73.05+0.072A-0.43B+0.25C-0.39D-0.39AB+ 0.26AC-0.38AD-0.32BC+1.41BD+0.10CD-0.85A2-2.41B2-1.95C2-2.19D2
利用分析软件对实验结果进行进一步分析,显著性结果及多元回归模型的方差分析结果见表3。
由表3可以看出,模型P<0.000 1,说明模型极显著;失拟项P=0.198 4>0.05,说明失拟项差异不显著;确定系数R2=0.981 1,说明响应值的变化中有98.11%是来自于所选因素的变化;模型修正决定系数说明模型能解释96.21%的响应值变化;离散系数表示试验的精确度,数值越大,表明试验的可靠性越差[26],离散系数为0.48%说明该试验的可靠性较好。综上,该模型的可信度和拟合度均很高。因此可用该模型回归方程预测超声波辅助酶法提取松籽油得率的工艺条件优化。由F值可以得到4 个因素对松籽油得率影响大小顺序为:B(加酶量)>D(酶解温度)>C(酶解时间)>A(料液比)。
由表3还可看出,因素B、D对响应值Y的影响极显著,因素C对Y值影响显著,交互项BD极显著,交互项AB、AD影响显著,说明加酶量、酶解温度之间交互作用极显著,料液比与加酶量、料液比与酶解温度之间交互作用显著。
2.5.3 交互作用分析
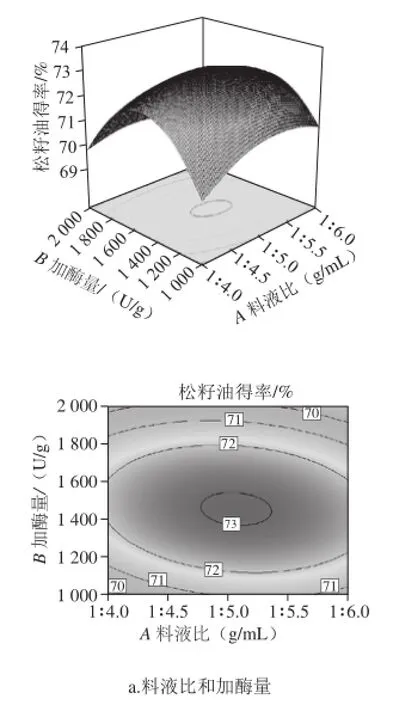
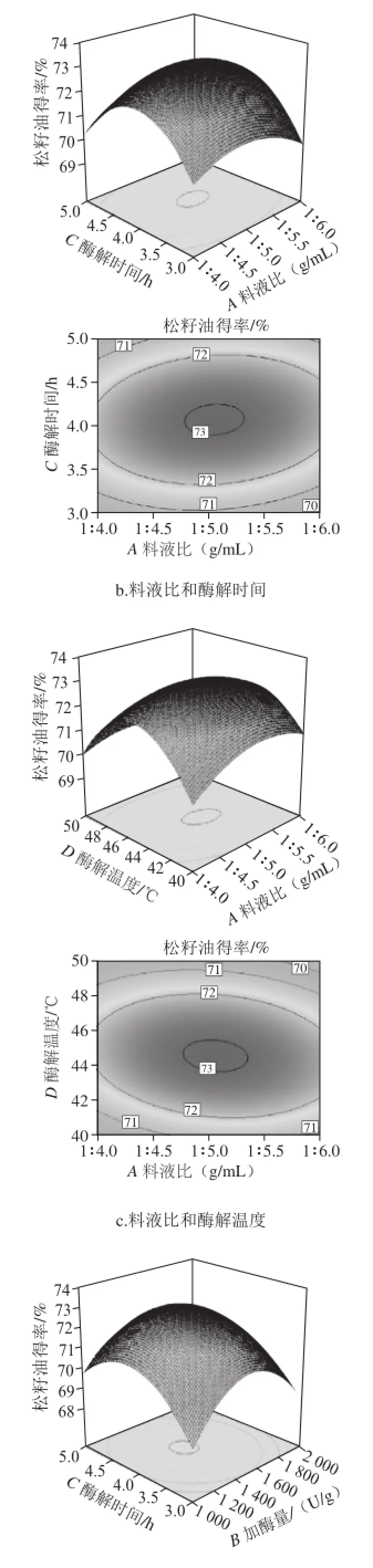
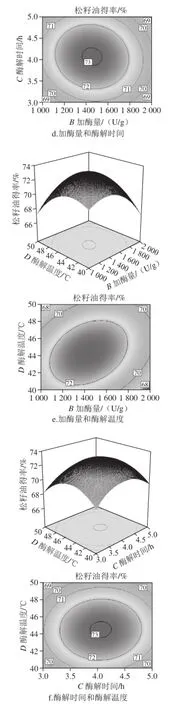
图9 各因素交互作用的响应面和等高线图Fig.9 Response surface and contour plots showing the interactive effects of four extraction parameters on the yield of pine nut oil
响应面图能直接反应各因素与响应值的关系及各个因素间的交互作用,响应曲面坡度越陡、等高线密集成椭圆形表示两因素交互作用的影响越大[27],而圆形表示交互作用不显著。由图9e可以看出,加酶量(B)与酶解温度(D)交互作用对松籽油得率的影响极显著,随着加酶量和酶解温度水平的增加,松籽油得率逐渐升高,酶解温度上升较缓慢。由图9a可知,料液比(A)与加酶量(B)的交互作用显著,随着料液比与加酶量水平的增加,松籽油得率先上升后下降;由图9c可以看出,料液比(A)与酶解温度(D)的交互作用显著,随着料液比与酶解温度水平的增加,松籽油得率逐渐增加,但较前两个交互作用较为平缓。
2.5.4 松籽油最佳提取条件的确定及验证实验
对工艺进行的响应面优化得到松籽油最佳的提取工艺条件为:料液比1∶5.1、加酶量1 427.06 U/g、酶解时间4.08 h、酶解温度44.27 ℃,在此条件下松籽油得率的理论值为73.12%。为检验试验设计的可靠性,对上述工艺条件进行验证,为方便实验的进行,将工艺参数设定为料液比1∶5、加酶量1427 U/g、酶解时间4.08 h、酶解温度44 ℃,进行3 次重复实验,取平均值。所得松籽油得率为73.01%,验证值与响应面预测值相比,相对误差为0.15%,表明经优化后的工艺条件能够较好地预测松籽油提取工艺。
2.6 松籽油氧化稳定性分析
2.6.1 温度对松籽油氧化稳定性影响
2.6.1.1 温度对松籽油POV的影响

图10 温度对松籽油POV的影响Fig.10 Effect of different temperatures on the POV of pine nut oil
由图10可知,不同温度条件下松籽油的氧化稳定性差异显著。在3 ℃与-20 ℃条件下,松籽油的POV在10 d内较为稳定,变化平缓;15 ℃条件下在6 d后POV明显升高;25 ℃以上松籽油POV迅速升高,35 ℃尤为迅速。因为高温会促使油脂氧化速率加快,破坏松籽油中的不饱和脂肪酸,加速其分解进而酸败。-20 ℃ POV的变化高于3 ℃,可能是由于-20 ℃时水分含量低于3 ℃,水分高会阻止油脂氧化,降低自由水分含量,可提高油脂稳定度[28]。因此,松籽油适宜保存在3 ℃以下。
2.6.1.2 温度对松籽油TBA值的影响

图11 温度对松籽油TBA值的影响Fig.11 Effect of different temperatures on the TBA value of pine nut oil
由图11可知,在3 ℃以下松籽油在贮藏过程中的TBA值变化较为平缓,在6 d后迅速升高;15 ℃以上条件下松籽油TBA值变化不大,在2 d后迅速升高。这表明低温能够减弱丙二醛的产生,延缓松籽油的氧化过程。由TBA值与POV的变化趋势说明松籽油在3 ℃以下保存可以增加松籽油的贮藏稳定性。
2.6.2 光照对松籽油氧化稳定性影响
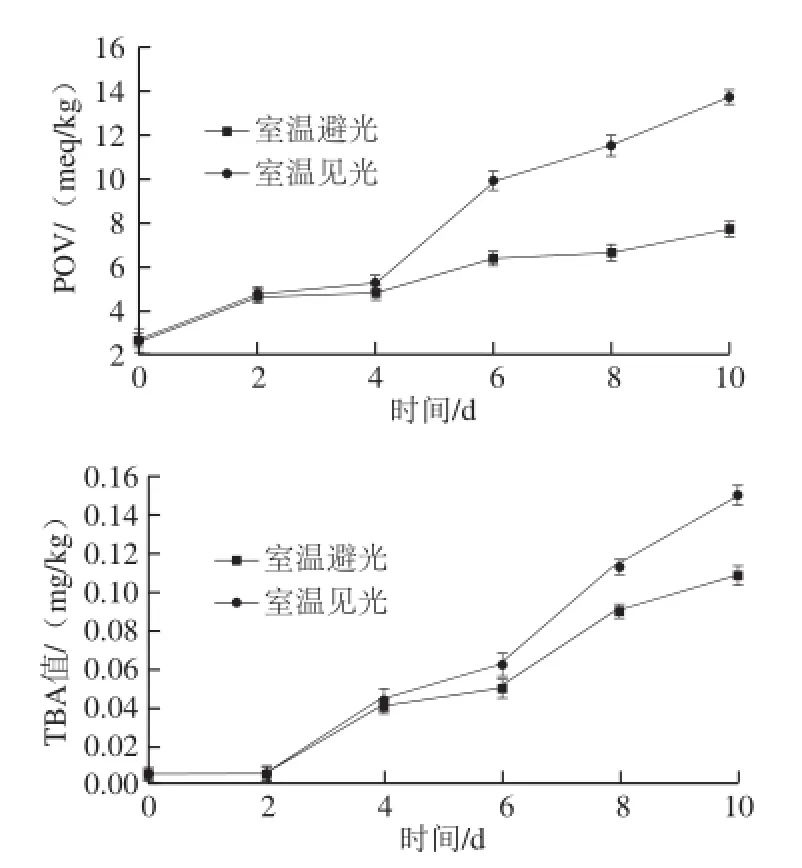
图12 光照对松籽油氧化稳定性的影响Fig.12 Effect of light on the oxidative stability of pine nut oil
由图12可知,室温光照与室温避光条件下松籽油POV及TBA值呈上升趋势,其中POV增幅的差异性在4 d后尤为显著;说明光照会加速松籽油的氧化,在长时间的贮藏过程中差异明显。在避光与见光的条件下TBA值于2 d内变化平稳,2 d后呈明显上升趋势;光照对TBA值增幅大于避光,说明避光能够降低丙二醛的生成速度,减缓松籽油的氧化程度。因此,松籽油要避光贮存。
2.7 松籽油的理化指标测定
由表4可知,超声波辅助水酶法提取的松籽油具有天然松籽清香,酸值、POV、皂化值、碘值均符合GB/T 5009.37—2003《食用植物油卫生标准的分析方法》,无氧化酸败,说明了原料的良好品质以及提取方法的可靠。马文君等[29]以水酶法及溶剂法提取松籽油,研究其POV、酸值均达到国家食用油标准,这与本实验研究结果基本一致。

表4 松籽油主要理化性质Table4 Physicochemical properties of the pine nut oil
3 结 论
利用超声辅助水酶法进行松籽油的提取,通过单因素试验和响应面分析试验,得到松籽油的最佳提取工艺条件为在超声强度0.28 W/cm2、超声时间40 min、超声温度50 ℃的预处理条件下,选用碱性蛋白酶对松籽进行酶解,料液比1∶5、加酶量1 427 U/g、酶解时间4.08 h、酶解温度44 ℃,松籽油得率可以达到73.01%,是优化前的1.17 倍。超声波辅助水酶法提取松籽油是安全、有效、经济的方法。
水酶法提取的松籽油品质优良,有松仁清香,呈浅黄色透明状,酸值低,不饱和程度高。由于松籽油富有不饱和脂肪酸,易氧化酸败,温度与光照对氧化程度呈正相关,影响显著。在3 ℃以下的温度避光贮存,松籽油具有良好的贮藏稳定性。
[1] 冯彦博, 白凤翎. 松仁的营养价值及其深加工[J]. 食品研究与开发, 2003, 24(4): 86-87. DOI:10.3969/j.issn.1005-6521.2003.04.038.
[2] ТИПСИНА Н Н, 刘艳霞. 松子及几种油料作物成分及功能比较分析[J]. 吉林农业科技学院学报, 2015, 24(2): 4-5. DOI:10.3969/ j.issn.1674-7852.2015.02.002.
[3] TAKAGI T, ITABASHI Y. Cis-5-olefinic unusual fatty acids in seed lipids of gymnospermae and their distribution in triacylglycerols[J]. Lipids, 1982, 17(10): 716-723. DOI:10.1007/bf02534657.
[4] SOYOUNG P, YESEO L, SUNHYE S, et al. Impact of Korean pine nut oil on weight gain and immune responses in high-fat diet-induced obese mice[J]. Nutrition Research and Practice, 2013, 7(5): 1363-1367. DOI:10.4162/nrp.2013.7.5.352.
[5] 李哲敏. 松子仁的营养保健功能[J]. 农牧产品开发, 2001, 7(7): 23-24. DOI:10.3969/j.issn.1671-4393.2001.07.010.
[6] CESARETTIN A, EBRU P. Fat-soluble bioactives in nuts[J]. European Journal of Lipid Science and Technology, 2011, 113(8): 943-949. DOI:10.1002/ejlt.201100066.
[7] 倪芳妍, 方晓璞, 蒋敏, 等. 松籽油的研究进展[J]. 粮食与食品工业, 2012, 19(6): 50-51. DOI:10.3969/j.issn.1672-5026.2012.06.019.
[8] 王瑛瑶, 贾照宝, 张霜玉. 水酶法提油技术的应用进展[J]. 中国油脂, 2008, 33(7): 24-26. DOI:10.3321/j.issn:1003-7969.2007.02.006.
[9] 张辉, 齐宝坤, 李杨, 等. 酶法制取大豆油脂过程中的蛋白酶解动力学[J]. 食品科学, 2016, 37(1): 145-149. DOI:10.7506/spkx1002-6630-201601026.
[10] 段作营, 李珺, 尤新, 等. 水酶法提取玉米胚芽油的研究[J]. 中国油脂, 2002, 27(3): 15-18. DOI:10.3321/j.issn:1003-7969.2002.03.005.
[11] 杨慧萍, 王素雅, 宋伟, 等. 水酶法提取米糠油的研究[J]. 食品科学, 2004, 25(8): 106-109. DOI:10.3321/j.issn:1002-6630.2004.08.022.
[12] 江连洲, 李杨, 王妍, 等. 水酶法提取大豆油的研究进展[J]. 食品科学, 2013, 34(9): 346-350. DOI:10.7506/spkx1002-6630-201309069.
[13] 王敬敬, 麻成金, 曾巧辉, 等. 响应面优化超声波辅助水酶法提取茶叶籽油工艺[J]. 中国食物与营养, 2010, 16(10): 53-57. DOI:10.3969/ j.issn.1006-9577.2010.10.015.
[14] 刘文倩, 王燕, 邓放明, 等. 超声辅助酶法提取虾黄油脂及其脂肪酸组成分析[J]. 食品科学, 2014, 35(12): 102-107. DOI:10.7506/ spkx1002-6630-201412020.
[15] 易建华, 朱振宝, 赵芳. 酶的选择对水酶法提取核桃油的影响[J]. 中国油脂, 2007, 32(2): 27-29. DOI:10.3321/ j.issn:1003-7969.2007.02.006.
[16] THANASUKARN P, PONGSAWATMANIT R, MCCLEMENTS D J. Influence of emulsifier type on freeze-thaw stability of hydrogenated palm oil-in-water emulsions[J]. Food Hydrocolloids, 2004, 18(6): 1033-1043. DOI:10.1016/j.foodhyd.2004.04.010.
[17] MOHAMMADI A, JAFARI S M, ESFANJANI A F, et al. Application of nano-encapsulated olive leaf extract in controlling the oxidative stability of soybean oil[J]. Food Chemistry, 2016, 190(93): 513-519. DOI:10.1016/j.foodhyd.2004.04.010.
[18] 章绍兵, 王璋, 许时婴. 水酶法提取菜籽油的机理探讨[J]. 中国油脂, 2009, 34(10): 41-45. DOI:10.3321/j.issn:1003-7969.2009.10.012.
[19] JIANG L, HUA D, WANG Z, et al. Aqueous enzymatic extraction of peanut oil and protein hydrolysates[J]. Food and Bioproducts Processing, 2010, 88(2/3): 233-238. DOI:10.1016/j.fbp.2009.08.002.
[20] 高霞, 仇农学, 庞福科, 等. 超声波辅助提取苹果籽油工艺研究[J]. 中国油料作物学报, 2007, 29(1): 78-82. DOI:10.3321/ j.issn:1007-9084.2007.01.016.
[21] 马文君, 齐宝坤, 李杨, 等. 超声辅助水酶法提取月见草籽油的研究[J]. 中国食物与营养, 2015, 21(4): 54-58. DOI:10.3969/ j.issn.1006-9577.2015.04.014.
[22] 方芳, 许凯扬, 朱强, 等. 超声波辅助水酶法萃取葫芦籽油的研究[J]. 中国粮油学报, 2012, 27(10): 62-66. DOI:10.3969/ j.issn.1003-0174.2012.10.013.
[23] 胡滨, 陈一资, 苏赵. 超声波和微波辅助水酶法提取葡萄籽油的工艺研究[J]. 中国油脂, 2015, 40(12): 12-17. DOI:10.3969/ j.issn.1003-7969.2015.12.003.
[24] 王瑛瑶, 王璋. 水酶法从花生中提取蛋白质与油: 酶解工艺参数[J]. 无锡轻工大学学报: 食品与生物技术, 2003, 22(4): 60-64. DOI:10.3321/j.issn:1673-1689.2003.04.014.
[25] 张志伟, 王素梅. 水酶法提取玉米胚芽油-酶解工艺参数优化[J]. 食品研究与开发, 2015, 36(9): 115-118. DOI:10.3969/ j.issn.1005-6521.2015.09.033.
[26] 喻峰, 熊华, 吕培蕾, 等. 核桃粕酶解工艺研究[J]. 食品与发酵工业, 2006, 32(5): 89-91. DOI:10.13995/j.cnki.11-1802/ts.2006.05.024.
[27] 施瑛, 裴斐, 周玲玉, 等. 响应面法优化复合酶法提取紫菜藻红蛋白工艺[J]. 食品科学, 2015, 36(6): 51-57. DOI:10.7506/spkx1002-6630-201506010.
[28] 王兴国. 油脂化学[M]. 北京: 科学出版社, 2012.
[29] 马文君, 齐宝坤, 王晶, 等. 不同方式提取松籽油理化性质及微波加热对其品质影响的研究[J]. 中国食物与营养, 2015, 21(3): 50-54. DOI:10.3969/j.issn.1006-9577.2015.03.014.
Optimization of Ultrasonic-Assisted Aqueous Enzymatic Extraction of Pine Nut Oil and Its Oxidative Stability
BAO Yihong, GUO Yang
(School of Forestry, Northeast Forestry University, Harbin 150040, China)
The ultrasound-assisted aqueous enzymatic extraction of pine nut oil from Korean pine (Pinus koraiensis) nuts subjected to ultrasonic pretreatment was optimized using one-factor-at-a-time method and response surface methodology. Meanwhile the effects of temperature and light on the oxidative stability of pine nut oil were also analyzed. The optimal extraction conditions were obtained as follows: ultrasonic pretreatment at an intensity of 0.28 W/cm2for 40 min at 50 ℃, followed by 4.08 h of hydrolysis using 1 427 U/g of alcalase with a substrate to water ratio of 1:5 (g/mL) at 44 ℃. Under these conditions, the yield of pine nut oil reached 73.01%. Both temperature and light significantly influenced the oxidative stability of pine nut oil. Storage at 3 ℃ without light could markedly improve the stability of pine nut oil.
ultrasonic; aqueous enzymatic method; response surface methodology; pine nut oil
10.7506/spkx1002-6630-201622009
TS224.4
A
1002-6630(2016)22-0060-09
包怡红, 郭阳. 响应面试验优化超声波辅助水酶法提取松籽油工艺及其氧化稳定性[J]. 食品科学, 2016, 37(22): 60-68. DOI:10.7506/spkx1002-6630-201622009. http://www.spkx.net.cn
BAO Yihong, GUO Yang. Optimization of ultrasonic-assisted aqueous enzymatic extraction of pine nut oil and its oxidative stability[J]. Food Science, 2016, 37(22): 60-68. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201622009. http://www.spkx.net.cn
2016-04-07
中央高校基本科研业务费专项(2572014EA02);哈尔滨市科技创新人才项目(2015RAXXJ010)
包怡红(1970—),女,教授,博士,研究方向为食品生物技术与功能食品。E-mail:baoyihong@163.com
