响应面试验优化复凝聚法制备槲皮素微胶囊工艺及其理化性质
2016-12-06杨小兰王丽颖
廖 霞,杨小兰,李 瑶,王丽颖,明 建,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
响应面试验优化复凝聚法制备槲皮素微胶囊工艺及其理化性质
廖 霞1,杨小兰1,李 瑶1,王丽颖1,明 建1,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
以槲皮素为芯材,壳聚糖、海藻酸钠为壁材,采用复凝聚法制备槲皮素微胶囊。以包埋率和载药量为综合评价指标,通过单因素试验和响应面试验分析各因素,并对槲皮素微胶囊的理化性质进行研究。结果表明:壁材比(壳聚糖-海藻酸钠质量比)1∶3.34(g/g)、芯壁比4.34∶1(g/g)、京尼平用量18.44 g/100 g壳聚糖、固化温度41.56 ℃时,包埋率为69.53%。制备的槲皮素微胶囊水分含量为3.26%,休止角为40.39°,溶解度为256.44 μg/mL,粒径大小较为均匀,平均粒径为1 362 nm,具有较好的溶解性和稳定性。
槲皮素;复凝聚法;微胶囊;理化性质
槲皮素是一类天然的黄酮类化合物[1],广泛存在于食用植物,具有抗氧化[2]、抗肿瘤[3]、抗炎[4]、抗糖尿病[5]等多种生物活性,近年来颇受国内外学者重视。由于槲皮素亲水性、亲脂性较差[6],在酸性和中性条件下易被氧化,对光、热和氧气敏感,生物利用率低,限制了其在食品工业中的应用。为此,国内外大量的研究者对槲皮素的研究方向主要是对槲皮素的结构进行修饰、改性、合成槲皮素衍生物,改善槲皮素的生物活性及溶解性,并采用亲水性物质对槲皮素进行包埋从而提高其水溶性。微胶囊包埋可减少功能因子在加工或贮藏过程中的
损失,保护其免受肠道不利环境的影响,使芯材对靶细胞具有较好的靶向性[7],提高功能因子的生物利用度。壳聚糖-海藻酸钠微胶囊在食品中主要用于包埋营养物质、固化酶类制剂,在微胶囊缓释、控制功能因子释放方面应用广泛。
复凝聚法是采用带有相反电荷的聚电解质作为壁材,将芯材分散在壁材溶液中,通过调节溶液pH值、温度、质量浓度或加入无机盐电解质等,使电解质发生静电作用,使得壁材溶解度降低,发生凝聚以形成微胶囊将芯材包覆[8]。其凝聚过程温和,适于对芯材为非水溶性的固体粉末或液体的包埋,尤其对一些不稳定的物质,如多酚类物质,复凝聚包埋效率较高。由于有良好的控释特性[9],复凝聚包埋技术广泛应用于食品成分微胶囊化、提高食品功能成分稳定性[10]。海藻酸钠和壳聚糖是无毒、生物相容性高、具有生物降解性、可再生性的天然多糖[11],由于二者复合物具有聚电解质的性质,被广泛应用于微胶囊制备[12],两种壁材通过静电作用力形成囊壁结构,同时,氢键、范德华力、疏水相互作用、其他非共价键等作用力也对囊壁结构的稳定性具有辅助作用[13]。京尼平是近几年研究比较热的一种交联剂,以共价键的形式对壳聚糖、明胶、蛋白质、胶原等富含自由氨基的聚合物进行交联[14],其交联壳聚糖等含氨基基团的化合物交联的机理还不是很明确,其中,最为成熟的机理是pH值依赖型机理,在不同的pH值条件下,京尼平与壳聚糖等的交联机理不同[15-16]。本研究以壳聚糖、海藻酸钠为复合壁材,采用复凝聚法对槲皮素进行微胶囊化包埋,进行制备工艺优化和理化性质分析,进而评价其溶解性和稳定性。
1 材料与方法
1.1 材料与试剂
槲皮素、京尼平 西安小草植物科技有限责任公司;壳聚糖(食品级) 济南海得贝海洋生物工程有限公司;海藻酸钠(食品级) 青岛明月海藻有限公司;水溶性VE聚乙二醇琥珀酸酯(vitamin E polyethylene glycol succinate,TPGS) 杭州天诚药业有限公司;其他化学试剂(均为分析纯) 成都科龙化工试剂公司。
1.2 仪器与设备
XHF-D均质机 宁波新芝生物科技股份有限公司;HH-6数显恒温水浴锅 金坛市富华仪器有限公司;1-15PK离心机 美国Sigma公司;UV-2450紫外分光光度计 日本岛津公司;DHG-9140A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;85-2数显恒温磁力搅拌器 金坛市易晨仪器制造有限公司;5810台式高速离心机 德国Eppendorf公司;RE-5296旋转蒸发器上海亚荣生化仪器厂;LGJ-10真空冷冻干燥 北京松原华兴科技发展有限公司;Nano-ZS90纳米粒度及Zeta电位分析仪 英国Malvern仪器有限公司;DSC400差示扫描量热(differential scanning calorimetry,DSC)仪 美国PerkinElmer公司。
1.3 方法
1.3.1 槲皮素微胶囊的制备
工艺流程:壳聚糖+乳化剂→搅拌混合→加入槲皮素→高速剪切乳化→加入海藻酸钠→充分反应→加入固化剂→固化→冷冻干燥→产品。
称取0.2 g TPGS于烧杯中,置于50 ℃的水浴锅中熔融成可以流动的状态,加入10 g质量分数1%的壳聚糖溶液,混匀,加入一定量槲皮素,高速(10 000 r/min)剪切乳化50 s。将乳剂和30 g质量分数1%的海藻酸钠溶液,同时滴加到25 mL 10 ℃的蒸馏水中,充分反应(800 r/min)30 min。升温至20 ℃,缓慢加入20 mL京尼平溶液(含20 mg京尼平),固化30 min。调节溶液pH 6.0,继续反应30 min。升温至50 ℃,继续固化反应60 min。降温至20 ℃,静置,沉降,抽滤,用蒸馏水多次洗涤,真空冷冻干燥得到槲皮素微胶囊样品。
1.3.2 槲皮素微胶囊的效果评定
1.3.2.1 槲皮素标准曲线制作[17]
精确称取10 mg槲皮素标准品,于100 mL容量瓶中用无水乙醇溶解,稀释适当倍数,以无水乙醇为空白,在200~600 nm波长范围扫描,确定最大吸收波长在373 nm处。精确量取一定量槲皮素标准液,用无水乙醇稀释为质量浓度分别为2、4、6、8、10 μg/mL的标准溶液,于373 nm波长处测定吸光度,并以吸光度为纵坐标(Y)、槲皮素标准溶液质量浓度为横坐标(X),得到标准曲线为y=0.096 4x+0.001 4,R2=0.999 8(n=5)。
1.3.2.2 槲皮素含量测定
精确称取20 mg槲皮素微胶囊样品,置于棕色容量瓶中,加入少量无水乙醇,超声提取15 min,使得其微胶囊结构被破坏,用无水乙醇定容至50 mL,过滤,准确量取1 mL上清液,置于棕色容量瓶中,用无水乙醇定容至50 mL,于373 nm波长处测定吸光度。
1.3.2.3 包埋率计算

1.3.2.4 载药量计算

1.3.3 槲皮素微胶囊制备工艺优化
1.3.3.1 单因素试验
对乳化剂(Span 80、Tween 80、PEG 400、
TPGS)、乳化剂加入量(2、3、4、5 g/g壳聚糖)、壁材质量分数(0.5%、1.0%、1.5%)、壁材(壳聚糖-海藻酸钠)比(2∶1、1∶1、1∶2、1∶3、1∶4(g/g))、芯壁比(5∶1、4∶1、3∶1、2∶1、1∶1、1∶2、1∶3(g/g))、pH值(3.0、4.0、5.0、6.0)、京尼平用量(5、10、15、20、25 g/100 g壳聚糖)、固化温度(10、20、30、40、50 ℃)进行单因素试验。
1.3.3.2 响应面试验
在单因素试验基础上,选取对槲皮素微胶囊包埋率和载药量影响较大的4 个因素壁材比、芯壁比、京尼平用量、固化温度为自变量,以包埋率为响应值,采用Design-Expert 8.0.6分析软件设计响应面组合,对制备工艺进行优化。因素与水平设计见表1。

表1 响应面试验因素与水平Table1 The coded levels and corresponding actual levels of the factors investigated in response surface analysis
1.3.4 槲皮素微胶囊理化性质的测定
1.3.4.1 含水量测定
参照GB 5009.3—2010《食品中水分的测定》[18]直接干燥法测定。
1.3.4.2 流动性测定
粉体的流动性常用休止角来表示,参照GB 11986—1989《表面活性剂:粉体和颗粒休止角的测定》[19]固定圆锥底法。
1.3.4.3 溶解度测定
称取适量槲皮素微胶囊样品置于质量分数2%的TPGS溶液,在室温条件下搅拌3 d,8 000 r/min离心30 min,上清液经过0.45 μm微孔滤膜,滤液于45 ℃旋转蒸发至蒸干,然后用少量乙醇溶解,并稀释适当倍数,于373 nm波长处测定吸光度,根据标准曲线计算出槲皮素的溶解量,实验做3 次平行。
1.3.4.4 Zeta电位测定
称取一定量槲皮素微胶囊样品,配制成质量分数0.01%的溶液,室温条件下分别调至不同pH值,每次测定吸取1 mL样液,采用Zeta电位分析仪,于25 ℃测定不同pH值条件下的Zeta电位。
1.3.4.5 粒度测定
称取一定量槲皮素微胶囊样品,均匀分散在蒸馏水中,配制成0.01 g/L左右溶液,用磁力搅拌器搅拌分散均匀,静置,用注射器吸取1 mL微胶囊分散液,置于纳米粒度分析仪中测定粒度。
1.3.4.6 DSC分析
称取3.0 mg槲皮素微胶囊样品加到DSC铝盒中,以空白铝盒为对照,以10 ℃/min 的速率从25 ℃加热至400 ℃,在氮气的保护下,采用DSC仪记录加热过程中的图谱。
2 结果与分析
2.1 单因素试验结果
2.1.1 乳化剂种类对槲皮素微胶囊的影响

图1 槲皮素在不同乳化剂中的显微形态(400×)Fig.1 Morphology of quercetin emulsified with different emulsifiers (400 ×)
由图1可知,1% PEG 400、1% Tween 80、1% TPGS为均匀的分散乳液,槲皮素乳剂易过滤,澄清透明,稳定,没有出现分层。1% TPGS槲皮素乳剂为溶液状,在1% TPGS条件下乳剂颜色最深,槲皮素相对质量浓度最大;1% Span 80条件下槲皮素乳剂为乳黄色半透明混悬液,呈现圆球状,液滴不均匀,槲皮素乳剂粒径较大,不易过滤,放置一段时间(24 h)会出现分层,稳定性差。乳剂特性与表面活性剂亲水亲油平衡值相关,考虑到溶解性等综合因素,后续试验选用TPGS作为表面活性剂。
2.1.2 TPGS加入量对槲皮素微胶囊的影响
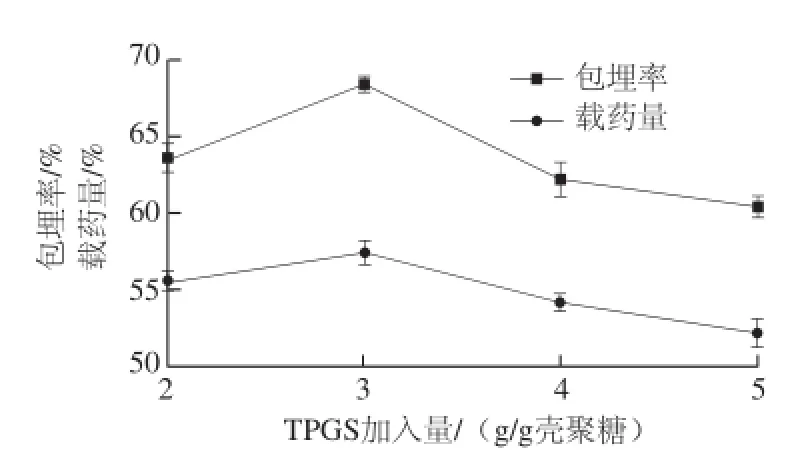
图2 TPGS加入量对微胶囊包埋效果的影响Fig.2 Effects of TPGS addition on the embedding efficiency and yield of quercetin microcapsules
如图2所示,乳化剂加入量增加,包埋率和载药量相应增加,TPGS加入量为3 g/g壳聚糖溶液时,包埋效果最好。当TPGS加入量超过3 g/g壳聚糖溶液时,包埋率和载药量则呈现下降趋势。可能的原因是TPGS室温条件下在水中溶解度为20%(质量分数),超过此质量分数将形成高黏度的液晶相。随着TPGS在水中质量分数的增加,液晶相结构逐渐变化,从各向同性的球状胶束到圆筒状胶束、正反六角形胶束、反球状胶束变化,最后形成薄层片状液晶态[20],在一定程度上将影响槲皮素的乳化性和溶解性。为此,后续试验确定TPGS加入量为3 g/g壳聚糖溶液。
2.1.3 壁材质量分数对槲皮素微胶囊的影响
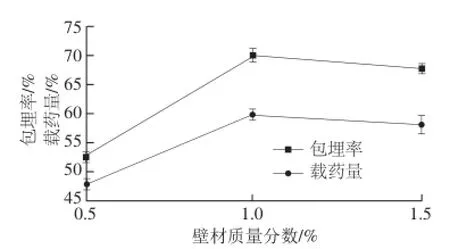
图3 壁材质量分数对微胶囊包埋效果的影响Fig.3 Effect of wall material concentration on the embedding efficiency and yield of quercetin microcapsules
由图3可知,当壁材质量分数为0.5%时,包埋率和载药量都较低,对槲皮素的包埋效果较差;当壁材质量分数为1.0%时,包埋率和载药量都达到最高值。当壁材质量分数为1.5%时,包埋率和载药量都有所下降。而壁材质量分数过低时,壁材对槲皮素包覆不完全,形成的微胶囊囊壁厚度不均匀,稳定性差,容易破裂,使芯材渗漏;随着壁材质量分数的增加,其黏度增大,流动性也相应变差,微胶囊容易聚集成团,黏连较严重,不利于形成均一稳定的槲皮素微胶囊。根据包埋率和载药率的综合评价,壁材质量分数为1%时,包埋效果最好。
2.1.4 壁材比对槲皮素微胶囊的影响
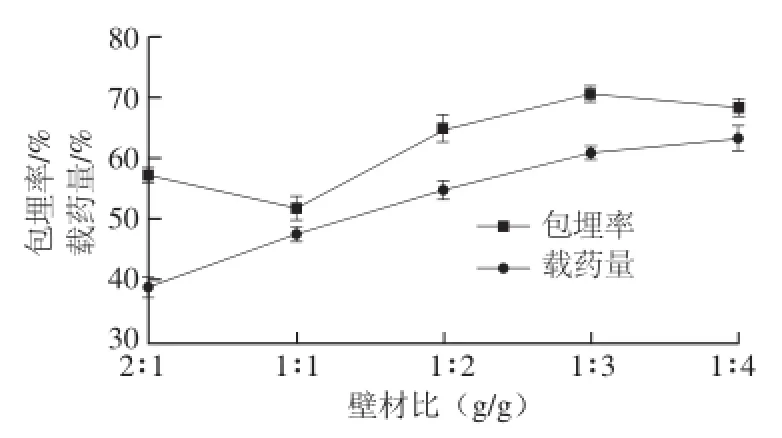
图4 壁材比对微胶囊包埋效果的影响Fig.4 Effect of wall material ALG/CS ration on the embedding efficiency and yield of quercetin microcapsules
由图4可知,壁材比在1∶1~1∶3区间,随着壁材海藻酸钠比例增加,包埋率呈现增加趋势;壁材比为1∶3时,槲皮素的包埋率达到最高值;而1∶3后,包埋率则呈现下降趋势。载药量随着壁材中海藻酸钠比例的增大一直呈现上升趋势,当壳聚糖-海藻酸钠质量比在1∶3之后,载药量增加趋势趋于平缓。为此优化试验壁材选用壳聚糖与海藻酸钠最佳质量比为1∶3。
2.1.5 芯壁比对槲皮素微胶囊的影响
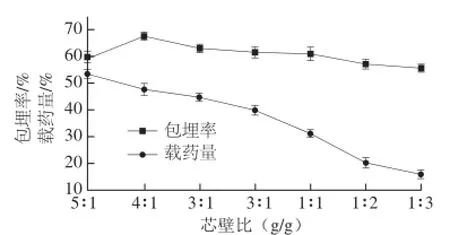
图5 芯壁比对微胶囊包埋效果的影响Fig.5 Effect of core/wall material ratio on the embedding efficiency and yield of quercetin microcapsules
由图5可知,芯壁比在4∶1~1∶1区间,包埋率较高,随着体系芯材比例提高,包埋率和载药量逐渐提高,因为随芯材比例的增加,单位质量的壁材包埋芯材的量也逐渐增加。当芯壁比为4∶1时,包埋率达到最高。但随着芯材比例不断增大,单位质量的壁材包埋芯材的量也逐渐增加,会导致凝聚在芯材液滴周围的壁材复合物含量减少[21],使得微胶囊的囊壁越来越薄,难以形成完整的囊壁而呈现裂缝,未包埋芯材易渗透出来[22],微囊粒相互黏连严重。当壁材含量升高时,包埋率和载药量都相应的降低。当壁材含量过高时,微胶囊壁材所带的正负电荷相互吸引,容易发生聚集,不利于微胶囊的形成。综合考虑后续试验确定芯壁比为4∶1。
2.1.6 pH值对槲皮素微胶囊的影响
当体系的pH值为3.0时,微胶囊粒径均一,囊粒之间不黏连,包埋效果好,与吴春等[23]的研究结果相似;当pH值为4.0、5.0、6.0时,微胶囊囊粒黏连非常严重,聚
集成团,因此包埋率和载药量的计算值不准确。为此,确定制备槲皮素微胶囊的pH 3.0为最佳值,其微胶囊包埋率和载药量分别为68.34%和56.50%。
2.1.7 京尼平用量对槲皮素微胶囊的影响
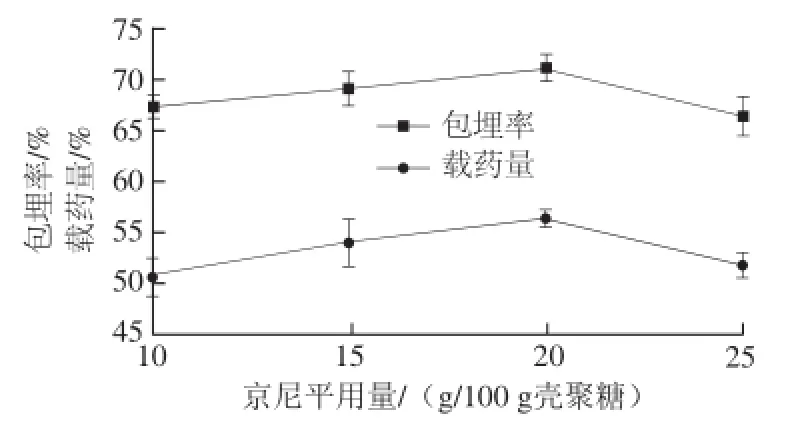
图6 京尼平用量对微胶囊包埋效果的影响Fig.6 Effect of cross-linker (genipin) concentration on the embedding efficiency and yield of quercetin microcapsules
由图6可知,当京尼平用量为20 g/100 g壳聚糖时,包埋率和载药量都达到最大值。当京尼平用量较小时,京尼平与壁材中的壳聚糖结合量少,微胶囊因交联不充分而发生变形,囊粒间出现黏连,包埋率和载药量较低。当京尼平用量低于20 g/100 g壳聚糖时,随着京尼平用量增加,交联剂与壳聚糖的氨基结合数量增加,包埋率和载药量也相应增加。当京尼平用量高于20 g/100 g壳聚糖,壳聚糖与京尼平交联度过高,囊粒也会出现严重的黏连,甚至析出京尼平。过量的京尼平在与壳聚糖分子上的氨基反应的同时,京尼平还能自发的与官能团氨基发生反应,发生自聚反应,生成一种蓝色素,导致包埋率和载药量下降。最后确定固化剂的最佳用量为20 g/100 g壳聚糖。
2.1.8 固化温度对槲皮素微胶囊的影响
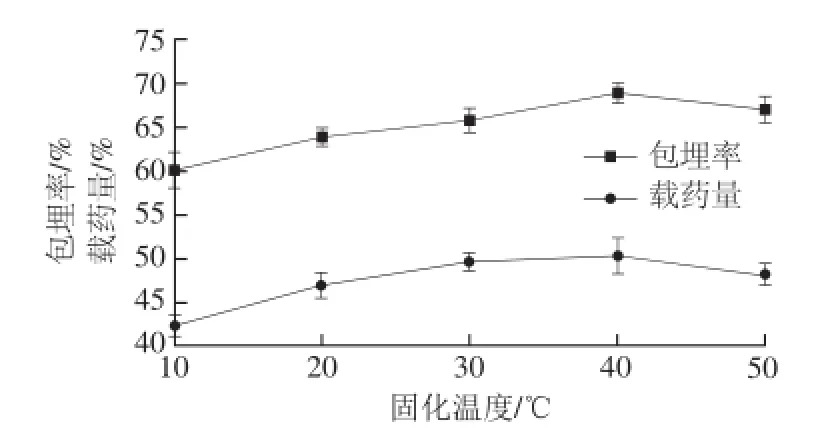
图7 固化温度对微胶囊包埋效果的影响Fig.7 Effect of cross-linking temperature on the embedding efficiency and yield of quercetin microcapsules
由图7可知,当京尼平的固化温度为40 ℃时,包埋率和载药量最高。体系温度的升高,一方面可以提高京尼平在水中的溶解性。另外,分子运动速率会随着温度的升高而加剧,促进交联反应的发生,提高微胶囊的包埋率和载药量。但京尼平在高温条件下稳定性差,超过55 ℃,京尼平会发生分解。当体系交联温度为50 ℃时,京尼平稳定性降低,所以交联温度升高,微胶囊的包埋率和载药量下降。因此,确定京尼平的固化温度为40 ℃,这个反应温度值与Peng Chao等[24]的研究结果相吻合。
2.2 响应面试验结果
2.2.1 响应面试验设计与结果
基于单因素试验结果,响应面试验确定TPGS作为乳化剂、TPGS加入量3 g/g壳聚糖、pH 3.0。根据Box-Behnken设计原理,对影响槲皮素微胶囊包埋率的壁材比、芯壁比、京尼平用量、固化温度进行响应面优化,试验设计与结果见表2。
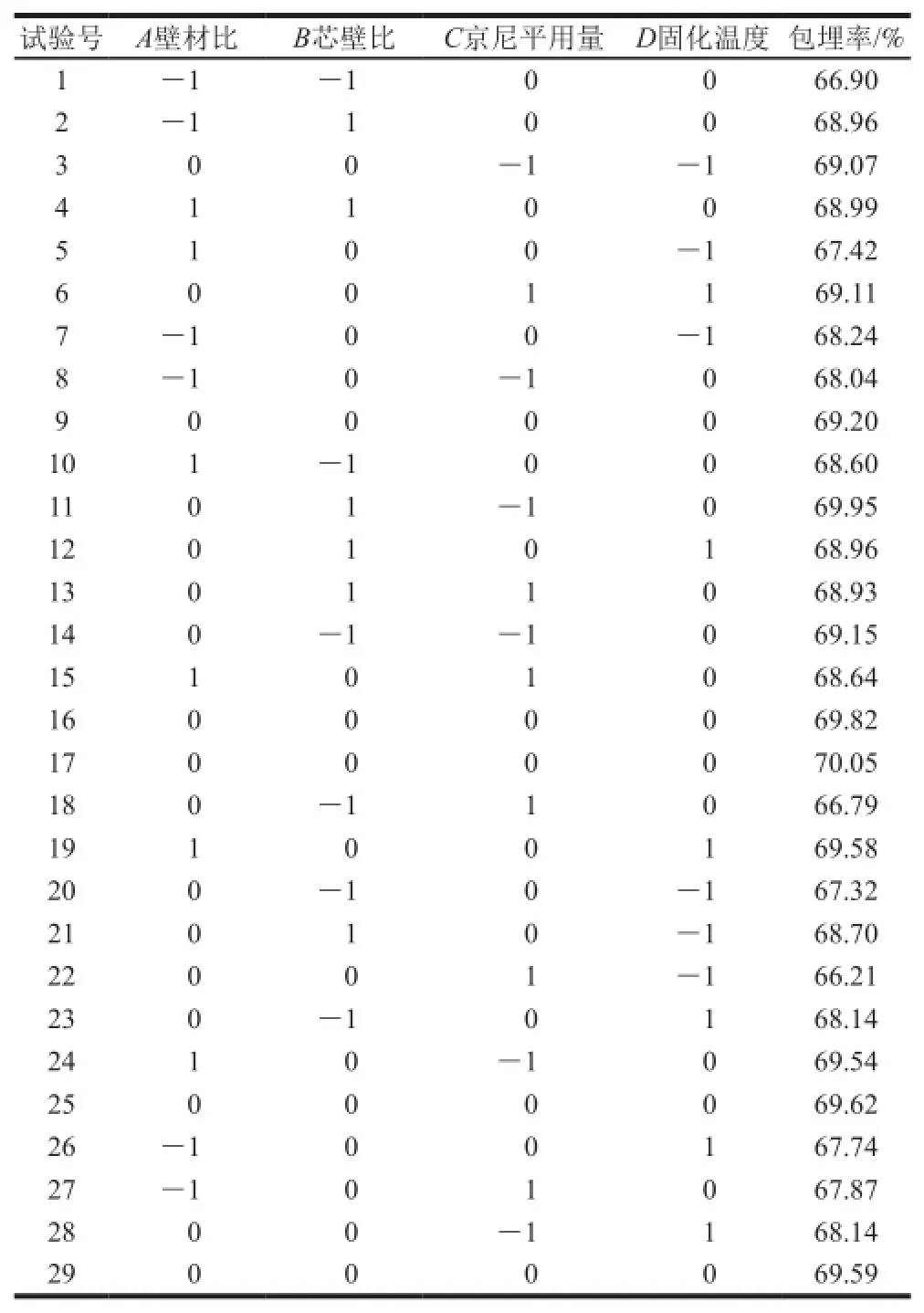
表2 槲皮素微胶囊响应面试验设计与结果Table2 The experimental design and results for response surface analysis
采用Design-Expert 8.0.6对试验数据进行二次完全回归分析,得到4 个因素与包埋率的回归方程:Y/%=69.66+0.42A+0.63B-0.53C+0.39D-0.42AB-0.18AC+0.67AD+0.34BC-0.14BD+0.96CD-0.64A2-0.53B2-0.52C2-0.87D2。
由表3可知,用回归方程描述的方程的全体自变量与响应值之间的线性关系显著,回归模型达到显著水平(P<0.01),R2=0.940 5,失拟项不显著,纯误差值小,说明该模型与试验中的实际情况拟合较好,试验误差小。方差分析还表明,一次项和二次项中各因素对包埋率都有较显著影响,交互项CD高度显著。结果显示,
一次项中影响槲皮素微胶囊包埋率的各因素按大小排序依次为:B(芯壁比)>C(京尼平用量)>A(壁材比)>D(固化温度)。
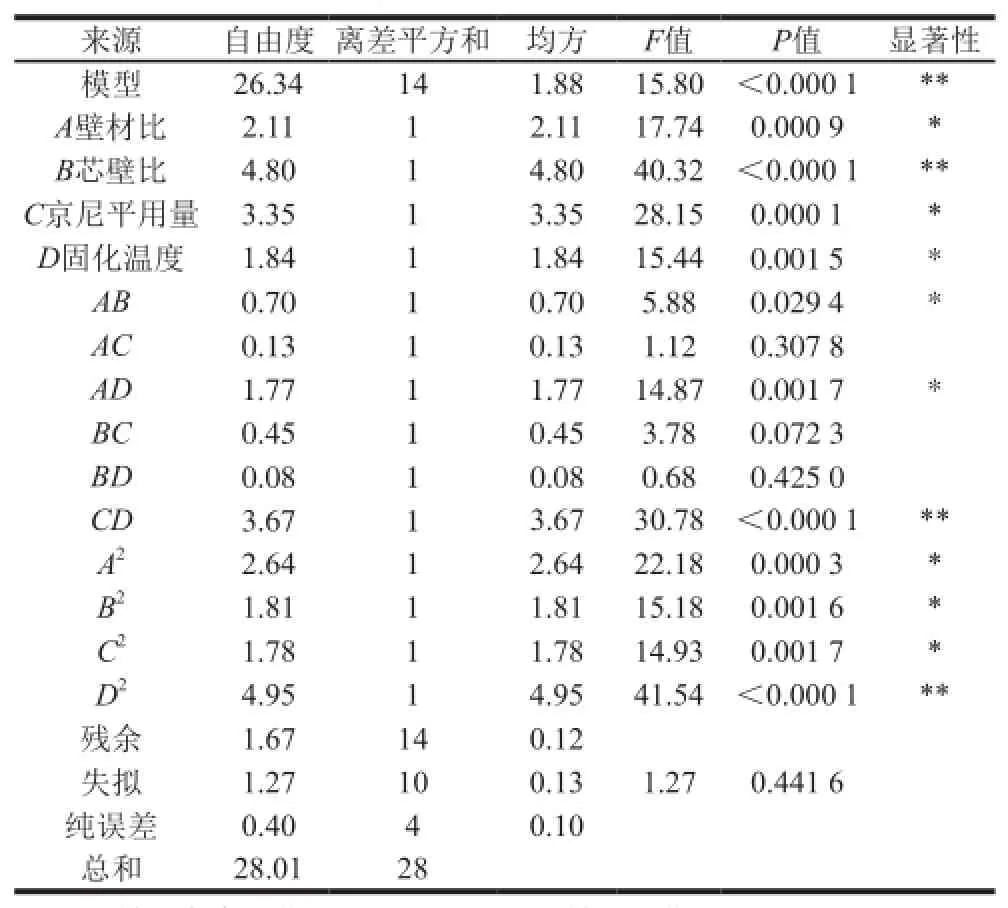
表3 响应面模型的方差分析Table3 Analysis of variance and significance test of the response surface quadratic regression model
2.2.2 响应面及等高线分析
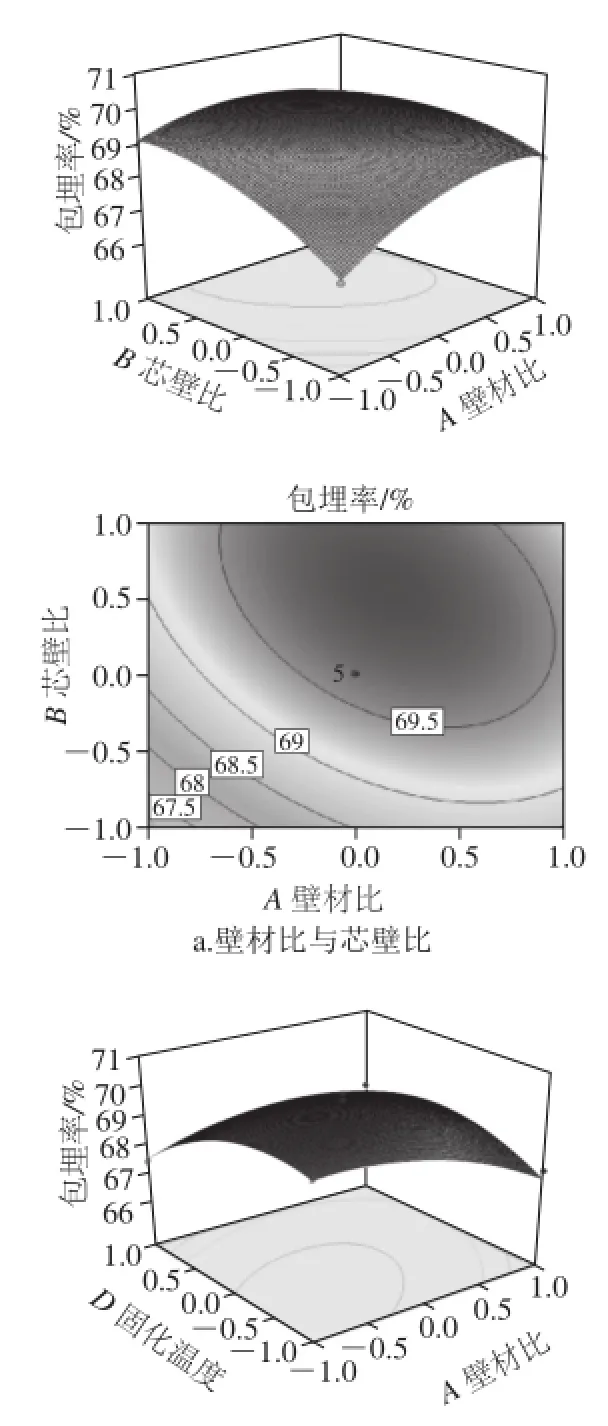
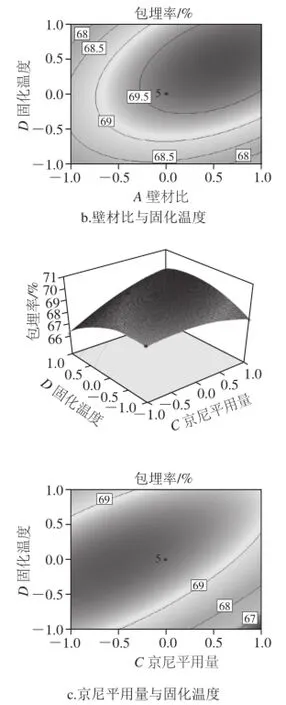
图8 因素交互作用对包埋率影响的响应面和等高线图Fig.8 Response surface and corresponding contour plots showing the effects of preparation conditions on the embedding efficiency of quercetin microcapsules
从图8可以看出,C(京尼平用量)与D(固化温度)交互作用显著,等高线图最扁平,说明这两个因素之间的交互作用最大;A(壁材比)与D(固化温度)的交互作用较显著,表现为曲线较陡;A(壁材比)与B(芯壁比)交互作用最小。而其他因素之间的交互作用不显著,曲面图较平滑。响应面结果与响应面方差分析结果相同。
2.2.3 验证实验
结合回归方程和响应曲面图可以得到复凝聚法制备槲皮素微胶囊的最佳工艺参数为壁材比1∶3.34、芯壁比4.34∶1、京尼平用量18.44 g/100 g壳聚糖、固化温度41.56 ℃,此工艺条件下,理论最高包埋率为69.95%。根据最优方案进行验证实验,得到槲皮素的最高包埋率为69.53%,与理论值接近,表明响应面法优化得到的方案可靠。
2.3 槲皮素微胶囊的理化特性
2.3.1 槲皮素微胶囊的含水量、流动性和溶解度
槲皮素微胶囊水分含量为3.26%,此条件有利于微胶
囊产品保存。粉体产品的休止角越小,摩擦力越小,流动性也越好,测定槲皮素微胶囊粉末的休止角为40.39°,说明产品的流动性较好。未包埋之前,槲皮素几乎不溶于水,在水中的溶解度仅有5.48 μg/mL,包埋后溶解度为256.44 μg/mL,提高了近50 倍。溶解度的提高与制备中使用了TPGS乳化剂有关,此外微胶囊壁材采用水溶性壳聚糖和海藻酸钠,对槲皮素的溶解度有促进作用。
2.3.2 槲皮素微胶囊的Zeta电位及粒径分布分析
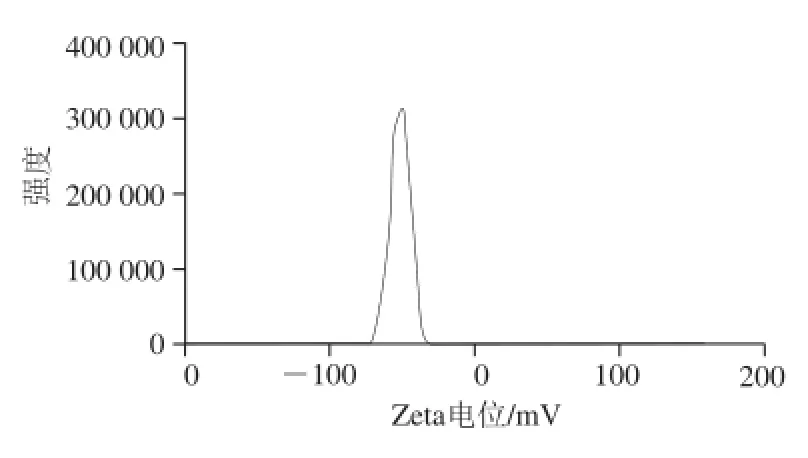
图9 槲皮素微胶囊的Zeta电位分布图Fig.9 Zeta potential distribution of quercetin microcapsules
图9中槲皮素微胶囊的Zeta电位为-51.3 mV。体系Zeta电位绝对值大于30 mV时,粒子之间能达到稳定状态[25]。本体系Zeta电位绝对值足够大,微胶囊稳定性较好。由图10可知,槲皮素微囊平均粒径为1 362 nm,多分散系数为0.204,粒径呈正态分布且区域狭窄,说明槲皮素胶粒均匀。
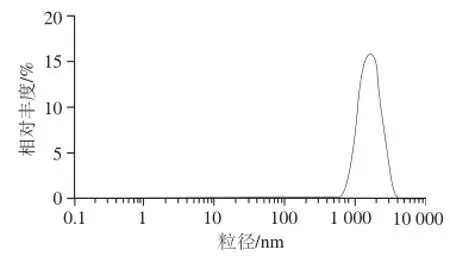
图10 槲皮素微胶囊的粒径分布图Fig.10 Particle size distribution of quercetin microcapsules
2.3.3 槲皮素微胶囊的DSC分析
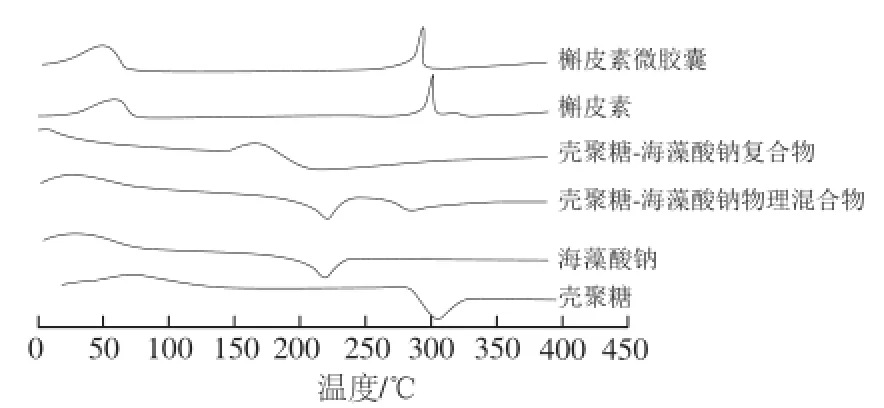
图11 槲皮素微胶囊及其单体成分的DSC图谱Fig.11 DSC curves of quercetin microcapsules and its individual components
由图11可知,所有的物质在25~100 ℃范围内,都出现了一个吸热峰,这是由于在升温的过程中,样品失水和结构变化导致的一个放热过程。壳聚糖-海藻酸钠复合物的吸热峰的温度与壳聚糖、海藻酸钠以及壳聚糖-海藻酸钠物理混合物相比要低,这可能是由于壳聚糖和海藻酸钠发生静电相互作用过程中发生能量变化引起的。壳聚糖、海藻酸钠的放热峰304.74、226.29 ℃。槲皮素和槲皮素微胶囊的DSC曲线趋势大致相同,二者在25~75 ℃范围内,由于水分丢失以及温度升高引起的槲皮素的结构变化而引起的一个吸热峰分别为314.81、305.28 ℃。说明,槲皮素与壳聚糖-海藻酸钠复合物之间的相互作用一定程度上导致了吸收热量的变化,影响了槲皮素的热稳定性。
3 结 论
本研究以壳聚糖、海藻酸钠复凝聚法制备槲皮素微胶囊,在单因素试验的基础上,采用响应面法对制备工艺优化,得到最佳工艺参数为TPGS为乳化剂、TPGS加入量3 g/g壳聚糖、壁材质量分数1.0%、壁材比(壳聚糖-海藻酸钠质量比)1∶3.34、芯壁比4.34∶1、pH 3.0、京尼平用量18.44 g/100 g壳聚糖、固化温度41.56 ℃,得到的包埋率为69.53%。所得槲皮素微胶囊具有较好的热稳定性、流动性和溶解性,冷冻干燥后易于保存。
[1] CATAURO M, BOLLINO F, PAPALE F, et al. Sol-gel synthesis and characterization of SiO2/PCL hybrid materials containing quercetin as new materials for antioxidant implants[J]. Materials Science and Engineering C, 2016, 58: 945-952. DOI:10.1016/j.msec.2015.09.054.
[2] HEO D J, SHON M S, KIM G N, et al. Effect of UV irradiation on the antioxidant and anti-adipogenic activities of quercetin[J]. Food Science and Biotechnology, 2015, 24(1): 341-345. DOI:10.1007/s10068-015-0045-8.
[3] CÍNTIA J K, FABRÍCIO F, FABRÍCIA D, et al. Quercetin derivative induces cell death in glioma cells by modulating NF-κB nuclear translocation and caspase-3 activation[J]. European Journal of Pharmaceutical Sciences, 2016, 84: 116-122. DOI:10.1016/ j.ejps.2016.01.019.
[4] GUAZELLI C F S, FATTORI V, COLOMBO B B, et al. Quercetinloaded microcapsules ameliorate experimental colitis in mice by antiinflammatory and antioxidant mechanisms[J]. Journal of Natural Products, 2013, 76(2): 200-208. DOI:10.1021/np300670w.
[5] BARDY G, VIRSOLVY A, QUIGNARD J F, et al. Quercetin induces insulin secretion by direct activation of L-type calcium channels in pancreatic beta cells[J]. British Journal of Pharmacology, 2013, 169(5): 1102-1113. DOI:10.1111/bph.12194.
[6] 彭游, 付小兰, 陶春元, 等. 槲皮素化学修饰与体内转运过程研究进展[J]. 天然产物研究与开发, 2012, 24(3): 398-405. DOI:10.3969/ j.issn.1001-6880.2012.03.028.
[7] ARMIN M, REBECCA N, NIGEL C T, et al. Microencapsulation as a novel delivery method for the potential antidiabetic drug, Probucol[J]. Drug Design, Development and Therapy, 2014, 8: 1221-1230. DOI:10.2147/DDDT.S67349.
[8] 杨小兰, 袁娅, 谭玉荣, 等. 纳米微胶囊技术在功能食品中的应用研究进展[J]. 食品科学, 2013, 34(21): 359-368. DOI:10.7506/spkx1002-6630-201321076.
[9] ASHAY J, DEEPIKA T, GARGI G, et al. Characterization of microcapsulated β-carotene formed by complex coacervation using casein and gum tragacanth[J]. International Journal of Biological Macromolecules, 2016, 87: 101-113. DOI:10.1016/ j.ijbiomac.2016.01.117.
[10] DONG Die, QI Zhengliang, HUA Yufei, et al. Microencapsulation of flaxseed oil by soya proteins-gum arabic complex coacervation[J]. International Journal Food Science Technology, 2015, 50(8): 1785-1791. DOI:10.1111/ijfs.12812.
[11] XIAO Congming, SUN Fei. Fabrication of distilled water-soluble chitosan/alginate functional multilayer composite microspheres[J]. Carbohydrate Polymers, 2013, 98(2): 1366-1370. DOI:10.1016/ j.carbpol.2013.07.068.
[12] HUANG Guoqing, CHENG Lingyun, XIAO Junxia, et al. Preparation and characterization of o-carboxymethyl chitosan-sodium alginate polyelectrolyte complexes[J]. Colloid and Polymer Science, 2015, 293(2): 401-407. DOI:10.1007/s00396-014-3432-4.
[13] SCHMITT C, SANCHEZ C, DESOBRY B S, et al. Structure and techno-functional properties of protein-polysaccharide complexes: a review[J]. Critical Reviews in Food Science and Nutrition, 1998, 38(8): 689-753. DOI:10.1080/10408699891274354.
[14] MUZZARELLI R A A. Genipin-crosslinked chitosan hydrogels as biomedical and pharmaceutical aids[J]. Carbohydrate Polymers, 2009, 77(1): 1-9. DOI:10.1016/j.carbpol.2009.01.016.
[15] MI F L, SHYU S S, PENG C K. Characterization of ring-opening polymerization of genipin and pH-dependent crosslinking reactions between chitosan and genipin[J]. Polymer Science. Part A: Polymer Chemistry, 2005, 43(10): 1985-2000. DOI:10.1002/pola.20669.
[16] BUTLER M F, NG Y F, PUDNEY P D A. Mechanism and kinetics of the crosslinking reaction between biopolymers containing primary amine groups and genipin[J]. Polymer Science. Part A: Polymer Chemistry, 2003, 41(24): 3941-3953. DOI:10.1002/pola.10960.
[17] 郭晨煜. 槲皮素纳米脂质载体制剂及其经皮给药的研究[D]. 青岛:山东大学, 2011. DOI:10.7666/d.y1936021.
[18] 卫生部. 食品中水分的测定: GB 5009.3—2010[S]. 北京: 中国标准出版社, 2010.
[19] 轻工业部日用化学工业科学研究所. 表面活性剂: 粉体和颗粒休止角的测定: GB 11986—1989[S]. 北京: 中国标准出版社, 1989.
[20] 于永新, 俞红凯, 王中彦. 聚乙二醇1000维生素E琥珀酸酯应用进展[J].沈阳医科大学学报, 2006, 23(6): 407-412. DOI:10.14066/j.cnki.cn21-1349/r.2006.06.018.
[21] HUANG Y Y, CHUNG T W, TZENG T W. Drug release from PLA/ PEG microparticulates[J]. International Journal of Pharmaceutics, 1977, 156: 9-15. DOI:10.1016/S0378-5173(97)00154-3.
[22] 曾治平. 叶黄素的微胶囊制备及其稳定性的研究[D]. 广州: 华南理工大学, 2010.
[23] 吴春, 孔琪, 李健, 等. 槲皮素微胶囊的稳定性及缓释性能研究[J]. 化学与黏合, 2006(1): 11-13. DOI:10.3969/ j.issn.1001-0017.2006.01.004.
[24] PENG Chao, ZHAO Suqing, ZHANG Jun, et al. Chemical composition, antimicrobial property and microencapsulation of Mustard (Sinapis alba) seed essential oil by complex coacervation[J]. Food Chemistry, 2014, 165: 560-568. DOI:10.1016/ j.foodchem.2014.05.126.
[25] 吕怡. 复合凝聚反应制备茉莉香精微/纳米胶囊及其机理研究[D].无锡: 江南大学, 2012.
Response Surface Optimization of Preparation of Microencapsulated Quercetin Using Complex Coacervation and Its Physicochemical Properties
LIAO Xia1, YANG Xiaolan1, LI Yao1, WANG Liying1, MING Jian1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Chongqing Special Food Programme and Technology Research Center, Chongqing 400715, China)
Quercetin microcapsules were prepared by complex coacervation using sodium alginate and chitosan as the wall materials and quercetin as the core material. Single factor experiments and response surface methodology were employed to optimize the preparation conditions based on embedding rate and drug loading. The physicochemical properties of quercetin microcapsules were investigated as well. Under the optimized conditions: sodium alginate/chitosan ratio, 3.34:1; core/wall material ratio, 4.34:1; genipin concentration, 18.44 g/100 g chitosan; and curing temperature, 41.56 ℃, the embedding rate could reach 69.53%. The moisture content, repose angle and solubility of the quercetin microcapsules was 3.26%, 40.39° and 256.44 μg/mL, respectively. The encapsulated quercetin had good solubility and stability.
quercetin; complex coacervation; microencapsulation; physicochemical properties
10.7506/spkx1002-6630-201622004
R151.2
A
1002-6630(2016)22-0020-08
廖霞, 杨小兰, 李瑶, 等. 响应面试验优化复凝聚法制备槲皮素微胶囊工艺及其理化性质[J]. 食品科学, 2016, 37(22): 20-27. DOI:10.7506/spkx1002-6630-201622004. http://www.spkx.net.cn
LIAO Xia, YANG Xiaolan, LI Yao, et al. Response surface optimization of preparation of microencapsulated quercetin using complex coacervation and its physicochemical properties[J]. Food Science, 2016, 37(22): 20-27. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201622004. http://www.spkx.net.cn
2016-04-06
国家自然科学基金面上项目(31471576);重庆市社会民生科技创新专项(cstc2015shmszx80019)
廖霞(1992—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:994671521@qq.com
*通信作者:明建(1972—),男,教授,博士,研究方向为食品化学与营养学。E-mail:mingjian1972@163.com
