响应面法优化β-环糊精提取葡萄叶白藜芦醇工艺
2016-12-06王周利袁亚宏刘宇璇岳田利
王周利,袁亚宏,刘宇璇,岳田利,蔡 瑞,崔 璐*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
响应面法优化β-环糊精提取葡萄叶白藜芦醇工艺
王周利,袁亚宏,刘宇璇,岳田利,蔡 瑞,崔 璐*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
研究水、50%甲醇溶液和β-环糊精溶液对葡萄叶中多酚和白藜芦醇提取效果的影响,并采用分子对接方法分析β-环糊精与白藜芦醇之间的相互作用。结果表明:50%甲醇溶液提取所得多酚的提取量最大,而β-环糊精所得白藜芦醇的提取量最大;β-环糊精的疏水性空腔可以容纳白藜芦醇分子,并通过氢键的形成维持复合物的稳定。通过单因素和响应面优化试验对β-环糊精提取葡萄叶中白藜芦醇的工艺参数进行分析和优化,结果表明,3 个因素对白藜芦醇提取量的影响主次顺序为提取温度>β-环糊精质量浓度>处理时间;白藜芦醇的最佳提取条件为β-环糊精质量浓度28 g/L、提取温度50 ℃、处理时间68 min,在此条件下,白藜芦醇提取量为152.2 μg/g。
葡萄叶;白藜芦醇;β-环糊精;分子对接;提取
白藜芦醇又称芪三酚,其结构如图1所示,是一种天然的二苯乙烯类多酚物质,主要存在于虎杖、藜芦、葡萄、花生、桑葚等植物中[1-2]。研究表明白藜芦醇具有抗氧化、抗衰老、抗肿瘤、抗菌消炎、预防心血管疾病和保护肝脏等生理药理活性,因此在食品、药品和化妆品等领域应用前景十分广阔[3-6]。目前,白藜芦醇的制备主要是以虎杖、葡萄、花生等为基础原料,采用甲醇、乙醇、乙酸乙酯、丙酮等有机溶剂提取获得[7-9]。由于这些植物资源的日益匮乏和有机溶剂本身的危害性,其挥发和排放不但会污染环境,还会对人体产生一定的危害,
寻求获得新的植物来源并探究白藜芦醇提取新方法是食品工业中研究的热点之一。
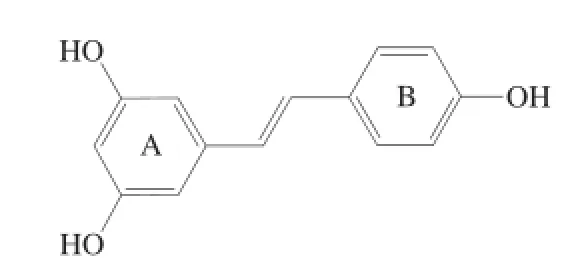
图1 白藜芦醇的二维分子结构Fig.1 2D Molecular structure of resveratrol
我国是全球第二大葡萄种植区,每年秋季丢弃的葡萄叶数量可观,而葡萄叶中含有丰富的白藜芦醇[10-11]。研究和开发葡萄叶中白藜芦醇提取新技术,不但可以实现葡萄叶废弃物的再利用,减少环境压力,还可以扩大白藜芦醇的植物来源,因此具有重大意义。β-环糊精作为一种环状低聚糖,其特殊的环状中空圆筒型结构可以对一些生物活性物质进行包合,如挥发油和多酚类化合物等,从而增加这些物质的稳定性、溶解度和生物利用率[12-14]。早在1998年β-环糊精即被美国食品和药品管理局列入“一般公认安全”名单,目前已广泛地应用于食品工业中[15]。近年来,采用β-环糊精提取中药活性成分的研究逐渐增多,也有学者在多酚类物质提取方面开展了积极的尝试,并取得了较理想的结果[16-19]。与有机溶剂提取相比,β-环糊精提取法以水作为溶剂,因此更安全、经济和环保。β-环糊精在生物活性物质制备方面的优势为白藜芦醇的提取提供了思路。
本研究首先对不同溶剂(水、50%甲醇溶液和β-环糊精溶液)对葡萄叶中白藜芦醇的提取效率进行评价,并采用分子对接方法对β-环糊精与白藜芦醇之间的相互作用进行分析;其次,通过单因素试验(β-环糊精质量浓度、提取温度和处理时间)和响应面优化试验对β-环糊精提取葡萄叶中白藜芦醇的工艺参数进行优化,旨在为白藜芦醇的资源开发和葡萄废弃物的综合利用提供指导。
1 材料与方法
1.1 材料与试剂
户太八号葡萄叶,2015年10月采自西安市户县葡萄园。白藜芦醇(纯度≥99%) 美国Sigma公司;β-环糊精(≥98%) 上海阿拉丁生化科技股份有限公司;乙腈(色谱纯) 美国Tedia公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
LC-20A型高效液相色谱(high performance liquid chromatography,HPLC)仪(包括LC-20AD高压泵、SPD-M20A型二极管阵列检测器、SIL-20A型自动进样器、CBM-20A型系统控制器、CTO-10AS型柱温箱、LC solution工作站) 日本岛津公司;Milli-Q超纯水仪 美国Millipore公司;QJ3-W1000A高速万能粉碎机天津泰斯特仪器有限公司;KQ-700GVDV双频恒温数控超声波清洗器 昆山市超声仪器有限公司;RE-5205旋转蒸发仪 上海亚荣生化仪器厂;MCFD冷冻干燥机美国SIM公司;HC-3018R型高速冷冻离心机 安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 多酚物质的提取
将葡萄叶于恒温干燥箱中50 ℃干燥12 h,粉碎后过80 目筛。准确称取葡萄叶粉末1.0 g置于50 mL具塞三角瓶中,分别加入水、体积分数50%甲醇溶液和15 g/L β-环糊精溶液各20 mL,在功率300 W、温度40 ℃条件下,超声提取40 min后,于10 000×g、4 ℃条件下离心2 min。50%甲醇溶液提取上清液40 ℃旋转蒸干,残渣溶于20 mL甲醇;水和β-环糊精提取上清液进行冷冻干燥,取20 mL甲醇用于沉淀β-环糊精[20],同时溶解多酚物质,对所得甲醇溶液进行总酚含量测定和HPLC分析。
1.3.2 总酚含量的测定
采用福林-酚法测定总酚含量[21]。取0.5 mL样品,分别加入0.5 mL Folin-Ciocalteau试剂、2 mL 7.5% Na2CO3溶液和2 mL蒸馏水,摇匀,35 ℃水浴中反应90 min后,在波长765 nm处测定吸光度。配制没食子酸的质量浓度分别为0、2、4、8、16、32、64、100 μg/mL,以没食子酸质量浓度为横坐标,吸光度为纵坐标,制作标准曲线,所得回归方程为:y=0.011 5x+0.030 5(R2=0.998 9)。
1.3.3 HPLC分析
采用HPLC法分析样品中的白藜芦醇。色谱柱:Waters C18柱(250 mm×4.6 mm,5 μm);流动相:A为乙腈,B为0.2%乙酸溶液;等度洗脱程序为20% A洗脱30 min;进样体积20 μL;柱温40 ℃;流速1.0 mL/min;二极管阵列检测器波长306 nm。
配制不同质量浓度的白藜芦醇(0.5、1、2、4、6、8 μg/mL和10 μg/mL),以白藜芦醇质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得到回归方程:y=198 419x+5 667(R2=0.997 2)。
1.3.4 分子对接
从PubChem数据库获得β-环糊精和白藜芦醇的分子模型,并在UCSF Chimera程序中分别添加AMBER14SB力场和AM1-BCC电荷,进行几何优化,优化后结构用于对接计算。对接参数为:对接盒子大小为34×40×26,对接中心坐标为(7.894,12.159,11.776),搜索步长为0.375 Å,其余采用程序默认设置,采用拉马克遗传算法进行100 个构象运算。对结果进行聚类分析,均方根偏差为2.0 Å,β-环糊精与白藜芦醇对接结果用PyMOL显示。
1.3.5 β-环糊精提取葡萄叶中白藜芦醇工艺优化
1.3.5.1 单因素试验
将β-环糊精提取葡萄叶中白藜芦醇的初始工艺参数设定为:β-环糊精质量浓度15 g/L、提取温度40 ℃、处理时间60 min,并固定料液比1∶20(g/mL)、超声功率300 W。分别考察β-环糊精质量浓度(5、10、15、20、25 g/L和30 g/L)、提取温度(20、30、40、50、60 ℃和70 ℃)及处理时间(20、40、60、80、100 min和120 min)对β-环糊精提取葡萄叶中白藜芦醇提取量的影响。
1.3.5.2 响应面优化试验设计
在单因素试验基础上,采用统计分析软件Design-Expert 8.0.6中Box-Behnken试验方法,以β-环糊精质量浓度、提取温度和处理时间为自变量,以白藜芦醇提取量为响应值,设计3因素3水平试验方案,确定最佳的白藜芦醇提取工艺参数,因素及水平编码如表1所示。
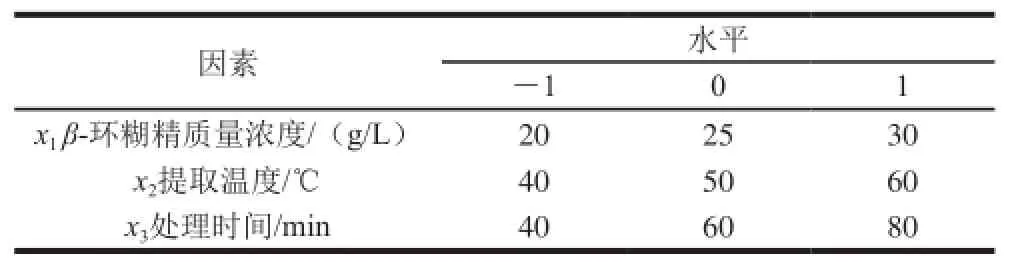
表1 因素及水平编码Table1 Coded levels for factors used in Box-Behnken design
1.4 数据处理
采用SAS 9.1软件对数据进行方差分析和Duncan多重比较分析,当P<0.05时,说明各处理之间存在显著性差异。
2 结果与分析
2.1 总酚含量的测定
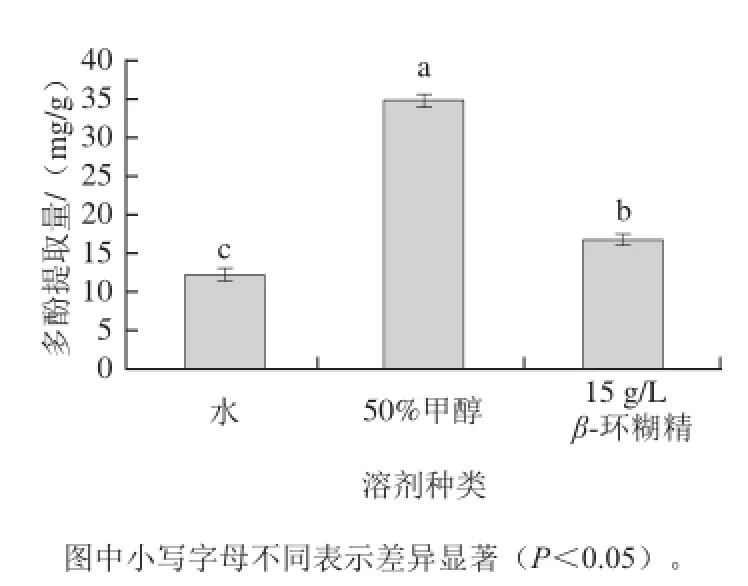
图2 不同溶剂对葡萄叶中多酚含量的提取量Fig.2 The yield of polyphenols extracted from grape vine leaves by different solvents
如图2所示,不同溶剂提取所得多酚含量存在显著性差异,50%甲醇溶液提取所得多酚的提取量最大(34.9 mg/g),β-环糊精对多酚提取量次之(16.7 mg/g),而水作为提取剂所得多酚提取量最小(12.1 mg/g)。
2.2 HPLC分析
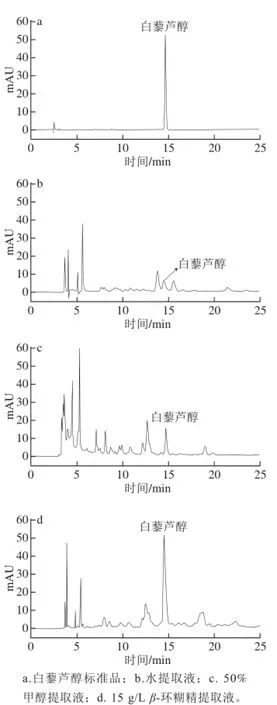
图3 白藜芦醇标准品及不同溶剂所得提取液的HPLC图Fig.3 HPLC chromatograms of resveratrol standard and grape vine leaf extracts obtained using different solvents
为考察不同溶剂对葡萄叶中白藜芦醇提取的影响,对提取液进行HPLC分析,如图3所示。白藜芦醇标准品的保留时间为14.592 min。水作为提取溶剂时,白藜芦醇的提取量较低,仅为15.3 μg/g(图3b);50%甲醇溶液进行提取时,白藜芦醇的提取量为34.6 μg/g(图3c);而15 g/L β-环糊精溶液提取所得白藜芦醇提取量大大提高,达到了111.6 μg/g(图3d)。从以上结果可以得出β-环糊精可以显著提高葡萄叶中白藜芦醇的提取量,分析原因可能是白藜芦醇溶出后立即被β-环糊精包合,从而增加了白藜芦醇在葡萄叶组织细胞和水溶液中的浓度差,提高了白藜芦醇的溶出率[22],另外β-环糊精的包合作用还可以防止白藜芦醇的氧化。
2.3 分子对接
为了探究β-环糊精与白藜芦醇之间的相互作用,本实验采用Autodock 4.2软件将两者进行分子对接研究,所得100 个最优构象的聚类分布情况如图4a所示,可以看出对接构象主要形成了4 个集群,其中能量最低的第1个集群包含了74%的构象,在聚类数目上占绝对优势,这表明对接结果较为理想[23]。β-环糊精与白藜芦醇之间的最佳结合模式如图4b所示,此时的结合能为-5.38 kcal/mol。由图4b可以推测出复合物的形成过程为:白藜芦醇分子向β-环糊精的大端口接近,以图1中A环为头进入环状空腔,并与β-环糊精形成2 对氢键(O—H…O),从而形成稳定的复合物,该分子对接结果也说明了利用β-环糊精提取葡萄叶中白藜芦醇的可行性。
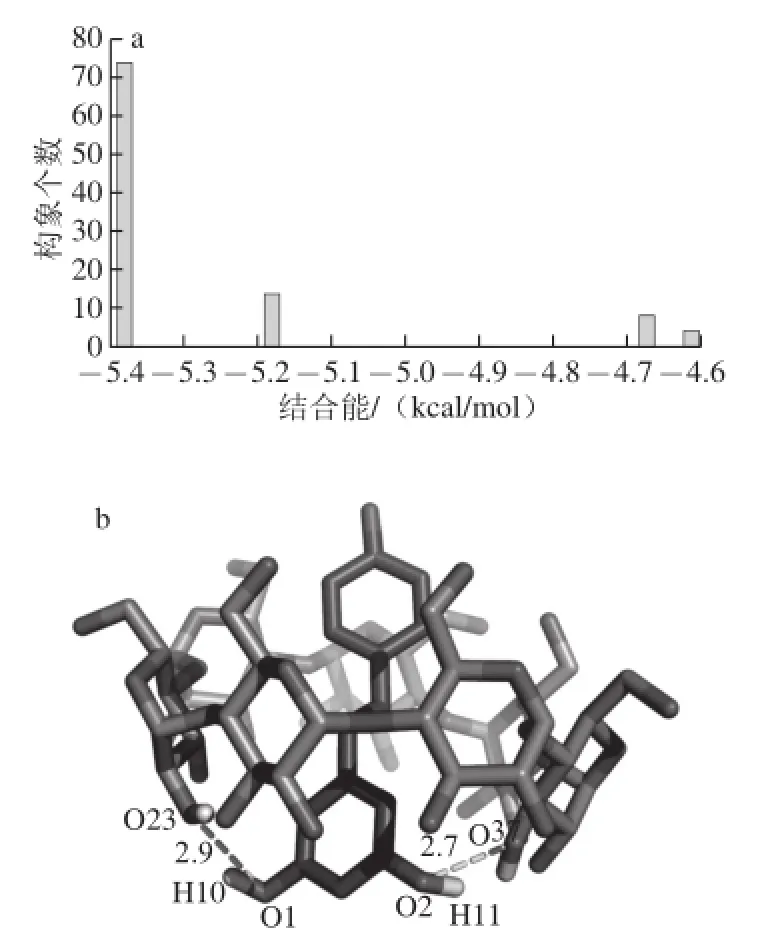
图4 β-环糊精与白藜芦醇的对接构象聚类图(a)及最佳结合模式图(b)Fig.4 Docking conformation clustering (a) and optimal binding mode (b) of β-cyclodextrin with resveratrol
2.4 单因素试验结果
2.4.1 β-环糊精质量浓度对提取葡萄叶中白藜芦醇提取量的影响
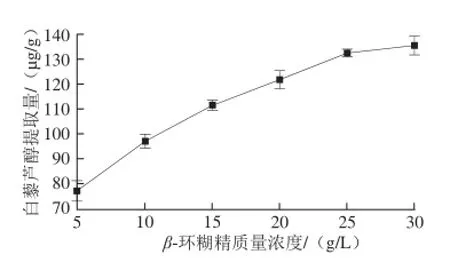
图5 β-环糊精质量浓度对提取葡萄叶中白藜芦醇提取量的影响Fig.5 Effect of β-cyclodextrin concentration on resveratrol release from grape vine leaves
如图5所示,提取温度40℃、处理60 min时,当β-环糊精的质量浓度从5 g/L升高至25 g/L时,白藜芦醇的提取量显著增加,从77.1 μg/g提高到了132.2 μg/g,这是因为随着提取液中β-环糊精质量浓度的提高,所形成的β-环糊精-白藜芦醇包合物量越多,最终所得白藜芦醇的提取量也越高;再继续增大β-环糊精的质量浓度至30 g/L时,白藜芦醇的提取量无显著性变化,为135.3 μg/g。因此,选择β-环糊精质量浓度20、25 g/L和30 g/L进行后续优化试验。
2.4.2 提取温度对β-环糊精提取葡萄叶中白藜芦醇提取量的影响
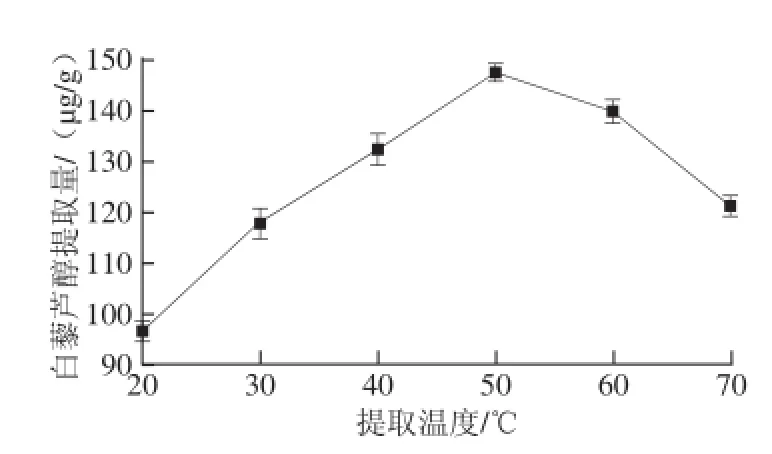
图6 提取温度对β-环糊精提取葡萄叶中白藜芦醇提取量的影响Fig.6 Effect of temperature on resveratrol release from grape vine leaves by β-cyclodextrin
如图6所示,β-环糊精质量浓度为25 g/L、处理60 min时,随着提取温度的升高,白藜芦醇的提取量呈现先增加后降低的趋势。当提取温度从20 ℃升高至50 ℃时,提取量从96.5 μg/g提升至147.5 μg/g,分析原因可能是较高的温度有利于白藜芦醇的溶出;当提取温度继续升高时,提取量显著下降,在70 ℃的提取条件下,白藜芦醇的提取量为121.0 μg/g,这是因为当温度过高时,一方面β-环糊精与白藜芦醇形成的包合物会解包[12,24],另一方面会加速未被包合白藜芦醇的氧化[25],从而造成白藜芦醇提取量的降低。因此,选取温度40、50 ℃和60 ℃作为后续优化试验条件。
2.4.3 处理时间对β-环糊精提取葡萄叶中白藜芦醇提取量的影响
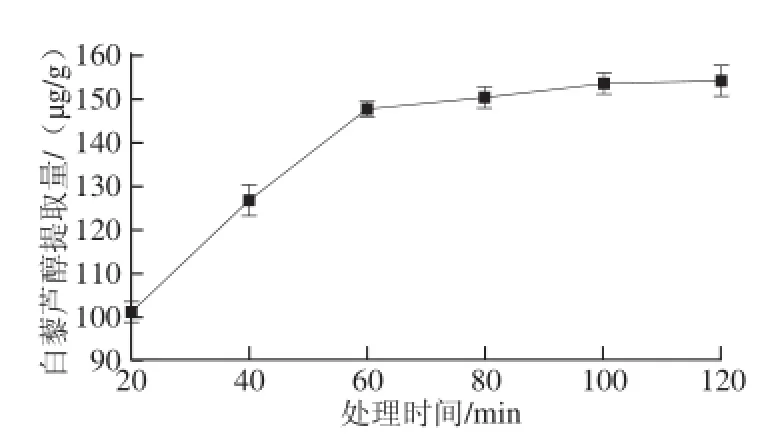
图7 处理时间对β-环糊精提取葡萄叶中白藜芦醇提取量的影响Fig.7 Effect of extraction time on resveratrol release from grape vine leaves by β-cyclodextrin
如图7所示,β-环糊精质量浓度为25 g/L、提取温度为50 ℃时,当处理时间从20 min延长至60 min时,白藜芦醇的提取量显著提高,含量从101.0 μg/g增加至147.5 μg/g;当提取时间超过60 min时,白藜芦醇的提取量趋于平缓,在处理120 min后,提取量为154.1 μg/g,分析原因可能是白藜芦醇的溶出已达到饱和,溶出率趋于平衡。因此,选取处理时间40、60 min和80 min作为进一步优化提取的条件。
2.5 响应面试验结果
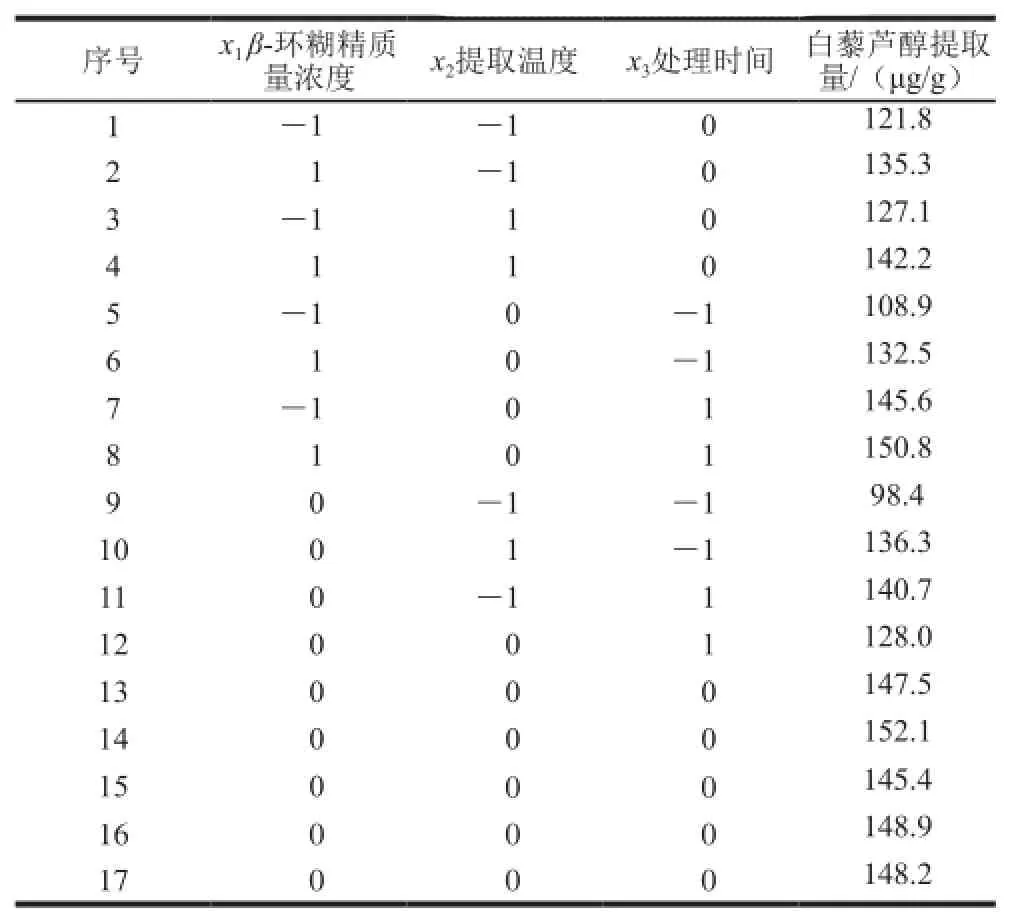
表2 Box-Behnken试验设计及结果Table2 Design and results of Box-Behnken experiments

表3 回归模型方差分析Table3 Analysis of variance for regression equation
如表2所示,白藜芦醇的提取量在98.4~152.1 μg/g之间。对试验数据进行拟合,得到白藜芦醇提取量(y)对β-环糊精质量浓度(x1)、提取温度(x2)和处理时间(x3)的二次多项回归模型方程:y=-702.195+12.015x1+ 16.773x2+7.827x3+0.008x1x2-0.046x1x3-0.063x2x3-
对该模型进行方差分析和模型系数显著性检验,结果见表3。建立的二次回归模型方程是显著的(P=0.000 1);失拟项P=0.097 2>0.05,不显著;相关系数R2为0.972 8,表明该模型预测值与试验值拟合良好。模型的一次项x1、x2和x3的P值均小于0.05,说明β-环糊精质量浓度、提取温度和处理时间对白藜芦醇提取量的影响显著;另外,β-环糊精质量浓度与处理时间的交互作用(x1x3)、提取温度与处理时间的交互作用(x2x3)、提取温度的二次项(x22)以及处理时间的二次项(x32)对提取效果也有显著影响。回归方程的一次项系数表明影响因素的主次顺序为提取温度>β-环糊精质量浓度>处理时间。

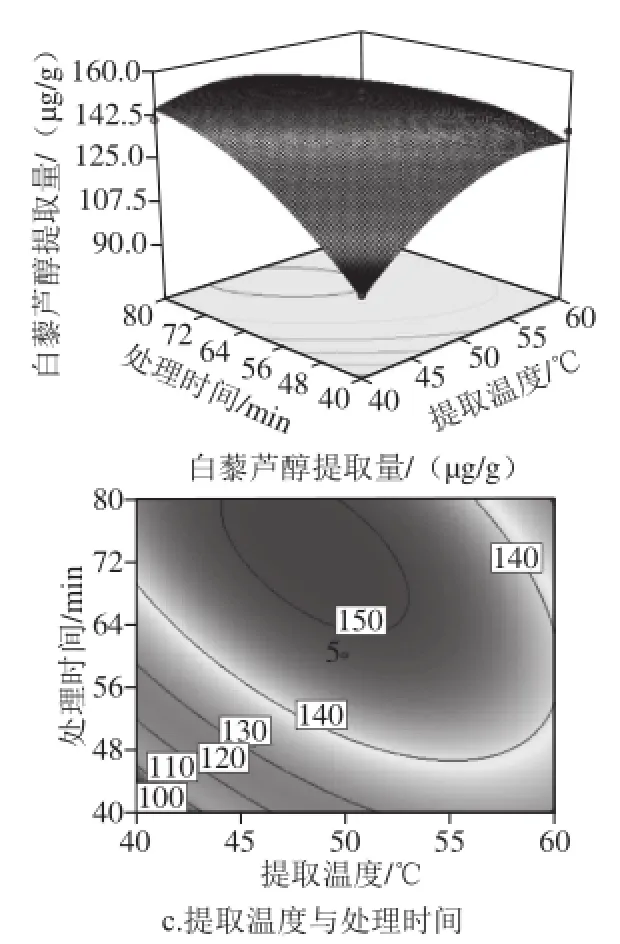
图8 各因素及其交互作用对白藜芦醇提取量影响的响应面图和等高线图Fig.8 Response surface and contour plots for the extraction yield of resveratrol versus various factors
通过考察响应面的形状,分析不同因素对β-环糊精辅助提取葡萄叶中白藜芦醇的影响以及不同因素之间的交互作用。由图8可以看出,响应曲面均呈现为向下开口的凸面,等高线为椭圆形,中心位于所考察的区域范围内,因此,在各考察因素范围内存在白藜芦醇的最大提取量值。由图8a可知,随着β-环糊精质量浓度的增加及提取温度的升高,在β-环糊精质量浓度为25.9~30.0 g/L、提取温度为48.0~56.0 ℃时,能获得较高的白藜芦醇提取量。由图8b可知,当β-环糊精质量浓度为23.6~30.0 g/L、处理时间为56.4~80.0 min时,白藜芦醇提取效果较好。由图8c可以看出,提取温度在低水平时,可以通过延长处理时间提高白藜芦醇的提取量,而提取温度在高水平时,处理时间过长则会导致提取量明显下降;当提取温度为44.1~53.0 ℃、处理时间为63.0~80.0 min时,白藜芦醇提取量较高。
利用Design-Expert软件的优化功能获得葡萄叶中白藜芦醇的最佳提取条件为β-环糊精质量浓度28.2 g/L、提取温度49.8 ℃、处理时间68.6 min,此时模型预测值为153.03 μg/g。考虑到实际操作的便利,将优化的提取条件修正为β-环糊精质量浓度28 g/L、提取温度50 ℃、处理时间68 min,在此条件下进行6 次验证实验,所得白藜芦醇提取量为(152.2±2.64) μg/g,与预测值没有显著性差异,说明了模型的可靠性和准确性。
3 结 论
本实验比较了不同溶剂(水、50%甲醇溶液和β-环糊精溶液)对葡萄叶中白藜芦醇的提取效率,其次采用分子对接方法分析了β-环糊精与白藜芦醇之间的相互作用,最后通过单因素(β-环糊精质量浓度、提取温度和处理时间)和响应面优化试验获得了β-环糊精提取葡萄叶中白藜芦醇的最佳工艺参数。研究结果表明:β-环糊精提取所得白藜芦醇的提取量最大;β-环糊精的疏水性空腔可以容纳白藜芦醇分子,并通过氢键的形成维持复合物的稳定;葡萄叶中白藜芦醇的最佳提取条件为β-环糊精质量浓度28 g/L、提取温度50 ℃、处理时间68 min,在此条件下,白藜芦醇提取量为152.2 μg/g。本研究为白藜芦醇的资源开发和葡萄废弃物的综合利用提供了理论依据和指导。
[1] SALES J M, RESURRECCION A V. Resveratrol in peanuts[J]. Critical Reviews in Food Science and Nutrition, 2014, 54(6): 734-770. DOI:10.1080/10408398.2011.606928.
[2] FRANCIOSO A, MASTROMARINO P, MASCI A, et al. Chemistry, stability and bioavailability of resveratrol[J]. Medicinal Chemistry, 2014, 10(3): 237-245. DOI:10.2174/15734064113096660053.
[3] NAKATA R, TAKAHASHI S, INOUE H. Recent advances in the study on resveratrol[J]. Biological and Pharmaceutical Bulletin, 2012, 35(3): 273-279. DOI:10.1248/bpb.35.273.
[4] KASIOTIS K M, PRATSINIS H, KLETSAS D, et al. Resveratrol and related stilbenes: their anti-aging and anti-angiogenic properties[J]. Food and Chemical Toxicology, 2013, 61(6): 112-120. DOI:10.1016/ j.fct.2013.03.038.
[5] CARRIZZO A, FORTE M, DAMATO A, et al. Antioxidant effects of resveratrol in cardiovascular, cerebral and metabolic diseases[J]. Food and Chemical Toxicology, 2013, 61(4): 215-226. DOI:10.1016/ j.fct.2013.07.021.
[6] 张泽生, 贺伟, 刘甜甜, 等. 白藜芦醇的体外抗氧化活性[J]. 食品科学, 2012, 33(11): 266-268.
[7] KISELEV K V. Perspectives for production and application of resveratrol[J]. Applied Microbiology and Biotechnology, 2011, 90(2): 417-425. DOI:10.1007/s00253-011-3184-8.
[8] ZHANG J, ZHOU L, ZHANG P, et al. Extraction of polydatin and resveratrol from Polygonum cuspidatum root: kinetics and modeling[J]. Food and Bioproducts Processing, 2015, 94: 518-524. DOI:10.1016/ j.fbp.2014.07.011.
[9] 董爱文, 姚姝凤, 许新军, 等. 虎杖果实中白藜芦醇与大黄素提取工艺优化及其与3 类根茎含量比较[J]. 食品科学, 2016, 37(10): 12-16. DOI:10.7506/spkx1002-6630-201610003.
[10] 毛俊霞, 张文君, 李曦默, 等. 响应面法优化葡萄叶中白藜芦醇的提取条件[J]. 天然产物研究与开发, 2014(12): 2027-2032.
[11] 侯斌峰, 马龙, 张煊, 等. 新疆葡萄叶中白藜芦醇的含量分析[J].新疆医科大学学报, 2006, 29(5): 418-420. DOI:10.3969/ j.issn.1009-5551.2006.05.014.
[12] del VALLE E M M. Cyclodextrins and their uses: a review[J]. Process Biochemistry, 2004, 39(9): 1033-1046. DOI:10.1016/S0032-9592(03)00258-9.
[13] 徐晶, 刘欢, 夏光辉, 等. β-环糊精包埋柠檬醛微胶囊工艺优化及其缓释性能[J]. 食品科学, 2014, 35(14): 82-86. DOI:10.7506/spkx1002-6630-201414016.
[14] 刘本国, 张瑞婷, 吴晓楠, 等. 橙皮苷/羟丙基-β-环糊精包合物的理化性质研究[J]. 现代食品科技, 2013, 29(10): 2349-2352.
[15] SZENTE L, SZEJTLI J. Cyclodextrins as food ingredients[J]. Trends in Food Science and Technology, 2004, 15(3/4): 137-142. DOI:10.1016/j.tifs.2003.09.019.
[16] ZHANG H J, LIU Y N, WANG M, et al. One-pot β-cyclodextrinassisted extraction of active ingredients from Xue-Zhi-Ning basing its encapsulated ability[J]. Carbohydrate Polymers, 2015, 132: 437-443. DOI:10.1016/j.carbpol.2015.06.072.
[17] RAJHA H N, CHACAR S, AFIF C, et al. β-cyclodextrin-assisted extraction of polyphenols from vine shoot cultivars[J]. Journal of Agricultural and Food Chemistry, 2015, 63(13): 3387-3393. DOI:10.1021/acs.jafc.5b00672.
[18] LÓPEZ-MIRANDA S, SERRANO-MARTÍNEZ A, HERNÁNDEZSÁNCHEZ P, et al. Use of cyclodextrins to recover catechin and epicatechin from red grape pomace[J]. Food Chemistry, 2016, 203: 379-385. DOI:10.1016/j.foodchem.2016.02.100.
[19] PARMAR I, SHARMA S, RUPASINGHE H P V. Optimization of β-cyclodextrin-based flavonol extraction from apple pomace using response surface methodology[J]. Journal of Food Science and Technology, 2014, 52(4): 2202-2210. DOI:10.1007/s13197-014-1282-1.
[20] MANTEGNA S, BINELLO A, BOFFA L, et al. A one-pot ultrasoundassisted water extraction/cyclodextrin encapsulation of resveratrol from Polygonum cuspidatum[J]. Food Chemistry, 2012, 130(3): 746-750. DOI:10.1016/j.foodchem.2011.07.038.
[21] 魏征, 赵雅娇, 黄羽, 等. 响应面试验优化超声波辅助提取圆叶葡萄鞣花酸和总酚工艺[J]. 食品科学, 2015, 36(12): 29-35. DOI:10.7506/ spkx1002-6630-201512006.
[22] 王恩举, 李津. β-环糊精辅助从绿茶中提取茶多酚[J]. 海南师范大学学报(自然科学版), 2010, 23(1): 62-65. DOI:10.3969/ j.issn.1674-4942.2010.01.017.
[23] 岳俊杰, 梁龙, 冯华. 蛋白质结构预测实验指南[M]. 北京: 化学工业出版社, 2010: 64-65.
[24] RATNASOORIYA C C, RUPASINGHE H P V. Extraction of phenolic compounds from grapes and their pomace using β-cyclodextrin[J]. Food Chemistry, 2012, 134(2): 625-631. DOI:10.1016/ j.foodchem.2012.02.014.
[25] YANG N C, LEE C H, SONG T Y. Evaluation of resveratrol oxidation in vitro and the crucial role of bicarbonate ions[J]. Bioscience Biotechnology and Biochemistry, 2010, 74(1): 63-68. DOI:10.1271/bbb.90549.
Response Surface Optimization of Extraction of Resveratrol from Grape Vine Leaves Using β-Cyclodextrin
WANG Zhouli, YUAN Yahong, LIU Yuxuan, YUE Tianli, CAI Rui, CUI Lu*
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
The effects of β-cyclodextrin, 50% methanol and water on the recoveries of phenolic compounds and resveratrol from grape vine leaves were evaluated. The interaction between β-cyclodextrin and resveratrol was analyzed using molecular docking method. The results indicated that the highest total phenolic content was obtained by using 50% methanol, while β-cyclodextrin resulted in the highest yield of resveratrol. The hydrophobic cavity of β-cyclodextrin could accommodate the resveratrol molecule, and hydrogen bindings between β-cyclodextrin and resveratrol led to the formation of sTablecomplexes. By applying one-variable-at-a-time approach and response surface methodology, the β-cyclodextrin-assisted extraction process of resveratrol from grape vine leaves was optimized. Temperature was the most significant factor affecting the yield of resveratrol, followed by β-cyclodextrin concentration and treatment time. The optimal conditions obtained were as follows: β-cyclodextrin concentration, 28 g/L; temperature, 50 ℃; and extraction duration, 68 min, under which a resveratrol yield of 152.2 μg/g was achieved.
grape vine leaves; resveratrol; β-cyclodextrin; molecular docking; extraction
10.7506/spkx1002-6630-201622003
TS255.1
A
1002-6630(2016)22-0013-07
王周利, 袁亚宏, 刘宇璇, 等. 响应面法优化β-环糊精提取葡萄叶白藜芦醇工艺[J]. 食品科学, 2016, 37(22): 13-19. DOI:10.7506/spkx1002-6630-201622003. http://www.spkx.net.cn
WANG Zhouli, YUAN Yahong, LIU Yuxuan, et al. Response surface optimization of extraction of resveratrol from grape vine leaves using β-cyclodextrin[J]. Food Science, 2016, 37(22): 13-19. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201622003. http://www.spkx.net.cn
2016-06-05
国家自然科学基金青年科学基金项目(31301498);西北农林科技大学基本科研业务费专项(Z109021424)
王周利(1984—),男,讲师,博士,研究方向为农产品加工与安全控制。E-mail:wzl1014@nwsuaf.edu.cn
*通信作者:崔璐(1981—),女,实验师,博士,研究方向为食品工程与农产品加工。E-mail:cuiluct@nwsuaf.edu.cn
