创伤弧菌铁调基因fur的原核表达及多克隆抗体制备
2016-12-05李素一张丽娟林晨韬
李素一,张丽娟,陈 华,柯 翎,陈 叙,林晨韬
(福建省农业科学院生物技术研究所,福建 福州 350003)
创伤弧菌铁调基因fur的原核表达及多克隆抗体制备
李素一,张丽娟,陈 华,柯 翎,陈 叙*,林晨韬*
(福建省农业科学院生物技术研究所,福建 福州 350003)
应用PCR方法克隆了创伤弧菌VibriovulnificusFJ03-X2株的铁调基因fur(Ferric uptake regulator),该基因片段大小为450 bp,编码149个氨基酸;以pET32a为表达载体,构建了原核表达质粒pET32a-FUR,表达质粒测序结果表明目的基因与GenBank中报道的创伤弧菌fur基因的同源性达98%以上;诱导表达获得可溶性的重组表达蛋白rFUR。镍离子金属螯合亲和层析介质(Ni-NTA)纯化rFUR,SDS-PAGE电泳分析其分子量约33 kD。以纯化后的融合蛋白rFUR为抗原,4次免疫SD大鼠,制备抗rFUR蛋白大鼠多克隆抗体。用ELISA方法检测鼠多克隆抗体的效价达到1∶256 000,表明融合蛋白rFUR具有良好的免疫原性。
创伤弧菌;铁调基因fur;克隆;原核表达;多克隆抗体
创伤弧菌Vibriovulnificus是嗜盐性的弧菌,主要存在于海水及海产品中。根据文献报道,创伤弧菌可感染牡蛎[1]、虾[2]等贝壳类动物及鳗鲡[3]、石斑鱼[4]、大菱鲆[5]等海水养殖经济鱼类。感染后鱼体常表现为严重的出血性败血症和溃烂症状,往往带来爆发性死亡,造成严重的经济损失。创伤弧菌也威胁着人类的健康:2006年,创伤弧菌被美国《Emerging Infectious Diseases》杂志列为最危险的细菌之一,病死率极高,在美国、日本、中国、韩国、以色列等许多国家都有感染和病死的报告。创伤弧菌的致病机制目前尚未明确,但普遍认为,创伤弧菌的毒力和致病力主要取决于其多种毒力因子。对创伤弧菌的多种毒力因子包括溶血素VvhA[6-7]、VvhB、MARTX毒素[8-9]、金属蛋白酶VvpE[10]、荚膜多糖CPS[11]、铁调蛋白[12]、外膜蛋白[13]等已有大量研究。其中,表达铁调蛋白的铁摄取调节基因fur是影响和调控着创伤弧菌许多毒力基因表达的关键基因。铁是包括创伤弧菌在内的许多病原菌生存和产生毒力所必需的元素,通过调节病原菌对宿主铁的利用就可以调控许多毒力基因和代谢基因的表达。Kim等发现,编码创伤弧菌弹性蛋白酶的VvpE基因在富含铁元素的环境下表达受到抑制,而这种抑制正是由于smcR基因受到其所依赖的铁调基因fur的调控,受到表达抑制[14]。Lee的研究表明,fur基因通过调控VvpE 和VvpM的表达来调控创伤弧菌溶血素操纵子的转录和翻译水平[15]。Machado等发现fur基因在弧菌间的相似度高于95%,因此开发fur作为新的系统发育分子标记,他们发现相比于传统的16S rRNA基因,fur基因在弧菌之间具有更高的亲缘关系分辨率[16]。
创伤弧菌FJ03-X2是福建省农业科学院生物技术研究所鱼病研究室分离自发病欧鳗的一株毒力较强的致病菌,生化反应和分子鉴定为可对鳗鱼和人类致病的生物I型[3]。普通创伤弧菌半致死量(LD50)为106数量级,而FJ03-X2对欧鳗的半数致死剂量约为7.1×103CFU·尾-1[17]。 本研究克隆了创伤弧菌FJ03-X2的fur基因,构建原核表达载体pET32a-FUR,诱导表达获得融合蛋白rFUR,并制备抗rFUR蛋白的大鼠多克隆抗体。结果表明rFUR蛋白具有良好的免疫原性。该研究为探明创伤弧菌FJ03-X2 的致病机制提供参考,也为后续疫苗的研究开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 创伤弧菌FJ03-X2,经鉴定为人兽共患的生物I型,由福建省农业科学院生物技术研究所鱼病研究室分离、鉴定与保存[3]。
1.1.2 主要试剂 细菌DNA提取试剂盒,琼脂糖凝胶DNA回收试剂盒及质粒小量提取试剂盒均购自天根生化科技有限公司,PCR引物由上海生工有限公司合成,ExTaq酶、限制性内切酶、T4 DNA 连接酶购自大连宝生物工程有限公司( TaKaRa)、原核表达质粒pET32a和表达宿主菌E.coli(DH5α)和BL21 (DE3)由福建省农业科学院生物技术研究所鱼病研究室提供,Ni-NTA亲和层析材料购自Novagen公司。IPTG购自Sigma 公司。蛋白浓度测定试剂盒购自Thermo公司。
1.2 方法
1.2.1 FJ03-X2基因组DNA提取 将以30%甘油冻存于-80℃的FJ03-X2按1%的比例接种于TSB培养基中,28℃、200 r · min-1摇床培养16 h,利用细菌DNA提取试剂盒提取基因组DNA,琼脂糖凝胶电泳检测DNA的纯度。
1.2.2fur基因克隆 根据GenBank 登陆的fur基因(No.L06428.1) 的核苷酸序列和pET32a载体的多克隆位点图谱设计5'端带有内切酶位点的引物。上游引物序列为:5′-CG GAA TTC ATG TCA GAC AAT AAC CAA G-3′(EcoR I);下游引物序列为:5′-CCG CTC GAG TTA GTT CTT ACG TTT ATG T-3′ (Xho I)。采用ExTaq酶及其他PCR试剂扩增fur基因, PCR 反应体系为25 μL,引物浓度为5 mmol·L-1,DNA 模板100 ng。PCR 反应程序为:94℃ 5 min,94℃ 40 s,55℃ 30 s,72℃ 40 s,30个循环;72℃ 7 min。用1%浓度的琼脂糖凝胶电泳检测PCR 产物,目的基因预期大小为450 bp。
1.2.3 表达载体构建及核苷酸序列测定 PCR产物经回收纯化后,利用T4 DNA连接酶试剂盒将fur基因连接到表达载体pET32a中,命名为:pET32a-FUR,转化E.coli(DH5α),应用双酶切方法对构建的表达载体进行初步鉴定。挑取阳性克隆测序,于Genebank上分析与比对目的基因的核苷酸序列。
1.2.4 融合蛋白的表达、纯化及免疫原性检测 提取构建好的重组质粒pET32a-FUR,转化E.coli(BL21)。挑取阳性克隆,接种于600 mL LB液体培养基中,200 r·min-1,37℃培养至OD值为0.6~0.8,加入终浓度为0.5 mmol·L-1的IPTG,转速调整为120 r · min-1,37℃继续振荡培养4 h诱导fur基因的表达。10 000 r·min-1离心收集细菌,用10 mL PBS重悬后进行超声破碎(400 V,超声10 s,间隔15 s)至菌体澄清。12 000 r · min-1,4℃条件下离心破碎菌体,取部分上清和沉淀的重悬液,用10%分离胶的SDS-PAGE检查融合蛋白的表达情况。按Ni-NTA 亲和层析柱操作说明纯化原核表达工程菌超声破碎物上清中的融合蛋白rFUR。用10%分离胶的SDS-PAGE检查纯化效果,用试剂盒BCA法测定蛋白浓度。
1.2.5 免疫大鼠及抗血清效价测定和特异性检测 将纯化的融合蛋白rFUR,皮下多点注射免疫SPF级SD大鼠,每隔14 d免疫1次,共免疫4次。前3次每只大鼠免疫剂量为150 μg,第4次免疫剂量为75 μg,首次注射的抗原为融合蛋白与完全弗氏佐剂CFA乳化后免疫,其余3次注射的抗原均与不完全弗氏佐剂IFA乳化后免疫。第4次加强免疫后1 周腹腔静脉取血,离心分离血清,-80℃保存。
用纯化的重组蛋白为抗原包被96孔板,浓度约每孔100 ng。待测大鼠抗血清为一抗,按1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶128 000以及1∶256 000比例稀释,阴性血清以相同比例稀释作为对照,HRP标记的羊抗鼠的IgG为二抗, 邻苯二胺(OPD)溶液显色后,于酶标仪测定抗体效价,检测波长为490 nm。OD值大于或等于对应阴性血清OD值2倍者判定为阳性。
2 结果与分析
2.1 fur基因克隆
琼脂糖凝胶电泳显示,PCR扩增获得了约450 bp的目标条带,大小与预期符合(图1)。
2.2 pET32a-FUR表达载体构建及fur基因测序
选择酶切结果正确的阳性克隆(图2),酶切结果为pET32a载体骨架(约为5.9K)和fur基因片段。测序结果如图3,基因片段大小为450 bp,编码149个氨基酸。与GenBank中的序列进行BLAST比对,结果显示与已经登录的创伤弧菌fur基因(序列号:KP721378.1)的同源性在98%以上。
2.3 融合蛋白rFUR 的表达与纯化
SDS-PAGE检验是否有可溶性的融合蛋白rFUR的表达,如图4第3泳道所示,在0.5 mmol·L-1的IPTG诱导下,pET32a-FUR在E.coilBL21 (DE3)中表达出目的融合蛋白rFUR。
将菌体超声破碎、离心,分为上清和沉淀两部分进行SDS-PAGE,发现融合蛋白绝大多数包含于上清中,故认定其为可溶性表达,融合蛋白分子量大小为33 kDa(图4)。Ni-NTA法纯化得到的rFUR用10%分离胶浓度的SDS-PAGE检验,仅在预期33 kDa的位置上显示出单一的蛋白条带(图4) 。
2.4 ELISA分析检测rFUR的抗体效价
免疫的3只SD大鼠共采集到约15 mL抗血清,ELISA方法测定抗体效价在1∶256 000以上(表1)。
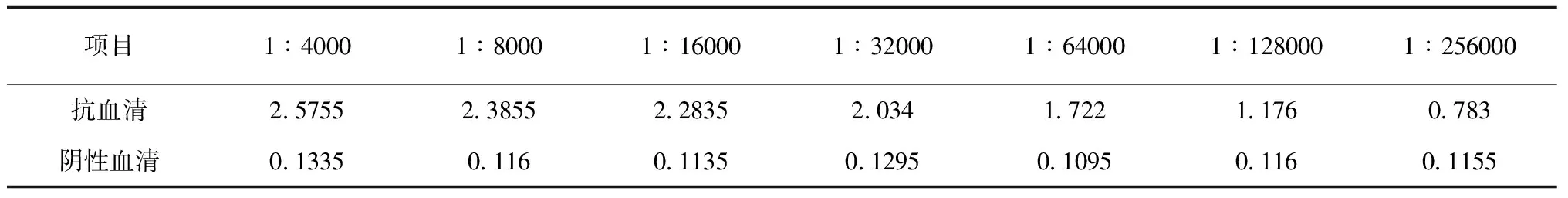
表1 ELISA 测定抗体效价(λ=490nm)
3 讨论与结论
铁元素是许多病原菌必不可少的生存因素,也是与毒力密切相关的元素。许多研究发现,在创伤弧菌的众多毒力基因中,fur由于与铁摄取密切相关,往往调控和影响着其他重要的毒力基因(如溶血素基因)的表达。本研究克隆得到的创伤弧菌FJ03-X2的fur基因经BLAST比对发现,与已经登录的创伤弧菌fur基因(序列号:KP721378.1)的同源性在98%以上。这一结果说明fur基因在创伤弧菌中非常保守。不仅如此,在与其他弧菌的比对中发现,fur在整个弧菌属中也相当保守:例如与哈维氏弧菌Vibrioharveyi和霍乱弧菌Vibriocholerae的fur基因的编码产物同源性分别为94%和92.1%。
通过构建原核表达载体pET32a-FUR并在大肠杆菌E.coli中进行了原核表达和纯化,得到的融合蛋白,分子量大小为33 kDa,与预期相符。融合蛋白主要以可溶性的形式表达,为后续的蛋白质纯化提供了便利,而且目的蛋白无需经过变性再复性的过程,更大程度保留了蛋白质的活性。用纯化的融合蛋白免疫SPF级SD大鼠,制备大鼠抗血清,ELISA检测其效价高达1∶256 000。初步试验表明融合蛋白具有较高的免疫原性,提示了fur基因作为疫苗靶基因的可能性。融合蛋白的获得为进一步制备亚单位疫苗奠定了基础。综上所述,fur基因的原核表达和抗体制备可以为揭示创伤弧菌FJ03-X2强毒力的原因及毒力调控网络提供一定的参考,并对创伤弧菌的亚单位疫苗的研究开发以及和其他类型疫苗进行比较奠定基础。
[1]GUERRERO A,GOMEZ G R B,WONG-CHANG I,et al. Genetic characterization ofVibriovulnificusstrains isolated from oyster samples in Mexico[J]. Int J Environ Health Res. 2015, 25(6): 614-627.
[2]DONASCIMENTO S, DOS FERNANDES V R,THEOPHILO G N,et al.Vibriovulnificusas a health hazard for shrimp consumers[J]. Rev Inst Med Trop Sao Paulo, 2001, 43(5): 263-266.
[3]许斌福,林天龙,董传甫. 鳗鲡创伤弧菌的分子鉴定[J].中国人兽共患病杂志,2005, 11(21): 995-997.
[4]辜良斌,徐力文,王雨,等. 从珍珠龙趸体内分离的1株创伤弧菌的鉴定及耐药性分析[J]. 大连海洋大学学报, 2016, 31(2): 162-167.
[5]于兰萍,王斌,李艳,等.大菱鲆出血性败血症病原菌的分离与鉴定[J]. 大连水产学院学报, 2008, 23(5): 335-339.
[6]LOHITH G K, KINGSTON J J, SINGH A K, et al. Evaluation of recombinant leukocidin domain of VvhA exotoxin of Vibrio vulnificus as an effective toxoid in mouse model[J]. Immunol Lett. 2015, 167(1): 47-53.
[7]LEE S J, JUNG Y H, OH S Y, et al.VibriovulnificusVvhA induces NF-kappaB-dependent mitochondrial cell death via lipid raft-mediated ROS production in intestinal epithelial cells[J]. Cell Death Dis, 2015, (6): 1655.
[8]KIM B S, SATCHELL K J. MARTX effector cross kingdom activation by Golgi-associated ADP-ribosylation factors[J]. Cell Microbiol, 2016,18(8):1078-1093.
[9]ZIOLO K J, JEONG H G, KWAK J S, et al. Vibrio vulnificus biotype 3 multifunctional autoprocessing RTX toxin is an adenylate cyclase toxin essential for virulence in mice[J]. Infect Immun, 2014, 82(5): 2148-2157.
[10]LEE S J, JUNG Y H, OH S Y, et al. Vibrio vulnificus VvpE inhibits mucin 2 expression by hypermethylation via lipid raft-mediated ROS signaling in intestinal epithelial cells[J]. Cell Death Di, 2015, (6): e1787.
[11]LEE K J, KIM J A, HWANG W, et al. Role of capsular polysaccharide (CPS) in biofilm formation and regulation of CPS production by quorum-sensing inVibriovulnificus[J]. Mol Microbiol, 2013, 90(4): 841-857.
[12]LEE H J, KIM J A, LEE M A, et al. Regulation of haemolysin (VvhA) production by ferric uptake regulator (Fur) inVibriovulnificus: repression of vvhA transcription by Fur and proteolysis of VvhA by Fur-repressive exoproteases[J]. Mol Microbiol, 2013, 88(4): 813-826.
[13]SONGLIN G, PANPAN L, JIANJUN F, et al. A novel recombinant bivalent outer membrane protein ofVibriovulnificusandAeromonashydrophilaas a vaccine antigen of American eel (Anguillarostrata)[J]. Fish Shellfish Immunol, 2015, 43(2): 477-484.
[14]KIM I H,WEN Y,SON J S, et al. The fur-iron complex modulates expression of the quorum-sensing master regulator, SmcR, to control expression of virulence factors inVibriovulnificus[J]. Infect Immun, 2013, 81(8): 2888-2898.
[15]LEE H J,KIM J A,LEE M A, et al. Regulation of haemolysin (VvhA) production by ferric uptake regulator (Fur) inVibriovulnificus: repression of vvhA transcription by Fur and proteolysis of VvhA by Fur-repressive exoproteases[J]. Mol Microbiol, 2013, 88(4): 813-826.
[16]MACHADOH,GRAM L. The fur gene as a new phylogenetic marker forVibrionaceaespeciesidentification[J]. Appl Environ Microbiol, 2015, 81(8): 2745-2752.
[17]田丁,许斌福,林能峰. 创伤弧菌外膜蛋白免疫刺激复合物对欧洲鳗鲡的免疫保护性分析[J]. 水生生物学报, 2010, 34(2): 431-435.
(责任编辑:林海清)
Prokaryotic Expression and Polyclonal Antibody for Ferric Uptake Regulator Prepared fromVibriovulnificusFJ03-X2
LI Su-yi, Zhang Li-juan, CHEN Hua, KE Ling, CHEN Xu*, LIN Chen-tao*
(InstituteofBiotechnology,FujianAcademyofAgriculturalSciences,Fuzhou,Fujian350003,China)
Ferric uptake regulator (fur) gene fromVibriovulnificusFJ03-X2 was cloned, and inserted into the prokaryotic expression vector, pET32a. Coding sequence of the gene contained 450 bps, encoding 149 amino acids. Its sequencing showed a greater than 98% homology with that of thefurgene from GenBank. Subsequently, the plasmid, pET32a-FUR, was transformed intoE.coliBL21 to express the recombinant protein, rFUR. The soluble rFUR was then subject to the Ni-NTA His Binding affinity purification. The purified rFUR was injected into SD rats to produce polyclonal antibody. The obtained highly specific antibodies of FUR was confirmed by ELISA assay.
Vibriovulnificus; ferric uptake regulator; cloning; prokaryotic expression; polyclonal antibody
2016-06-11初稿;2016-07-18修改稿
李素一(1985-),女,硕士,研究实习员,主要从事鱼类免疫学研究
*通讯作者:陈叙(1978-),女,博士,副研究员,主要从事水产免疫学研究 (E-mail:chenxu97@hotmail.com)
福建省科技计划项目——省属公益类科研院所基本科研专项(2014R1019-9);福建省农业科学院引进海外人才科研启动基金项目(HWRC2011-03、HWRC2011-02);国家自然科学基金项目(31100658); 福建省农业科学院青年英才计划项目(YC2015-20);福建省农业科学院杰出青年人才基金项目(2014JQ-4)
S 941
A
1008-0384(2016)09-912-05
李素一,张丽娟,陈华,等.创伤弧菌铁调基因fur的原核表达及多克隆抗体制备[J].福建农业学报,2016,31(9):912-916.
LI S-Y,ZHANG L-J,CHEN H,et al.Prokaryotic Expression and Polyclonal Antibody for Ferric Uptake Regulator Prepared fromVibriovulnificusFJ03-X2[J].FujianJournalofAgriculturalSciences,2016,31(9):912-916.
林晨韬(1979-),男,博士,研究员,主要从事免疫学研究 (E-mail:linchentao@hotmail.com)
