乙型肝炎病毒X蛋白通过DNMT3A诱导肝癌细胞RUNX3基因高甲基化
2016-12-01林万松林巧燕周智锋李洁羽叶韵斌
林万松,林 洁,林巧燕,周智锋,李洁羽,叶韵斌
乙型肝炎病毒X蛋白通过DNMT3A诱导肝癌细胞RUNX3基因高甲基化
林万松1,林 洁2,林巧燕1,周智锋1,李洁羽1,叶韵斌1
目的 研究肝癌细胞中乙型肝炎病毒X蛋白(HBx)对抑癌基因Runt相关转录因子3(RUNX3)表达的影响及相关作用机制,探讨乙肝病毒促肝癌发生的表观遗传调控。方法 HBx重组表达载体转染5-aza-CdR处理或未处理的Huh7、HepG2肝癌细胞,Western Blot及RT-qPCR检测RUNX3 的表达,分析RUNX3基因启动子CpG岛甲基化水平。合成DNA甲基转移酶3A的小干扰RNA(siRNA_3A)单独转染或与HBx共转染,检测RUNX3的表达。PCR检测21例手术切除的肝细胞癌新鲜组织标本HBx表达情况,比较HBx阴性与HBx阳性组织样本间RUNX3的表达差异以及启动子甲基化程度。结果 过表达HBx可导致肝癌细胞内RUNX3表达下调,且甲基转移酶抑制剂5-aza-CdR可完全阻断HBx对RUNX3的抑制作用。HBx诱导RUNX3基因启动子CpG岛发生高甲基化,但不影响DNA甲基转移酶的表达。siRNA_3A转染肝癌细胞后,RUNX3 mRNA与蛋白表达均显著上调;其与HBx共转染后,逆转了单独HBx对RUNX3的抑制作用。HBx阳性的肝癌组织中RUNX3 mRNA表达水平较HBx阴性组低,且RUNX3启动子甲基化程度也相对较高。结论 HBx通过促进RUNX3启动子区域发生高甲基化而抑制其表达,且这一过程是由DNMT3A所介导的。
乙型肝炎病毒X蛋白;肝细胞癌;Runt相关转录因子3;DNA甲基转移酶3A;甲基化
乙型肝炎病毒X蛋白(hepatitis B virus X protein,HBx)是乙型肝炎病毒(hepatitis B virus, HBV)编码的的一个重要调节因子,具有多功能性,在HBV致肝癌(hepatocellular carcinoma,HCC)发生发展过程中起着关键作用[1]。HBx可通过反式激活功能诱导多种病毒和宿主细胞基因的转录,通过调节信号转导通路,参与了氧化应激、DNA修复、蛋白降解、细胞周期和凋亡等细胞活动过程[2-3]。此外,研究报道HBx能够诱导宿主基因的表观遗传学改变,包括DNA甲基化修饰异常等[4-5]。Runt相关转录因子3(Runt-related transcription factor 3,RUNX3)隶属于Runt 结构域转录因子家族,具有抑癌基因的功能,在包括HCC在内的多种实体瘤中均发现RUNX3基因由于启动子高甲基化而表达受到抑制[6-7],但其异常甲基化的分子机制有待深入分析。本文通过研究HBx对RUNX3表达的影响及相关作用机制,探讨二者之间的联系以及对HCC发病所起的作用。
1 材料与方法
1.1 细胞与主要试剂 Huh7和HepG2肝癌细胞株由福建省肿瘤医院肿瘤免疫学研究室保存。DMEM高糖培养基、胎牛血清(美国Gibco公司);X-tremeGENE HP DNA转染试剂、逆转录试剂盒、LightCycler 480 SYBR Green定量PCR试剂盒(美国Roche公司);RUNX3单克隆抗体、DNMT1、DNMT3A、DNMT3B多克隆抗体(英国Abcam公司);Xpress单克隆抗体、TRIzol试剂(美国Invitrogen公司);β-actin多克隆抗体、HRP标记二抗(美国Cell Signaling Technology公司);DNA提取试剂盒、EpiTect Bisulfite Kit亚硫酸氢钠处理试剂(德国Qiagen公司);5-aza-CdR(美国Sigma公司)。
1.2 标本 21例新鲜HCC标本取自2014-2015年福建省肿瘤医院肝胆外科住院手术患者,术前均未接受放射和化学治疗,术后均经病理学证实,组织离体后立即置液氮保存。
1.3 HBx重组表达载体构建 HBx全长克隆于真核表达载体pcDNA3.1/HisC,载体多克隆位点N端带有Xpress多肽表位,HBx与Xpress融合表达。该重组表达载体命名为pcDNA3.1-HBx已构建完成[8],由本实验室保存。
1.4 细胞培养与转染 Huh7和HepG2细胞以5%CO2、含10%胎牛血清的DMEM常规培养,转染前24 h细胞用胰酶消化,按2×105个细胞每孔接种至6孔板中,转染时细胞达50%~70%融合。转染按X-tremeGENE HP DNA转染试剂说明书操作,每次均设空白对照组以及阴性对照组。
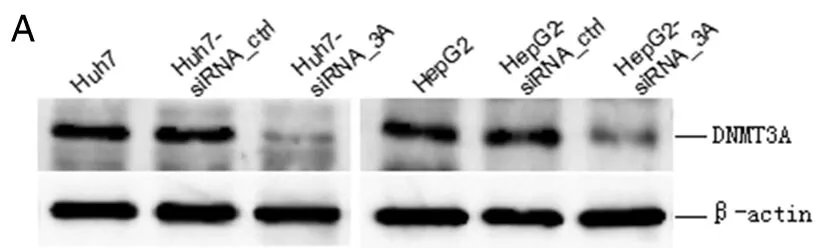
1.5 RNA干扰(RNAi)实验 DNMT3A小干扰RNA(siRNA_3A)及阴性对照siRNA_ctrl设计参照文献[9],序列如下(只列出正义链):siRNA_3A:5′-CAGGAGATGATGTCCAACCC-3′;siRNA_ctrl:5′- CACGACATCATCTCGAACGC- 3′。单链寡核苷酸片段由上海生工生物公司合成,经退火后形成双链siRNA,转染细胞,终浓度为100 nmol/L,48 h后Western Blot检测DNMT3A的表达。
1.6 RT-qPCR TRIzol试剂提取总RNA,经55 ℃ 30 min逆转录合成cDNA,实时定量PCR按试剂说明书配制反应液,在Roche LightCycler 480 PCR仪上运行,循环参数为95 ℃ 15 s,60 ℃ 1 min,40个循环。RUNX3引物序列:上游:5′-CAGGCAATGACGAGAACT-3′,下游:5′-GGTTGGTGAACACAGTGA-3′,扩增片段长度为147 bp。
1.7 PCR扩增HCC组织HBx基因 PCR扩增HBx引物设计依据文献[10],使用普通Taq DNA聚合酶,PCR产物经1.5%琼脂糖凝胶电泳分离。
1.8 Western Blot 细胞加入RIPA裂解液提取总蛋白,BCA蛋白定量。取25 μg变性总蛋白经10%SDS-PAGE凝胶电泳分离后电转移至PVDF膜。膜以3%BSA室温封闭2 h,加相应的一抗4 ℃孵育过夜,各抗体稀释浓度分别为:RUNX3(1∶500),DNMT3A(1∶500),Xpress(1∶1 000),β-actin(1∶2 000)。PVDF膜经TBST漂洗后加入HRP标记的二抗(1∶3 000)孵育2 h,加入化学发光底物并置于Bio-Rad ChemiDoc XRS成像系统进行显影与图像分析。
1.9 甲基化特异性PCR(Methylation Specific PCR,MSP) MSP实验参照文献[11],按试剂盒说明提取基因组DNA并进行亚硫酸盐转化及纯化,合成针对RUNX3启动子区域-271 bp至-52 bp的甲基化与非甲基化特异性引物,并分别进行PCR扩增,产物用1.5%的琼脂糖凝胶电泳分离,凝胶置于Bio-Rad ChemiDoc XRS成像系统进行拍照并扫描DNA条带灰度值。
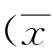
2 结 果
2.1 HBx可抑制肝癌细胞中RUNX3的表达 3 μg的pcDNA3.1-HBx或空载体对照pcDNA3.1分别转染Huh7细胞,48 h后提取细胞总蛋白,Western Blot检测RUNX3蛋白水平。与pcDNA3.1组比较,HBx组的RUNX3蛋白表达水平显著下调(t=12.036,P<0.01),见图1A。细胞加入终浓度为5 μmol/L的5-aza-CdR处理20 h后,再行上述转染实验,48 h后提取总RNA,RT-qPCR结果显示5-aza-CdR处理后,RUNX3 mRNA的表达显著高于单独HBx(未加药)组(t=17.120,P<0.01),见图1B。另外,在HepG2细胞中重复上述实验,亦获得类似的结果。以上结果表明过表达HBx可抑制肝癌细胞中RUNX3的表达,且甲基转移酶抑制剂可阻断该抑制作用,提示其作用机制可能与表观遗传相关。
注:* * P<0.01Note: * * P<0.01A:Western Blot检测RUNX3表达,β-actin为内参照;B:RT-qPCR检测RUNX3 mRNA水平A: The RUNX3 protein was detected by western blot; B: The RUNX3 mRNA was detected by RT-qPCR.图1 过表达HBx抑制肝癌细胞RUNX3的表达Fig.1 Ectopic HBx inhibited the expression of RUNX3
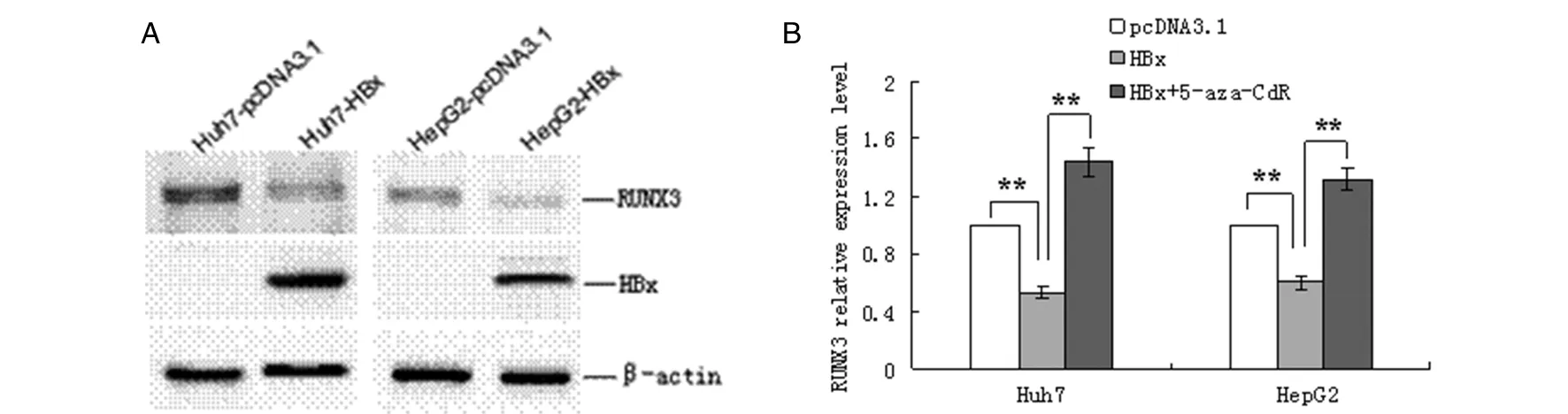
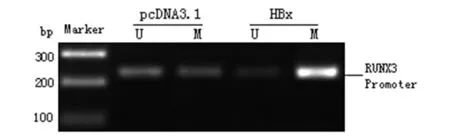
2.2 HBx诱导RUNX3启动子发生高甲基化 培养Huh7细胞进行上述步骤1的基因转染实验,48 h后提取细胞基因组DNA用于MSP实验。结果显示,对照组DNA甲基化与非甲基化条带均存在,提示RUNX3启动子在肝癌细胞中有部分发生甲基化;与对照组比较,HBx过表达组甲基化条带灰度值明显增强(t=9.982,P<0.01),非甲基化条带灰度值降低(t=10.337,P<0.01),见图2。MSP结果表明过表达HBx后RUNX3基因启动子区发生了高甲基化。另外,细胞过表HBx后,Western Blot检测DNMT1、 DNMT3A和DNMT3B的表达,结果显示,3种甲基转移酶蛋白表达均没有发生明显变化,见图3。
注:U表示未甲基化,M表示甲基化Note: U: unmethylated, M: methylated图2 MSP法检测RUNX3基因启动子CpG岛甲基化水平Fig.2 Methylation of RUNX3 promoter CpG island was evaluated by methylation specific PCR
图3 过表达HBx不影响肝癌细胞DNMTs的表达 Fig.3 Influence of ectopic HBx on the expression of DNMTs
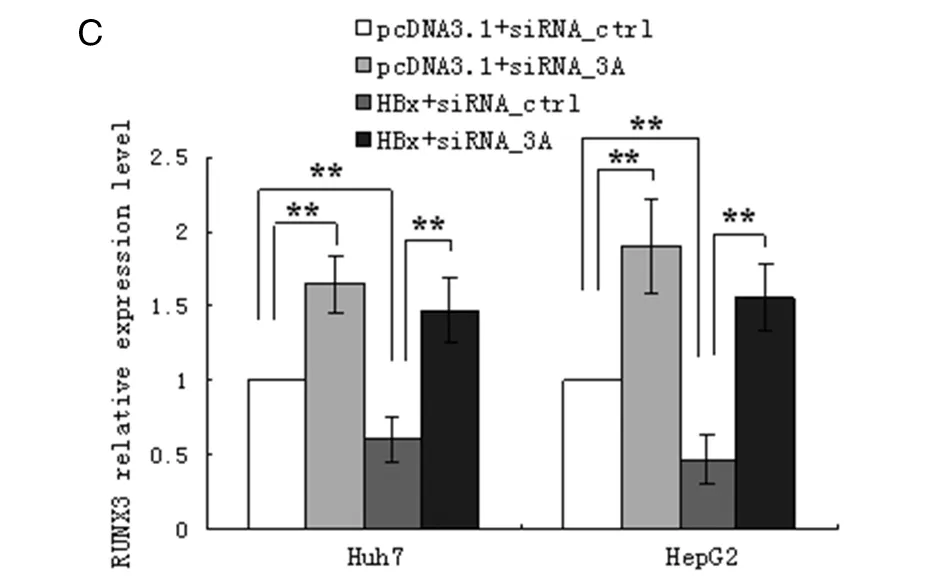
2.3 DNMT3A介导HBx对RUNX3的抑制作用 siRNA_3A转染Huh7、HepG2细胞后,可显著下调DNMT3A蛋白表达(与对照组比较,t值分别为20.486和18.058,P值均<0.01),表明siRNA能有效干扰DNMT3A,见图4A。培养Huh7细胞进行共转染实验,共转染分4个组:A组pcDNA3.1+siRNA_ctrl、B组pcDNA3.1+siRNA_3A、C组HBx+siRNA_ctrl、D组HBx+siRNA_3A。提取细胞总RNA和总蛋白,RT-qPCR检测RUNX3 mRNA水平,Western Blot检测RUNX3蛋白水平。与A组比较,B组的RUNX3 mRNA与蛋白表达均显著上调(t值分别为13.574和12.728,P值均<0.01),C组的RUNX3 mRNA与蛋白表达均显著下调,同结果1相似(t值分别为10.337和10.895,P值均<0.01);D组与C组比较,RUNX3 mRNA与蛋白表达均显著上调(t值分别为16.124和14.858,P值均<0.01),且B、D组间无显著差异(t值分别为1.910和2.135,P值均>0.05),见图4B、4C。在HepG2细胞中重复上述共转染实验,获得类似的结果。此外,我们还合成了siRNA_DNMT1及siRNA_DNMT3B,分别与HBx共转染,结果发现干扰DNMT1或DNMT3B的表达并不能逆转HBx对RUNX3的抑制作用。体外实验表明,HBx诱导RUNX3启动子高甲基化从而抑制RUNX3的表达,且干扰DNMT3A(而非DNMT1或DNMT3B)的表达可完全阻断该抑制作用,提示HBx可能通过DNMT3A介导RUNX3基因启动子异常甲基化。
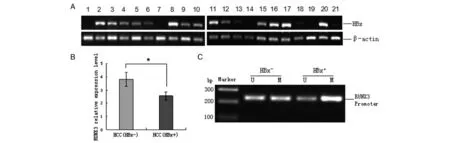
2.4 HCC组织中HBx与RUNX3表达相关性 为了进一步证实体外实验的结果,我们研究临床标本中HBx与RUNX3的相关性。PCR扩增21例HCC新鲜组织标本HBx基因,其中7例为阴性,14例为阳性,见图5A。将标本分为HBx阴性组与HBx阳性组,RT-qPCR检测组两组中RUNX3的表达并进行统计学分析,实验结果显示HBx阳性组RUNX3 mRNA的表达水平较HBx阴性组低(t=2.700,P<0.05),见图5B。选取HBx阴性和阳性标本各1例,分别提取基因组DNA,MSP法检测其RUNX3启动子甲基化程度,如图5C显示,HBx阳性标本中RUNX3启动子甲基化程度相对较高(t=4.717,P<0.05)。
注: * *P<0.01,siRNA_ctrl表示siRNA_control,siRNA_3A表示siRNA_DNMT3A
Note: * *P<0.01, siRNA_ctrl: siRNA_control, siRNA_3A: siRNA_DNMT3A
A:Western Blot检测siRNA对DNMT3A干扰的效率;B、C:Western Blot及RT-qPCR检测RUNX3表达
A: The DNMT3A protein was detected by western blot in HCC cells transfected with siRNA_DNMT3A; B, C: The expression of RUNX3 was measured in HCC cells co-transfected with siRNA_DNMT3A and HBx.
图4 DNMT3A介导肝癌细胞中HBx对RUNX3的抑制作用
Fig.4 HBx downregulates RUNX3 expression through DNMT3A in HCC cells
注:*P<0.05,U表示未甲基化,M表示甲基化
Note: *P<0.05, U: unmethylated, M: methylated
A:PCR扩增21例HCC新鲜组织标本HBx基因,数字1-21代表标本编号;B: RT-qPCR检测HCC组织中RUNX3的表达;C:MSP法检测HCC组织中RUNX3基因启动子CpG岛甲基化水平
A: HBx was detected by PCR in 21 HCC tissues; B: To analyzed the transcription of RUNX3 between HCC tissues with HBx negative and tissues with HBx positive by RT-qPCR; C: The methylation of RUNX3 promoter CpG island was evaluated by methylation specific PCR in HCC tissues with HBx negative or with HBx positive.
图5 RUNX3在HBx阳性及阴性HCC组织中的差异表达及启动子甲基化比较
Fig.5 Expression and methylation of RUNX3 were analyzed in HCC tissues
3 讨 论
染色质异常贯穿于肿瘤形成及进展的各个阶段,其中最具特征的就是通过表观遗传学改变,尤其是基因启动子区域的DNA高甲基化,在转录水平沉默某些调节细胞重要功能的基因表达。已有证据表明,病毒基因是调控DNA甲基化的一个关键因子。多种病毒,如人乳头瘤病毒、EB病毒所诱导的DNA甲基化是宫颈癌、胃癌等病毒相关性癌症的始动机制[12-13],猿猴病毒40T、EB病毒以及卡波氏肉瘤相关疱疹病毒等能够通过多种途径导致DNMTs的异常改变[14-16]。HBx相较于HBV中的其他组分,更常整合到宿主基因组中,并随着宿主基因持续复制,这一过程发生在HCC 形成之前,是促进HCC发生的一个重要生物学事件[17-18]。HBx具有广泛的调节作用,其确切的分子机制有待深入发掘。
RUNX3的缺失与细胞分化调节异常及肿瘤形成有关。在包括HCC在内的多种实体瘤中,因高甲基化而导致的RUNX3失活非常普遍。研究HBx与HCC中RUNX3甲基化调控间的关系,将会为理解HBx参与HCC发生发展机制提供新的思路。
本研究通过体外转染实验发现,过表达HBx可抑制肝癌细胞RNNX3 mRNA及蛋白表达,且诱导RUNX3启动子发生高甲基化;同时临床样本中也发现HBx阳性的HCC组织RUNX3表达水平较HBx阴性组低,且RUNX3启动子甲基化程度相对较高。提示HBx可促进RUNX3基因高甲基化从而抑制RUNX3的表达。这与之前的报道相符,RUNX3的表达确实受到了某些病毒相关蛋白的调控[19-20]。
另外,本研究发现干扰肝癌细胞DNMT3A的表达,可上调RUNX3水平; DNMT3A siRNA与HBx共转染可逆转单独HBx对RUNX3的抑制作用,使RUNX3回复上调表达,表明DNMT3A介导了HBx对RUNX3的抑制作用。DNMT3A属于从头DNA甲基化转移酶,在肿瘤进展的早期阶段,特定基因启动子区域的CpG岛高甲基化和非CpG岛的低甲基化均有赖于从头DNMTs的作用[21]。但HBx并不是通过上调DNMT3A而促进RUNX3高甲基化的。Zheng等报道,肝癌细胞中HBx可与DNMT3A发生直接相互作用,且HBx通过该相互作用促进或者抑制DNMT3A结合至某些抑癌或促癌基因启动子区[10]。因此我们推测HBx也可能通过该分子机制调控RUNX3的表达。总之,本文初步阐明了HCC中HBx对抑癌基因RUNX3表达的影响及相关作用机制,丰富了对表观遗传学调控HCC发生发展的认识,为利用表观遗传学原理治疗HCC提供了新的思路。
[1] Murakami S. Hepatitis B virus X protein: a multifunctional viral regulator[J]. J Gastroenterol, 2001, 36(10): 651-660. DOI: 10.1007/s005350170027
[2] Zhang XD, Wang Y, Ye LH. Hepatitis B virus X protein accelerates the development of hepatoma[J]. Cancer Biol Med, 2014, 11(3): 182-190. DOI: 10.7497/j.issn.2095-3941.2014.03.004
[3] Ali A, Abdel-Hafiz H, Suhail M, et al. Hepatitis B virus, HBx mutants and their role in hepatocellular carcinoma[J]. World J Gastroenterol, 2014, 20(30): 10238-10248. DOI: 10.3748/WJG.v20.i30.10238
[4] Tian Y, Yang W, Song J, et al. Hepatitis B virus X protein-induced aberrant epigenetic modifications contributing to human hepatocellular carcinoma pathogenesis[J]. Mol Cell Biol, 2013, 33(15): 2810-2816. DOI: 10.1128/MCB.00205-13
[5] Pogribny IP, Rusyn I. Role of epigenetic aberrations in the development and progression of human hepatocellular carcinoma[J]. Cancer Lett, 2014, 342(2): 223-230. DOI: 10.1016/j.canlet.2012.01.038
[6] Chuang LS, Ito Y. RUNX3 is multifunctional in carcinogenesis of multiple solid tumors[J]. Oncogene, 2010, 29(18): 2605-2615. DOI: 10.1038/onc.2010.88
[7] Yang Y, Ye Z, Zou Z, et al. Clinicopathological significance of RUNX3 gene hypermethylation in hepatocellular carcinoma[J]. Tumour Biol, 2014, 35(10): 10333-10340. DOI: 10.1007/s13277-014-2329-7
[8] Lin WS, Xu X, Chen JY, et al. Comparative analysis of transactivating capacities on MDR1 gene between X proteins of genotype B and C in hepatitis B virus[J]. J Fujian Med Univ, 2007, 41(6): 487-490. (in Chinese)
林万松,徐晓,陈金烟,等. B、C基因型乙型肝炎病毒X蛋白对MDR1基因反式激活能力的比较[J]. 福建医科大学学报, 2007, 41(6): 487-490.
[9] Robert MF, Morin S, Beaulieu N, et al. DNMT1 is required to maintain CpG methylation and aberrant gene silencing in human cancer cells[J]. Nat Genet, 2003, 33(1): 61-65. DOI: 10.1038/ng1068
[10] Zheng DL, Zhang L, Cheng N, et al. Epigenetic modification induced by hepatitis B virus X protein via interaction with de novo DNA methyltransferase DNMT3A[J]. J Hepatol, 2009, 50(2): 377-387. DOI: 10.1016/j.jhep.2008.10.019
[11] Li QL, Ito K, Sakakura C, et al. Causal relationship between the loss of RUNX3 expression and gastric cancer[J].Cell, 2002, 109(1): 113-124. DOI: 10.1016/S0092-8674(02)00690-6[12] Jimenez-Wences H, Peralta-Zaragoza O, Fernandez-Tilapa G. Human papilloma virus, DNA methylation and microRNA expression in cervical cancer[J]. Oncol Rep, 2014, 31(6): 2467-2476. DOI: 10.3892/or.2014.3142
[13] Matsusaka K, Funata S, Fukayama M et al. DNA methylation in gastric cancer, related toHelicobacterpyloriand Epstein-Barr virus[J]. World J Gastroenterol, 2014, 20(14): 3916-3926. DOI: 10.3748/wjg.v20.i14.3916
[14] Slack A, Cervoni N, Pinard M, et al. DNA methyltransferase is a downstream effector of cellular transformation triggered by simian virus 40 large T antigen[J]. J Biol Chem, 1999, 274(15): 10105-10112. DOI: 10.1074/jbc.274.15.10105
[15] Tsai CN, Tsai CL, Tse KP, et al. The Epstein-Barr virus oncogene product, latent membrane protein 1, induces the downregulation of E-cadherin gene expression via activation of DNA methyltransferases[J]. Proc Natl Acad Sci US A, 2002, 99(15): 10084-10089. DOI: 10.1073/pnas.152059399
[16] Shamay M, Krithivas A, Zhang J, et al. Recruitment of the de novo DNA methyltransferase Dnmt3a by Kaposi’s sarcoma-associated herpesvirus LANA[J]. Proc Natl Acad Sci USA, 2006, 103(39): 14554-14559. DOI: 10.1073/pnas.0604469103
[17] Vitvitski-Trepo L, Kay A, Pichoud C, et al. Early and frequent detection of HBxAg and/or anti-HBx in hepatitis B virus infection[J]. Hepatology, 1990, 12(6): 1278-1283. DOI: 10.1002/hep.1840120605
[18] Bonilla Guerrero R, Roberts LR. The role of hepatitis B virus integrations in the pathogenesis of human hepatocellular carcinoma[J]. J Hepatol, 2005, 42(5): 760-777. DOI: 10.1016/j.jhep.2005.02.005
[19] Kim R, Trubetskoy A, Suzuki T, et al. Genome-based identification of cancer genes by proviral tagging in mouse retrovirus-induced T-cell lymphomas[J]. J Virol, 2003, 77(3): 2056-2062. DOI: 10.1128/JVI.77.3.2056-2062.2003
[20] Spender LC, Cornish GH, Sullivan A, et al. Expression of transcription factor AML-2 (RUNX3, CBF(alpha)-3) is induced by Epstein-Barr virus EBNA-2 and correlates with the B-cell activation phenotype[J]. J Virol, 2002, 76(10): 4919-4927. DOI: 10.1128/JVI.76.10.4919-4927.2002
[21]Fernandez AF, Assenov Y, Martin-Subero JI, et al. A DNA methylation fingerprint of 1628 human samples[J]. Genome Res, 2012, 22(2): 407-419. DOI: 10.1101/gr.119867.110
Ye Yun-bin, Email: zjyunbin@189.cnSupported by the National Natural Science Foundation of China (No. 81301444) and the Program for Young Teacher Education Research of Fujian Province (No. JB13128)
Hepatitis B virus X protein induced hypermethylation of RUNX3 through DNMT3A in HCC cells
LIN Wan-song1, LIN Jie2, LIN Qiao-yan1, ZHOU Zhi-feng1, LI Jie-yu1, YE Yun-bin1
(1.TumorImmunologyLaboratoryofFujianProvincialCancerHospital,FujianKeyLaboratoryofTranslationalCancerMedicine,Fuzhou350014,China;2.PathologyDepartment,FujianProvincialHospital,theShengliClinicalMedicalCollegeofFujianMedicalUniversity,Fuzhou350001,China)
We investigated the effect of hepatitis B virus X protein (HBx) on runt-related transcription factor 3 (RUNX3) in hepatocellular carcinoma (HCC). The expression of RUNX3 was detected by quantitative real-time PCR and western blot as well as the methylation of RUNX3 promoter CpG island was evaluated by methylation specific PCR in HCC cells transfected with HBx recombinant plasmids. The small interfering RNA (siRNA) targeting DNA methyltransferase 3A (DNMT3A) were co-transfected with HBx recombinant plasmids into HCC cells, and then the expression of RUNX3 was measured. In addition, the expression and methylation of RUNX3 were analyzed in 21 HCC tissues. Result showed that ectopic HBx inhibited the expression of RUNX3 and induced hypermethylation of RUNX3 CpG island in HCC cells. Furthermore, this inhibitory effect was abrogated by DNMT3A siRNA. The transcription of RUNX3 was higher in HCC tissues with HBx negative than tissues with HBx positive. But the methylation of RUNX3 CpG island exhibited the opposite trend. Our data indicate that HBx may downregulate the expression of RUNX3 through epigenetic mechanism.
Hepatitis B virus X protein; hepatocellular carcinoma; runt-related transcription factor 3; DNA methyltransferase 3A; methylation
国家自然科学基金青年科学基金项目(No. 81301444)和福建省中青年教师教育科研项目(No. JB13128)联合资助
叶韵斌,Email:zjyunbin@189.cn
1.福建省肿瘤医院肿瘤免疫学研究室,福建省肿瘤转化医学重点实验室,福州 350014;
2.福建省立医院病理科,福建医科大学省立临床医学院,福州 350001
10.3969/j.issn.1002-2694.2016.08.007
373
A
1002-2694(2016)08-0717-06
2016-03-09;
2016-05-08
