汉坦病毒Hunan03株S基因克隆、表达及核蛋白免疫原性分析
2016-12-01高立冬刘建高何方玲刘佳惠邹义洲李俊华
蔡 亮,张 红,高立冬,刘建高, 覃 迪,何方玲,刘佳惠,邹义洲,李俊华
汉坦病毒Hunan03株S基因克隆、表达及核蛋白免疫原性分析
蔡 亮1,2,张 红1,高立冬1,刘建高1, 覃 迪1,何方玲1,刘佳惠1,邹义洲2,李俊华1
目的 构建汉坦病毒Hunan03株核蛋白基因原核重组表达载体,在大肠杆菌中进行核蛋白表达,研究核蛋白的免疫性及免疫反应性。方法 设计特异性扩增汉坦病毒Hunan03株S基因完整开放阅读框(ORF)的引物,RT-PCR扩增,产物克隆到pGM-T载体,转化感受态细胞TOP10,应用蓝白斑筛选、酶切、PCR鉴定,定向克隆到pGEX-6p-2原核表达载体,转化Ecoli.BL21 StarTM(DE3),IPTG诱导表达,SDS-PAGE、Western blot对重组蛋白进行鉴定。应用Glutathione Sepharose 4B纯化柱纯化重组蛋白,免疫新西兰兔,建立间接ELISA法对核蛋白的免疫原性与免疫反应性进行评价。结果 PCR扩增S基因ORF区域产物大小约1 306 bp,重组载体pGEX-6p-2-S经双酶切、PCR、测序鉴定提示构建成功;在37 ℃,IPTG浓度为0.8 mmol/L诱导5 h的条件下,表达出最高量的相对分子量约74 kDa的GST-NP融合蛋白。建立的间接ELISA法检测GST-NP融合蛋白免疫后的新西兰兔血清,IgM抗体滴度达1∶8 000,IgG抗体滴度达1∶16 000。结论 成功构建了高效表达的汉坦病毒S基因重组表达载体,获得了纯度较高具有较好的免疫原性与免疫反应性的核蛋白,为后续汉坦病毒单克隆抗体的制备奠定了基础。
汉坦病毒;S基因;原核表达;核蛋白免疫原性
汉坦病毒(Hantavirus, HV) 为分节段的单股负链RNA病毒,人和啮齿类动物均可被感染,其L、M、S基因分别编码依赖RNA的RNA聚合酶、包膜糖蛋白(G1、G2)及核衣壳蛋白(NP)[1]。NP又称核蛋白,由S基因编码,是病毒的主要结构蛋白,免疫原性极强,刺激机体可引起强烈的体液免疫和细胞免疫应答,产生的抗体滴度高、维持时间长,在抗病毒免疫中起重要作用,不同株、型的病毒NP氨基酸序列保守,常用作为HV感染后的诊断蛋白[2,3]。在前期研究中我们从黑线姬鼠肺组织中分离到了汉坦病毒Hunan03株(GenBank No. JN712306)[4],对S基因分子特征及核蛋白二级结构进行了预测和分析[5,8],在此基础上我们将S基因的ORF区域克隆到pGEX-6p-2原核表达载体,在大肠杆菌中进行了表达,利用动物实验对核蛋白的免疫原性与免疫反应性进行了初步研究,现将结果报道如下。
1 材料与方法
1.1 质粒、菌株与试剂 质粒pGEX-6P-2(GE Healthcare, USA),Glutathione Sepharose 4B蛋白纯化柱(GE Healthcare, USA),抗GST McAb(Cell Signaling Technology Inc,USA),Ecoli.BL21 StarTM(DE3)、JM109(TIANGEN,北京),Trizol、One-step RT-PCR System with Platinum○RTaq High Fidelity、Platinum○RPCR Super Mix、TOPO○R TA Cloning○R Kit(Invitrogen,USA)、T4 DNA连接酶、EcoRⅠ、XhoⅠ限制性内切酶、1 000 bp DNA Marker、低分子量蛋白Marker(Fermentas,Canada),胶回收试剂盒、小量质粒提取试剂盒(Axygen,USA)。
1.2 引物设计与合成 根据前期研究上传至GenBank的汉坦病毒Hunan03株(GenBank No. JN712306)S基因编码区序列及质粒pGEX-6P-2多克隆位点,应用Primer Premier 6.0设计一对扩增S基因编码区全长的特异性引物,为了便于克隆与表达,在引物两端引入EcoRⅠ和XhoⅠ酶切位点及保护性碱基。上游引物pGEX-6P-2-F:5′-TAGAATTCTGATGGCAACTATGGAGG- 3′(5′端下划线部分为EcoRⅠ酶切位点);下游引物pGEX-6P-2-R : 5′-CGCTCGAGTTATAGTTTTAAAGGCTC- 3′(5′端下划线部分为XholⅠ酶切位点),委托Invitrogen公司合成。
1.3 RNA提取、cDNA合成及PCR产物纯化回收 Trizol 法提取HV鼠肺组织Hunan03株阳性标本总RNA,在引物pGEX-6P-2-F、pGEX-6P-2-R作用下,应用One-step RT-PCR System with Platinum○RTaq High Fidelity试剂盒对S基因ORF区域进行一步法逆转录及扩增。扩增产物经1.0%琼脂糖凝胶电泳,应用Axygen胶回收试剂盒对产物进行纯化回收。
1.4 TA克隆与鉴定 PCR产物纯化回收后,参照TOPO○RTA Cloning Kit说明书按照PCR产物与T载体1∶5的比例于22 ℃进行连接反应,取10 μL连接产物转化Ecoli. TOP10,挑选阳性克隆抽提质粒,应用Platinum○RPCR Super Mix试剂盒进行 PCR鉴定,应用EcoRⅠ、XhoⅠ于37 ℃进行双酶切鉴定。
1.5 重组质粒pGEX-6P-2/S的构建与鉴定 鉴定后的TA克隆阳性质粒与pGEX-6P-2空质粒在37 ℃条件下同时进行EcoRⅠ、XhoⅠ双酶切、电泳、目的片段回收纯化。在1∶3比例下应用T4 DNA连接酶于22 ℃连接反应10 min,取连接产物10 μL转化感受态细胞TOP10,涂布100 μg/mL氨苄青霉素的LB平板,37 ℃倒置培养过夜。挑选单克隆菌落,抽提质粒,取1 μL进行PCR鉴定。应用EcoRⅠ、XholⅠ对重组质粒进行双酶切,PCR产物及酶切产物于1.0%琼脂糖凝胶电泳,对pGEX-6P-2/S重组质粒送Invitrogen公司进行序列测定。
1.6 S基因的表达 将pGEX-6P-2/S重组质粒转化工程菌Ecoli.BL21 StarTM(DE3)感受态细胞,37 ℃培养24 h,挑单克隆菌落于含100 ug/mL氨苄青霉素的LB培养液中(2 mL)培养至OD值为0.6左右,加入不同浓度IPTG(0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L、1.0 mmol/L、1.2 mmol/L),37 ℃水浴诱导培养3~8 h,离心收集菌体。
1.7 包涵体的溶解与复性 收集的菌体经冰浴超声裂解,应用洗液Ⅰ(60 mmol/L EDTA,4% Triton X-100,1.5 mol/L NaCl,pH7.0),洗液Ⅱ(0.1 mol/L Tris-Cl,20 mmol/L EDTA,2 mol/L Urea,pH7.0)洗涤,收集上清和包涵体,12%SDS-PAGE电泳。包涵体应用溶解液(8 mol/L Urea,20 mmol/L Tris-Cl,1 mmol/L EDTA,6 mmol/L DTT,pH8.0)溶解过夜后装入含GST融合蛋白复性液(20 mmol/L Tris-Cl pH8.0,1 mmol/L EDTA pH8.0,0.9 mmol/L GSH,0.1 mmol/L GSSG)的透析袋中复性24 h。
1.8 GST-NP重组蛋白纯化、Western blot 将10 mL Glutathione Sepharose 4B 加入GST蛋白纯化柱,PBS洗涤至柱平衡,以0.1 mL/ min流速加入10 mL 的复性蛋白,使蛋白充分吸附,PBS 洗涤层析柱至重新平衡,超纯水洗脱目的蛋白,具体操作参考GST蛋白纯化柱说明进行。洗脱的GST-NP融合蛋白经12% SDS-PAGE 电泳分离,电转移至PVDF膜,以抗GST McAb为一抗、HRP标记的羊抗鼠抗体为二抗, ECL显影,Western blot鉴定。
1.9 GST-NP重组蛋白浓度测定 在核酸蛋白分析仪上,采用A280紫外分光光度法,应用BSA蛋白浓度标准品绘制标准曲线,测定纯化后GST-NP浓度。
1.10 动物实验制备抗GST-NP重组蛋白特异性抗体 以鉴定的重组蛋白GST-NP为免疫原免疫新西兰兔(雄性,6只,2.5~3.0 kg/只),初次免疫用纯化蛋白200 μg与等体积弗氏完全佐剂注射器搅拌混匀,皮内多点注射,15 d后每隔10 d用纯化蛋白100 μg与等体积弗氏不完全佐剂混匀,加强免疫3次;同时用纯化蛋白的洗涤液和GST蛋白各免疫2只新西兰兔作对照;每次免疫前于耳缘静脉采血,末次免疫10 d后心脏采血,离心分离血清,保存于-20 ℃。
1.11 免疫血清抗GST-NP重组蛋白抗体滴度测定 用0.05 mmol/L碳酸盐缓冲液(pH9.6)稀释纯化的GST-NP重组蛋白至1 mg/L,按每孔100 μL包被酶标板过夜,间接ELISA法检测PBS系列稀释的末次兔免疫血清,二抗为羊抗兔IgG-HRP和IgM-HRP 100 μL(1∶1 000稀释),TMB显色,酶标仪测定A450值,以对照组兔血清作阴性对照,待测样本A450值/阴性对照A450值≥2.1(P/N值≥2.1)为阳性,阳性最高抗体稀释度为血清效价。
2 结 果
2.1 S基因的PCR扩增及TA克隆鉴定 Trizol提取后的RNA经pGEX-6P-2-F、pGEX-6P-2-R引物进行一步法RT-PCR扩增S基因,1.0%琼脂糖凝胶电泳显示扩增条带约1 306 bp,与预期大小一致,提示扩增的DNA为目的片段。以抽提后的TA克隆质粒为模板,用pGEX-6P-2-F、pGEX-6P-2-R引物对S基因进行PCR扩增,产物经1.0%琼脂糖凝胶电泳,可见一约1 306 bp的目的条带(图1),以构建好的pUCm-T/S经EcoR I、XhoI双酶切鉴定,酶切后的产物经1.0%琼脂糖凝胶电泳,可见一约1 306 bp的目的条带,与预期值一致。
2.2 pGEX-6P-2/S的构建与鉴定 以抽提后的质粒pGEX-6P-2/S为模板,以pGEX-6P-2-F、pGEX-6P-2-R为引物进行PCR扩增,可见一约1 306 bp的目的条带(图1),与预期值一致。用限制性内切酶EcoRⅠ、XholⅠ对重组质粒pGEX-6P-2/S进行双酶切,得到与目的基因(1 306 bp)及载体(4 985 bp)相同大小的2个片段(图1)。挑取含插入片段pGEX-6P-2/S的阳性克隆,用小量质粒提取试剂盒提取质粒测序,结果表明S基因片段已经成功的插入pGEX-6P-2载体,且插入方向正确。
2.3 测序结果分析 核蛋白基因编码区以起始密码ATG开始,以终止密码子TAA结尾,ORF长1 290个核苷酸残基,包括碱基A423个(32.79%),碱基C244个(18.91%),碱基G325个(25.19%),碱基T298个(23.10%),GC含量为44.11%,AT含量为55.89%,单链分子量约为391.41 kDa,编码429个氨基酸(20种),平均分子量为48.13 kDa,含量最高的氨基酸为Leu(亮氨酸),占总蛋白含量的9.79%(42/429),含量最低的为Cys(半胱氨酸)和Trp(色氨酸),仅各占1.17%(5/429)。
2.4 pGEX-6P-2/S的表达与鉴定 含重组质粒pGEX-6P-2/S的E.coliStarTMBL21(DE3)菌株应用不同浓度IPTG进行诱导,SDS-PAGE凝胶电泳图上均显示特异性条带,蛋白分子量与理论值一致,约为74 kDa。菌株在IPTG终浓度0.8 mmol/L、37 ℃条件下诱导5 h条件下,表达量最大(图2)。菌体经超声波破菌,包涵体经8 mol/L尿素溶解后过GST亲和层析柱,SDS-PAGE凝胶电泳显示单一的目的蛋白条带,分子量与预期大小一致,约74 kDa,融合蛋白主要存在于不溶性的包涵体中。
2.5 NP蛋白的纯化与Western blot鉴定 A280紫外分光光度法测得蛋白浓度为1.80 mg/mL。蛋白复性后经GST蛋白纯化柱纯化,SDS-PAGE凝胶电泳显示蛋白分子量约74 kDa(图3);以抗GST McAb为一抗、HRP标记的羊抗鼠IgG为二抗的Western blot在相应位置出现特异性条带。
2.6 重组蛋白免疫原性 重组蛋白免疫新西兰兔4次后,间接ELISA法检测血清中特异性IgG和IgM抗体显著升高,其效价分别达到1∶16 000和1∶8 000以上,血清阳性反应率为6/6。同时阴性对照组兔免疫4次后,血清中未检出抗GST-NP特异性抗体。
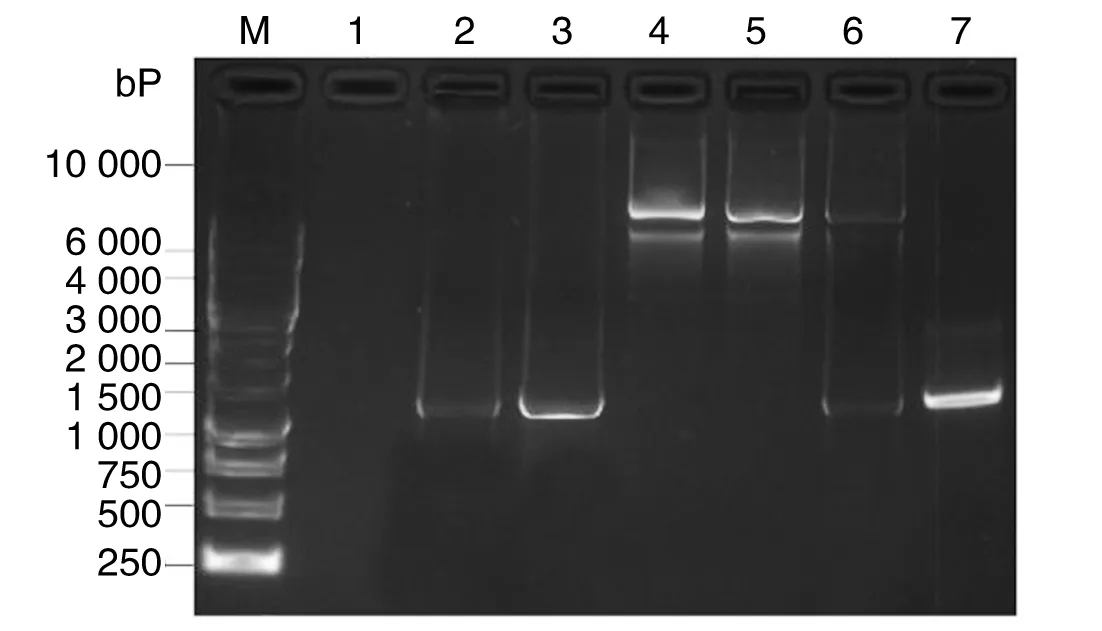
M:1 kb DNA ladder;1:PCR阴性对照;2:RT-PCR;3:重组质粒pGEX-6P-2/S为模板的PCR产物;4:空质粒pGEX-6P-2;5:重组质粒pGEX-6P-2/S;6:重组质粒pGEX-6P-2/S经EcoR I、Xho I双酶切;7:重组质粒pUCm-T/S经EcoR I、Xho I双酶切M: 1kb DNA ladder;1:PCR negative control;2:RT-PCR;3:PCR products of recombinant plasmid pGEX-6P-2/S;4:Plasmid of pGEX-6P-2;5: Recombinant plasmid of pGEX-6P-2/S;6: Recombinant plasmid of pGEX-6P-2/S digested by EcoR I and Xho I;7: Recombinant plasmid pUCm-T/S digested by EcoR I and Xho I图1 S基因原核重组质粒pGEX-6P-2/S构建(8 cm length gel,1×TAE,7V/cm,45 min)Fig.1 Construction of the prokaryotic expression recombinant plasmid of pGEX-6P-2/S
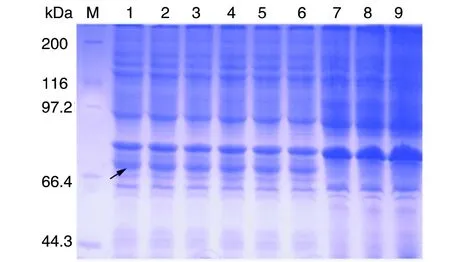
M:蛋白Marker;1-6: 0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L、1.0 mmol/L、1.2 mmol/L IPTG诱导pGEX-6P-2/S;7:空质粒pGEX-6P-2;8:空菌E.coli BL21 StarTM(DE3);9:pGEX-6P-2/S未经IPTG诱导M:Protein Marker,1-6: 0.2 mmol/L,0.4 mmol/L,0.6 mmol/L,0.8 mmol/L,1.0 mmol/L,1.2 mmol/L IPTG induced pGEX-6P-2/S,7:Plasmid of pGEX-6P-2,8:E.coli BL21 StarTM(DE3),9:pGEX-6P-2/S induced without IPTG图2 重组质粒pGEX-6P-2/S在大肠杆菌中的诱导表达(12%SDS-PAGE)Fig.2 Recombinant plasmid pGEX-6P-2/S expressed in Ecoli. BL21 StarTM(DE3)
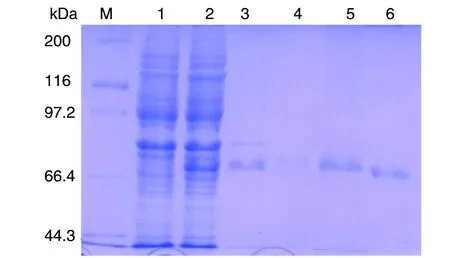
M:蛋白Marker;1:pGEX-6P-2/S未经IPTG诱导;2:pGEX-6P-2/S经1.0 mmol/L IPTG诱导;3:过GST蛋白纯化柱前;4:过GST蛋白纯化柱后;5:第一次洗脱液,6:第二次洗脱液M:Protein Marker,1:pGEX-6P-2/S induced without IPTG,2:pGEX-6P-2/S induced with 1.0 mmol/L IPTG,3:Induced products of pGEX-6P-2/S before purification,4:Induced products of pGEX-6P-2/S after purification,5:The first eluant,6:The second eluant图3 Hunan03株汉坦病毒核蛋白纯化效果分析(12%SDS-PAGE)Fig.3 The purification of hantavirus nucleoprotein of Hunan03(12%SDS-PAGE)
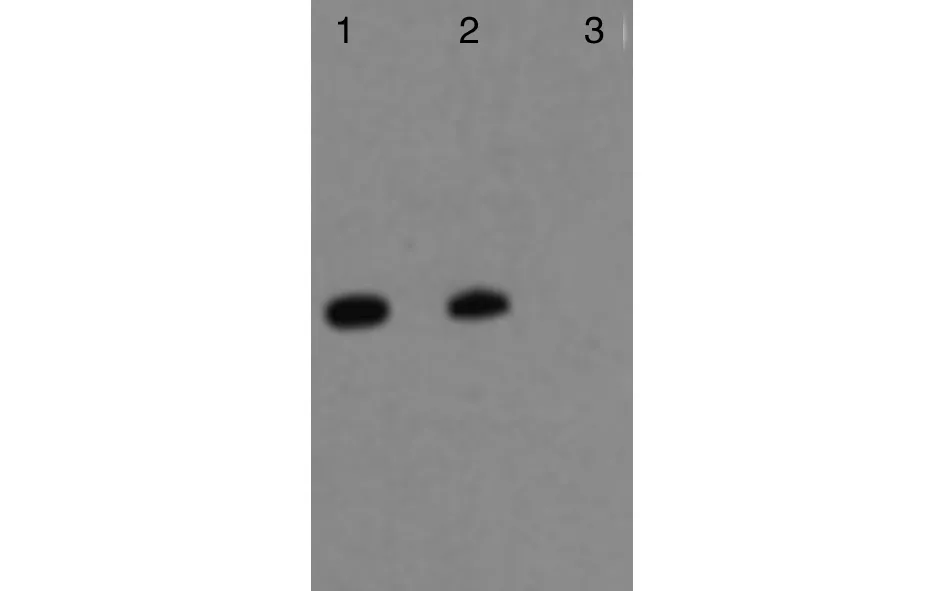
1:pGEX-6P-2/S经0.8 mmol/L IPTG诱导表达产物;2:纯化后的pGEX-6P-2/S重组蛋白;3:pGEX-6P-2/S无IPTG诱导产物1:The expression product of recombinant plasmid of pGEX-6P-2/S with 0.8 mmol/L IPTG,2:Purified recombinant pGEX-6P-2/S nucleoprotein,3:The expression product of recombinant plasmid of pGEX-6P-2/S without IPTG图4 Hunan03株汉坦病毒核蛋白免疫印迹分析Fig.4 Immunoblot analysis of hantavirus recombinant nucleoprotein of Hunan03
表1 ELISA法检测新西兰兔免疫血清中GST-NP特异性抗体滴度及阳性反应率
Tab.1 Specificity antibody titer in New Zealand rabbit serum detected by ELISA and the positive rate analysis

分组Groups新西兰兔(只)No.ofNewZealandrabbitIgM抗体滴度TiterofIgMIgG抗体滴度TiterofIgG阳性率(%)Positiverate(%)免疫组Immunegroup6≥1∶8000≥1∶160006/6(100%)缓冲液对照组Buffersolutioncontrol2--0/2(0)GST对照组GSTcontrol2--0/2(0)
注:结果以待测标本平均A450值/阴性对照A450值≥2.1为阳性,以出现阳性反应的最高稀释度作为该血清的滴度。
Note:If the ratio of the absorbance value of the sample to the negative control at 450nm was ≥2.1,the sample was considered as positive, and the highest serum dilution was the serum’s titer.
3 讨 论
不同株、型的汉坦病毒核蛋白氨基酸序列相对保守,均携带有T细胞和B细胞抗原决定簇,能诱导机体产生特异性体液免疫应答和细胞免疫应答,可直接与体外转录病毒的RNA及被感染细胞的细胞器结合,起着调节病毒复制的作用[6]。以前汉坦病毒感染后的血清学诊断所用抗原常为病毒感染的组织细胞,其敏感性、特异性和可操作性不是十分理想,免疫印迹实验表明重组的完整核蛋白或截短的核蛋白均具有良好的免疫原性和免疫反应性,可替代天然抗原用于汉坦病毒感染的实验室诊断[7]。
前期研究表明Hunan03株来源于野生黑线姬鼠,属汉坦病毒HTN型,S基因编码的核蛋白由428~433个氨基酸组成,相对分子量为49~51 kDa,基因片段抗原位点呈非构象依赖性。在感染细胞内过量表达时由于肽链的合成速度过快且缺乏足够的时间和空间进行折叠和盘曲,可形成颗粒状包涵体[8]。本研究通过对汉坦病毒S基因的ORF区域进行克隆、测序和表达,获得了一分子量约74 kDa的GST-NP融合蛋白,SDS-PAGE试验表明融合蛋白以包涵体形式存在于菌体中,由于包涵体组织结构稳定,实验中应用低浓度的表面活性剂十二烷基磺酸钠和低浓度的变性剂尿素等在低能量的超声波中除去了大部分杂质,采用含Triton X-100、EDTA的洗涤液洗涤包涵体,大部分杂蛋白得到了洗脱,用含8 mol/L尿素的溶解液对包涵体进行了较好的溶解。pGEX-6P-2载体自身携带有分子量为26 kDa的在解毒过程中起重要作用的谷胱甘肽巯基转移酶(GST),具有增加外源基因的表达、提高表达蛋白的可溶性和易纯化的特点,我们应用GST琼脂糖凝胶纯化柱一步分离到了纯度较高的目的蛋白。
包涵体蛋白的复性是一个费时且效率较低的过程,经常会导致重组蛋白的损失,是基因工程研究领域的瓶颈。本研究经条件摸索后发现:采用缓慢透析法、氧化型和还原型谷胱甘肽相结合的方法对汉坦病毒核蛋白复性非常有效。即在4 ℃条件下,用8 mol/L Urea溶液作为起始透析液,然后逐渐降低透析液的尿素浓度,由于尿素浓度下降连续缓慢,减少了复性过程中蛋白沉淀,提高复性蛋白回收率。研究中还发现核蛋白含有较多的二硫键,我们通过在复性缓冲液中加入2 mol/L还原型谷胱甘肽GSH和0.2 mol/L氧化型谷胱甘肽 GSSG,能有效促进二硫键的形成,有利于汉坦病毒核蛋白恢复其天然的空间结构,从完全伸展的变性状态恢复到正常的折叠结构,最大程度地恢复了变性后重组蛋白的生物活性。
将GST-NP重组蛋白包被酶标板,以羊抗兔IgG-HRP和IgM-HRP为二抗,建立的间接ELISA法检测免疫45 d之后的兔血清,IgG和IgM抗体其效价分别达到1∶16 000和1∶ 8 000以上,血清阳性反应率为100%。说明重组蛋白GST-NP具有较好的免疫原性和免疫反应性,为后续汉坦病毒单克隆抗体的制备奠定了基础。
[1] Antic D, Kang CY, Spik K, et al. Comparison of the deduced gene products of the L, M and S genome segments of Hantavirus[J]. Virus Res, 1992, 24(1): 35-46.DOI: 10.1016/0168- 1702 (92)90029-9
[2] Elliott RM, Schmaljohn CS, CoHeu MS. Bunyaviridae genome structure and gene expression[J]. Curt Top Microbiol Immunol, 1991, 169: 91-141. DOI:10.1007/ 978 -3-642-76018-1_4
[3] Li JL,Li DX. The research progress of hantavirus[J].Chinese J Exp Clin Virol, 2005, 19(2):198-200.(in Chinese)
李家亮,李德新.汉坦病毒病原学研究进展[J].中华实验和临床病毒学杂志,2005,19(2):198-200.
[4] Li JH,Cai L,Gao LD,et al. Epidemiologic and phylogenetic study on hemorrhagic fever with renal syndrome in Hunan province from 2007 to 2010[J]. Chin PREV Med, 2012,10(10):724-728.(in Chinese)
李俊华,蔡亮,高立冬,等.2007-2010年湖南省肾综合征出血热监测及病毒种系进化分析[J].中国预防医学杂志,2012,10(10):724-728.
[5] Cai L, Zhang H,Gao LD,et al.Detection and genotyping of hantavirus M and S gene and its phylogenetic analysis[J].Chinese journal of Zoonoses, 2012,28(2):111-115.(in Chinese)
蔡亮,张红,高立冬,等.汉坦病毒M、S基因分型及种系进化分析[J].中国人兽共患病学报,2012,28(2):111-115.
[6] Xue XP,Xu ZK,Ma WY,et al. Hantavirus nucleoprotein sectorial expression and the epitope analysis[J].Virologica Sinica, 2000,15(3):220-224. (in Chinese)
薛小平,徐志凯,马文煜,等.汉滩病毒核蛋白的分段表达及抗原表位分析[J].中国病毒学,2000,15(3):220-224.
[7] Yao ZH,Dong GM.Hantavirus research progress[J]. Chinese journal of Zoonoses, 1999,15(5):75-79. (in Chinese)
姚智慧,董关木.汉坦病毒(Hantavirus)研究进展[J].中国人兽共患病杂志,1999,15(5):75-79.
[8] Cai L,Gao LD,Zhang H,et al. The characteristics of hantanvirus Hunan03 strain S gene and the nucleoprotein structure prediction[J]. Chin J Microbiol Immunol, 2012,32(8):725-729. (in Chinese)
蔡亮,高立冬,张红,等.汉坦病毒Hunan03株S基因分子特征及核蛋白结构分析[J].中华微生物学和免疫学杂志,2012,32(8):725-729.
Cloning and expression of hantavirus nucleoprotein gene of Hunan03 and its immunogenicity
CAI Liang1,2, ZHANG Hong1, GAO Li-dong1, LIU Jian-gao1,QIN Di1,HE Fang-ling1, LIU Jia-hui1, ZOU Yi-zhou2, LI Jun-hua1
(1.HunanProvincialCenterforDiseaseControlandPrevention,theKeyLaboratoryofMicrobialMolecularBiologyofHunanProvince,Changsha410005,China;2.SchoolofBasicMedicalScience,CentralSouthUniversity,Changsha410013,China)
We cloned the hantavirus nucleoprotein gene and expressed it inE.colifor laboratory diagnosis. The whole open reading frame(ORF)of hantavirus Hunan03 strain S gene was amplified by RT-PCR after designing specific primers, and the PCR products was cloned into the pGM-T vector and transformed into competent cell of TOP10 and identified by the assay of blue-white spot screening, PCR and enzyme digestion. Then, we directed cloned the S gene into the prokaryotic expression vector of pGEX-6p-2 and the recombinant plasmid of pGEX-6p-2/S was transformed into the competent cell ofE.coliBL21 StarTM(DE3) and induced by IPTG. We identified the expression product by SDS-PAGE and Western-blot. Results showed that the PCR product of S gene was about 1 306 bp. The recombinant plasmid of pGEX-6p-2/S was constructed successfully after being identified by PCR and double enzyme digestion. Under the condition of 37 ℃ and 0.8 mmol/L IPTG induction, the pGEX-6p-2/S has expressed a 74 kDa fusion GST-NP protein. The successful expression of the recombinant prokaryotic plasmid pGEX-6p-2/S will benefit to the laboratory diagnosis of hantavirus infection.
hantavirus; nucleoprotein gene; prokaryotic expression; Nucleoprotein immunogeicity
李俊华,Email: hncdc_ljh@163.com
邹义洲,Email:289034452@qq.com
1. 湖南省疾病预防控制中心,湖南省微生物分子生物学重点实验室,长沙 410005;
2. 中南大学基础医学院,长沙 410013
10.3969/j.issn.1002-2694.2016.08.006
373
A
1002-2694(2016)08-0711-06
2016-03-29;
2016-05-19
湖南省科技厅科研基金(No.2013TT2016)资助
Supported by the Project of the Scientific & Technological of Hunan province (No.2013TT2016).Corresponding authors: Li Jun-hua, Email: hncdc_ljh@163.com;Zou Yi-zhou, Email: 289034452@qq.com
