巨噬细胞刺激因子(MSF)与巨噬细胞抑制因子(MIF)对视网膜节细胞轴突再生的影响
2016-12-01岑令平梁嘉健张铭志
岑令平,梁嘉健,张铭志
巨噬细胞刺激因子(MSF)与巨噬细胞抑制因子(MIF)对视网膜节细胞轴突再生的影响
岑令平,梁嘉健,张铭志
目的研究巨噬细胞刺激因子(macrophage stimulating factor,MSF)及巨噬细胞抑制因子(macrophage inhibitory factor,MIF)对视网膜节细胞(retinal ganglion cell,RGC)轴突再生的影响。方法实验性研究。费希尔大鼠9只,施行视神经损伤术7 d后取出眼球并剥离视网膜,把剥离下来的视网膜平铺,放射状剪成8片,每一片视网膜粘铺于已包被好的培养板孔中,分为对照组、MSF组、MIF组,分别加入培养基及MSF/MIF等处理因素试剂;培养7 d后对视网膜培养块进行固定及免疫荧光染色,分别计数RGC再生神经轴突的数量及长度和外迁巨噬细胞的数量。结果与对照组相比,MSF及MIF可以一定程度上分别增多及减少迁移巨噬细胞的数量(P>0.05),与此同时,MIF可以减少RGC再生神经轴突的数量及长度(P<0.05),MSF虽未能增加神经突的长度,但还是有效地增加了再生神经突的数量(P<0.05)。结论MSF可以促进RGC神经轴突的再生,与此相反MIF可以抑制神经轴突的再生。
视网膜节细胞;巨噬细胞;视神经损伤;存活;神经再生
视神经损伤严重影响视觉功能,甚至可以导致视力丧失而致盲。视神经损伤会引起大量视网膜神经节细胞(retinal ganglion cell,RGC)继发性凋亡,从而导致视力损害。研究表明,在大鼠视神经被横切3周后,只有约10%的RGC能存活下来〔1〕。视神经属于中枢神经系统的一部分,在损伤后缺乏再生的能力,而且中枢神经胶质存在很多阻碍神经轴突生长的抑制因子,迄今仍缺乏有效的治疗手段。目前大量动物实验研究表明,在适当的条件下,中枢神经纤维也可以再生,促进再生的方法包括应用神经营养因子〔2〕、雪旺氏细胞移植、外周神经移植、下调神经生长抑制因子等〔3〕。
近年的研究显示,通过往眼内注入巨噬细胞激活剂酵母聚糖(zymosan,ZYM)来激活巨噬细胞同样可以显著地促进RGC的存活及神经轴突再生〔4〕,而应用巨噬细胞抑制因子(macrophage inhibitory factor,MIF)或巨噬细胞清除剂氯膦酸二钠脂质体可以明显降低其促进神经修复的作用〔5〕。然而,眼内注射ZYM除了可以趋化并激活来自外周血的巨噬细胞外,还有可能激活视网膜组织当中的巨噬细胞-小胶质细胞〔6〕,并产生相应的生物学作用,但这些作用是否有利于神经修复尚未被完全阐明。我们前期的研究工作表明,视神经损伤本身可以激活视网膜的小胶质细胞,使其转变成巨噬细胞,以清除凋亡的RGC〔7〕。有研究显示,巨噬细胞刺激因子(macrophage stimulating factor,MSF)及MIF可以直接影响巨噬细胞/小胶质细胞的活性,从而影响实验性自身免疫性脑脊髓炎的转归〔8〕。本研究拟应用体外视网膜整体培养模型,研究MSF/MIF对巨噬细胞/小胶质细胞的作用,并观察其对培养视网膜中神经轴突再生的直接影响。
1 材料和方法
1.1实验材料
8~10周龄费希尔大鼠9只,体质量约200 g(北京维通利华公司);生物安全柜(上海瑞仰净化装备公司);手术显微镜(德国LEICA);眼科手术器械(苏州六六公司);培养板(美国Corning);二氧化碳培养箱(美国REVCO);倒置荧光显微镜(日本Nikon);图像采集分析系统(美国Conpix)。神经细胞培养基Neurobasal-A、B27及谷氨酰胺(美国Invitrogen);视网膜节细胞特异性抗体TUJ-1(美国COVANCE);巨噬细胞特异性抗体ED-1(美国Serotec);Cy3荧光染料(美国Jackson Lab);MSF(美国Sigma-Aldrich);MIF(美国Sigma-Aldrich)。
1.2实验方法
1.2.1视神经损伤模型:研究发现,视神经损伤本身可以刺激培养中RGC神经轴突的再生,因此在视网膜整体培养之前7 d,我们对视神经进行损伤处理〔9〕。具体操作如下:腹腔注射1.5 ml/kg 1:1混合的盐酸氯胺酮(100 mg/ml)及盐酸赛拉嗪(20 mg/ml)麻醉大鼠。在左侧眼球上方切开结膜切口长约5 mm,分离眼外肌及眶内结缔组织暴露视神经。在距离眼球后端1.5 mm处用显微眼科镊夹紧视神经持续10 s,以达到完全离断视神经而确保视神经外鞘膜完整性,操作中注意避免伤及行走在视神经下的血管〔5〕,损伤术后大鼠存活7 d。
1.2.2包被培养板:视网膜培养在24孔培养板中进行,培养板需进行预先包被,每孔加入0.25 ml多聚赖氨酸(200 μg/ml溶于超纯水)在37℃,5%CO2培养箱中静置过夜。超纯水洗5 min×3次,加入层粘连蛋白[20 μg/ml溶于磷酸盐缓冲液(PBS)]置于37℃,5%CO2培养箱中2 h,进行视网膜培养前用PBS洗3次。
1.2.3视网膜分组培养:9只大鼠在视神经损伤术后7 d进行过量麻醉处死,无菌操作下取出眼球,置于冰冷的平衡盐溶液中进行视网膜剥离,把剥离下来的视网膜平铺,放射状剪成8片,取其中的3片随机分配至对照组、MSF及MIF处理组,即每组培养9个视网膜块,每组里面的各个视网膜培养块均取自不同个体大鼠左侧眼球的视网膜。将每一片视网膜粘铺于已包被好的培养板孔中,对照组加入0.5 ml培养基(Neurobasal-A+B27+谷氨酰胺+青霉素/链霉素),MSF、MIF组除培养基外分别加入MSF(终浓度为1 μmol/L)及MIF(终浓度为5 μmol/L),均置于37℃,5%CO2培养箱中培养7 d〔5〕。
1.2.4免疫组织化染色观察再生神经轴突及迁移巨噬细胞:培养7 d后,用4%多聚甲醛(上海生工公司)固定视网膜2 h,然后用PBS洗5 min×3次,加10%正常羊血清封闭液,湿盒内室温封闭1 h,吸掉多余液体,加入视网膜节细胞特异性抗体TUJ-1或巨噬细胞特异性抗体ED-1,湿盒内常温1 h,PBS洗5 min×3次,加入荧光二抗Cy3,湿盒内常温1 h,PBS洗5 min×3次后在倒置荧光显微镜下观察再生神经轴突或迁移的巨噬细胞,并对每个视网膜培养块再生轴突的数量与长度及外迁巨噬细胞的数量分别进行统计。再生轴突的数量为从每个视网膜培养块长出的所有神经轴突的数量;把每个视网膜培养块再生最长的5根轴突长度的平均值记录为再生轴突的长度〔5〕。
1.3统计学方法
应用GraphPad InStat(V2.04)统计软件对所得数据进行分析。各组数值以均数±标准误()表示,组间总体差异比较采用单因素方差分析,两两比较采用Bonferroni法〔10-11〕。检验水准α=0.05。
2 结果
2.1MSF/MIF对巨噬细胞迁移的影响
往视网膜外迁移的巨噬细胞形态及数量分别为图1A、1B、1C所示。巨噬细胞在视网膜培养第3~4天开始从视网膜块里往外迁移,并日渐增加,培养7 d后,对照组平均每个视网膜培养块往外迁移的巨噬细胞数量为306±34。当培养基中加入巨噬细胞激活剂MSF后,往外迁移的巨噬细胞平均数量约增多了30%(402±43),而应用巨噬细胞抑制剂MIF后,外迁的巨噬细胞数量则明显下降了30%(208±35)。MSF或MIF处理后,虽然迁移的细胞平均数量有所改变,但由于变异性较大,与对照组相比差别并没有统计学意义(P>0.05);然而MSF与MIF组间的差异则非常明显(P<0.01)(表1)。
2.2MSF/MIF对RGC神经轴突再生的影响
从视网膜培养块长出的RGC神经轴突形态及数量分别为图1D、1E、1F所示。在视网膜培养第2天开始即可见少量神经轴突从视网膜培养块边缘生长出来,并沿培养板表面向外延伸,神经突的数量及长度日渐增加。视网膜培养7 d后,对照组视网膜培养块的平均再生神经轴突数量为23±2.8,长度为(1.31±0.12)mm。MSF在促进巨噬细胞迁移的同时也明显促进神经轴突的再生,使其数量增加50%(36±3.3)(P<0.05),但神经轴突的长度并未明显受影响[(1.53±0.09)mm]。MIF则可以明显抑制神经轴突的再生,与对照组比较,它既可以减少再生神经轴突的数量(12±2.7)(P<0.05),同时也使再生神经轴突的长度降低了40%[(0.82±0.11)mm)](P<0.05)(表1)。
表1 各组大鼠视网膜培养7 d后巨噬细胞迁移及神经节细胞再生指标比较()
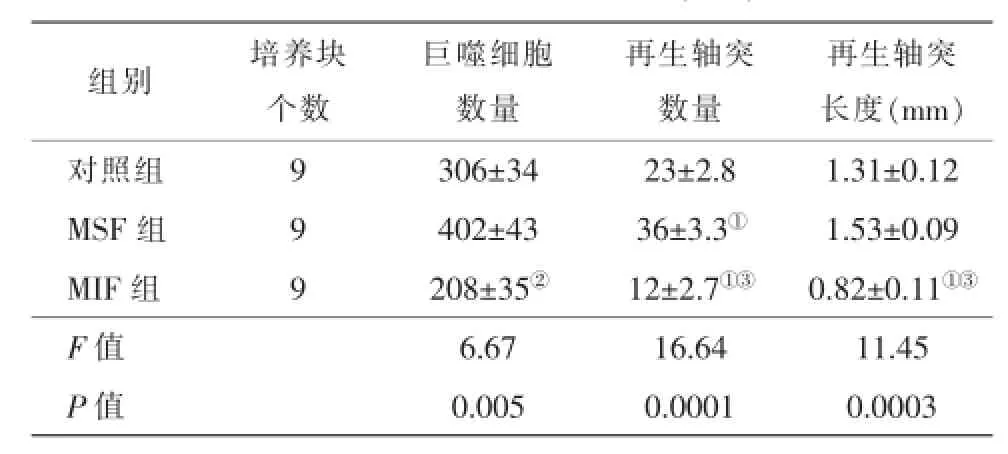
表1 各组大鼠视网膜培养7 d后巨噬细胞迁移及神经节细胞再生指标比较()
注:单因素方差分析,多重比较采用Bonferroni法。与对照组比较,①P<0.05;与MSF组比较,②P<0.01,③P<0.001 MSF:巨噬细胞刺激因子MIF:巨噬细胞抑制因子
再生轴突长度(m m)对照组9 3 0 6 ± 3 4 2 3 ± 2 . 8 1 . 3 1 ± 0 . 1 2 M S F组9 4 0 2 ± 4 3 3 6 ± 3 . 3①1 . 5 3 ± 0 . 0 9 M I F组9 2 0 8 ± 3 5②1 2 ± 2 . 7①③0 . 8 2 ± 0 . 1 1①③F值6 . 6 7 1 6 . 6 4 1 1 . 4 5 P值0 . 0 0 5 0 . 0 0 0 1 0 . 0 0 0 3组别培养块个数巨噬细胞数量再生轴突数量
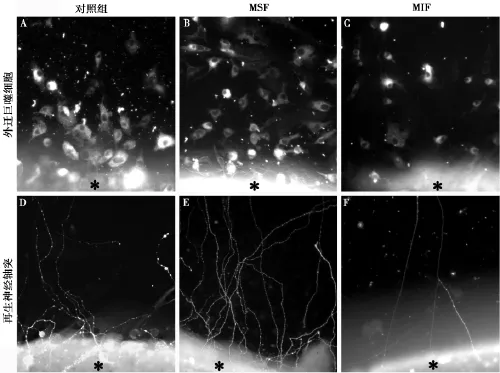
图1 各组大鼠视网膜培养7 d后倒置荧光显微镜像(Cy3×200)。显示视网膜培养中外迁的巨噬细胞及再生的神经轴突纤维。对照组可见巨噬细胞(A)及神经轴突(D)从视网膜培养块(*)边缘外迁及生长出来,并向外延伸;MSF组可见外迁巨噬细胞(B)及再生神经轴突(E)明显增多;MIF组可见外迁巨噬细胞(C)及再生神经轴突(F)显著减少MSF:巨噬细胞刺激因子MIF:巨噬细胞抑制因子
3 讨论
我们先前的研究发现睫状神经营养因子(ciliary neurotrophic factor,CNTF)除了能够促进RGC的存活及轴突再生〔11〕,也可以导致眼内巨噬细胞的增加,并证明趋化到眼内的巨噬细胞也参与CNTF的促神经修复作用〔5〕,其它研究也证实眼内巨噬细胞的直接激活可以有效地促进RGC存活及神经轴突再生〔4〕。被激活的巨噬细胞既可以分泌多种促神经修复的因子,其中包括主要促进神经元存活的因子如脑源性神经营养因子〔12〕,也包括主要促进神经轴突再生的因子,如癌调蛋白〔13〕。可见,巨噬细胞激活具有促进神经损伤后修复的作用。一般认为,眼内被激活的巨噬细胞是来自外周血液循环的单核巨噬细胞系统〔12〕,但有研究者认为视网膜内处于静息状态的巨噬细胞-小胶质细胞也可以被激活为具有吞噬功能及分泌功能的活性巨噬细胞〔14〕,这些细胞被激活后也可以分泌各种细胞因子及神经营养因子〔15-16〕,但神经组织来源的巨噬细胞是否具有促进神经损伤后修复的作用并没有被研究清楚。本研究通过应用MSF及MIF对体外培养的视网膜组织直接作用来研究其对视网膜组织自身的巨噬细胞及RGC神经轴突的再生的影响。MSF又称Tuftsin〔17〕,结构为苏氨酸-赖氨酸-脯氨酸-精氨酸,能够激活巨噬细胞并增强其自然杀伤及抗肿瘤的作用〔18〕;巨噬细胞抑制因子MIF在结构上比MSF少一个氨基酸,结构为苏氨酸-赖氨酸-脯氨酸,常用于抑制巨噬细胞的活性〔19〕。在体外视网膜培养模型中,由于缺乏外周血循环来源的巨噬细胞,我们可以观察到MSF及MIF对视网膜来源的巨噬细胞的直接作用,结果显示向培养块外迁移的巨噬细胞会分别相应地增多及减少;与此同时,MIF还可以减少RGC再生神经突的数量及长度,MSF虽未能增加神经突的长度,但还是有效地增加了再生神经突的数量。由此可见,视网膜来源的巨噬细胞被MSF激活后,很可能产生一些有利于神经轴突再生的因子,但是否会像血液源性的巨噬细胞一样,产生可以强烈促进轴突再生的癌调蛋白仍需进一步研究。
[1]Mey J,Thanos S.Intravitreal injections of neurotrophic factors support the survival of axotomized retinal ganglion cells in adult rats in vivo[J].Brain Res,1993,602(2):304-317.
[2]Cui Q,Lu Q,So KF,et al.CNTF,not other trophic factors,promotes axonal regeneration of axotomized retinal ganglion cells in adult hamsters[J].Invest Ophthalmol Vis Sci,1999,40(3):760-766.
[3]Chen MS,Huber AB,van der Haar ME,et al.Nogo-A is a myelinassociated neurite outgrowth inhibitor and an antigen for monoclonal antibody IN-1[J].Nature,2000,403(6768):434-439.
[4]Yin Y,Cui Q,Li Y,et al.Macrophage-derived factors stimulate optic nerve regeneration[J].J Neurosci,2003,23(6):2284-2293.
[5]Cen LP,Luo JM,Zhang CW,et al.Chemotactic effect of ciliary neurotrophic factor on macrophages in retinal ganglion cell survival and axonal regeneration[J].Invest Ophthalmol Vis Sci,2007,48(9):4257-4266.
[6]Baldwin KT,Carbajal KS,Segal BM,et al.Neuroinflammation triggered by beta-glucan/dectin-1 signaling enables CNS axon regeneration[J].Proc Natl Acad Sci U S A,2015,112(8):2581-2586.
[7]Cen LP,Han M,Zhou L,et al.Bilateral retinal microglial response to unilateral optic nerve transection in rats[J].Neuroscience,2015,311:56-66.
[8]Bhasin M,Wu M,Tsirka SE.Modulation of microglial/macrophage activation by macrophage inhibitory factor(TKP)or tuftsin(TKPR)attenuates the disease course of experimental autoimmune encephalomyelitis[J].BMC Immunol,2007,8:10.
[9]Fischer D,Petkova V,Thanos S,et al.Switching mature retinal ganglion cells to a robust growth state in vivo:gene expression and synergy with Rho A inactivation[J].J Neurosci,2004,24(40):8726-8740.
[10]Luo JM,Cen LP,Zhang XM,et al.PI3K/akt,JAK/STAT and MEK/ ERK pathway inhibition protects retinal ganglion cells via different mechanisms after optic nerve injury[J].Eur J Neurosci,2007,26(4):828-842.
[11]Park K,Luo JM,Hisheh S,et al.Cellular mechanisms associated with spontaneous and ciliary neurotrophic factor-cAMP-induced survival and axonal regeneration of adult retinal ganglion cells[J].J Neurosci,2004,24(48):10806-10815.
[12]Cui Q,Yin Y,Benowitz LI.The role of macrophages in optic nerve regeneration[J].Neuroscience,2009,158(3):1039-1048.
[13]Yin Y,Henzl MT,Lorber B,et al.Oncomodulin is a macrophagederived signal for axon regeneration in retinal ganglion cells[J].Nat Neurosci,2006,9(6):843-852.
[14]Garcia-Valenzuela E,Sharma SC,Pina AL.Multilayered retinal microglial response to optic nerve transection in rats[J].Mol Vis,2005,11:225-231.
[15]Hanisch UK.Microglia as a source and target of cytokines[J].Glia,2002,40(2):140-155.
[16]Hailer NP.Immunosuppression after traumatic or ischemic CNS damage:it is neuroprotective and illuminates the role of microglial cells[J].Prog Neurobiol,2008,84(3):211-233.
[17]Khare S,Bhutani LK,Rao DN.Quantitative assessment of tuftsin receptor expression and second messenger during in vitro differentiation of peripheral blood derived monocytes of leprosy patients[J].Mol Cell Biochem,1997,171(1-2):1-10.
[18]Gupta CM,Haq W.Tuftsin-bearing liposomes as antibiotic carriers in treatment of macrophage infections[J].Methods Enzymol,2005,391:291-304.
[19]Emmetsberger J,Tsirka SE.Microglial inhibitory factor(MIF/TKP)mitigates secondary damage following spinal cord injury[J].Neurobiol Dis,2012,47(3):295-309.
Effects of macrophage stimulating factor and macrophage inhibitory factor on retinal ganglion cell ax-on regeneration in retinal explant
CEN Lingping,LIANG Jiajian,ZHANG Mingzhi.
Joint Shantou International Eye Center of Shantou University and The Chinese University of Hong Kong,Shantou 515041,Guangdong,China
OBJECTIVE To investigate the effects of macrophage stimulating factor(MSF)and macrophage inhibitory factor(MIF)on retinal ganglion cells(RGC)axon regeneration in retinal explant.METHODS It was an experimental study.Seven days after optic nerve(ON)transection of Fischer rat,retinas were extracted out and flat-mounted onto a filter paper.After being cut into 8 pieces,each piece of retina was glued to the substrate of culture plate and incubated in culture medium with MSF or MIF interventions respectively.Retinal explants were fixed after cultured for seven days.After fluorescent immunostaining,migrating out macrophages and regenerating axon were counted under the fluorescent microscope.Main outcome were number of migrating out macrophage,number and length of regenerating axons.RESULTS Compared with the control group,MSF and MIF could increase or decrease the number of migrating out macrophages respectively.Meanwhile,MIF could increase the number of regenerating axons and their length.However,MSF could only increase the number of regenerating axons,but had no effect on axon length.CONCLUSIONS The MSF could promote axon regeneration in retinal explant,while MIF could inhibit axon regeneration.
retinal ganglion cell;macrophage;injury of optic nerve;subsist;axon regeneration
R774
A
1002-4379(2016)03-0150-04
10.13444/j.cnki.zgzyykzz.2016.03.003
国家自然科学研究基金(81570849);高等学校博士学科点专项科研基金(20114402120007);广东省自然科学基金(2015A030313446)
汕头大学·香港中文大学联合汕头国际眼科中心,广东汕头515041
岑令平,E-mail:cenlp@hotmail.com
