富硒茶中茶多酚和茶多糖的连续提取工艺研究
2016-11-21冯丽琴杨芙莲董文宾韩玮
冯丽琴,杨芙莲,董文宾,韩玮
(陕西科技大学食品与生物工程学院,陕西西安710021)
富硒茶中茶多酚和茶多糖的连续提取工艺研究
冯丽琴,杨芙莲,董文宾,韩玮
(陕西科技大学食品与生物工程学院,陕西西安710021)
采用紫阳富硒茶的老叶为原料,连续提取茶多酚和茶多糖,并测定其硒含量。以液固比、乙醇浓度、提取温度,提取时间为单因素试验的基础上,通过正交试验优化提取工艺。结果表明:最佳提取条件是液固比35∶1(mL/g)、乙醇浓度40%、提取温度65℃、提取时间60 min。其中,茶多酚的提取率为32.56%,纯度为43.29%,其硒含量为0.35 μg/g;茶多糖的提取率为26.33%,纯度为37.67%,其硒含量为1.75μg/g。
连续提取;茶多酚;茶多糖
紫阳富硒茶产于陕西省紫阳县天然富硒区,是当今世界上第一个通过科学鉴定具有特种保健功效的优质绿茶。除了具备普通茶叶的功能性成分外,富硒茶最显著的特点就是富含硒元素,是一种补硒佳品[1]。
茶多酚(Tea polyphenols,TP)是茶叶中多酚类化合物的总称,主要包括儿茶素类(黄烷醇类)、黄酮及黄酮醇类、花青素和花白素类、酚酸及缩酚酸类,具有抗氧化、抗菌、抗病毒、降血脂,提高人体综合免疫能力等作用[2]。茶多糖(Tea polysaccharides,TPS)是一种酸性糖蛋白,具有提高免疫力、降血脂、降血糖、抗辐射、抗凝血,抗血栓等功效,且茶多糖在老叶片中的含量高于嫩叶[3]。有文献[4-6]报道,茶多酚和茶多糖各自的提取方法,但少见茶多酚和茶多糖连续提取的报道。本试验利用紫阳富硒茶的老叶连续提取茶多酚和茶多糖,可提高茶叶资源的利用,降低主要原料成本,增加茶叶附加值,提高茶叶加工企业的抗风险能力和市场竞争力。
1 材料与方法
1.1试验材料
富硒茶:由陕西省安康市紫阳县盘龙天然富硒绿茶有限公司提供。
1.2试验试剂
福林酚试剂:美国sigma公司;硫酸:西安科洛试剂有限公司;苯酚:天津天士力化工有限公司;没食子酸:天津市科密欧化学试剂有限公司;氢氧化钠:红日化工有限公司;本试验所用试剂均为分析纯。
1.3仪器与设备
UV-2600紫外可见光分光光度计:上海龙尼柯仪器有限公司;超声波清洗仪:郑州长城科工贸有限公司;超滤机:上海新拓分析仪器科技有限公司;真空旋转蒸发仪:西安安泰仪器科技有限公司。
1.4试验方法
1.4.1分析方法
茶多酚含量的测定参照国标GB/T 8313-2008《茶叶中茶多酚和儿茶素含量的检测方法》执行;采用苯酚-硫酸法[7]测定茶多糖含量;硒含量的测定参照国标GB 5009.93-2010《食品中硒的测定》执行。
1.4.2工艺路线
工艺路线见图1。
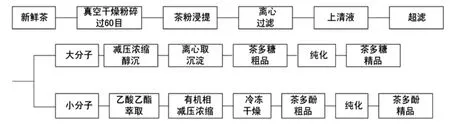
图1 茶叶中茶多酚和茶多糖的连续提取工艺Fig.1 Continuous extraction of tea polyphenols and tea polysaccharide
1.4.3连续提取的单因素试验设计
1.4.3.1液固比的影响
称取5 g茶粉5份,分别选取液固比10∶1、20∶1、30∶1、40∶1、50∶1(mL/g),以纯水为溶剂,70℃,超声功率200 W,提取时间60 min,提取2次来考察液固比对茶多酚、茶多糖提取率的影响。
1.4.3.2乙醇浓度的影响
称取5 g茶粉5份,以1.4.3.1所得的最佳液固比,分别采用浓度为15%、30%、45%、60%、75%的乙醇为溶剂,温度70℃,超声功率200 W,提取时间60 min,提取2次来考察乙醇浓度对茶多酚、茶多糖提取率的影响。
1.4.3.3提取温度的影响
称取5 g茶粉5份,采用1.4.3.1所得的最佳液固比,1.4.3.2所得的最佳溶剂,分别在40、50、60、70、80℃进行提取,超声功率200 W,提取时间60 min,提取2次来考察提取温度对茶多酚、茶多糖提取率的影响。
1.4.3.4提取时间的影响:
称取5 g茶粉5份,采用1.4.3.1所得的最佳液固比,1.4.3.2所得的最佳溶剂,1.4.3.3所得的最佳温度,分别在20、40、60、80、100 min进行提取,超声波功率200 W,考察提取时间对茶多酚、茶多糖提取率的影响。
1.4.4连续提取的条件优化
在单因素提取试验的基础上,选取液固比(A)、乙醇浓度(B)、提取温度(C)和提取时间(D)为考察因素,每个因素选择3个水平(如表1),按L9(34)进行正交设计,以茶多酚和茶多糖的提取率为指标,进行提取试验。采用正交助手进行正交统计分析,确定综合提取的最佳工艺条件。
1.4.5硒含量的测定
利用微波消解-紫外分光光度法[8]测定茶多酚和茶多糖的硒含量。
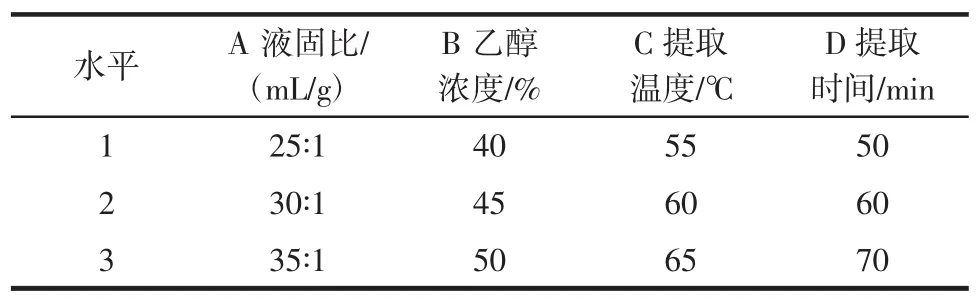
表1 L9(34)正交试验因素水平Table 1 Factors and levels in the orthogonal array design
2 结果与分析
2.1液固比对功能性组分提取率的影响
液固比对功能性组分提取率的影响见图2。

图2 液固比对茶多酚和茶多糖提取率的影响Fig.2 Effect of liquid-solid ratio on extraction rate of tea polyphenols and tea polysaccharides
由图2可以知:茶多酚和茶多糖的提取率均随液固比的增大而提高,但从30∶1(mL/g)后增加的幅度不明显,考虑到后续的浓缩处理,选30∶1(mL/g)为连续提取茶多酚和茶多糖的最佳液固比。
2.2乙醇浓度对功能性组分提取率的影响
乙醇浓度对功能性组分提取率的影响见图3。
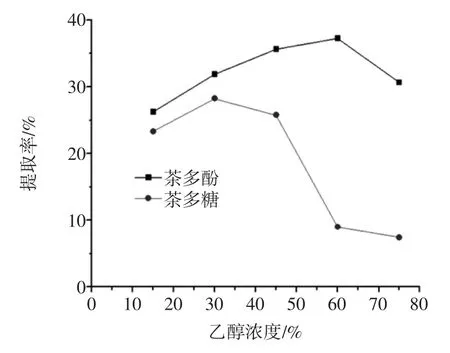
图3 乙醇浓度对茶多酚和茶多糖提取率的影响Fig.3 Effect of ethanol concentration on extraction rate of tea polyphenols and tea polysaccharides
由图3可知:随着乙醇浓度的增大,茶多酚和茶多糖的提取率先增大后减小,并且在乙醇浓度为60%时,茶多酚提取率最大,乙醇浓度为30%时茶多糖的提取率最大。综合考虑茶多酚和茶多糖的提取率,选择乙醇浓度为45%为最佳乙醇浓度。
2.3提取温度对功能性组分提取率的影响
提取温度对功能性组分提取率的影响见图4。

图4 提取温度对茶多酚和茶多糖提取率的影响Fig.4 Effect of temperature on extraction rate of tea polyphenols and tea polysaccharides
从图4可看出:随着温度的升高,茶多酚的提取率先增大后减小,60℃时提取率最大;茶多糖的提取率随温度升高而增大,但在60℃后增加的幅度不明显,综合考虑茶多酚和茶多糖的提取率,选取60℃为最佳提取温度。
2.4提取时间对功能性组分提取率的影响
提取时间对功能性组分提取率的影响见图5。
由图5可知:随着提取时间的增加,茶多酚提取率先增大后减小,在60 min时提取率最大;茶多糖在40min时提取率最大,随后提取率开始减小。综合考虑茶多酚和茶多糖的提取率,选取60min为最佳提取时间。

图5 提取时间对茶多酚和茶多糖提取率的影响Fig.5 Effect of extraction time on extraction rate of tea polyphenols and tea polysaccharides
由单因素试验可知,液固比、乙醇浓度、提取温度、提取时间对茶多酚、茶多糖的连续提取均有一定影响,选取较佳的提取条件液固比30∶1(mL/g),乙醇浓度45%,浸提温度60℃,提取时间60 min做正交试验优化工艺条件。
2.5条件优化
以液固比(A)、乙醇浓度(B)、提取温度(C)、提取时间(D)为考察因素,按L9(34)进行正交设计,结果如表2。

表2 L9(34)正交设计试验及结果Table 2 L9(34)Orthogonal design experiments and results
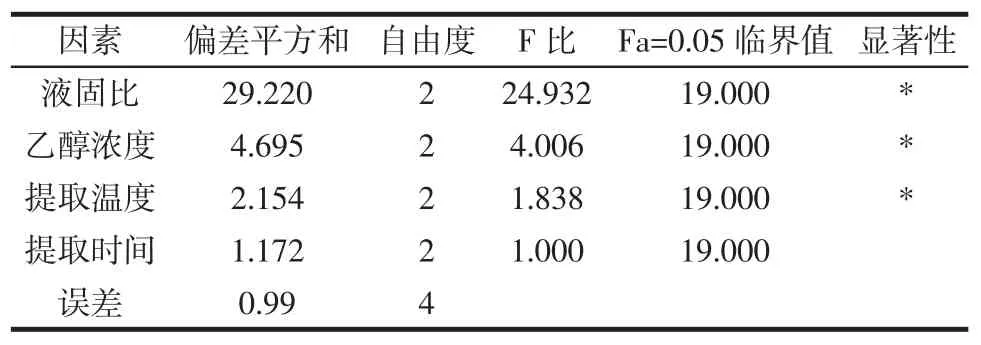
表3 茶多酚提取率方差分析Table 3 Tea polyphenols extraction yield variance analysis

表4 茶多糖提取率方差分析Table 4 Tea polysaccharide extraction yield variance analysis
运用直观分析法,比较极差分析表2中4个因素下茶多酚的极差R值,4个因素下茶多酚的R值分别是:液固比为4.396,乙醇浓度为1.763,提取温度为1.160,提取时间为0.813。由正交试验对茶多酚提取率影响的方差分析表3可知,4个因素中乙醇浓度相对于提取温度是显著差异,液固比相对于其他因素为极显著差异。由此,影响茶多酚提取率的因素:为液固比(A)>乙醇浓度(B)>提取温度(C)>提取时间(D)。正交试验第9组与均值得出的最佳组合进行验证,结果显示茶多酚提取的最佳提取组合为A3B3C2D1,即采用液固比为35∶1,乙醇浓度为50%,60℃水浴提取50 min,效果最佳。
但对于茶多糖而言,根据极差分析表2可知4个因素下茶多糖的极差R值为:液固比为10.150,乙醇浓度为5.283,提取温度为2.973,提取时间为0.987。由正交试验对茶多糖提取率影响的方差分析表4可知4个因素中乙醇浓度相对于提取温度是显著差异,液固比为极显著差异。由此,影响茶多糖提取率的因素:为液固比(A)>乙醇浓度(B)>提取温度(C)>提取时间(D)。正交试验第7组与均值得出的最佳组合进行验证,结果显示茶多酚提取的最佳提取组合为A3B1C3D2,即采用液固比为35∶1,乙醇浓度为40%,65℃水浴提取60 min,效果最佳。
综上所述分别分析了同一个正交试验对茶多酚和茶多糖提取率的影响。因为本试验是要对茶多酚和茶多糖进行连续提取,所以要综合考虑其提取工艺。由极差分析表可知正交试验4个因素对茶多酚与茶多糖的影响顺序一致,均为液固比(A)>乙醇浓度(B)>提取温度(C)>提取时间(D),即影响茶多酚茶多糖提取率的主要因素液固比和乙醇浓度。从连续提取的角度考虑,在A3条件下2者提取率均偏高故A3为理想条件;因素B对2者提取率影响较大,尤其对茶多糖影响最大,因此选取最优条件时应着重考虑B对茶多糖提取率的影响。虽然在B3条件下的茶多酚提取率高于B2和B1但差别并不显著。而B1条件下的茶多糖提取率则显著高于B2和B3,因此,综合考虑选取B1为最优条件;因素C在对两个指标的影响基本一致,因此选择C3为最佳条件;因素D在对两个指标的影响因素中都位于末位,根据茶多酚提取率变化不显著而茶多糖提取率变化显著因此D2为最佳条件。则连续提取最佳条件为A3B1C3D2,即功能性组分综合提取的最优工艺为液固比为35∶1(mL/g),乙醇浓度为40%,提取温度为65℃提取时间为60 min。
2.6硒含量测定结果
硒含量测定结果见表5。

表5 硒含量测定结果Table 5 Determination of selenium content
从表5中可看出茶多酚和茶多糖均含有硒,且茶多糖中硒含量高于茶多酚中的硒含量。
3 结论
利用紫阳富硒茶的粗老茶叶为原料,同时提取茶多酚和茶多糖,可对于原料充分利用,进一步提高茶叶深加工的附加值。本实验采用超声波辅助提取,在最佳条件下,茶多酚的提取率为32.56%,纯度为43.29%,其硒含量为0.35 μg/g;茶多糖的提取率为26.33%,纯度为37.67%,其硒含量为1.75 μg/g。该提取工艺简单易行,对设备要求不高,具有成本低、充分利用茶叶资源的优点。本提取工艺所得到的是粗产品,对茶多酚和茶多糖的精制纯化我们将在下一个实验组进行。
[1]李永菊.浅谈富硒茶的保健作用[J].茶叶通报,2009,31(1):18-20
[2]李叶云.茶多酚的生理活性及药理学研究进展[J].安徽中医学院学报,2002,21(5):57-59
[3]谢明勇,聂少平.茶叶多糖的研究进展[J].食品与生物技术学报,2006,25(2):107-115
[4]易凤英,刘素纯,李佳莲,等.茶多糖的提取方法及生理功能研究[J].安徽农业科学,2010,38(6):2911-2913
[5]张庆云.茶多酚提取方法的进展[J].中国茶叶,2013(1):16-17
[6]陈海霞.茶多糖不同提取工艺的比较研究[J].食品工业科技,2001,22(2):18-19
[7]傅博强,谢明勇,聂少平,等.茶叶中多糖含量的测定[J].食品科学,2001,26(11):70-73
[8]王娅,彭艺升.紫外-可见分光光度法测定干薇菜中铁和硒的含量[J].贵州化工,2008,33(4):28-30
Continuous Extraction of Polyphenols and Tea Polysaccharide from Selenium-rich Tea
FENG Li-qin,YANG Fu-lian,DONG Wen-bin,HAN Wei
(School of Food&Biological Engineering,Shaanxi University of Science&Technology,Xi'an 710021,Shaanxi,China)
This paper used old leaves of ziyang tea as raw materials,continuous extraction of tea polyphenous and tea polysaccharide,and determination of selenium content of both.Considering liquid-solid ratio,ethanol concentration,extraction temperature,extraction time as the single factor,the process parameters of extraction were optimized by orthogonal experime.Best of continuous extraction conditions:liquid-solid ratio was 35∶1(mL/g),ethanol concentration was 40%,extraction temperature was 65℃,extraction time was 60 min.The results showed that the extraction rate of tea polyphenols was 32.56%,the purity was 43.29%,the selenium content was 0.35 μg/g;the extraction rate of tea polysaccharide was 26.33%,the purity was 37.67%,the selenium content was 1.75 μg/g.
continuous extraction;tea polyphenols;tea polysaccharide
10.3969/j.issn.1005-6521.2016.21.007
陕西省科技统筹创新工程项目(2013KTZB02-01-04);西安市技术转移促进工程项目(CXY1434-3);陕西省教育厅产业化培育项目(14JF002)
冯丽琴(1991—),女(汉),硕士在读,研究方向:食品新材料制备与分析检测技术。
2015-12-20
