外周血淋巴与单核细胞绝对计数比值在滤泡性淋巴瘤中的预后意义
2016-11-17许彭鹏陈秋生李良群赵维莅
许彭鹏,钱 樱,陈秋生,李良群,张 莉,赵维莅
1.上海交通大学医学院附属瑞金医院血液科,上海 200025;
2.上海市闸北区北站医院血液科,上海 200070
外周血淋巴与单核细胞绝对计数比值在滤泡性淋巴瘤中的预后意义
许彭鹏1,钱 樱1,陈秋生1,李良群2,张 莉1,赵维莅1
1.上海交通大学医学院附属瑞金医院血液科,上海 200025;
2.上海市闸北区北站医院血液科,上海 200070
背景与目的:在利妥昔单抗时代,滤泡性淋巴瘤(follicular lymphoma,FL)国际预后指数(follicular lymphoma international prognostic index,FLIPI)等传统预后参数在FL中的预后作用存在局限性。该研究旨在探讨外周血淋巴细胞与单核细胞绝对计数比值(absolute lymphocyte count/absolute monocyte count,ALC/AMC)在中国人群FL中的意义。方法:对2003年1月—2013年12月以利妥昔单抗联合环磷酰胺、多柔比星、长春新碱及泼尼松(R-CHOP)样化疗方案治疗136例初治FL患者的情况进行回顾性分析,收集所有患者的外周血ALC/AMC数据,并进行FLIPI评分。结果:根据FLIPI评分,低危(评分0~1分)61例(44.9%),中危(评分2分)42例(30.9%),高危(评分3~5分)33例(24.2%);FLIPI低危、中危和高危组的治疗有效率分别为88.5%、95.2%和78.8%(P=0.090),2年无进展生存率(progression-free suivival,PFS)分别为91.4%、74.6%和47.8%(log-rank=23.3,P<0.001);ALC/ AMC≥4.7及<4.7患者的有效率分别为91.9%和68.6%(P=0.005),2年PFS分别为96.0%和69.7%(log-rank=13.0,P<0.001)。多因素分析显示,ALC/AMC≥4.7是独立于FLIPI的预后因素。对FLIPI无法区分的低危及中危患者,可通过ALC/AMC进一步细分为预后不同的两组(log-rank=7.535,P=0.006)。结论:对使用R-CHOP样方案的FL患者,ALC/AMC是简单可行的预后指标,反映患者机体免疫及肿瘤微环境并具有独立于FLIPI的预后意义。对于FLIPI难以区分的低危及中危患者,应当考虑ALC/AMC作为综合判断患者长期生存的预后指标。
滤泡性淋巴瘤;淋巴与单核细胞绝对计数比值;滤泡性淋巴瘤国际预后指数;利妥昔单抗
滤泡性淋巴瘤(follicular lymphoma,FL)是西方国家最常见的低度恶性淋巴瘤,约占所有淋巴瘤的22%[1]。我国FL发病率较欧美国家低,占非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)的5.9%~7.0%[2-3]。虽然FL通常表现为长期惰性病程,总体预后较好,但是其生存仍然存在异质性[4]。在利妥昔单抗的时代,该群患者需要更精确的预后评估[5]。Solal-Celigny等[6]通过回顾性研究,建立了滤泡性淋巴瘤国际预后指数(follicular lymphoma international prognostic index,FLIPI),包括年龄大于60岁、Ann Arbor分期Ⅲ期或Ⅳ期、血红蛋白低于120 g/L、乳酸脱氢酶(lactate dehydrogenase,LDH)水平升高和受累淋巴结区域大于4个,并在多个独立的队列中证实其有效性,目前已经在FL的危险分层中得到广泛应用。然而,FLIPI的建立基于利妥昔单抗使用之前的数据,可能无法反映利妥昔单抗时代的疾病病程。Buske等[7]发现,在利妥昔单抗联合环磷酰胺、多柔比星、长春新碱及泼尼松(R-CHOP)样方案治疗的晚期FL患者中,FLIPI仅能区分出高危患者,而低危及中危患者的2年至治疗失败时间(time to failure,TTF)分别为92%和90%,差异无统计学意义。国内许彭鹏等[8]也报道使用R-CHOP样方案作为初始治疗的FL,FLIPI低危及中位组的无进展生存率(progression-free survival,PFS)无法区分。因此,在R-CHOP样方案治疗FL患者时,明确FLIPI以外的预后因素显得非常重要。基因谱研究证实淋巴滤泡微环境中的免疫细胞与FL患者的预后相关[9]。外周血淋巴与单核细胞绝对计数比值(absolute lymphocyte count/absolute monocyte count,ALC/AMC)是能够简单有效地反映机体免疫稳态及肿瘤微环境的生物学指标,且ALC、AMC及其比值与骨髓是否受累无关[10-11]。已有研究报道,ALC/AMC≥4.7对于PFS具有独立预后意义[10],但是目前ALC、AMC及其比值在FL中的预后价值仍缺乏大规模尤其是前瞻性队列研究的支持,且在中国人群中尚缺乏相关报道。本研究旨在探讨在利妥昔单抗时代,ALC与AMC比值对中国人群FL的预后作用,以期寻找更适合中国患者的预后模型,为个体化治疗进行更深入的探索。
1 资料和方法
1.1 临床资料
本研究选取2003年1月—2013年12月在上海交通大学医学院附属瑞金医院治疗的136例初治FL患者。所有患者均经过病理组织活检和(或)免疫组织化学染色确诊,且符合世界卫生组织(WHO)2001年关于淋巴组织肿瘤分类标准[12]。患者均须CD20阳性且临床及随访资料完整。所有患者均收集外周血ALC/AMC数据,分别取ALC≤1.0×109/L,AMC>0.63×109/L[11],ALC/ AMC≥4.7[10]作为临界值,并行FLIPI评分。
所有患者至少有一项符合滤泡性淋巴瘤研究组GELF治疗指征[13]:① 大于等于3处淋巴结累及,每个淋巴结的直径均大于等于3 cm;② 任何直径大于等于7 cm的淋巴结或结外肿瘤病灶;③ B症状;④ 脾大;⑤ 胸腔积液或腹腔积液;⑥ 血细胞减少[白细胞计数<1.0×109/L和(或)血小板计数<100×109/L];⑦ 白血病(肿瘤细胞数大于5.0×109/L)。所有患者均接受利妥昔单抗联合化疗作为起始的化疗方案,其中112例(82.4%)每28 d接受1次R-CHOP样方案治疗,24例(17.6%)每28 d接受1次R-COP(利妥昔单抗、环磷酰胺、长春新碱及泼尼松)方案治疗。中位疗程数为6次(1~8次)。
1.2 疗效评估
所有患者均进行颈、胸、腹、盆部CT增强或PET/CT扫描检查,不论发病时这些部位是否受累。患者每完成2个疗程正规化疗后进行1次疗效评定,以后每治疗2个疗程再次评估。疗效分为完全缓解(complete remission,CR)、未证实的完全缓解(unconfirmed complete remission,uCR)、部分缓解(partial remission,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)[14]。前三者视为有效,后两者为无效。
1.3 随访
本研究的主要研究终点是PFS,其定义为明确诊断至PD、复发或任何原因死亡的时间。总生存(overall survival,OS)时间定义为明确诊断时间至死亡时间或末次随访时间。
1.4 统计学处理
数据处理应用SPSS 13.0软件。频数资料比较采用χ2检验。PFS的计算均采用Kaplan-Meier方法,并描绘生存曲线。生存资料的比较均采用log-rank检验。所有的P值均为双向,P<0.05为差异有统计学意义。
2 结 果
2.1 临床资料
患者中位年龄49岁(16~75岁)。其中:男性76例(55.9%),女性60例(44.1%);年龄小于等于60岁104例(76.5%),大于60岁32例(23.5%)。按东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)一般状况评分评估所有患者基线水平,均在2分以下。病理分级1级46例(33.8%),2级53例(39.0%),3级37例(27.2%)。Ann Arbor临床分期Ⅰ+Ⅱ期患者34例(25.0%),Ⅲ+Ⅳ期患者102例(75.0%)。LDH升高35例(25.7%),血红蛋白低于120 g/L 28例(21.1%)。受累淋巴结区域大于4个者41例(31.3%)。ALC≤1.0×109/L患者58例(42.6%),AMC>0.63×109/L患者27例(19.9%),ALC/ AMC≥4.7患者37例(27.2%)。根据FLIPI评分,低危(评分0~1分)61例(44.9%),中危 (评分2分) 42例(30.9%),高危(评分3~5分)33例(24.2%)。
2.2 治疗效果
136例患者中,治疗6个疗程后107例(78.7%)获得CR(包含12例uCR),13例(9.5%)获得PR,总有效率为88.2%,8例(5.9%)SD,8例(5.9%)PD。FLIPI评分系统低危、中危、高危组的有效率差异无统计学意义(P=0.090,表1)。
2.3 生存情况
对所有患者进行随访,中位随访时间为33个月(1~133个月)。2年PFS率为71.9%,2年OS率为93.5%,共计发生40次事件,包括6例PD和34例复发。至本研究末次随访为止,共16例患者死亡,无非疾病相关死亡。
2.4 单因素分析
单因素分析中,FLIPI预后模型中,低危、中危和高危组患者的2年PFS率分别为91.4%、74.6%和47.8%(log-rank=23.3,P<0.001),ALC/ AMC≥4.7及<4.7患者的2年PFS率分别为96.0%和69.7%(log-rank=13.0,P<0.001,图1)。FLIPI与ALC/AMC≥4.7均为差异有统计学意义的预后因素。
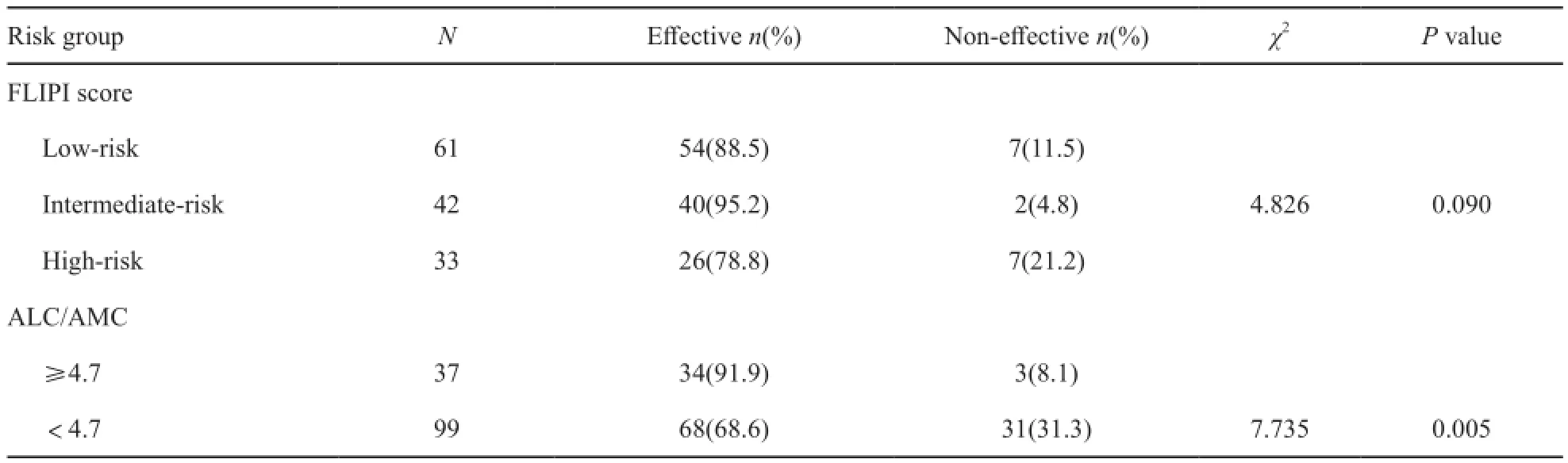
表 1 FLIPI及ALC/AMC中各危险组的疗效分析Tab. 1 The response analysis of FLIPI and ALC/AMC subgroups
2.5 多因素分析
多因素分析中,ALC/AMC≥4.7是独立于FLIPI的预后因素(表2)。对FLIPI无法区分的低危及中危患者,可通过ALC/AMC进一步细分为预后不同的两组,ALC/AMC≥4.7及<4.7患者的2年PFS率分别为95.4%和81.6%(log-rank=7.535,P=0.006,图2)。
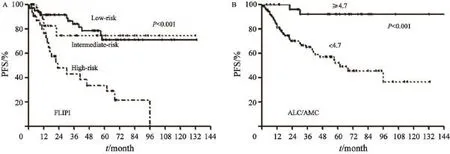
图 1 R-CHOP样化疗方案初治滤泡性淋巴瘤患者使用FLIPI及ALC/AMC进行危险分层后的PFS曲线Fig. 1 The PFS curves of de novo follicular lymphoma patients treated with R-CHOP like regimen according to FLIPI and ALC/AMC A: FLIPI; B: ALC/AMC

表 2 FLIPI及ALC/AMC的多因素分析Tab. 2 Multivariate analysis of FLIPI and ALC/AMC
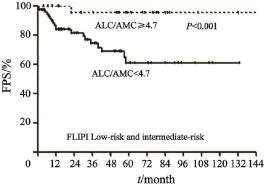
图 2 R-CHOP样化疗方案初治滤泡性淋巴瘤患者FLIPI低危及中危患者使用ALC/AMC分为预后不同的两组Fig. 2 The progression-free survival curves of FLIPI low-risk follicular lymphoma patients treated with R-CHOP like regimen according to ALC/AMC
3 讨 论
FL起源于淋巴结滤泡中心细胞,肿瘤性滤泡主要由不同比例的中心细胞和中心母细胞组成。大多数FL中,中心细胞占绝大多数,中心母细胞增多,说明肿瘤的恶性程度增加。本研究病理分级1级、2级和3级的患者比例分别为33.8%、39.0%和27.2%,与国外的报道类似[15]。本组患者以成年男性为主,中位发病年龄较年轻。本研究的主要研究指标ALC≤1.0×109/L的比例更高并导致ALC/ AMC≥4.7的比例更低,提示我国FL患者免疫抑制可能比国外患者更严重。
本研究从治疗效果来看,完全缓解率略高于曾艳等[16]及Federico等[15]的报道,主要原因可能与本组患者均采用标准R-CHOP或R-COP化疗方案有关。本队列中,由于治疗方案相对统一,可部分避免因不同治疗方案所带来的疗效差异。本研究发现,ALC/AMC≥4.7患者的治疗有效率显著优于<4.7的患者,提示患者的免疫状态是治疗有效的重要前提。
本次研究中位随访时间接近3年。在该时间段内,绝大多数患者依旧生存,故本研究亦并未采用OS作为主要研究终点。通过研究发现,FLIPI难以区分低危及中危组患者的长期生存,可能与我们的样本量或与其建立时不同的治疗策略有关。FLIPI诞生于利妥昔单抗时代之前,随着利妥昔单抗的使用,FLIPI中的部分因素的预后意义可能已经被削弱。而多因素分析发现,ALC/AMC≥4.7是独立于FLIPI的预后因素,对于FLIPI无法区分的低危及中危组患者,可以通过ALC/AMC将其分为预后显著不同的两组患者,且FLIPI低危+中危组且ALC/AMC≥4.7的患者预后佳,长期无进展生存。
总之,本研究针对使用R-CHOP样化疗方案的FL患者,ALC/AMC是简单可行的预后指标,它反映患者机体免疫及肿瘤微环境并独立于FLIPI。
[1] TAN D, HORNING S J. Follicular lymphoma: clinical features and treatment[J]. Hematol Oncol Clin North Am, 2008,5(22): 863-882.
[2] YANG Q P, ZHANG W Y, YU J B, et al. Subtype distribution of lymphomas in Southwest China: analysis of 6 382 cases using WHO classification in a single institution[J]. Diagn Pathol, 2011, 6: 77.
[3] GROSS S A, ZHU X, BAO L, et al. A prospective study of 728 cases of non-Hodgkin lymphoma from a single laboratory in Shanghai, China[J]. Int J Hematol, 2008, 2(88): 165-173.
[4] 陈晓晨, 吴德沛. 利妥昔单抗时代滤泡性淋巴瘤移植治疗的现状及前景[J]. 白血病·淋巴瘤, 2013, 6(22): 335-338.
[5] JOHNSTON A, SALLES G. Prognostic systems for lymphomas[J]. Hematol Oncol Clin North Am, 2008, 5(22):839-861.
[6] SOLAL-CELIGNY P, ROY P, COLOMBAT P, et al. Follicular lymphoma international prognostic index[J]. Blood, 2004,5(104):1258-1265.
[7] BUSKE C, HOSTER E, DREYLING M, et al. The Follicular Lymphoma International Prognostic Index (FLIPI) separates high-risk from intermediate- or low-risk patients with advanced-stage follicular lymphoma treated front-line with rituximab and the combination of cyclophosphamide,doxorubicin, vincristine, and prednisone (R-CHOP) with respect to treatment outcome[J]. Blood, 2006, 5(108): 1504-1508.
[8] 许彭鹏, 余 栋, 钱 樱, 等. 两种滤泡性淋巴瘤国际预后指数对利妥昔单抗联合化疗治疗滤泡性淋巴瘤的预后意义[J]. 白血病·淋巴瘤, 2013, 12(22): 720-723.
[9] DAVE S S, WRIGHT G, TAN B, et al. Prediction of survival in follicular lymphoma based on molecular features of tumorinfiltrating immune cells[J]. N Engl J Med, 2004, 21(351): 2159-2169.
[10] KUMAGAI S, TASHIMA M, FUJIKAWA J, et al. Ratio of peripheral blood absolute lymphocyte count to absolute monocyte count at diagnosis is associated with progressionfree survival in follicular lymphoma[J]. Int J Hematol,2014, 6(99): 737-742.
[11] MARCHESELLI L, BARI A, ANASTASIA A, et al. Prognostic roles of absolute monocyte and absolute lymphocyte counts in patients with advanced-stage follicular lymphoma in the rituximab era: an analysis from the FOLL05 trial of the Fondazione Italiana Linfomi[J]. Br J Haematol, 2015,4(169): 544-551.
[12] JAFFE E S, HARRIS N L, STEIN H, et al. Pathology and genetics: Tumours of haematopoietic and lymphoid tissues, in Kleihues P, Sobin LH (eds): WHO Classification of Tumours[M]. Edited by Lyon, France, IARC Press, 2001: 227-223.
[13] SOLAL-CELIGNY P, LEPAGE E, BROUSSE N, et al. Doxorubicin-containing regimen with or without interferon alfa-2b for advanced follicular lymphomas: final analysis of survival and toxicity in the Groupe d’Etude des Lymphomes Folliculaires 86 Trial[J]. J Clin Oncol, 1998, 7(16): 2332-2338.
[14] CHESON B D, PFISTNER B, JUWEID M E, et al. Revised response criteria for malignant lymphoma[J]. J Clin Oncol,2007, 5(25): 579-586.
[15] FEDERICO M, BELLEI M, MARCHESELLI L, et al. Follicular lymphoma international prognostic index 2: a new prognostic index for follicular lymphoma developed by the international follicular lymphoma prognostic factor project[J]. J Clin Oncol, 2009, 27(27): 4555-4562.
[16] 曾 艳, 刘志彬, 文菁菁, 等. 滤泡性淋巴瘤的临床特征及预后因素分析[J]. 中华血液学杂志, 2012, 33(7): 590-592.
The prognostic significance of peripheral blood ALC/AMC in follicular lymphoma patients treated
with R-CHOP-like chemotherapy
XU Pengpeng1, QIAN Ying1, CHEN Qiusheng1, LI Liangqun2,ZHANG Li1, ZHAO Weili1
(1.Department of Hematology, Ruijin Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200025, China; 2. Department of Hematology, Shanghai Beizhan Hospital,Shanghai 200070, China)
Correspondence to: ZHANG Li E-mail: dr-lisa@hotmail.com
Background and purpose: The prognostic capability of traditional prognostic index like follicular lymphoma international prognostic index (FLIPI) is limited in the rituximab era. This study was to investigate the prognostic significance of peripheral blood absolute lymphocyte count/absolute monocyte count (ALC/AMC) in Chinese patients with follicular lymphoma (FL). Methods: This study retrospectively analyzed 136 newly diagnosed FL patients who patients with ALC/AMC≥4.7 and <4.7 were 91.9%, 68.6% (P=0.005) and 96.0%, 69.7% (log-rank=13.0, P<0.001),respectively. In the multivariate study, ALC/AMC≥4.7 was independent of FLIPI and was able to distinguish the FLIPI low-risk and intermediate-risk patients (log-rank=7.535, P=0.006). Conclusion: For FL patients treated with R-CHOP-like regimens, ALC/AMC is a simple and effective biomarker reflecting tumor microenvironment and human immunity, and could be considered for prognosis evaluation.
rituximab plus cyclophosphamide, doxorubicin, vincristine and prednisone (R-CHOP)-like chemotherapy in Department of Hematology, Ruijin Hospital from Jan. 2003 to Dec. 2013, and further classified these patients according to FLIPI scoring system. Results: According to FLIPI, 61 patients (44.9%) were stratified into the low-risk (0-1 points) group, 42 cases(30.9%) into the intermediate-risk (2 points) group, and 33 cases (24.2%) into the high-risk (3-5 points) group. The overall response rate and 2-year progression-free survival (PFS) of the 3 risk groups were 88.5%, 95.2%, and 78.8% (P=0.090),and 91.4%, 74.6%, and 47.8% (log-rank=23.3,P<0.001), respectively. The overall response rate and 2-year PFS for
Follicular lymphoma; Absolute lymphocyte count/absolute monocyte count; Follicular lymphoma international prognostic index; Rituximab
10.19401/j.cnki.1007-3639.2016.10.009
R733.4
A
1007-3639(2016)10-0861-05
国家自然科学基金委员会青年科学基金(81201863);上海市科学技术委员会科研计划(08411953900);瑞金医院优秀青年教师(800000000003);上海交通大学晨星青年学者奖励计划;上海市青年医师培养资助计划。
张 莉 E-mail: dr-lisa@hotmail.com
(2015-10-30
2016-02-15)
