脉冲电场-超声波作用对黑豆球蛋白功能性质的影响
2016-11-14马文君齐宝坤王中江江连洲
毕 爽,马文君,李 杨,齐宝坤,王中江,江连洲*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
脉冲电场-超声波作用对黑豆球蛋白功能性质的影响
毕 爽,马文君,李 杨,齐宝坤,王中江,江连洲*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
研究了脉冲电场(15 kV/cm)与低频高强度超声波(150、300、450 W)在不同的时间条件下(18、36 min)的协同作用对黑豆球蛋白功能性质的影响。结果表明:不同脉冲电场-超声波条件处理的黑豆球蛋白具有不同的性质,当处理条件为脉冲电场强度15 kV/cm、超声波时间36 min、超声波功率300 W时,黑豆分离蛋白具有最高的持水性(75.69%)和凝胶硬度(45.126 g)。同时,溶解度也有所提升。在热诱导凝胶流变实验中,经超声波处理(36 min,300 W)的黑豆分离蛋白4号样品最终形成的凝胶弹性模量最高;在频率扫描流变学实验中,该条件下形成的凝胶具有一种类似于固体的凝胶网状结构;扫描电子显微镜的结果显示此条件下形成的黑豆蛋白凝胶更加规则。
黑豆球蛋白;脉冲电场-超声波;凝胶性质;流变学性质;持水性
我国黑豆资源丰富,分布很广,全国各地都有种植和生产[1]。黑豆是植物中营养最丰富的保健佳品。据研究统计,黑豆含粗蛋白质34%,比人们常食的肉类还要高。黑豆中氨基酸种类丰富,且黑豆蛋白质的氨基酸组成与动物蛋白类似,必需氨基酸含量占氨基酸总量的40%以上[2]。其中生物活性物质含量高,兼具营养价值与药用价值[3]。
在脉冲电场作用下,水分子配位能力增大,同时,当脉冲电场作用于蛋白质时,蛋白质表面的离子会受到电场作用力,其方向与大小均随时间变化而改变,对蛋白质的结构和功能产生影响。超声波既是一种波动形式,又是一种能量形式,在传播过程中与媒介相互作用产生超声效应[4]。超声波与蛋白质相互作用可分为机械作用、空化作用和热作用。超声波能够提高蛋白质的溶解性。
本实验在传统黑豆球蛋白加工基础上先采用脉冲电场处理,再采用超声波处理黑豆球蛋白。研究脉冲电场(强度15 kV/cm)协同不同超声波(150、300、450 W)以及不同的时间(18、36 min)处理条件,对黑豆球蛋白的功能性质和结构性质的影响,得到最好的脉冲电场-超声波处理条件,以期为黑豆球蛋白及其开发利用提供理论基础。
1 材料与方法
1.1 材料与试剂
黑豆,由北大荒绿野食品有限公司提供。
Lowry法蛋白质含量测定试剂盒 上海荔达生物科技有限公司;盐酸、氢氧化钠、葡萄糖酸内酯(gluconoδ-lactone,GDL)、磷酸二氢钠、磷酸氢二钠、正己烷等试剂 北京新光化工试剂厂;所有试剂均为国产分析纯试剂。
1.2 仪器与设备
pHS-25型酸度计 上海伟业仪器厂;电子分析天平 梅勒特-托利多仪器(上海)有限公司;低速离心机 德国Eppendorf公司;精密电动搅拌机 江苏省金坛市荣华仪器制造有限公司;电热恒温水浴锅 余姚市东方电工仪器厂;锤片式粉碎机 中国天津泰斯特仪器有限公司;电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;超声波仪 宁波新芝生物科技股份有限公司;分光光度计 尤尼柯中国(上海)公司;流变仪英国马尔文仪器公司;扫描电子显微镜 日立高新技术公司;脉冲电场-超声波处理器(具有超声波发生器、脉冲电场发生器,待处理溶液装入圆形柱不锈钢容器。脉冲电场发生器外表面涂有聚四氟乙烯层作为绝缘层以保证安全) 东北农业大学食品学院自制。
1.3 方法
1.3.1 黑豆蛋白的制备
1.3.1.1 脱脂黑豆粉的制备
工艺流程:黑豆清理→粉碎→过筛→脱脂。
具体操作为:选取新鲜干净的黑豆置于托盘中,放入55 ℃的烘干机中烘干12 h,烘干后去皮、磨粉并过60 目筛,所得的黑豆粉与正己烷以料液比1∶3(m/V)混合,在室温下搅拌3 h。将所得混合物在4 ℃、10 000×g的条件下离心20 min,弃去上层油脂,再重复离心过程3 次,室温条件下风干备用。
1.3.1.2 黑豆蛋白的提取
工艺流程:脱脂黑豆粉→加碱液调pH值至8.0→离心分离→取上清液→加酸液调pH值至4.0→离心分离→取沉淀→反复水洗和离心→黑豆蛋白。
具体操作参考O'donnell等[5]的方法。将脱脂黑豆粉按1∶10(m/V)与蒸馏水混合,然后用2 mol/L的NaOH调节溶液的pH值至8.0,在50 ℃搅拌l.5 h后,将其悬浮液在4 ℃、10 000×g的条件下离心20 min,取离心后所得的上清液再用2 mol/L HCl调节pH值至4.0。静置后在4 ℃、6 000×g的条件下离心20 min,将离心所得的黑豆蛋白沉淀水洗2 次,最后将沉淀分散于水中并用2 mol/L NaOH调节pH值至7.0。将此时得到的黑豆蛋白溶液置于-40 ℃的冰箱中预冻48 h,然后进行冷冻干燥,蛋白溶液冷冻干燥后粉碎即得粉末状黑豆分离蛋白。黑豆分离蛋白于4 ℃冰箱保存。
1.3.2 脉冲电场-超声波处理黑豆球蛋白样品
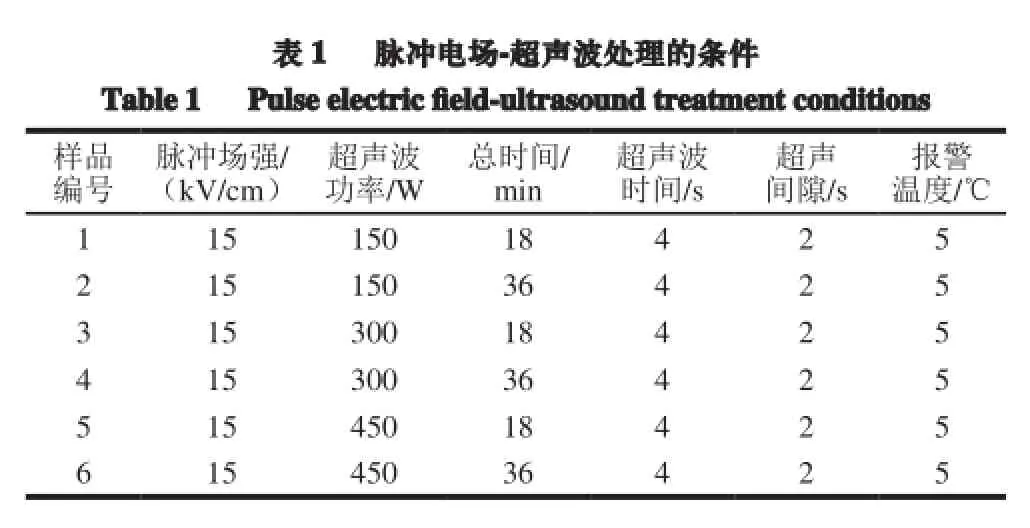
脉冲电场参数:场强为 15 kV/cm,波形为衰减波,频率1.02 Hz,脉宽1.4 μs。超声波处理参数:频率 20 kHz,功率0~450 W,连续可调;脉冲电场-超声波处理条件如表1所示。超声波在5 ℃条件下进行,将装有样品的烧杯置于冰水浴中,每5 min更换一次冰水,以维持低温。
1.3.3 溶解性的测定
精确称取10 mg左右样品,溶解于10 mL的去离子水中,室温下磁力搅拌溶解1 h,3 000 r/min离心15 min,上清液经适度稀释,采用Lowry法测定蛋白质含量,以牛血清白蛋白为标准物绘制标准曲线。蛋白质的溶解度表示为上清液蛋白质量浓度占总蛋白质量浓度的百分比[6]。
1.3.4 流变学性质测定
1.3.4.1 温度扫描
将黑豆球蛋白溶于50 mmol/L的磷酸盐缓冲溶液中(100 mg/mL),用磁力搅拌仪均匀搅拌1 h,然后将蛋白溶液加于流变仪底部的平板上,平板直径:40 mm,探头型号:pp20 mm。设定上下探测平行板之间的距离为1 mm,当平板间完全充满蛋白溶液时,擦去多余的液体,并且将两板四周用注射器滴加石蜡油,以防止样品的水分蒸发。参数设定:起始温度25 ℃,以5 ℃/min的速率升温至90 ℃,保持90 ℃ 30 min,再以5 ℃/min的速率降温至25 ℃,整个过程中,保持角频率在0.63 rad/s,固定形变0.0[7]。在整个加热及冷却过程中,都记录下弹性模量G'以及损耗模量G''及其他参数数值的变化。
1.3.4.2 频率扫描
将温度扫描形成的凝胶(加热-冷却循环之后)于25 ℃的条件下,对凝胶进行频率扫描(0.1~10.0 Hz),固定形变为0.01。
1.3.5 酸诱导黑豆球蛋白凝胶的形成
工艺流程:黑豆球蛋白→溶解→加GDL→加热→冷藏→陈化→凝胶。
将黑豆蛋白用50 mmol/L的磷酸盐缓冲溶液溶解后混匀,分散液质量浓度100 mg/mL,然后加入GDL(0.3 g/100 mL)轻轻搅拌2 min,将分散液在90 ℃的条件下加热20 min,然后冷却至室温形成酸诱导黑豆蛋白凝胶,将其在4 ℃的条件下冷藏24 h以完全形成凝胶。随后取出陈化30 min,测定其持水性、质构性质。
1.3.6 持水性的测定
黑豆球蛋白凝胶的持水性测定根据Tang Chuanhe等[8]的方法,且稍做改动。将凝胶样品放在5 mL的离心管中,使用离心机在室温、800 r/min的条件下离心20 min,将试管倒转,甩去多余的水分仔细用纸移出,分别将离心前与离心后移出多余水分的试管称质量,持水性(water holding capacity,WHC)的计算公式如下。

式中:m1为样品离心前与离心管的质量/g;m2为样品离心除水后与离心管的质量/g。
1.3.7 凝胶质构特性的测定
采用穿刺模式对凝胶进行测定。将黑豆球蛋白分散液在烧杯中形成凝胶(直径为40 mm,高35 mm,每个烧杯内盛装10 g凝胶)。使用TA-XT2质构仪进行测定,采用P/0.5的探头。测定时,直接使用凝胶形成时所用的烧杯,不需要将它们从烧杯中移出再进行测定。探头下行速率为1 mm/s,进入凝胶检测过程中的速率为1 mm/s,检测时的触发力为7 g,压缩变形为样品高度的30%,测定温度为室温,每个样品重复3 次测定,取其平均值作为最终结果,且同一样品测定的3 个凝胶破裂强度值和质构其他方面性质数值的相对标准偏差(relative standard deviation,RSD)小于2.50%。
1.3.8 扫描电子显微镜观察
将黑豆蛋白用0.05 mol/L的磷酸盐缓冲溶液溶解后混匀,分散液质量浓度为100 mg/mL。脉冲电场-超声波处理后,将分散液在90 ℃条件下加热20 min,然后冷却至室温形成黑豆蛋白凝胶,将其在4 ℃的条件下冷藏24 h以完全形成凝胶。进行样品前处理,将制好的凝胶切成块状,浸泡在固定剂溶液中(戊二醛溶液)固定24 h。然后用pH值为7.2的磷酸盐缓冲液清洗3 次,每次10 min。用不同体积分数的乙醇溶液依次洗脱,选择表面较为平整的凝胶块切成小片状,用冷冻干燥机进行干燥。干燥后的凝胶脆断处理、镀金。镀金方法:离子溅射;镀金条件:15 kV、15 mA、2.5 min。最后将样品置于扫描电子显微镜(15 kV)下观察其显微结构。
2 结果与分析
2.1 溶解度

溶解度是衡量蛋白质变性和聚集的一种实用方法,同时也能够反映蛋白质的功能性质。由图1可知,未经脉冲电场-超声波处理的黑豆球蛋白具有良好的溶解度,经超声波处理后溶解度普遍减小,但随着超声波强度的增加,黑豆蛋白的溶解性先增加后降低,这与Jambrak等[9]提出的理论是一致的。这是由于超声波导致蛋白质分子部分打开增加了蛋白质和水分子之间的交互作用,且因为超声波的空化作用以及脉冲电场对蛋白表面电荷性质增强的作用,使蛋白质的溶解性提高[10]。另一种可能的原因是,超声波处理还可以降低黑豆蛋白的粒径,从而增加了黑豆蛋白的溶解性[11]。但当超声波强度达到450 W时,黑豆蛋白溶液的溶解性下降,可能是由于超声波处理功率的增加和超声波处理时间的延长,黑豆蛋白疏水基团暴露而巯基被掩埋在分子内部,通过非共价键形成了蛋白质聚集体,从而降低了黑豆蛋白的溶解度。
2.2 流变学性质
2.2.1 温度扫描

图2为黑豆蛋白分散液的弹性模量(G')在加热及冷却过程中随时间变化的流变图。储能模量是凝胶在形变过程中由于弹性形变而储存的能量,它是衡量凝胶强度的一种尺度,而损耗模量(G'')反映的是凝胶在形变过程中因黏性形变而以热的形式损耗的能量,这些能量是由于分子间的摩擦产生的,它反映样品的黏性[12]。
如图2所示,随着超声波条件的变化,黑豆蛋白溶液表现出不同的流变学性质。所有黑豆蛋白样品,在升温过程中(25~90 ℃)的G'变化很小或几乎不变。此时,黑豆蛋白分子发生解离和变性,分子部分展开,功能基团暴露,功能性质发生一定的改变。但还不会形成凝胶,因此G'没有增加。在90 ℃保温后期G'开始有增加的趋势,但趋势不明显,这是由于蛋白质分子正在经历前凝胶阶段,分散液中的黑豆蛋白分子空间结构在升温及保温的过程中逐渐打开,并发生了一定的相互作用[13]。刚开始冷却时,可以观察到分散液的弹性模量突然下降,马上又出现上升的趋势,这是由于溶液中相邻的蛋白质分子通过氢键、疏水相互作用、静电吸引、二硫键等化学作用力结合到一起形成三维网状结构,将水以及溶液中其他物质包容起来,形成凝胶。弹性模量开始上升的点是凝胶形成的开始点,因为所有样品(0~6号)都在相同的条件下被加热,因此这个点可以用来比较各种样品的凝胶能力[14]。随着降温过程(90~25 ℃)的延长,分散液的弹性模量显著递增,说明蛋白质分子充分展开,凝胶形成[15]。
对比降温结束时各个样品的弹性模量可以发现,4号样品与0号样品形成凝胶的过程最相似。但经过脉冲电场-中等超声强度处理的4号样品凝胶强度大于未经脉冲电场-超声波处理的0号样品。这说明适当的脉冲电场-超声波处理条件(超声波频率20 kHz、超声波时间36 min、超声波功率300 W)有助于提高黑豆球蛋白分散液的凝胶能力。因为超声波具有空化及高压冲击波作用,使蛋白质分子链选择性地打开,蛋白质得二级结构发生变化,凝胶能力增强[16]。但当脉冲电场协同低强度超声波时,空化作用不明显,不足以使样品形成较高弹性模量。当脉冲电场协同高强度超声波时,因为黑豆蛋白的溶解性低,因此G'降低。
2.2.2 频率扫描

如图3所示,4号样品的G'和G''不随频率变化,且互相平行。这说明它们不受频率大小的影响,样品具有较好的稳定性[17]。同时,4号样品的G'和G''较高,且两者间的间距也较大,G'比G''高出一个数量级,这说明其凝胶弹性很好,“固体”性质相对明显,该凝胶具有一种类似于固体的凝胶网状结构,可能是由于脉冲电场-超声波作用使黑豆球蛋白溶液中聚集体粒度降低,黑豆蛋白溶解性提高,脉冲电场-超声波作用的促溶机制提高了黑豆蛋白溶液的流变学性质。1号样品的G'和G''较小,说明其凝胶弹性部分所占比例较小,“固体”性质不明显。样品所形成的凝胶G'和G''对频率有一定的相关依赖性,即随着频率的增加,剪切模量(G'、G'')会随之呈上升的趋势,说明此黑豆球蛋白在相对较高振荡频率下,才具有凝胶特性[18]。其他的样品的弹性模量值同1号样品相似,这也与质构的测量结果相吻合。
2.3 质构特性
质构特性是品评食品优劣程度的重要因素之一,因为其直接影响到食物在口中给人的感觉[19]。采用TA-XT2质构仪模拟口腔的咀嚼运动,对样品进行两次压缩,给出力-时间的关系曲线,通过计算机处理分析给出质构特性的各个参数如表2所示。
脉冲电场-超声波处理时间对凝胶破裂强度 的影响非常明显。由表2可知,超声波处理18 min的1、3、5号样品的硬度值分别为26.383、38.050、29.909 g,而经过36 min超声处理的2、4、6号样品,它们的凝胶硬度值分别30.681、45.126、27.495 g,可见每组样品当超声波处理功率相同时,延长超声波处理的时间可升高凝胶的硬度值,因为凝胶的过程是缓慢过程,超声波处理时间延长即空化作用时间延长,蛋白质分子链充分打开,形成了凝胶网状结构。但是5号样品的硬度大于6号样品,这是由于脉冲电场-超声波处理功率过大导致黑豆球蛋白的分子结构发生了不可逆性变化变化,继续延长超声波处理时间,易形成不溶性蛋白质聚集体[20],进而影响凝胶网状结构的形成构建。
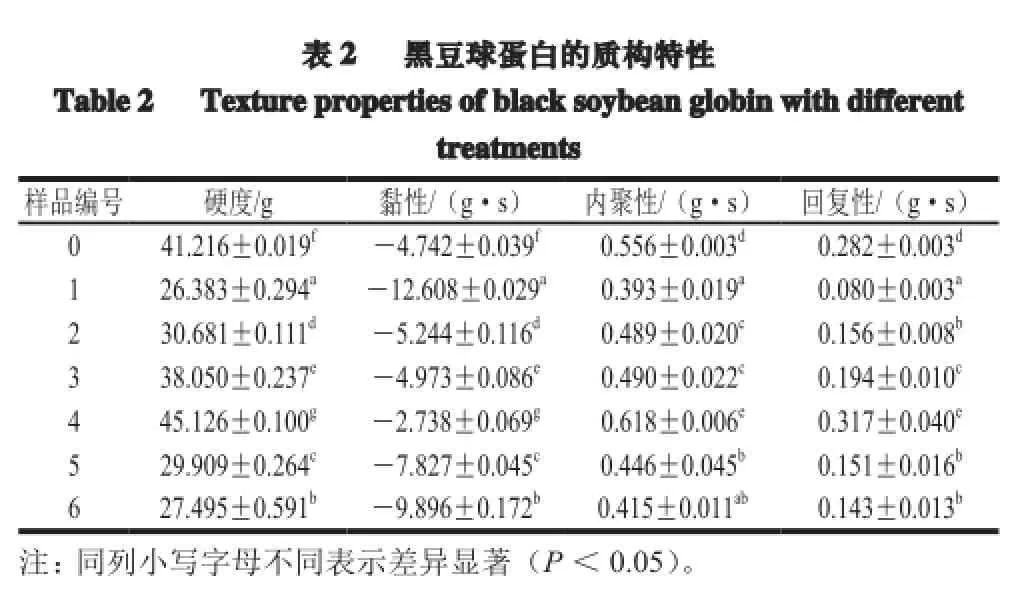
如表2所示,1、3、5号样品的超声波时间相同,超声波功率依次增大,形成凝胶的硬度、内聚性及回复性等质构特性在300 W(3号)超声波功率时最佳,由于5号样品超声波功率过高,导致蛋白质分子发生变性,使其性质随之下降。同比其他样品,4号样品表现出最好的凝胶性质,凝胶强度与蛋白质的空间结构紧密相关,说明该脉冲电场-超声波处理条件可以显著降低蛋白质的粒度、加速蛋白质变性、提高蛋白的溶解性使蛋白质形成致密的空间结构[21]。
2.4 持水性
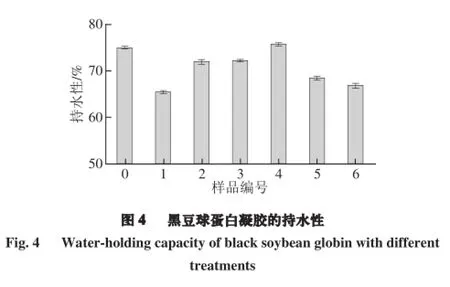
持水性是最重要的凝胶特性之一,在不同的食物体系中都会发生这种具有意义的蛋白质与水之间的反应。不同凝胶样品的持水性情况如图4所示,4号黑豆蛋白凝胶样品的持水性最强,而1号的持水性最弱。由此可说明,超声波时间36 min、超声波功率300 W,可以显著提高蛋白凝胶的持水性。这可能是因为脉冲电场-超声波处理增加了蛋白质的溶解性,同时减小了黑豆分离蛋白的粒径,使蛋白凝胶形成了密集且均一的凝胶网状结构[22]。这种密集且均一的微观结构有助于凝胶结合水分。Wei Wu等[23]曾有结论表明,提高蛋白质的溶解性、减少分离蛋白的粒径大小可以提高凝胶的持水性。另一个可能的原因是:随着超声波强度增加,蛋白质疏水基团暴露更多。曾有研究发现凝胶网状结构具有重要作用的是疏水基团的暴露[24]。蛋白质分子的疏水基团暴露从而形成的聚集体是形成蛋白质凝胶的主导因素,超声波对于疏水基团的作用可能是在处理过程中加速了蛋白质-蛋白质聚集体的产生,因此最终形成的凝胶网状结构具有良好的持水性[25]。但是高强度的超声波处理(超声波总时间36 min,超声波功率450 W)会导致蛋白质的分子结构发生不可逆性改变,降低其凝胶持水性[18]。
2.5 扫描电子显微镜观察结果
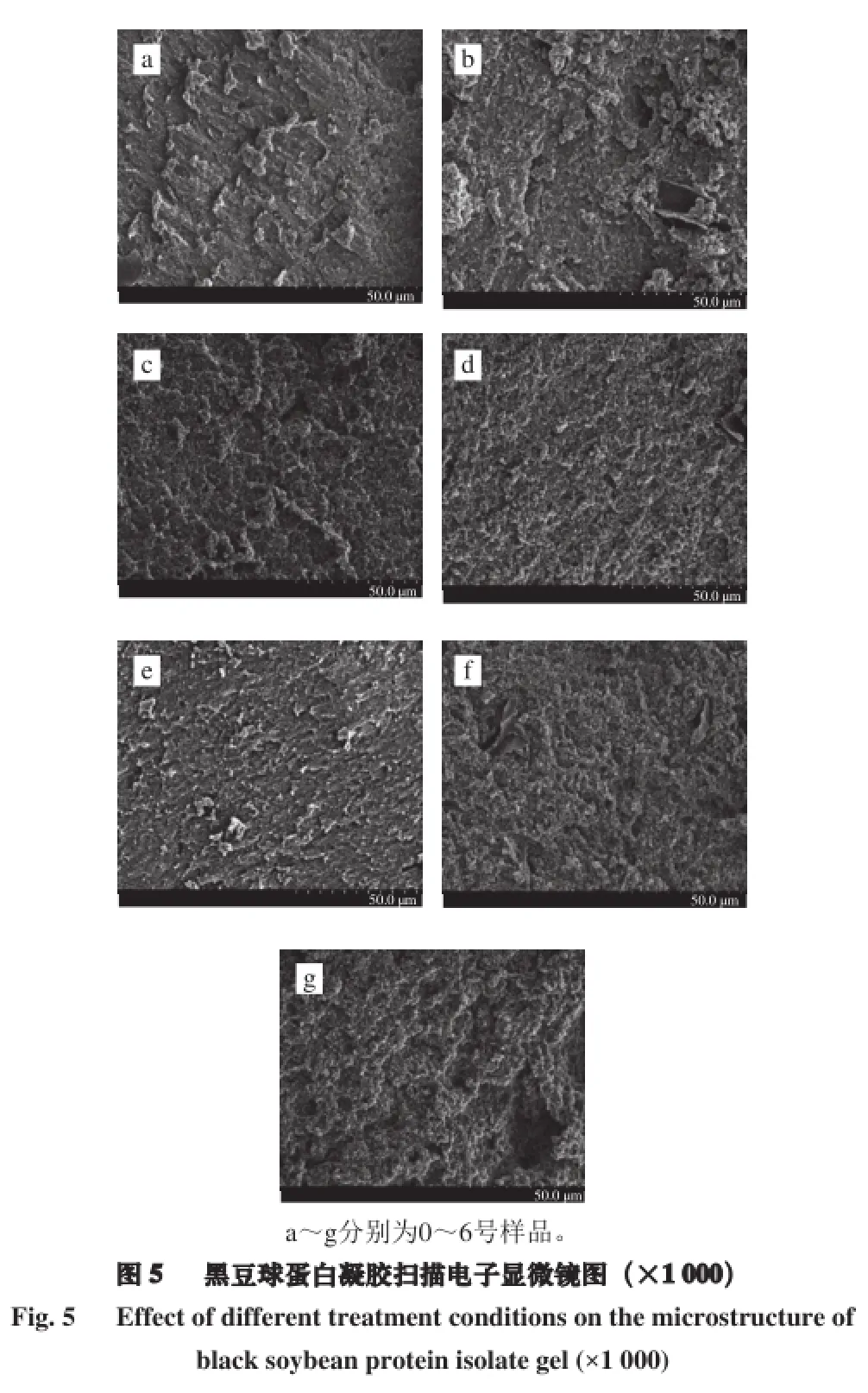
经过脉冲电场-超声波处理的黑豆分离蛋白形成凝胶后,在扫描电子显微镜下放大1 000 倍的微观结构见图5。未经超声波处理的天然蛋白凝胶结构不均匀,表面不平整且出现一些细小的孔洞。经过脉冲电场协同中强度超声波处理的凝胶空间结构与未处理样品有显著差异,凝胶结构更为致密、均一,表面平整,呈现出层状结构。而经过高强度、长时间超声波处理的凝胶空间结构表面不均一且出现较大的空洞。原因可能是适宜强度的超声波处理可以加速黑豆蛋白凝胶聚集体的形成,与Zuniga等[26]结果一致。黑豆蛋白空间结构展开,功能基团(如疏水基团)暴露,立即彼此发生相互作用从而形成蛋白质聚集体,呈现网状结构。已有研究[16]表明,凝胶性和聚集体是有紧密联系的,热诱导形成的聚集体越多,凝胶性质越强。也可能是因为超声处理减少了蛋白质的粒度,因为凝胶结构与蛋白质的大小和形状有关。粒度小,在凝胶过程中就会形成小聚合物,可以更好地填充在蛋白质的凝胶网络空间内,使凝胶的空间结构更加致密、均一。
3 结 论
本实验采用不同的脉冲电场-超声波条件,对黑豆球蛋白进行处理。经过特定的处理条件(脉冲电场强度15 kV/cm、超声波时间36 min、超声波功率300 W)可以显著提高黑豆球蛋白的溶解性、凝胶性、持水性和凝胶强度。从热凝胶过程来看,经过此处理条件的黑豆蛋白分散液更易形成凝胶,而且所得的凝胶动态黏弹性也高于其他脉冲电场-超声波处理以及未经超声波处理的情况。因此,脉冲电场协同中等强度(300 W)的超声波处理可显著提高黑豆蛋白的功能性质,但协同低强度(150 W)超声波和高强度(450 W)超声波会降低黑豆蛋白的功能性质。此结果为黑豆球蛋白在食品工业中的应用提供了一定的借鉴意义。
[1] 王寅, 张坤, 赵晋. 黑豆的营养价值及在食品中的开发应用[J]. 中国食品添加剂, 2007(6): 132-135.
[2] 李莹. 中国黑豆开发具有开发优势[J]. 山西农业, 2002(10): 4-5.
[3] KANAMOTO Y, YAMASHITA Y, NANBA F, et al. A black soybean seed coat extract prevents obesity and glucose intolerance by upregulating uncoupling proteins and down-regulating inflammatory cytokines in high-fat diet-fed mice[J]. Journal of Agricultural and Food Chemistry, 2011, 59(16): 8985-8993. DOI:10.1021/jf201471p.
[4] VIRANGKUMAR N L, MURTHY Z V P. Enhancing the stability of oil-in-water emulsions emulsified by coconut milk protein with the application of acoustic cavitation[J]. Industrial & Engineering Chemistry Research, 2012, 51(11): 4222-4229. DOI:10.1021/ ie202764f.
[5] O'DONNELL C P, TIWARI B K, BOURKE P, et al. Effect of ultrasonic processing on food enzymes of industrial importance[J]. Trends in Food Science & Technology, 2010, 21(7): 358-367. DOI:10.1016/j.tifs.2010.04.007.
[6] SAMMOTO M, MACBUCHI M, MIYAZAKI C, et al. Abundant proteins associated with lecithin in soy protein isolate[J]. Food Chemistry, 2007, 102(1): 317-322. DOI:10.1016/ j.foodchem.2006.05.054.
[7] 孙哲浩. 大豆分离蛋白与卡拉胶共凝胶体流变学特性的研究[J]. 食品工业科技, 2000, 21(6): 87-92.
[8] TANG C H, WANG X Y, YANG X Q, et al. Formation of soluble aggregates from insoluble commercial soy protein isolate by means of ultrasonic treatment and their gelling properties[J]. Journal of Food Engineering, 2009, 92(4): 432-437. DOI:10.1016/ j.jfoodeng.2008.12.017.
[9] JAMBRAK A R, LELAS V, MASON T J, et al. Physical properties of ultrasound treated soy proteins[J]. Journal of Food Engineering, 2009,93(4): 386-393. DOI:10.1016/j.jfoodeng.2009.02.001.
[10] 刘高梅, 任海伟. 不同功率超声波对芸豆蛋白理化和功能性质的影响[J]. 中国粮油学报, 2012, 27(12): 17-21. DOI:10.3969/ j.issn.1003-0174.2012.12.004.
[11] ARZENI C, MARTINEZ K, ZEMA P, et al. Comparative study of high intensity ultrasound effects on food proteins functionality[J]. Journal of Food Engineering, 2012, 108(3): 463-472. DOI:10.1016/ j.jfoodeng.2011.08.018.
[12] HU H, WU J H, CHAN E C, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J]. Food Hydrocolloids, 2013, 30(2): 647-655. DOI:10.1016/ j.foodhyd.2012.08.001.
[13] 朱建华, 杨晓泉. 超声处理对大豆分离蛋白流变学性质的影响[J].食品科学, 2005, 26(12): 52-57.
[14] 李坚斌, 李琳, 陈玲, 等. 超声波处理下马铃薯淀粉糊的流变学特性[J].华南理工大学学报, 2006, 34(3): 90-94.
[15] STATHOPULOS P B, SCHOLZ G A, HWANG Y M, et al. Sonication of proteins causes formation of aggregates that resemble amyloid[J]. Protein Science, 2004, 13(11): 3017-3027. DOI:10.1016/ j.foodhyd.2012.05.011.
[16] RINGGENBERG E, ALEXANDER M, CORREDIG M, et al. Effect of concentration and incubation temperature on the acid induced aggregation of soymilk[J]. Food Hydrocolloids, 2013, 30(1): 463-469. DOI:10.1016/j.foodhyd.2012.05.011.
[17] 沈兰, 王昌盛, 唐传核. 高压微射流处理对大豆分离蛋白构象及功能特性的影响[J]. 食品科学, 2012, 33(3): 72-76.
[18] TSENG Y C, XIONG Y L, BOATRIGHT W L, et al. Effects of inulin/ oligofructose on the thermal stability and acid-induced gelation of soy proteins[J]. Journal of Food Science, 2008, 73(2): 44-50. DOI:10.1016/ j.foodhyd.2012.05.011.
[19] TUNICK M H. Small-strain dynamic rheology of food protein networks[J]. Journal of Agricultural and Food Chemistry, 2011, 59(5):1481-1486. DOI:10.1021/jf1016237.
[20] WANG L C. Soybean protein agglomeration: promotion by ultrasonic treatment[J]. Journal of Agricultural and Food Chemistry, 1981, 29(1):177-180. DOI:10.1021/jf00103a044.
[21] 明建, 邓科, 谭静. 超声波处理对菱角淀粉糊凝胶质构特性的影响[J].食品科学, 2009, 30(19): 81-84.
[22] 张艳, 朱珠, 张传智, 等. 黑豆饼粕蛋白的超声波提取及其性质的研究[J]. 食品研究与开发, 2014, 35(24): 49-53.
[23] WEI W, HUA Y F, LIN Q L, et al. Effects of oxidative modification on thermal aggregation and gel properties of soy protein by peroxyl radicals[J]. International Journal of Food Science and Technology,2011, 46(9): 1891-1897. DOI:10.1111/j.1365-2621.2011.02698.x.
[24] HU H, CHAN E C, WAN L, et al. The effect of high intensity ultrasonic pre-treatment on the properties of soybean protein isolate gel induced by calcium sulfate[J]. Food Hydrocolloids, 2013, 32(2):303-311. DOI:10.1016/j.foodhyd.2013.01.016.
[25] 石燕, 葛辉, 涂宗财, 等. 超声波对酪蛋白结构与功能性质的影响[J].食品发酵与工业, 2014, 40(2): 16-21.
[26] ZUNIGA R N, KULOZIK U, AGUILER J M. Ultrasonic generation of aerated gelatin gels stabilized by whey protein beta-lactoglobulin[J]. Food Hydrocolloids, 2011, 94(5): 958-967. DOI:10.1016/ j.foodhyd.2010.09.010.
Combined Effect of Pulse Electric Field and Ultrasound on Functional Properties of Black Soybean Globin
BI Shuang, MA Wenjun, LI Yang, QI Baokun, WANG Zhongjiang, JIANG Lianzhou*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
The effect of combined pulsed electric field (15 kV/cm) and low-frequency ultrasound (150, 300 or 450 W)treatments for different time periods on functional properties of black soybean globin was addressed in this study. Functional properties of black soybean globin varied among different treatments. The highest water-holding capacity (75.69%) and gel strength (45.126 g) were obtained when black soybean globin was treated with pulsed electric field at 15 kV/cm in combination with ultrasound irradiation at 300 W for 36 min. Moreover, its solubility also increased after the combined treatment, and its elastic modulus was the highest as indicated by rheological test. Frequency sweep rheological experiments revealed that a solid-like gel network was formed from black soybean globin under the above treatment conditions. The microstructure of the gel was more regular under scanning electron microscopy (SEM).
black soybean globin; combined ultrasound-pulse electric field treatment; gel properties; rheological properties;water-holding capacity
10.7506/spkx1002-6630-201609002
TS214.9
A
1002-6630(2016)09-0007-06
毕爽, 马文君, 李杨, 等. 脉冲电场-超声波作用对黑豆球蛋白功能性质的影响[J]. 食品科学, 2016, 37(9): 7-12. DOI:10.7506/spkx1002-6630-201609002. http://www.spkx.net.cn
BI Shuang, MA Wenjun, LI Yang, et al. Combined effect of pulse electric field and ultrasound on functional properties of black soybean globin[J]. Food Science, 2016, 37(9): 7-12. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609002. http://www.spkx.net.cn
2015-05-05
国家自然科学基金青年科学基金项目(31301501);“十二五”国家科技支撑计划项目(2014BAD22B00);黑龙江博士后科研启动基金项目(LBH-Q13018);黑龙江省自然科学基金项目重点项目(ZD201302);高等学校博士生学科点专项科研基金博导类资助课题(20132325110013)
毕爽(1992—),女,硕士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:13163436989@163.com
*通信作者:江连洲(1960—),男,教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:jlzname@yeah.net
