半干旱地区不同生育期菊芋生长特性与气体交换特征
2016-11-12杨彬吕世奇寇一翾孙杉赵长明
杨彬,吕世奇,寇一翾,孙杉,赵长明
(兰州大学生命科学学院, 草地农业生态系统国家重点实验室, 甘肃 兰州 730000)
半干旱地区不同生育期菊芋生长特性与气体交换特征
杨彬,吕世奇,寇一翾,孙杉,赵长明*
(兰州大学生命科学学院, 草地农业生态系统国家重点实验室, 甘肃 兰州 730000)
为了探讨半干旱地区不同生育期菊芋的生长特征和气体交换特性,加快菊芋高产品系选育进程。本文以菊芋块茎高产品系(LZJ004和LZJ119)和低产品系(LZJ018和LZJ188)为研究材料,研究不同生育期菊芋品系生长表型和光合生理基础。结果表明,各生育期菊芋高产品系株高、节长、叶片数及叶面积均高于低产品系。高产品系在花冠直径、花托直径、舌状花花瓣数量和花瓣长度方面分别比低产品系大44.94%、8.26%、12.11%和24.79%。高产品系净光合速率(Pn)高于低产品系。高产品系水分利用效率WUE(除根茎形成期外)高于低产品系,且整个生育期内高产品系水分利用效率变化不大。另外,菊芋高产品系Pn、气孔导度(Gs)、蒸腾速率(Tr)对大气饱和水蒸汽压差(VPD)变化的敏感性小于低产品系。在整个生育期,菊芋高产品系表现出强的生长势和低的干旱胁迫敏感性,从而保证了地下块茎产量的高效形成。
菊芋;高产品系;生育期;生长特性;气体交换参数
菊芋(Helianthustuberosus)具有较高的生态和经济价值,是一种近年来发展较快又极具发展潜力的能源作物。菊芋块茎常用于加工生产新型资源食品菊粉、生物柴油和医药产品等[1-2]。菊粉是一种低聚果糖,不仅可以起到膳食纤维的作用[3],并能促进乳酸菌生长,改善肠道环境[4],预防各种疾病,对维持人体健康具有重要的保健作用,被世界粮食专家称为“21世纪人畜共用植物”[5-6]。菊芋适应能力强,耐寒、耐旱、耐盐碱,病虫害较少,枝叶繁茂,根系发达,对土壤要求不高,且种植管理简便经济收益高,还是优质的牧草,并具有保持水土流失和防风固沙的作用[7]。由此,菊芋是适宜于半干旱地区推广种植的优良生态经济作物。如何系统优化半干旱地区高产菊芋表型和光合生理基础,尽可能地提高菊芋产量,已成为菊芋高产生理的重要科学问题之一。我国已在菊芋研究领域做了大量的工作,如菊芋育种、高产栽培和产品研发[8],海水灌溉、盐胁迫、矿质元素、施肥处理等因素对菊芋光合、蒸腾变化的影响[9-14],以及株型[15]、叶片数、叶面积在菊芋育种中的作用。高凯等[16]研究了不同生境下菊芋的气体交换特征,发现沙地生境菊芋的净光合速率高于其他生境,且主茎叶片高于分枝叶片,而蒸腾速率盐碱地和农田高于其他生境。代晓华等[17]发现低施肥量光合速率和水分利用率较高,而蒸腾速率是以高施肥水平下较高。吕世奇等[18]发现在半干旱地区菊芋高产品系的光补偿点和暗呼吸速率显著小于低产品系。对于菊芋种质资源或不同品系的研究主要集中于形态性状和分子标记[19-22],很少涉及半干旱地区菊芋高产品系尤其是不同生育期的生长表型和光合特性研究。基于对半干旱地区菊芋高产品系缺乏深入的研究,本研究在整个生育期通过对高、低产菊芋品系生长表型和气体交换特征进行持续的监测,比较分析不同生育期菊芋高低产品系生长与气体交换特征的差异,旨在探讨不同生育期高产菊芋品系块茎形成的表型和光合生理基础,为半干旱地区菊芋优质高产品系选育和高效种植提供科学依据。
1 材料与方法
1.1试验时间和地点
本研究田间试验于2011-2012年在兰州大学榆中校区植物种质资源圃(35°56′ N,104°09′ E,海拔1750 m)内进行。该地区属于典型的黄土高原半干旱型气候,年均温7.1 ℃,年均降雨量300 mm,年均蒸发量1450 mm,无霜期130 d,年均日照时数2666 h,土壤类型为黑垆土,耕层有机质含量12.6 g/kg、全氮1.05 g/kg、全磷0.79 g/kg、全钾8.32 g/kg、速效氮91.9 mg/kg、速效磷23 mg/kg、速效钾168.5 mg/kg,pH值8.14,容重1.25 g/cm2[23]。
1.2供试材料与实验设计
本课题组在菊芋种质资源评价和品系选育的基础上[20],选取高产品系(LZJ004和LZJ119)和低产品系(LZJ018和LZJ188)为供试材料,并通过前期生产试验结果表明,高产品系单株块茎产量显著高于低产品系[18]。按完全随机区组设计,将平整好的地块分为12个小区,每个品系3个重复,每个小区面积45 m2,株行距均为40 cm。分别在2011、2012年3月中下旬选取具有1~2个芽眼的30 g左右的菊芋种薯播种,播深为10~15 cm;幼苗期进行适时除草,且在根茎形成期和开花期各浇水一次,每次浇水量为300 m3/hm2。
1.3测定项目及方法
在2011和2012 年的幼苗期(6月15-16日)、根茎形成期(7月15-17日)、开花期(8月16-17日)和成熟期(9月15-17日)对供试菊芋品系的生长表型性状和2012年的幼苗期(6月15-17日)、根茎形成期(7月16-17日)、开花期(8月15-17日)和成熟期(9月15-18日)对供试菊芋品系的气体交换参数进行测定,且成熟期生长表型数据引自本课题组已发表数据[18]。生长表型性状主要包括株高、节长、叶面积、叶片数等,每项指标每个品系测定植株重复8~10株。其中株高和节长利用卷尺测量,而整株叶面积利用Li-3000A (Li-COR USA)叶面积仪进行测定并统计其叶片数,叶面积和叶片数是以主茎自顶部开始完全展开叶计数和测量。在各个生育期分别选取长势一致的自顶部第3~5片叶采用Li-6400(Li-COR USA)便携式光合测定系统进行净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)等气体交换参数的测定,瞬时水分利用效率(WUE) 按WUE=Pn/Tr计算。测定时,选择晴天上午9:00-11:30进行,叶室温度控制在30 ℃,流速设为500 μmol/s,光强利用LED红蓝光源设定为1000 μmol/(m2·s),每次测定每个品系选取3~5片叶重复。2011和2012年开花期对供试菊芋品系的繁殖性状进行测定。繁殖性状主要包括花冠直径、花托直径、舌状花花瓣数、舌状花花瓣长、舌状花花瓣宽等,每项指标每个品系测定植株重复8~10株,其中花冠直径、花托直径、舌状花花瓣长、舌状花花瓣宽用游标卡尺在开花期测量。10月上旬待菊芋地上部分完全干枯后收获,2年单株块茎产量按其鲜重计算。
1.4数据处理
用Microsoft Excel 2010和SPSS 16.0软件统计分析,LSD法分析差异显著性,Origin 8.0作图。2011和2012年的供试菊芋品系生长表型性状和繁殖性状2年实验结果趋势一致,本研究主要分析2012年的数据。
2 结果与分析
2.1不同生育期菊芋高、低产品系生长表型特征和繁殖性状
在整个生育期的4个阶段,菊芋高产品系的株高均极显著高于低产品系(表1)。在成熟期,高、低产品系分别达到240.10和186.73 cm,属于比较典型的植株高度,且高产品系的株高属于中等型,而低产品系属于低矮型[24]。无论高产还是低产品系,幼苗期和根茎形成期植株生长较慢,而开花期植株生长迅速(最大可至前一时期的2.57倍),进入成熟期后,其株高增长率又变小。可见,株高是菊芋块茎产量形成的关键指标之一,若过高,地上部分易徒长倒伏,不利于地下生物量的累积;而过低则不利于光合作用,且影响地下生物量的积累。就节长而言,在整个生育期高产品系大于低产品系。其中,高产品系分为两个阶段,即幼苗期、开花期分别与其根茎形成期、成熟期差异不大,幼苗期到根茎形成期节长仅从5.52 cm伸长至 5.80 cm,而开花期和成熟期的节长均为8.25 cm;且节长的快速生长时期为根茎形成期到开花期,这段时间也是高产菊芋需水需肥的生长旺盛时期。相比较而言,低产品系在成熟期前均表现出快速伸长,如幼苗期到根茎形成期再至开花期,其节长分别为2.81,5.47和7.40 cm,而其伸长率分别为95%和35%。
菊芋高产品系在整个生育期叶片数呈增加趋势,而低产品系先增加后降低。高产品系,根茎形成期至开花期的增加速度最快(增长率达90%),随后几乎不再增加;而低产品系叶片数在开花期前也呈现出增加趋势,最多为49片,但随后成熟期逐渐减少至45 片。表明在成熟期,低产品系叶片开始脱落,这可能与低产品系生育期相对较短且对秋季低温较为敏感,表现出干枯脱离现象。叶片是进行光合作用的主要部位,叶面积大小对光合作用的进行有着十分重要的影响。叶面积与叶片数的变化有一定的关联性,高产品系的叶面积在整个生育期呈现出逐步增加的趋势,在4个生育期间叶面积增长速率分别为106%、63%和18%;而低产品系叶面积在前3个生育期呈现出逐步增加的趋势,但在成熟期又开始下降,这可能与叶片数下降有关。高产品系的繁殖性状除舌状花花瓣宽外,花冠直径、花托直径、舌状花花瓣数、舌状花花瓣长极显著大于低产品系(表2),分别大44.94%、8.26%、12.11%、24.79%,高产品系表现出花冠、花托大,舌状花花瓣多、花瓣长的特征。
2.2不同生育期菊芋高、低产品系气体交换参数与水分利用效率特征
无论高产品系还是低产品系,菊芋叶片Pn、Gs和Tr在幼苗期至根茎形成期都呈现出增加趋势,而在随后的阶段逐渐下降,至成熟期最小(表3)。此外,高产品系的Pn在幼苗期之后的3个时期都显著高于低产品系,而在幼苗期二者Pn无显著差异;高产品系的Gs在幼苗期和根茎形成期显著小于低产品系,而开花期显著大于低产品系,但在成熟期二者差异不显著;在根茎形成期和开花期,高产品系的Tr显著大于低产品系,而幼苗期显著小于低产品系。就WUE而言,高产品系除根茎形成期外,其余各时期均高于低产品系;菊芋高、低产品系都呈现出先增加后降低的趋势,高产品系在整个生育期变化不大,根茎形成期与成熟期间相差仅为0.86 mmol/mol,而低产品系变化较大,根茎形成期与成熟期间相差1.20 mmol/mol。
2.3菊芋高、低品系气体交换参数对大气饱和水蒸气压差变化的响应
无论高产还是低产品系,菊芋叶片Pn和Gs均随着大气饱和水蒸气压差(VPD) 增加而降低,但高产品系叶片Pn和Gs对VPD 变化的敏感性显著小于低产品系(图1a,b)。气孔导度是影响叶片净光合速率和蒸腾速率的主要因子,因为其控制着大气和叶片内部间CO2和水分进出,从而对光合作用和蒸腾作用具有一定的调节作用,表现出其与光合速率和蒸腾速率间高度的相关性[16]。菊芋高、低产品系叶片Tr随着 VPD增加均表现先增加后降低的趋势(图1c),但在高VPD情况下,随着VPD的增加高产品系Tr下降幅度较低,表明其对VPD变化的敏感性较低产品系低。就WUE而言,VPD对菊芋高、低产品系均有极显著影响,且高产品系总体高于低产品系(图 1d)。在 VPD<1.0 kPa时,二者下降趋势基本一致;当1.0 kPa≤VPD≤1.5 kPa时,高产品系WUE下降幅度小于低产品系;当VPD>1.5 kPa时,高产品系WUE上升幅度大于低产品系。

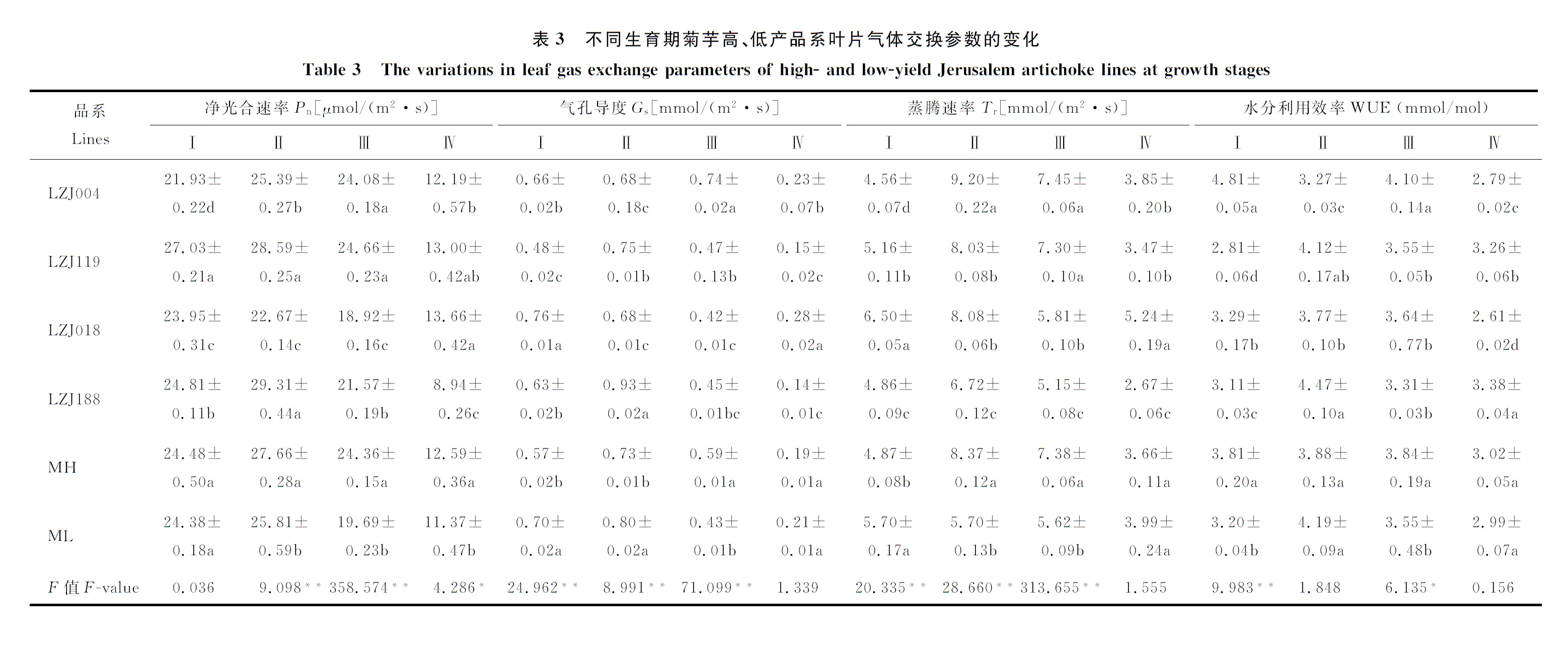

图1 菊芋高、低产品系叶片气孔导度、净光合速率、蒸腾速率、水分利用效率对大气饱和水蒸气压差变化的响应Fig.1 Response of leaf stomatal conductance (Gs), net photosynthetic rate (Pn), transpiration rate (Tr) and water use efficiency (WUE) of high- and low-yield Jerusalem artichoke lines to the changes of vapour pressure difference (VPD)
3 讨论
3.1不同生育期菊芋高产品系生长表型特征和繁殖性状
高产是菊芋新品种选育的首要目标,决定高产的因素主要由遗传特性和环境条件共同控制的。不同生育期作物的生长表型、繁殖性状与产量间存在密切关联,如植株的株高和叶片数等株型性状与产量的关联紧密[25],且植株叶片面积和叶片数对光合产物累积的形成具有显著影响[26-27]。菊芋高产品系的株高、节长、叶片数、叶面积在生育期内都比低产品系表现出明显的优势(表1)。株高主要是由节长和节数决定,高产品系的节长会在一定的时期维持稳定,株高的增加可能与节数有关。在半干旱地区,菊芋高产品系的株高属于中等型[24],这可能是该地区水分不足限制了菊芋的地上部分生长和有机物的累积,因而选育和合理优化菊芋的植株高度对于该区菊芋新品种的选育和规模化种植产业的发展至关重要。此外,低产品系的整株叶片数和叶面积自开花期到成熟期下降明显,表明低产品系自开花后期部分叶片开始脱落,菊芋整株光合能力下降,进而使其生育后期光合有机物的累积减少,最终导致块茎产量下降;而高产品系却未见减少趋势,同样在玉米(Zeamays)[28-29]的研究发现延长绿叶持续期是获得高产的关键。
3.2不同生育期菊芋高产品系气体交换特征
植物光合作用是作物产量形成的基础,多种农作物研究表明光合作用强度与产量间存在紧密的相关性[30-31]。本试验结果也证实,菊芋高产品系几乎在整个生育期(幼苗期除外)净光合速率显著高于低产品系(表3),说明较高的叶片光合能力是菊芋块茎高产的生理基础,这与前人研究结果一致[32],高产品系较高的光合性能是其适应干旱环境的生理基础[33]。同时,Soja等[34]对菊芋幼苗期叶片光合能力与块茎产量进行了研究发现,该时期菊芋叶片的光合能力和块茎产量之间没有关联性。由于幼苗期是菊芋地上部分形态建成期,此时的光合同化物主要分配在地上部分,而块茎尚未开始形成,由此该阶段的叶片光合能力不适于作为评估菊芋块茎产量的生理指标。相比而言,根茎形成期和开花期是影响菊芋块茎产量的关键时期,该时期通过叶片光合作用固定的有机物分配重点已不是地上部分而是直接运输到块茎中,进而促使块茎迅速膨大。张美德等[32]研究发现菊芋块茎形成期(相当于本文的根茎形成期和开花期),高产品系具有相对较高的 CO2同化速率,而该阶段较高的 CO2同化速率对块茎产量起着至关重要作用。因此,改善和提高作物光合效率潜能和提高光能利用率是突破作物产量限制的主要途径,进而高效的作物群体光合性能是获得高产的基本保证。水分亏缺是限制作物产量最重要的环境因子,尤其在半干旱地区经常遭受到干旱胁迫。当作物水分亏缺到足以干扰其正常代谢机能时就会产生水分胁迫,并影响作物光合有机物的累积,最终影响作物产量[35]。在多数情况下,气孔导度下降将造成 CO2供应受阻进而使植物的光合速率下降[36];而气孔对水分亏缺的敏感性是影响作物产量和WUE的重要因素之一,气孔通过快速关闭使蒸腾速率降低程度显著大于光合速率降低程度,进而提高了WUE[37]。本试验结果表明,菊芋高产品系气孔对大气干旱的敏感程度低,且WUE高,这与前人研究结果一致[38-39],这可能由于高产品系具有高WUE的相关基因[40],有待于今后进一步的研究证实。
4 结论
[1]Kou Y X, Lv S Q, Liu J Q,etal. The review ofHelianthustuberosusL. and its comprehensive utilization as a bioenergy plant rich in oligosaccharide. Chinese Bulletin of Life Sciences, 2014, 26: 1-7.
[2]Jia J D, Ma L L, Jiang D P,etal. Development Strategy for the Science and Technology Innovation of Biomass Energy Industry[M]. Beijing: Chemical Industry Press, 2014: 249-253.
[3]Roberfroid M B. Dietary fiber, inulin and oligofructose: a review comparing their physiological effects. Critical Reviews in Food Science and Nutrition, 1993, 33: 103-148.
[4]Niness K R. Inulin and oligofructos: what are they. Journal Nutrition, 1999, 129(S): 1402-1406.
[5]Zhuang D F, Jiang D, Liu L. Assessment of bioenergy potential on marginal land in China. Renewable & Sustainable Energy Reviews, 2011, 15: 1050-1056.
自DSM-5人格障碍替代模型发布以来,对基于替代模型的PID-5问卷得到了大量翻译、验证以及校正。PID-5问卷具有良好的结构以及信效度指标,且PID-5问卷对病理性人格特质评估具有独特的优势。但目前PID-5问卷仍存不足,如题目数量过多限制了使用,特质在维度上的负荷存在争议,界定病理性人格特质缺乏明确的评分标准等。因此,对PID-5人格问卷需要进一步进行本土化研究修订,以便推广人格障碍维度诊断模式。
[6]Zhao G M, Mehta S K, Liu Z P. Use of saline aquaculture wastewater to irrigate salt-tolerant Jerusalem artichoke and sunflower in semiarid coastal zones of China. Agricultural Water Management, 2010, 97: 1987-1993.
[7]Wang P J, Wang K C, Mei F S,etal. Utilization status and development prospects ofHelianthustuberosusgermplasm resources in Yunyang Mountainous area. Journal of Changjiang Vegetables, 2013, 12: 72-74.
[8]Long X H, Liu Z P, Zheng Q S,etal. Effects of seawater with different concentrations on growth and physiological and biochemical characteristics ofHelianthustuberosusL. seedlings. Acta Ecologica Sinica, 2005, 29: 1881-1890.
[9]Denoroy P. The crop physiology ofHelianthustuberosusL.: A model orientated view. Biomass and Bioenergy, 1996, 11: 11-32.
[10]Zhao G M, Liu Z P, Chen M D. Effect of saline aquaculture effluent on salt-tolerant Jerusalem artichoke (HelianthustuberosusL.) in a semi-arid coastal area of China. Pedoaphere, 2006, 16: 762-769.
[11]Zhong Q W, Wang Y, Wang L H,etal. Change of growth, development and photosynthesis indicators of Jerusalem artichoke. Acta Bot Boreal-Occident Sinica, 2007, 27: 1843-1848.
[12]Huang Z R, Long X H, Liu Z P,etal. Effect of KNO3on the growth and photosynthetic of two varieties ofHelianthustuberosusL. seedlings under NaCl stress. Acta Prataculturae Sinica, 2011, 20: 82-88.
[13]Sun X E, Liu Z P, Long X H. Effects of different levels of magnesium supply on the seedling’s growth, photosynthesis, and chlorophyll fluorescence characteristics of twoHelianthustuberousvarieties. Chinese Journal of Ecology, 2012, 31: 823-829.
[14]Lu Y, Ye H J, Geng S B,etal. Effects of NaCl stress on growth, leaf photosynthetic parameters and ion distribution ofHelianthustuberosusL. seedling. Journal of Plant Resources and Environment, 2010, 19: 86-91.
[15]Long X H, Liu Z P. Function of ideal plant type in breeding ofHelianthustuberosusL. for high yield and good grain quality. Chinese Agricultural Science Bulletin, 2010, 26(9): 263-266.
[16]Gao K, Han G D, Xu S T. Study of photosynthesis and transpiration of energy plantHelianthustuberosusL. in different existed environment. Northern Horticulture, 2011, 3: 60-62.
[17]Dai X H, Kang J H, Xu C J. Photosynthetic rate determination of Jerusalem artichoke under different fertilization. Sugar Crops of China, 2009, (1): 40-43.
[18]Lv S Q, Kou Y X, Yang B,etal. Phenotypic traits and photosynthetic characteristics of Jerusalem artichoke (HelianthustuberosusL.) in the semi-arid area. Acta Agronomica Sinica, 2014, 40(10): 1857-1864.
[19]Liu Z X, Spiertz J H J, Sha J,etal. Growth and yield performance of Jerusalem artichoke clones in a semi-arid region of China. Agronomy Journal, 2012, 104(6): 1538-1546.
[20]Wangsomnuk P P, Khampa S, Wangsomnuk P,etal. Genetic diversity of worldwide Jerusalem artichoke (Helianthustuberosus) germplasm as revealed by RAPD markers. Genetics and Molecular Research, 2011, 10(4): 4012-4025.
[21]Kou Y H, Zeng J, Liu J Q,etal. Germplasm diversity and differentiation ofHelianthustuberosusL. revealed by AFLP marker and phenotypic traits. Journal of Agricultural Science, 2014, 152: 779-789.
[22]Zhao M L, Han R, Li L. ISSR marker analysis on genetic diversity of twenty-four cultivars (lines) ofHelianthustuberosus. Journal of Plant Resources and Environment, 2013, 22(4): 44-49.
[23]Zhang M L. Evaluation of Cultivated Land Fertility Based on GIS-a Case Study of Yuzhong County of Gansu province[D]. Lanzhou: Lanzhou University, 2010: 23-64.
[24]Pas’ko N M. Basic morphological features for distinguishing varieties of Jerusalem artichoke. Trudypo Prikladnoy Botanike, Genetiki Selektsii, 1973, 50(2): 91-101.
[25]Huo C B, Li Y H. Gray correlative degree analysis relationship between yield and plant type traits in maize. Heilongjiang Agricultural Sciences, 2010, 6: 32-34.
[26]Wen B B, Zhang X G, Cheng F X,etal. Preliminary research of the relevance on ophiopogon plant traits tuber yield and polysaccharide content. Journal of Anhui Agricultural Sciences, 2009, 37: 13435-13436, 13509.
[27]Liang H, Zhang X G, Cheng F X,etal. Research on the relationship among the leaf number, tuber yield, flavonoids content and saponins content in erect typeOphio-pogon·jaonicus(Thunb.) Ker-Gaw. Journal of Anhui Agricultural Sciences, 2009, 37: 16361-16362, 16416.
[28]Shao G Q, Li Z J, Ning T Y,etal. Effects of irrigation and urea types on ear leaf senescence after anthesis, yield and economic benefit of maize. Scientia Agricultura Sinica, 2009, 42(10): 3459-3466.
[29]Lv L H, Zhao M, Zhao J R,etal. Canopy structure and photosynthesis of summer maize under different nitrogen fertilizer application rates. Scientia Agricultura Sinica, 2008, 41(9): 2624-2632.
[30]Fischer R A, Rees D, Sayre K D. Wheat yield progress associated with higher stomatal conductance and photosynthetic rate and cooler canopies. Crop Science, 1998, 38: 1467-1475.
[31]Sweetlove L J, Kossmann J, Riesmeier J W. The control of source to sink carbon flux during tuber development in potato. Plant Journal, 1998, 15: 697-706.
[32]Zhang M D, Chen Q, Shen S H. Characterization of photosynthesis in Jerusalem artichoke during tuberization stage. Journal of Shandong Agricultural University: Natural Science, 2010, 41: 498-502.
[33]Du W L, Gao J, Hu F L,etal. Responses of drought stress on photosynthetic trait and osmotic adjustment in two maize cultivars. Acta Agronomica Sinica, 2013, 39: 530-536.
[34]Soja G, Haunold E. Leaf gas exchange and tuber yield in Jerusalem artichoke (HelianthustuberosusL.). Field Crop Research, 1991, 26: 241-252.
[35]Wang J H, Zha X Q, Luo J P,etal. Effect of drought stress on lipid peroxidation and activity of cell defense enzyme in maize seedling. Journal of Anhui Agricultural Sciences, 2006, 34: 3568-3569, 3571.
[36]Zhang N H, Gao H Y, Zou Q. Effect of calcium on alleviation of decreased photosynthetic ability in salt-stressed maize leaves. Acta Phytoecologica Sinica, 2005, 29: 324-330.
[37]El-Sharkawy M A, Cock J H, Held K A. A water use efficiency of cassava ii. differing sensitivity of stomata to air humidity and other warm-climate species. Crop Science, 1983, 24: 503-507.
[38]Yang T, Liang Z S, Xue J Q,etal. Diversity of water use efficiency of various maize varieties. Transactions of the Chinese Society of Agricultural Engineering, 2005, 21: 21-25.
[39]Yang T, Liang Z S, Xue J Q,etal. Water consumption characteristics and water use efficiency of different maize varieties under drought stress. Agricultural Research in the Arid Areas, 2005, 23: 103-107.
[40]Jia X L, Jian J L, Ma R K,etal. A study on water efficiency and its components in high-yielding winter wheat. Acta Agronomica Sinica, 1995, 25: 309-314.
[1]寇一翾, 吕世奇, 刘建全, 等. 寡糖类能源植物菊芋及其综合利用研究进展. 生命科学, 2014, 26: 1-7.
[2]贾敬墩, 马隆龙, 蒋丹平, 等. 生物质能源产业科技创新发展战略[M]. 北京: 化学工业出版社, 2014: 249-253.
[7]王平杰, 王开昌, 梅富山, 等. 郧阳山区菊芋资源利用现状及开发前景展望. 长江蔬菜, 2013, 12: 72-74.
[8]隆小华, 刘兆普, 郑青松, 等. 不同浓度海水对菊芋幼苗生长及以生理生化特征的影响. 生态学报, 2005, 29: 1881-1890.
[11]钟启文, 王怡, 王丽慧, 等. 菊芋生长发育动态及光合性能指标变化研究. 西北植物学报, 2007, 27: 1843-1848.
[12]黄增荣, 隆小华, 刘兆普, 等. KNO3对NaCl胁迫下两菊芋品种幼苗生长及光合能力的影响. 草业学报, 2011, 20: 82-88.
[13]孙晓娥, 刘兆普, 隆小华. 不同供镁水平对两菊芋品种幼苗生物量光合和叶绿素荧光特性的影响. 生态学杂志, 2012, 31: 823-829.
[14]陆艳, 叶慧君, 耿守保, 等. NaCl胁迫对菊芋幼苗生长和叶片光合作用参数以及体内离子分布的影响. 植物资源与环境学报, 2010, 19: 86-91.
[15]隆小华, 刘兆普. 菊芋株型在高产育种中的作用. 中国农学通报, 2010, 26(9): 263-266.
[16]高凯, 韩国栋, 徐苏铁. 不同生境条件下能源植物菊芋净光合速率和蒸腾速率的研究. 北方园艺, 2011, 3: 60-62.
[17]代晓华, 康建宏, 徐长警. 不同施肥条件下菊芋光合速率测定. 中国糖料, 2009, (1): 40-43.
[18]吕世奇, 寇一翾, 杨彬, 等. 半干旱地区菊芋品系植株表型与光合特性分析. 作物学报, 2014, 40(10): 1857-1864.
[22]赵孟良, 韩睿, 李莉. 24个菊芋品种遗传多样性的 ISSR标记分析. 植物资源与环境学报, 2013, 22(4): 44-49.
[23]张美兰. 基于GIS的耕地地力评价研究-以甘肃省榆中县为例[D]. 兰州: 兰州大学, 2010: 23-64.
[25]霍成斌, 李岩华. 玉米产量与株型性状的灰色关联度分析. 黑龙江农业科学, 2010, 6: 32-34.
[26]文便便, 张兴国, 程方叙, 等. 麦冬植株叶片·块根产量与多糖含量相关性的初步研究. 安徽农业科学, 2009, 37: 13435-13436, 13509.
[27]梁辉, 张兴国, 程方叙, 等. 直立型川麦冬叶片数·块根产量及黄酮·皂苷含量的相关性研究. 安徽农业科学, 2009, 37: 16361-16362, 16416.
[28]邵国庆, 李增嘉, 宁堂原, 等. 灌溉与尿素类型对玉米花后穗位叶衰老、产量和效益的影响. 中国农业科学, 2009, 42(10): 3459-3466.
[29]吕丽华, 赵明, 赵久然, 等. 不同施氮量下夏玉米冠层结构及光合特性的变化. 中国农业科学, 2008, 41(9): 2624-2632.
[32]张美德, 陈强, 沈世华. 菊芋块茎形成期的光合特性. 山东农业大学学报: 自然科学版, 2010, 41: 498-502.
[33]杜伟莉, 高杰, 胡富亮, 等. 玉米叶片光合作用和渗透调节对干旱胁迫的响应. 作物学报, 2013, 39: 530-536.
[35]王军辉, 查学强, 罗建平, 等. 干旱胁迫对玉米幼苗脂质过氧化作用及保护酶活性的影响. 安徽农业科学, 2006, 34: 3568-3569, 3571.
[36]张乃华, 高辉远, 邹琦. Ca2+缓解NaCl胁迫引起的玉米光合能力下降的作用. 植物生态学报, 2005, 29: 324-330.
[38]杨涛, 梁宗锁, 薛吉全, 等. 不同玉米品种水分利用效率的差异性研究. 农业工程学报, 2005, 21: 21-25.
[39]杨涛, 梁宗锁, 薛吉全, 等. 干旱胁迫下不同玉米品种的耗水特性及其水分利用效率的差异. 干旱地区农业研究, 2005, 23: 103-107.
[40]贾秀领, 蹇家利, 马瑞昆, 等. 高产冬小麦水分利用效率及其组分特征分析. 作物学报, 1995, 25: 309-314.
Growth and gas exchange characteristics of Jerusalem artichoke (Helianthus tuberosus) at different growth stages in a semi-arid area
YANG Bin, LV Shi-Qi, KOU Yi-Xuan, SUN Shan, ZHAO Chang-Ming*
State Key Laboratory of Grassland and Agro-ecosystems, College of Life Sciences, Lanzhou University, Lanzhou 730000, China
The aim of this study was to evaluate the growth and gas exchange characteristics of Jerusalem artichoke (Helianthustuberosus) at different growth stages in a semi-arid area. The growth phenotype and photosynthetic physiology of Jerusalem artichoke high-yield lines (LZJ004 and LZJ119) and low-yield lines (LZJ018 and LZJ188) were evaluated at different growth stages. The results showed that plant height, internode length, leaf number, and leaf area were greater in high-yield lines than in low-yield lines at each stage. Compared with low-yield lines, high-yield lines showed a 44.94%, 8.26%, 12.11%, and 4.79% increase in corolla diameter, receptacle diameter, ligulate petal number, and ligulate petal length, respectively. The net photosynthetic rate (Pn) of high-yield lines was higher than that of low-yield lines. The water use efficiency (WUE) was also higher in high-yield lines than in low-yield lines, except at the rhizome formation stage, and the WUE of high-yield lines did not vary widely among the different growth stages. The sensitivity of Pn, stomatal conductance, and transpiration rate to changes in vapor pressure difference was lower in high-yield lines than in low-yield lines. During the whole growth period, the high-yield lines of Jerusalem artichoke had stronger growth potential and lower sensitivity to drought stress, which ensured highly efficient formation of underground tubers. This information will be useful to accelerate the breeding of high-yield Jerusalem artichoke cultivars.
Jerusalem artichoke; high-yield line; growth stage; growth characteristics; gas exchange parameters
10.11686/cyxb2015550
2015-12-07;改回日期:2016-03-25
国家科技支撑计划(2015BAD15B03)和兰州大学中央高校基本科研业务费专项资金(lzujbky-2015-k14)资助。
杨彬(1989-),男,甘肃天水人,在读硕士。E-mail: ybinbeyond@163.com
Corresponding author. E-mail:zhaochm@lzu.edu.cn
http://cyxb.lzu.edu.cn
杨彬,吕世奇,寇一翾,孙杉,赵长明. 半干旱地区不同生育期菊芋生长特性与气体交换特征. 草业学报, 2016, 25(10): 77-85.
YANG Bin, LV Shi-Qi, KOU Yi-Xuan, SUN Shan, ZHAO Chang-Ming. Growth and gas exchange characteristics of Jerusalem artichoke (Helianthustuberosus) at different growth stages in a semi-arid area. Acta Prataculturae Sinica, 2016, 25(10): 77-85.
