朱蕉叶枯病菌的鉴定及生物学特性
2016-11-12童依婷晏冬华彭文煊黄静华黄洪滨易润华
童依婷,晏冬华,彭文煊,黄静华,黄洪滨,易润华
(广东海洋大学农学院,广东 湛江 524088)
朱蕉叶枯病菌的鉴定及生物学特性
童依婷,晏冬华,彭文煊,黄静华,黄洪滨,易润华
(广东海洋大学农学院,广东湛江524088)
通过致病性测定、形态学特性和系统发育分析,确定引起朱蕉叶枯病的病原菌为轮状镰刀菌 Fusarium verticillioides (Saccardo) Nirenberg。研究表明,在测试的7种培养基中,PDA最有利于病原菌生长,PSCA最有利于产孢。以蜂蜜为碳源的培养基上生长最快,产孢量最大,而以柠檬酸钠作碳源时生长最慢,产孢量最小; 以蛋白胨为氮源时生长最快,而以酵母膏为氮源时产孢量最大。病原菌的最适生长和产孢的温度为25℃,在pH值为8时生长速率最快,pH值为7时产孢量最大。光照对病原菌生长影响差异显著,对产孢量影响差异不显著。
朱蕉;叶枯病;轮状镰刀菌;生物学特性
朱蕉(Cordyline fruticosa Chevalier 1919),别称铁树,为龙舌兰科(Laxmanniaceae)朱蕉属(Cordyline)灌木植物,在亚洲、澳大利亚、太平洋岛屿、南美等地区及我国广东、广西、海南、台湾等省种植广泛。朱蕉茎高约1~3m,不分枝或很少分枝,叶淡红色至紫色,株形美观,色彩鲜艳,花色诱人,是一种观赏价值极高的植物,其叶可用于服饰、庭院装饰和食品包装等[1]。朱蕉也是一种药用植物[2],可治疗腹泻等疾病[3],叶片含有甾体皂苷,具有很好的抗菌和抑制肿瘤细胞的作用[4]。在种植中,出现一种叶枯病,导致叶片枯萎,植株中下部的叶片枯萎死亡,严重影响观赏价值。为确定引起朱蕉叶枯病的病原菌,本研究从广东海洋大学校区发病植株中分离出病原菌,对其进行致病性测定,根据形态学和ITS序列分析确定病原菌的分类地位,并研究病原菌生物学特性,以期为该病害防治提供依据。
1 材料与方法
1.1材料
1.1.1病原菌 从朱蕉病叶上分离得到。
1.1.2培养基(1)马铃薯葡萄糖琼脂培养基(PDA);(2)察氏培养基(CDM);(3)燕麦培养基(OMA);(4)马铃薯蔗糖培养基(PSA);(5)燕麦培养基(OMA):燕麦片30.0g,琼脂20.0g,H2O 1000mL;(6)葡萄糖蛋白胨酵母膏培养基(GTYA):蛋白胨2.0g,酵母菌1.0g,葡萄糖10.0g,琼脂20.0g,H2O 1000mL;(7)马铃薯蔗糖朱蕉叶培养基(PSCA):马铃薯200.0g,蔗糖20.0g,朱蕉叶50.0g,琼脂20.0g,H2O 1 000 mL。
1.1.3主要仪器OLYMPUS BX5显微镜(日本OLYMPUS公司);Nikon DXM 1200F数码显微成像系统(日本Nikon公司);ABI-9700 PCR仪(美国ABI公司)。
1.2方法
1.2.1病原菌的分离采集朱蕉叶枯病病害标本,清水冲洗干净,剪取叶片病健交界处5mm × 5mm大小的组织,用无菌水清洗后,经体积分数75%的乙醇洗1min,无菌水冲洗3次,以1g/L的升汞消毒40~50 s,无菌水冲洗3次后,将组织块接种到PDA平板培养基,置 30℃倒置培养。长出菌丝后挑取菌丝先端接种纯化。产孢后,进行单孢分离获取病原菌的纯培养。
1.2.2致病性测定将病原菌接种到 PDA培养基黑暗培养3 d后备用。选取朱蕉健康叶片用体积分数75%乙醇消毒后,用针稍微刺伤叶片,接种孢子浓度为105~106个/mL的孢子悬浮液和5mm的菌饼,用无菌水和琼脂块对照。接种后用塑料袋包好保湿。致病性测定在室外和室内进行。
1.2.3病原菌鉴定形态学观察:参考 Leslie和Summerell方法[5],观察病原菌在PDA培养基25℃黑暗培养7天的菌落大小和形态特征。将培养基放入凹玻片中,接种孢子悬浮液后,置于25℃恒温箱中培养1~3 d,观察产孢结构和孢子形态,测量孢子大小等。
ITS序列分析:将病原菌接种到PDA培养基,25℃下恒温黑暗培养3d,用无菌牙签挑取少许菌丝放入 PCR反应管中,按照 LU等[6]方法进行菌落PCR扩增ITS序列。引物为ITS 4(TCC TCC GC TTA TTG ATA TGC)和ITS 5(GGA AGT AAA AGT CGT AAC AAG G)[8]。用TaKaRa公司的MightyAmp DNA Polymerase Ver.2试剂盒配置PCR反应体系,含1×MightyAmp Buffer,0.2μM上下游引物,1.25U MightyAmp DNA聚合酶体积50µL。PCR扩增程序为98℃预变性,2min;98℃变性10 s;56℃退火15 s;68℃延伸 1min;35个循环。PCR 产物由生工生物工程(上海)股份有限公司测序。所得序列在GenBank进行BLAST,比较其与近缘种的同源性。
在GengBank中选取16个与病原菌亲缘关系较近的近缘种序列,用MEGA 6.0软件[7]的Clustal W模块进行序列比对后,采用邻接法(Neighbor -joining,NJ)构建系统发育树,采用自举法(Bootstrap)进行1 000次循环检测系统发育树的可信度。比对后的序列矩阵用jModelTest V2.1.4[8]分析,根据BIC准则(Bayesian information criterion,BIC)选择核苷酸替换最优模型(TPM2+G),MrBayes3.2软件[9]进行贝叶斯分析构建系统发育树。分析程序为:lset nst = 6 rates = invgamma; unlink statefreq =(all)revmat =(all)shape =(all)pinvar =(all);prset applyto =(all)ratepr = variable;mcmcp ngen = 10000000 relburnin = yes burninfrac = 0.25 printfreq = 1000 samplefreq = 1000 nchains = 4 savebrlens = yes。用马尔科夫链蒙特卡罗法(Markov Chain Monte Carlo method,MCMC)计算后验概率(Posterior probability)[10],评价系统发育树的可信度。
1.2.4生物学特性测定培养基、碳源、氮源、pH、温度和光照等因素对病原菌生长和产孢量的影响。
菌丝生长和产孢量测定:将病原菌接种到PDA平板培养基中,25℃黑暗培养3 d,取7mm菌饼接种至直径9cm的平板培养基培养4 d,采用十字交叉法测量菌落生长直径,6 d后,用无菌水将每个培养皿的病原菌孢子洗出,适当稀释后测量孢子数量。在测量不同培养基、碳源、氮源和pH对病原菌生长和产孢影响时,培养条件为25℃黑暗。
培养基:将病原菌分别接种到PDA、OMA、SCS、GTY、PSA、PSCA、CDM 7种培养基。
碳源:用等质量的D-麦芽糖、蜂蜜、肌醇、甘油、可溶性淀粉、柠檬酸钠、纤维素钠、乳糖、甘露醇、葡糖糖分别代替察氏培养基中的蔗糖作为碳源。
氮源:用等质量的甘氨酸、胰蛋白胨、酵母膏、氯化铵、尿素、L-苯丙氨酸、硫酸铵、硝酸钾、水解乳蛋白和牛肉浸膏分别代替察氏培养基中的硝酸钠作为氮源。
pH:将PDA培养基的pH调至2、3、4、5、6、7、8、9和10。
温度:将病原菌接种至PDA培养基,置于5℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃和45℃培养箱黑暗培养。
光照:将病原菌接种至PDA培养基,置于25℃培养箱,分别用24h 黑暗,12h光照 + 12h黑暗和24h光照处理。
1.2.5数据分析用SPSS 19.0软件进行显著性和Duncan新复方差分析。
2 结果与分析
2.1朱蕉叶枯病病症与致病性测定
朱蕉叶枯病一般发生在叶缘或叶部表面,病害多从植株中上部叶片的叶缘发生,病斑多不规则,黑褐色,中间浅褐色至白色,病斑逐步扩大蔓延整个叶片,导致叶片干枯死亡(图1 A);在叶片表面发病初期出现小点,后形成水渍状病斑,病斑圆形或椭圆形,随着病害发展,病斑变浅黄褐色,病斑边缘形成黄色晕圈(图1 B),后期病斑不规则,边缘黄褐色,中间白色(图1 C)。
将从病斑中分离到的菌株孢子或菌丝接种到健康朱蕉叶片,3~5 d后在室内和室外的接种叶片均出现水渍状病斑,15 d后室外接种的叶片发病症状与自然发病的症状一致(图1 D)。从人工接种的发病叶片中分离得到同样的菌,证实所接种的菌株为朱蕉叶枯病菌。

图1 朱蕉叶枯病症状Fig 1 Symptoms of leaf blight on ti plant
2.2病原菌鉴定
形态学特征:病原菌在 PDA培养基中生长迅速,气生菌丝棉絮状、浓密发达,形成绳状或束梗状,不产生分生孢子座;菌落表面白色至浅紫色,背面浅紫色(图2 A和B)。分生孢子梗从气生菌丝中长出,不分枝或呈轮枝状分枝,单瓶梗产孢,分生孢子排列呈链状或形成假头状(图2 C,D和E)。产两种分生孢子(图2 F和G),大孢子少见,镰刀形,细长,中部较直,两端略弯,3~5分隔,(20.24~35.01)×(2.98~4.35)μm;小孢子丰富,形状多样,卵形至棍棒状,0~1分隔(图2 H-P),(4.78~12.63)×(2.03~3.52)μm。无厚垣孢子形成。朱蕉叶枯病菌与轮状镰刀菌 Fusarium verticillioides的形态特征一致[5,11-12]。
用通用引物扩增朱蕉叶枯菌得到的ITS序列,长度为 555 bp(KX119132),在 NCBI网站进行BLAST,结果显示,朱蕉叶枯病菌的 TS序列与GenBank中的轮状镰刀菌F.verticillioides(有性型Gibberella moniliformis),藤仓镰孢F.fujikuroi(有性型G.fujikuroi),尖孢镰刀菌F.oxysporum和层出镰刀菌 F.proliferatum 的同源性为 100%。从Genebank选取近缘种构建邻接树和贝叶斯系统发育树,朱蕉叶枯病菌与它们处于系统发育树的同一分支(图3),其形态学差异见表1。根据形态学特征及系统发育关系,将朱蕉叶枯病菌鉴定为轮状镰刀菌Fusarium verticillioides (Saccardo) Nirenberg。
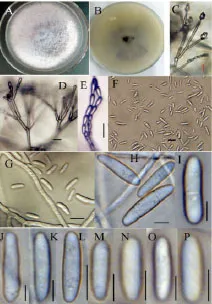
图2 病原菌形态特征Fig.2 Morphologic characteristic of F.verticillioides causing leaf blight on ti plant

图3 基于ITS序列的系统发育树Fig 3.Phylogenetic tree of Fusarium species reconstructed by neighbor-joining (NJ) and Bayesian inference (BI) using ITS sequence dataset
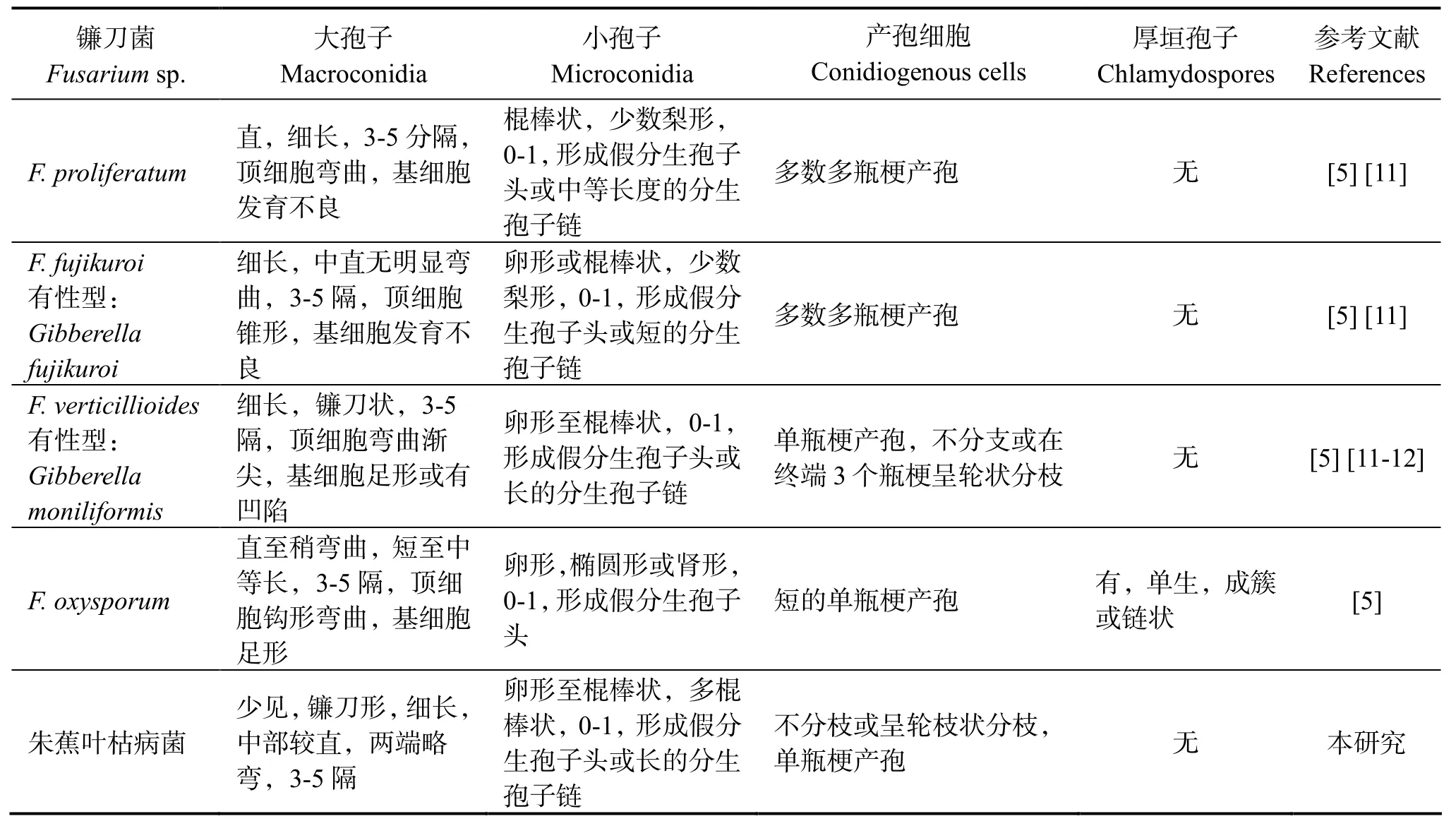
表1 朱蕉叶枯病菌与其近缘种形态特征比较Table 1 Morphological comparison of pathogen of leaf blight on ti plant with the relative Fusarium spp.
2.3病原菌的菌丝生长及产孢量
2.3.1培养基病原菌在7种培养基上的菌丝生长速度与产孢量差异显著(P<0.05)(图 4)。菌落直径依次为:PDA >PSCA >PSA >SCS >CDM > OMA>GTYA,其中在PDA、PSCA和PSA培养基上生长差异不显著,在PDA培养基上生长最快,菌落直径为61.5mm;产孢量依次为:PSCA >PSA >PDA>CDM >SCS >GTYA >OMA,其中PSCA培养基最有利于病原菌产孢,产孢量为 5.17×108个/皿,而OMA、SCS和GTYA培养基不利于病原菌产孢,OMA产孢量最低,仅为4.0×106个/皿。
2.3.2碳、氮源朱蕉叶枯病菌在含不同碳、氮源的培养基上的菌丝生长与产孢量差异显著(P<0.05)(表2)。病原菌在以蜂蜜、蔗糖、肌醇、甘露醇、淀粉、葡萄糖、乳糖和麦芽糖为碳源时,菌丝生长差异不显著,但以蜂蜜为碳源的培养基上生长最快,产孢量也最大,菌落直径和产孢量分别为54.5mm和10.94×108个/皿,而以柠檬酸钠作碳源生长最慢,产孢量最小,菌落直径和产孢量分别为28.8mm和1.3×107个/皿;在以蛋白胨为氮源的培养基上生长最快,而以硫酸铵为氮源生长最慢,4 d后菌落直径分别为60.7mm和32.5mm;以酵母膏为氮源时,病原菌的产孢量最大,为5.04×108个/皿,在缺乏氮源时,不产生孢子。
2.3.3温度与pH病原菌在5℃以下,35℃以上不生长和产孢,在10~30℃范围内可生长和产孢,适合生长的温度范围20~30℃,最适生长和产孢的温度为25℃,菌落直径和产孢量分别为52.3mm和5.92×108个/皿(表3)。病原菌在pH值为2~10的PDA培养基上均能生长,pH值为8时生长速度最快,菌落直径为57.2mm,pH值为7时最有利于产孢,产孢量为6.40×108个/皿。
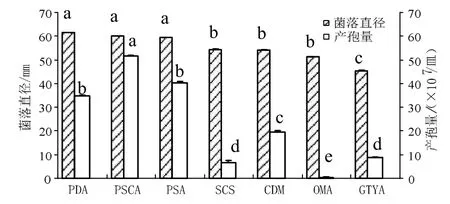
图4 培养基对朱蕉叶枯病菌菌丝生长和产孢量的影响Figure 4 Effect of different medium on mycelia growth and sporulation of pathogen causing leaf blight on ti plant
2.3.4光照在不同光照条件下病原菌生长差异显著(P<0.05),用24h 黑暗、12h光照+12h黑暗和24h光照处理后,菌落直径分别为 51.5,45.0和41.3mm,在黑暗条件下生长最快;光照处理对产孢量没有显著影响(P>0.05),在24h 黑暗、12h光照+12h黑暗和24h光照条件下,产孢量分别为4.38×108,4.00×108和3.77×108个/皿。
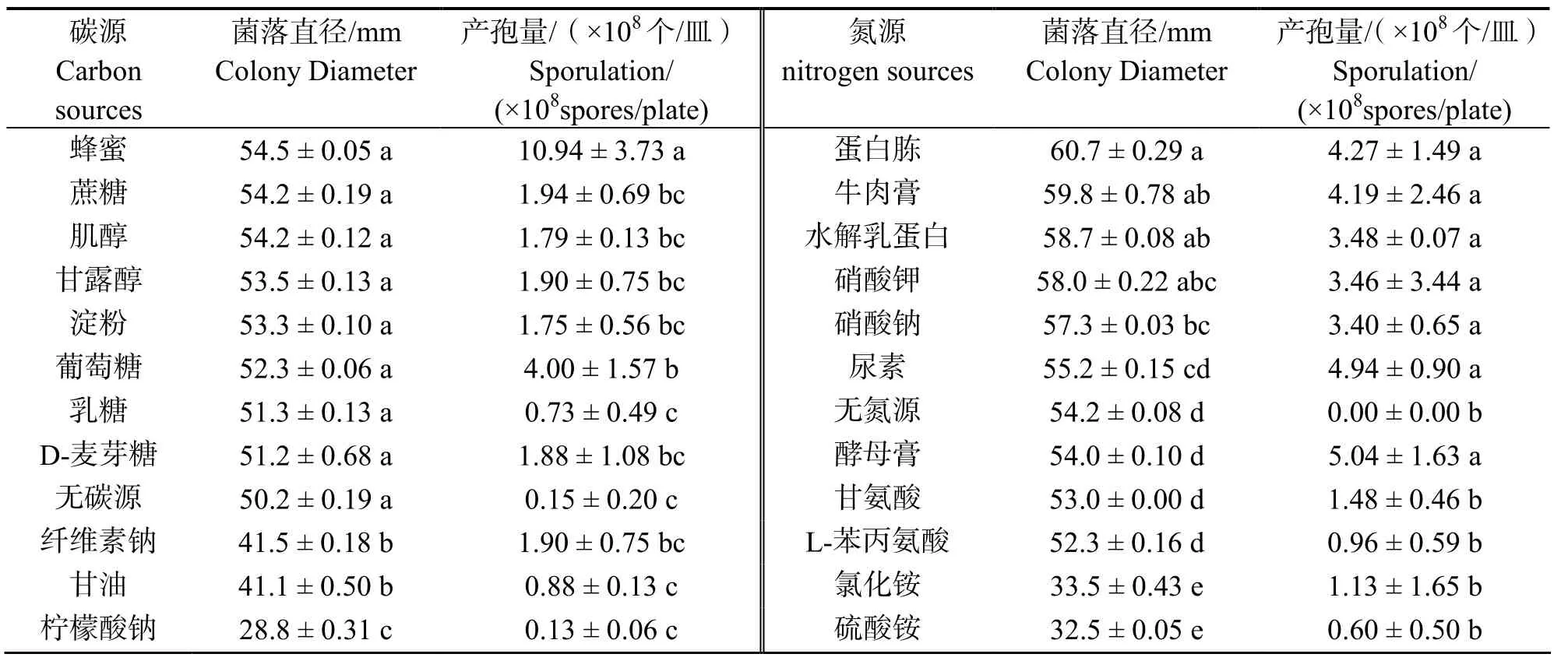
表2 碳、氮源对朱蕉叶枯病菌菌丝生长和产孢量的影响Table 2 Effect of carbon sources and nitrogen sources on the mycelial growth and sporulation of pathogen causing leaf blight on ti plant
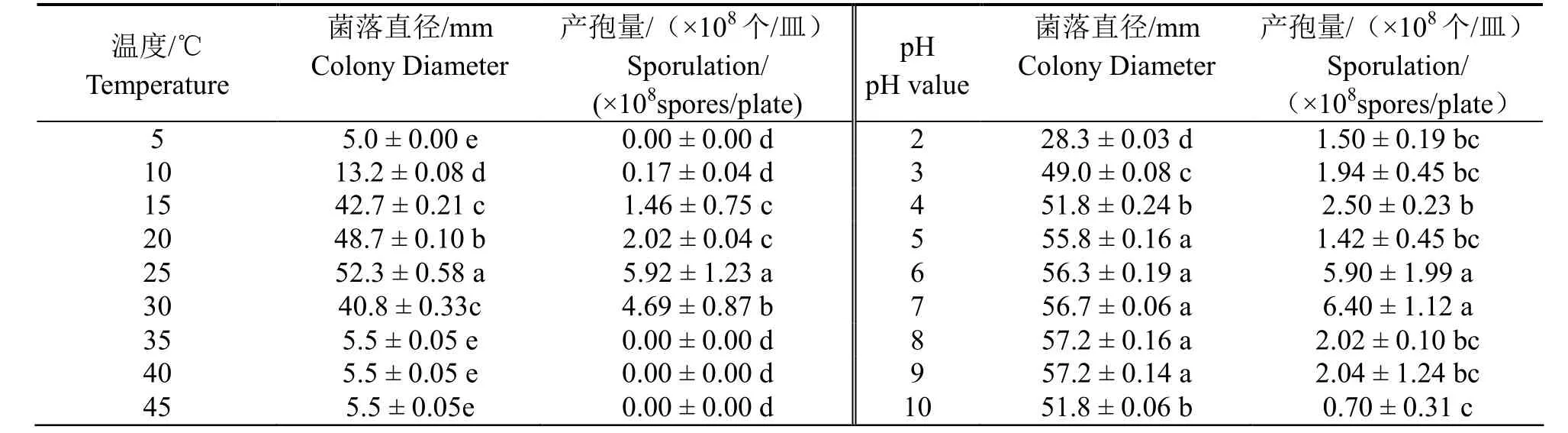
表3 温度和pH对朱蕉叶枯病菌菌丝生长和产孢量的影响Table 3 Effect of temperatures and pH values on the mycelial growth and sporulation of pathogen causing leaf blight on ti plant
3 讨论与结论
镰刀菌Fusarium在世界范围分布广,可产生多种次生代谢产物,人、动物和植物的很多病害都是由镰刀菌引起[5]。镰刀菌通常以形态学特性分类,但是有时两个种的形态差异非常微小,很难区分。根据家系一致系统发育种识别(Genealogical concordance phylogenetic species recognition,GCPSR)原理,利用多位点序列分型(Multilocus sequence typing,MLST)可有效确定物种间的亲缘关系,区分微生物的物种和姊妹种[13]。复合种(Species complex)是指形态学特征差异微小,亲缘关系相近的种的集合,O'Donnell等利用MLST-GCPSR将镰刀菌分成20个复合种和9个单型系(Monotypic lineages)[14]。朱蕉叶枯病菌具轮枝状分枝的特征与 Gibberella fujikuroi复 合 种 的 轮 状 镰 刀 菌 Fusarium verticillioides一致,与其它种明显不同[12]。本研究通过致病性测定、形态学特征和系统发育分析,确定引起朱蕉叶枯病的病原菌为轮状镰刀菌Fusarium verticillioides。
轮状镰刀菌F.verticillioides(异名:串珠镰刀菌F.moniliforme)在全球分布广泛,可侵染32科61属约116650种植物,大多数是重要粮食作物[15],如侵染玉米苗、茎杆和玉米穗而严重影响玉米的产量和品质[16],侵染水稻和甘蔗[17]、玉米的野生近缘种(Zea spp.)[18]、芦笋(Asparagus spp.)[19]等。轮状镰刀菌F.verticillioides侵染人或动物引起角膜炎、皮肤炎和腹膜炎等疾病[20],也侵染农业昆虫[21-23]。笔者发现轮状镰刀菌 F.verticillioides可侵染朱蕉引起叶枯病。
生物学特性研究表明病原菌在25℃时生长速度快,产孢量最大,朱蕉叶枯病在广东湛江地区常年发生,10—11月气温利于病原菌生长和产孢,导致病害发生严重。多菌灵、百菌清、三唑酮和甲基托布津对轮状镰刀菌 F.verticillioides的生长、产孢和分生孢子萌发有抑制效果[24],在田间使用烯哇醇对由轮状镰刀菌F.verticillioides引起的玉米穗腐病有85.8%的防效[25]。这些药剂在发病初期可用于朱蕉叶枯病的防治。
[1]EHRLICH C.The ethnobotany of Cordyline fruticosa(L)A.Chev.:The “Hawaiian Ti Plant”[D],Buffalo:State University at Buffalo,1999.
[2]LIM T K.Cordyline fruticosa[C]//Edible Medicinal and Non Medicinal Plants:Volume 9,Modified Stems,Roots,Bulbs.Dordrecht:Springer Netherlands,2015,627-632.
[3]DASH S K,PADHY S.Review on ethnomedicines for diarrhoea diseases from Orissa:Prevalence versus culture[J].Journal of Human Ecology,2006,20(1):59-64.
[4]FOUEDJOU R T,TEPONNO R B,QUASSINTI L,et al.Steroidal saponins from the leaves of Cordyline fruticosa(L.) A.Chev.and their cytotoxic and antimicrobial activity[J].Phytochemistry Letters,2014,7:62-68.
[5]LESILE J F,SUMMERELL B A.The Fusarium Laboratory Manual [M].Ames,Iowa,USA:Blackwell Publishing,2006.
[6]LU Q,HU H,MO J,et al.Enhanced amplification of bacterial and fungal DNA using a new type of DNA polymerase[J].Australasian Plant Pathol,2012,41(6):661-663.
[7]TAMURA K,STECHER G,PETERSON D,et al.MEGA6:Molecular Evolutionary Genetics Analysis version 6.0[J].Mol Biol Evol,2013,30(12):2725-2729.
[8]SANTORUM JM,DARRIBA D,TABOADA GL,et al.jmodeltest.org:selection of nucleotide substitution models on the cloud[J].Bioinformatics,2014,30(9):1310-1311.
[9]RONQUIST F,HUELSENBECK JP.MrBayes 3:Bayesian phylogenetic inference under mixed models[J].Bioinformatics,2003,19(12):1572-1574.
[10]MOSSEL E,VIGODA E.Phylogenetic MCMC algorithms are misleading on mixtures of trees[J].Science,2005,309(5744):2207-2209.
[11]HIRATA T,KIMISHIMA E,AOKI T,et al.Morphological and molecular characterization of Fusarium verticillioides from rotten banana imported into Japan[J].Mycoscience,2001,42(2):155-166.
[12]NIRENBERG H I,O'DONNELL K.New Fusarium species and combinations within the Gibberella fujikuroi species complex[J].Mycologia,1998,90(3):434-458.
[13]TAYLOR J W,JACOBSON D J,KROKEN S,et al.Phylogenetic species recognition and species concepts in fungi[J].Fungal Genetics and Biology,2000,31(1):21-32.
[14]O'DONNELL K,ROONEY A P,PROCTOR R H,et al.Phylogenetic analyses of RPB1 and RPB2 support a middle Cretaceous origin for a clade comprising all agriculturally and medically important fusaria[J].Fungal Genetics and Biology,2013,52(1):20-31.
[15]BACON C W,PORTER J K,NORRED W P,et al.Production of fusaric acid by Fusarium species[J].Applied and Environmental Microbiology,1996,62(11):4039-4043.
[16]MURILLO-WILLIAMS A,MUNKVOLD G P.Systemic infection by Fusarium verticillioides in maize plants grown under three temperature regimes[J].Plant Disease,2008,92(12):1695-1700.
[17]HSUAN H M,SALLEH B,ZAKARIA L.Molecular identification of Fusarium species in Gibberella fujikuroi species complex from rice,sugarcane and maize from Peninsular Malaysia[J].International Journal of Molecular Sciences,2011,12(10):6722.
[18]DESJARDINS A E,PLATTNER R D,GORDON T R.Gibberella fujikuroi mating population A and Fusarium subglutinans from teosinte species and maize from Mexico and Central America[J].Mycological Research,2000,104(7):865-872.
[19]STEPHENS C T,DE VRIES R M,SINK K C.Evaluation of Asparagus species for resistance to Fusarium oxysporum f.sp.asparagi and Fusarium moniliforme[J].Hortscience,1989,24(2):365-368.
[20] TORRES H A,KONTOYIANNIS D P.Hyalohyphomycoses( Hyaline Moulds)[C]// KAUFFMAN C,PAPPAS P G,SOBEL J D.Essentials of Clinical Mycology.New York:Springer,2011,281.
[21]PELIZZA S A,STENGLEIN S A,CABELLO M N,et al.First record of Fusarium verticillioides as an entomopathogenic fungus of grasshoppers[J].J Insect Sci,2011,11:70.
[22]李宏科.一种重要的虫生真菌—串珠镰刀菌[J].微生物学通报,1983(5):239.
[23]庞献伟,刘志荣,王庆克.林木害虫病原轮状镰刀菌的初步研究[J].林业科技通讯,1993(8):25-26.
[24]侯浪.玉米穗腐病串珠镰刀菌的生物学特性和玉米抗病性研究[D].雅安:四川农业大学,2007.
[25]石洁.玉米镰刀菌型茎腐、穗腐、苗期根腐病的相互关系及防治[D].保定:河北农业大学,2002.
(责任编辑:陈庄)
Identification and Biological Characteristics of Fusarium verticillioides(Saccardo)Nirenberg Causing Leaf Blight on Ti Plant(Cordvline fruticosa Chevalier)
TONG Yi-ting,YAN Dong-hua,PENG Wen-xuan,HUANG Jing-hua,HUANG Hong-bin,YI Run-hua
(Agricultural College,Guangdong Ocean University,Zhanjiang 524088,China)
The pathogen of leaf blight on ti plant(Cordyline fruticosa Chevalier)was recognized as Fusarium verticillioides(Saccardo)Nirenberg according to the pathogenicity tests,the biological characteristics and phylogenetic analysis.The results of biological characteristics showed that among the seven tested media,the pathogen grew fastest and sporulated richest on potato dextrose agar(PDA)medium and potato sugar Cordyline fruticosa leaf agar(PSCA); the Czapek-Dox medium(CDM)with equal quality of honey to substitute as carbon source was most favorable for the mycelial growth and sporulation of F.verticillioides,while with sodium citrate was most unfavorable among the eleven tested carbon sources; the best nitrogen source for the mycelial growth and sporulation were peptone and yeast extract respectively among the tested nitrogen sources; the temperature 25℃ was optimum for the mycelial growth and sporulation; the mycelial growth was encouraged by pH 8.0 and the sporulation was by pH 7.0; light treatments had no significant effect on the sporulation but it had significant on the mycelial growth of the pathogen of leaf blight on ti plant.
Ti plan(tCordvline fruticosa);leaf blight;Fusarium verticillioides;biological characteristics
S436.8
A
1673-9159(2016)04-0089-07
10.3969/j.issn.1673-9159.2016.04.015
2016-04-22
国家级和广东海洋大学学生创新创业训练计划项目【校教务〔2012〕31号CXXL12026】
童依婷(1991—),女,2015届植物保护专业。
易润华,男,博士,副教授,从事植物病理学研究。E-mail:scibyrh@163.com
