直接获取生物组织内部磷脂类物质的质谱分析方法
2016-11-09卢海艳张建勇魏益平陈焕文
卢海艳 张建勇 周 炜 魏益平 陈焕文*
1(江西省质谱科学与仪器重点实验室,东华理工大学,南昌330013)2(南昌大学第二附属医院,南昌330006)
直接获取生物组织内部磷脂类物质的质谱分析方法
卢海艳1张建勇2周炜1魏益平2陈焕文*1
1(江西省质谱科学与仪器重点实验室,东华理工大学,南昌330013)2(南昌大学第二附属医院,南昌330006)
选择肺癌组织等多种生物组织为代表性样品,在正离子检测模式下,以磷脂类物质丰度、信号强度高为目标,考察了21种不同组成的CH3OH/H2O溶剂体系,获得了最佳溶剂(CH3OH-H2O,30∶70,V/V),建立了一种无需破坏、研磨即可获取组织内部样品中磷脂类物质信号的内部萃取电喷雾电离质谱(iEESI-MS)方法,并成功应用于肺癌、食管癌、猪肉、牛肉、猪肺、猪心等不同生物组织样品中磷脂类物质的直接质谱分析。本方法无需样品预处理,可通过选择合适的萃取溶剂来提高方法的分析灵敏度和选择性,单个样品的平均分析时间少于1min,样品耗量少,有望为生物组织样品中磷脂类物质的研究提供一种质谱学新方法。
生物组织样品;磷脂;萃取剂;内部萃取电喷雾电离质谱
1 引言
磷脂类物质及其代谢物具有重要的生理功能,在细胞生长分化、凋亡吞噬、能量储存、信号传递等生理过程起到重要作用[1,2]。磷脂作为细胞膜的主要组成成分,在细胞中的含量相对较高,是单细胞领域研究备受关注的物质之一[3,4]。由于很多疾病的发生、发展都与体内磷脂类物质含量的变化、代谢紊乱等密切相关[5],可作为一些疾病的生物标记物。因此,尽可能全面地得到生物组织样品中磷脂类物质信息,对揭示其在生命体内的作用机制、寻找疾病的分子标志物及医药研发等方面具有重要意义。
然而,由于磷脂类物质种类繁多,相互作用复杂,传统的分析技术检测复杂样品(如血浆、组织)中磷脂类物质时,一般都要经过分离、纯化、提取等复杂的样品预处理过程[6],不仅耗时较长,而且可能带来不确定因素。直接质谱分析技术,如电喷雾解吸电离(DESI)[7,8]、激光消融电喷雾电离(LAESI)[9]等,因其无需样品预处理、样品耗量少、响应速度快、灵敏度高等,可实现生物组织样品中多种磷脂类物质的同时、直接、快速识别。这些方法主要分析组织样品表面的磷脂,无法实现对整体组织样品内部磷脂的直接检测。
内部萃取电喷雾电离质谱(iEESI-MS)技术直接将萃取剂导入到组织样品内部,可实现组织样品内部小分子代谢产物等组分的直接质谱分析[10~12]。本研究采用iEESI-MS技术,在无需样品预处理的条件下,考察了21种不同组成的CH3OH-H2O溶剂体系,获得CH3OH-H2O(30∶70,V/V)为适合不同生物组织样品中磷脂类物质分析的最佳溶剂,建立了一种无需破坏、研磨即可获取生物组织样品内部磷脂类物质的质谱学新方法。
2 实验部分
2.1仪器与试剂
内部萃取电喷雾电离源(iEESI)为本实验室自制;LTQ-XL线性离子阱质谱仪并配有Xcalibur数据处理系统(美国Thermo Scientific公司);质谱仪设置在正离子检测模式下,质量扫描范围为m/z 50~2000,离子源电压5.5 kV,离子传输管温度为150℃,毛细管电压为10 V,透镜电压为100 V;在进行串联质谱分析时,设置碰撞能量为10~30%,碰撞时间为30 ms,母离子隔离宽度为1.5 Da;其它检测参数由LTQ-Tune系统自动优化得到。石英毛细管(内径0.10 mm,外径0.19 mm,美国Agilent Technologies公司);甲醇(色谱纯,美国ROE公司),实验用水为二次蒸馏水。
2.2实验方法
iEESI-MS的实施方式如图1所示。将石英毛细管平行插入组织样品内部,插入组织样品内部的石英毛细管前端距离样品前沿约2 mm,样品前端与质谱入口的距离为5~6 mm,萃取溶剂以0.5μL/min的流速通过石英毛细管,流经组织样品内部并在组织样品内部进行选择性萃取。在微量进样针的钢针部位施加5.5 kV正高压,在电场的作用下,样品前端产生大量承载待测物的微小带电液滴。这些微小带电液滴去溶剂化后得到气态待测物离子,引入质谱仪检测。
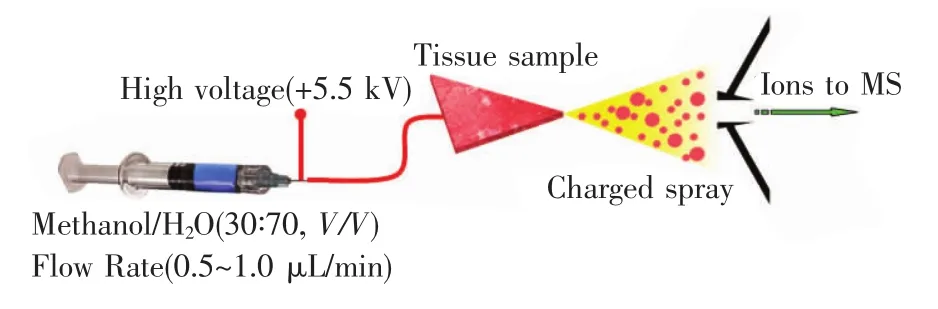
图1 内部萃取电喷雾电离质谱(iEESI-MS)实验原理示意图Fig.1 Schematic diagram of internal extractive electrospray ionization(iEESI)mass spectrometry
本研究所用实验样品人体肺癌组织(包括癌症组织与癌旁组织(距离癌症组织中心约5 cm))和食管癌组织由南昌大学第二附属医院提供,其它组织样品,如猪肺、猪肉、牛肉、猪心等,购自当地市场。所有样品均储存于-80℃超低温冰箱中,在进行iEESI-MS分析前,将样品取出室温下解冻,样品无需其它处理,即可直接进行iEESI-MS实验。在优化实验中,以不同体积比的CH3OH-H2O萃取每种样品,平行检测至少3次,确保实验结果的重复性。
3 结果与讨论
3.1萃取溶剂优化
为了全面获取组织样品中磷脂类物质信息,选择合适的萃取溶剂对提高分析方法的性能具有重要意义。目前,最常用的脂类物质萃取方法是传统的“金标准”法,即Folch or bligh and dyer recipes法[4]。该方法采用CHCl3-CH3OH(2∶1,V/V)混合液为萃取溶剂,但氯仿具有致癌性[13],且降解产生光气、氯化氢气体,可能使一些不稳定磷脂类物质发生化学修[14],影响检测结果的准确性。有文献报道,改进的二氯甲烷-甲醇(CH2Cl2-CH3OH)[15]、甲基叔丁酰乙醚-甲醇(MTBE-CH3OH)[1]等可用于组织样品中脂类物质的提取,但这些体系均不适于质谱进行直接检测。显然,在质谱分析中,萃取剂既是该待测物的电喷雾液滴,也是影响物质萃取效率的重要参数,不仅所选溶剂本身的化学及物理性质在一定程度上影响获得的分子信息,而且目标物离子化效率受到溶剂组成和其本身在溶剂中溶解度的影响,相似相溶的规律依然适用[16]。
实验选用不同体积比的CH3OH-H2O(0~100%)为萃取溶剂,选择肺癌患者的癌症与癌旁组织为实验样品,按2.2节实验方法测定组织样品中的磷脂类物质,每个比例至少测3次,萃取剂中CH3OH含量对癌症组织(CA)(图2a)与癌旁组织(CAB)(图2b)中二棕榈酰磷脂酰胆碱(m/z 757,[DPPC+Na]+)、1-棕榈酰基-2-油酰基磷脂酰胆碱(m/z 783,[POPC+Na]+)、二油酰磷脂酰胆碱(m/z 809,[DOPC+ Na]+)和花生四烯酰-硬脂磷脂酰胆碱(m/z 833,[SAPC+Na]+)的信号强度的影响如图2所示。
在癌症组织(图2a)中,当CH3OH含量在0~15%范围时,这4种磷脂类物质的信号强度随CH3OH含量的增加而逐渐下降;当CH3OH含量在15%~30%范围时,癌症组织中这4种磷脂类物质的信号强度随CH3OH含量的增加而逐渐增大;当CH3OH含量在30%~40%范围时,它们的信号强度随CH3OH含量的增加而逐渐下降;当CH3OH含量在35%~75%范围时,这4种磷脂类物质的信号强度不再随CH3OH含量的增大发生明显的变化;当CH3OH含量达到80%时,这4种物质的信号强度又开始增大。总体来说,CH3OH含量为30%时,这4种磷脂类物质的信号强度最高;当CH3OH含量大于80%后,它们的信号强度先下降后趋于稳定。
在癌旁组织(图2b)中,当CH3OH含量在0~30%范围时,随CH3OH含量增加,除m/z757([DPPC+Na]+)的信号强度变化趋势不稳定外,m/z783([POPC+Na]+)、m/z809([DOPC+Na]+)和m/z 833([SAPC+Na]+)这3种磷脂类物质的信号强度基本都逐渐增大;当CH3OH含量在35%时,这4种磷脂类物质的信号强度明显下降;当CH3OH含量在40%~70%范围时,这4种磷脂类物质的信号强度不再随CH3OH含量的增大发生明显的变化;当CH3OH含量达到75%时,这4种物质的信号强度又开始增大。但总体来说,CH3OH含量为30%时,这4种磷脂类物质的信号强度最高;当CH3OH含量大于75%后,它们的信号强度先下降后趋于稳定。综合考虑,选择CH3OH-H2O(30∶70,V/V)为癌旁与癌症组织中磷脂类物质的最佳萃取体系。

图2 溶剂组成对组织样品中磷脂物质信号的影响。癌症组织(CA)(a)与癌旁组织(CAB)(b)中(1)二棕榈酰磷脂酰胆碱 (m/z 757,[DPPC+Na]+);(2)1-棕榈酰基-2-油酰基磷脂酰胆碱(m/z 783,[POPC+ Na]+);(3)二油酰磷脂酰胆碱(m/z809,[DOPC+Na]+);(4)和花生四烯酰-硬脂磷脂酰胆碱(m/z 833,[SAPC+Na]+)的信号强度随萃取剂中CH3OH含量的变化情况Fig.2 Effect of solvent constitution of iEESI.(1)dipalmitoyl phosphatidylcholine(m/z757,[DPPC+Na]+); (2)phosphatidylcholine(m/z 783,[POPC+Na]+);(3)oleoyl phosphatidylcholine(m/z 809,[DOPC+ Na]+)and(4)arachidonic acid stearoyl phosphatidylcholine(m/z 833,[SAPC+Na]+)from lung cancer tissue (a)and adjacent tissue(b)with different proportion ofmethanol 1.m/z757;2.m/z 783;3.m/z 809;4.m/z 833.
上述结果表明,待测物在iEESI源中的电离效率可能与它在萃取剂中的溶解度、萃取剂极性及其本身极性等密切相关。因此,iEESI方法可通过选择合适的萃取溶剂提高方法的灵敏度和选择性。
3.2癌症组织样品分析
选择CH3OH∶H2O(30∶70,V/V)作萃取溶剂,获取了肺癌组织(图3a)、肺癌旁组织(图3b)与食管癌组织(图3c)的iEESI-MS化学指纹谱图。通过进行碰撞诱导解离实验(CID)和相关文献比较证实,这3种组织样品在m/z 700-900质量范围内主要得到磷脂类物质,如m/z 757[PC(32∶0)+Na]+,m/z 773[PC(32∶0)+K]+,m/z 783[PC(36∶4)+Na]+,m/z799[PC(36∶4)+K]+,m/z809[PC(36∶2) +Na]+,m/z825[PC(36∶2)+K]+和m/z833[PC(38∶4)+Na]+等。
从肺癌癌症组织谱图(图3a)可见,m/z 783[PC(36∶4)+Na]+,m/z 799[PC(36∶4)+K]+,m/z 809[PC(36∶2)+Na]+,m/z825[PC(36∶2)+K]+,m/z833[PC(38∶4)+Na]+等在癌症组织中的相对丰度明显高于它们在癌旁组织中的相对丰度,而m/z757[PC(32∶0)+Na]+在癌症组织中的相对丰度却低于它在癌旁组织中的相对丰度。有文献报道,质谱信号峰如m/z 757,783,809,833等都是肺表面活性物质(PS)的主要成分[17]。肺表面活性物质(PS)是由构成肺泡壁的肺泡2型(AT2)细胞分泌,其成分主要包括磷脂类(DPPC占80%)和少量肺表面活性物质结合蛋白。研究发现,AT2细胞基因突变可致肺癌[18],家族性肺纤维化和肺癌与表面活性物质结合蛋白D(SP-D)[19]突变有关。有学者甚至提出血清中前表面活性物质结合蛋白B(pro-SP-B)是一种肺癌生物标志物的观点[20]。但目前PS代谢异常与AT2细胞突变成肺癌细胞的关系尚不明确,还有待于进一步研究。
此外,对比肺癌组织(图3a)与食管癌组织(图3c)的化学指纹谱图可以看出,在较高质量范围(m/z 700~900),虽然这两种组织样品都主要得到磷脂类物质,如m/z726,761,757,773,783,799,809,825等,但是,由于不同组织样品之间的本体差异,得到的质谱信号峰表现出一定的区别。这主要表现在肺癌癌症组织得到的磷脂类物质明显比食管癌组织丰富。

图3 CH3OH∶H2O(30∶70,V/V)作萃取溶剂,iEESI-MS分析不同组织化学指纹谱图:(a)肺癌组织、(b)肺癌旁组织,(c)食管癌组织Fig.3 iEESI-MS analysis of different cancer tissues using CH3OH-H2O(30∶70,V/V)as solvent: (a)lung cancer tissue,(b)lung cancer adjacent tissue,(c)esophageal cancer tissue
磷脂类物质是细胞膜的主要成分,具有能量储存[1]、信号传递[2]等重要作用。越来越多的研究表明,磷脂类物质可以作为癌症诊断潜在的分子标志物[5];人类很多疾病的发生,都与其体内部分磷脂类物质含量的变化息息相关,例如磷脂类物质在心血管疾病中的作用已经得到初步确认[21,22]。因此,建立一种快速、准确的分析生物组织样品中磷脂类物质的方法,对寻找疾病分子标志物,进一步探究疾病的发病机制与磷脂类物质之间的关系具有重要意义。
3.3其它生物组织样品分析
选择CH3OH-H2O(30∶70,V/V)作萃取溶剂,获取了猪肉(图4a)、牛肉(图4b)、猪心(图4c)、猪肺组织(图4d)的iEESI-MS谱图。从图4可见,在m/z 700~900质量范围内,这几种组织样品均可得到磷脂类物质的质谱信号峰,如m/z 757,773,783,799,809,825等,但是,由于不同组织之间存在本体差异,它们质谱信号峰也表现出一定的差别。此结果进一步说明,CH3OH-H2O(30∶70,V/V)溶剂体系,不仅是分析人体癌症组织样品中磷脂类物质的最佳萃取剂,还适用于猪肉、牛肉、猪肺、猪心等动物组织样品中磷脂类物质的直接质谱分析。本研究为生物组织样品中磷脂类物质的分析提供了新思路。
4 结论
本研究采用iEESI-MS技术,在无需样品预处理的条件下,以磷脂类物质丰富、信号强度高为目标,考察了21种不同组成的CH3OH/H2O溶剂体系,确定CH3OH-H2O(30∶70,V/V)为适合不同生物组织样品中磷脂类物质分析的最佳溶剂,建立了一种无需破坏、研磨即可获取生物组织内部样品中磷脂类物质的质谱学新方法。同时进一步说明iEESI-MS方法可以通过选择合适的萃取溶剂来提高方法的分析灵敏度和选择性。

图4 CH3OH-H2O(30∶70,V/V)作萃取溶剂,iEESI-MS分析(a)猪肉、(b)牛肉、(c)猪心、(d)猪肺Fig.4 iEESI-MS analysis of different meat using CH3OH-H2O(30∶70,V/V)as solvent:(a)pork,(b)beef,(c)porcine heart,(d)porcine lung
References
1Wang H,Manicke N E,Yang Q,Zheng L,Shi R,Cooks R G,Ouyang Z.Anal.Chem.,2011,83(4):1197-1201
2Santos C R,Schulze A.FEBS J.,2012,279(15):2610-2623
3Ellis SR,Ferris C J,Gilmore K J,Mitchell TW,Blanksby S J,In Het Panhuis M.Anal.Chem.,2012,84(22): 9679-9683
4XieW,Gao D,Jin F,Jiang Y,Liu H.Anal.Chem.,2015,87(14):7052-7059
5Guo S,Wang Y,Zhou D,Li Z.Sci.Rep.,2014,4:5959
6Paglia G,Ifa D R,Wu C,Corso G,Cooks R G.Anal.Chem.,2010,82(5):1744-1750
7Girod M,Shi Y,Cheng JX,Cooks R G.Anal.Chem.,2011,83(1):207-215
8Lostun D,Perez C J,Licence P,Barrett D A,Ifa D R.Anal.Chem.,2015,87(6):3286-3293
9Nemes P,Woods A S,Vertes A.Anal.Chem.,2010,82(3):982-988
10Zhang H,Gu H,Yan F,Wang N,Wei Y,Xu J,Chen H.Sci.Rep.,2013,3:2495
11Zhang H,Chingin K,Zhu L,Chen H.Anal.Chem.,2015,87(5):2878-2883
12Zhang H,Zhu L,Luo L,Wang N,Chingin K,Guo X,Chen H.J.Agric.Food Chem.,2013,61(45):10691-10698
13Nagano K,Kano H,Arito H,Yamamoto S,Matsushima T.J.Toxicol.Env.Heal.A,2006,69(20):1827-1842
14XICong,CHEN Yan-Hua,YANGWei,ZHANG Rui-Ping,HE Jiu-Ming,ZHANG Hua-Bing,XIAO Xin-Hua,ZEPER Abliz.Chinese J.Anal.Chem.,2013,41(9):1308-1314习聪,陈艳华,杨维,张瑞萍,贺玖明,张化冰,肖新华,再帕尔·阿不力孜.分析化学,2013,41(9):1308-1314
15Hu C,van Dommelen J,van Der Heijden R,Spijksma G,Reijmers TH,Wang M,Slee E,Lu X,Xu G,van Der Greef J.J.Proteome Res.,2008,7(11):4982-4991
16JIA Bin,ZHANG Xing-Lei,DING Jian-Hua,YANG Shui-Ping,CHEN Huan-Wen.Chinese Science Bulletin(Chinese Version),2012,57(20):1918贾滨,张兴磊,丁健桦,杨水平,陈焕文.科学通讯,2012,57(20):1918
17Wei Y,Chen L,Zhou W,Chingin K,Ouyang Y,Zhu T,Wen H,Ding J,Xu J,Chen H.Sci.Rep.,2015,5:10077
18Sutherland K D,Berns A.Mol.Oncol.,2010,4(5):397-403
19Ishii T,Hagiwara K,Ikeda S,Arai T,Mieno M N,Kumasaka T,Muramatsu M,Sawabe M,Gemma A,Kida K.COPD.,2012,9(4):409-416
20Sin D D,Tammemagi C M,Lam S,Barnett M J,Duan X,Tam A,Auman H,Feng Z,Goodman G E,Hanash S.J.Clin.Oncol.,2013,31(36):4536-4543
21Zwaal R F A,Comfurius P,Bevers EM.Cell Mol.Life Sci.,2005,62(9):971-988
22Aboagye E O,Bhujwalla ZM.Cancer Res.,1999,59(1):80-84
Thiswork was supported by the National Natural Science Foundation of China(No.21565004,No.21225522),Program for Changjiang Scholars and Innovation Research Team in Universities(PCSIRT)(No.IRT13054)
Direct Analysis of Phospholipids in Biological Tissues Using Internal Exlractive Electrospray Ionization Mass Spectrometry
LU Hai-Yan1,ZHANG Jian-Yong2,ZHOUWei1,WEIYi-Ping2,CHEN Huan-Wen*1
1(East China Institute of Technology,Jiangxi Key Laboratory for Mass Spectrometry and Instrumentation,Nanchang 330013,China)2(Second Affiliated Hospital of Nanchang University,Nanchang 330006,China)
Phospholipids and their metabolites play an important role in a variety of cellular processes including cell-cell adhesion,cell growth and differentiation,apoptosis,phagocytosis as well as storage of energy.In this study,the phospholipid composition of cancer tissue and adjacent normal tissue from humans and animals were analyzed by internal extractive electrospray ionization mass spectrometry(iEESI-MS).Extractive solvent at high voltage(+5.5 kV)was injected into tissue samples using a fused silica capillary at a flow rate of0.5-1μL/min,producing fine charged droplets containing analytes of tissue samples at the tip of the sample.Charged dropletswere directly sampled to the atmospheric inlet of amass spectrometer.Out of 21 different ratios of CH3OH∶H2O solventmixture,the ratio CH3OH∶H2O=30∶70(V/V)showed the optimal phospholipids extraction and visibility in MS.A large number of phospholipids from different tissue samples (such as cancer tissue and adjacent normal tissue of lung cancer,esophageal cancer tissue,pork,beef,porcine heart and porcine lung)were obtained simultaneously by iEESI-MS analysis.The experimental results demonstrated that iEESI-MSwas characterized byminimal sample pretreatment,low sample consumption,and rapid analysis(the analysis time per samplewas less than 1min),and the selectivity and sensitivity of iEESIMS could be improved by choosing proper solvent.Importantly,the experimental results provided new information for further studies of phospholipids in biological tissues.
Biological tissue;Phospholipids;Extractive solvent;Internal extractive electrospary inozation mass spectrometry
14 January 2016;accepted 20 January 2016)
10.11895/j.issn.0253-3820.160034
2016-01-14收稿;2016-01-20接受
本文系国家自然科学基金(Nos.21565004,21225522),长江学者和创新团队发展计划项目(No.IRT13054)
*E-mail:chw8868@gmail.com
