镍配合物分子印迹光电流型传感器的研究
2016-11-09魏小平梁顺超黄文刚李建平
魏小平 梁顺超 黄文刚李建平
(广西电磁功能物质重点实验室,桂林理工大学化学与生物工程学院,桂林541004)
镍配合物分子印迹光电流型传感器的研究
魏小平梁顺超黄文刚李建平*
(广西电磁功能物质重点实验室,桂林理工大学化学与生物工程学院,桂林541004)
制作了一种基于光电流检测的分子印迹传感器,并应用于Ni2+测定。此传感器以CdTe 量子点为光电材料,将量子点覆盖在导电玻璃表面,并在此层上以光聚合法制作镍-1-(2-吡啶偶氮)-2-萘酚(PAN)分子印迹膜。365 nm紫外光作为激发光源,量子点在光照下生成电子-空穴对,电子与电子受体-抗坏血酸作用形成的光电流作为检测信号,根据“门效应”进行Ni2+检测。实验中对配合物进行了红外表征,对量子点进行了紫外和荧光表征,对洗脱吸附时间和底液中抗坏血酸浓度的用量进行了优化。实验表明Ni2+浓度在5×10-11~5×10-8mol/L的范围内与光电流大小呈线性关系,检出限达8.3×10-12mol/L。此传感器具有较好的选择性,已用于水样分析。
分子印迹传感器;光电流型;镍-1-(2-吡啶偶氮)-2-萘酚;量子点;镍
1 引言
镍是工业中广泛应用的一种金属,长期与镍接触会导致皮肤疾病发生的风险加大[1],镍在体内蓄积也会威胁人的健康,例如导致癌症或基因突变[2]。国际卫生组织(WTO)和美国环保机构规定的镍在饮用水中的最高浓度分别为0.07和0.04mg/L[3]。现有的检测镍的方法有原子吸收光谱法[4,5]、电感耦合等离子体质谱法[6~8]、电化学方法[9~11]、荧光法[12]等,但这些方法存在着干扰严重、样品前处理复杂、耗时、仪器昂贵、灵敏度不高等问题[13]。随着人类生活水平的提高,人们对水质的要求也越来越高,建立一种简单快捷廉价检测镍的方法成为亟待解决的问题。
分子印迹传感器[14,15]具有良好的特异识别能力和较低的检出限,近年来在金属离子分析测定中得到了重视[16,17],目前分子印迹传感器检测金属离子的方法有溶出伏安法[18]、电位法[19]等,这些方法普遍存在灵敏度不高、检出限较高的缺点,虽然电化学发光法[16]灵敏度已经很高,但其仪器较为昂贵,检测条件较为苛刻。
光电流传感器具有灵敏度高、检出限低、背景值低等优点,已成为灵敏度最高的检测方法之一[20~22],并在金属离子检测中得到了应用[23]。但这些方法在测定金属离子时性质相近的金属离子或其它物质容易产生干扰,测定的选择性较差。分子印迹膜具有高选择性的识别能力,适合于性质相近的组分分析,分子印迹光电流型传感器测定金属离子尚未见报道。
本研究将分子印迹技术与光电流技术相结合,制备出一种高灵敏度测定Ni2+的传感器。利用光聚合方法,以镍与1-(2-吡啶偶氮)-2-萘酚(PAN)形成的二元配合物作为模板分子,在修有量子点的ITO电极上制作分子印迹膜,以365 nm紫外光作为激发光源,光照下的光电流作为检测信号,根据“门效应”进行Ni2+检测。当分子印迹膜(MIP)内的模板分子(Ni-PAN配合物)被洗脱时,印迹膜上留下大量印迹孔穴,在光照射下,量子点的价带电子跃迁至导带,形成电子-空穴对,溶液中的电子受体通过印迹孔穴到达电极表面与电子结合,产生光电流;当模板分子与MIP的印迹孔穴复合时,孔穴数减少,电子受体通过印迹孔穴的数量减少,光电流减小[24],形成所谓“门控制效应”。由于光电信号是由光激发产生,避免了电激发源的信号干扰,提高了信噪比,使得传感器检测灵敏度显著提高。
2 实验部分
2.1仪器与试剂
CHI660D电化学工作站(上海辰华仪器有限公司),采用三电极系统:修MIP的ITO电极为工作电极,铂丝为对电极,Ag/AgCl电极为参比电极;KQ3200DE型数控超声波清洗器(昆山市超声仪器有限公司);DF-101S集热式恒温磁力搅拌器(郑州长城科工贸有限公司);AL204电子天平(梅特勒-托利多公司)。
安息香二甲醚(阿拉丁公司);1-(2-吡啶偶氮)-2-萘酚(上海试剂厂);NiSO4(广东试剂厂);N,N-亚甲基双丙烯酰胺、丙烯酰胺、Na2SO4(西陇化工公司);丙烯酸(天津市致远试剂有限公司),试剂均为分析纯,实验用水均为超纯水。
2.2实验过程
2.2.1量子点的合成参照文献[25]合成量子点:250 mL 0.0025 mol/L CdCl2溶液除氧15 min,加入100μL巯基乙酸,用2 mol/L NaOH调节pH≈10,在强磁力搅拌下继续通氮气除氧15 min,用橡胶塞封口。在三口烧瓶中加入2.5 mL超纯水,通氮除氧,称取0.144 g Te粉和0.36 g NaBH4置于三口烧瓶中,混合均匀,在65℃水浴和磁力搅拌下反应20 min,直至黑色Te粉完全消失,得到紫色透明的NaHTe溶液。将此溶液倒入上述溶液中,继续在95℃下搅拌回流2 h,即得酒红色透明的CdTe水溶性量子点。
2.2.2Ni-PAN的合成参照文献[26~28]合成配合物:称取1.0 g PAN溶解在50 mL乙醇中,称取0.52 g NiSO4·6H2O溶解在10 mL水中,将两种溶液混合在100 mL三口烧瓶中,强力磁力搅拌器搅拌,调节至pH 7.0,搅拌15min,加入大量超纯水,过滤,用乙醇和超纯水洗涤,干燥即可制得Ni-PAN配合物。
2.2.3传感器的制备将ITO电极切割成5 mm×10 mm的小块用于制作工作电极,ITO电极在0.5 mol/L NaOH溶液中浸泡活化20min后,在乙醇、超纯水中超声处理,晾干,在0.5%氨丙基三乙氧基硅烷(APTES)乙醇溶液中浸泡处理24 h表面修一层NH2,置于加入了偶联剂N-羟基琥珀酰亚胺(NHS)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)的量子点溶液中浸泡4 h,修一层量子点。
MIP电极制备:称取Ni-PAN配合物0.028 g,丙烯酸0.009 g,丙烯酰胺0.009 g,N,N-亚甲基双丙烯酰胺0.192 g,安息香二甲醚0.003 g,溶解于50mL丙酮溶液中,配制光聚合液。在上述处理好的ITO电极上滴加20μL光聚合液,置于紫外灯下照射至溶剂挥发完毕,取出,重复上述操作三次后,在甲醇-乙酸(5∶1,V/V)溶液中搅拌洗脱5 min,得到MIP电极。
非分子印迹膜(NIP)电极制备:称取丙烯酸0.009 g,丙烯酰胺0.009 g,N,N-亚甲基双丙烯酰胺0.192 g,安息香二甲醚0.003 g,不加Ni-PAN,其余按MIP制备过程制备NIP电极。
2.3实验方法
将MIP修ITO电极作为工作电极,置于含0.1mol/LNa2SO4和0.1mol/L抗坏血酸溶液的石英杯中,电极表面正对光源。用时间-电流法进行测试,外加电位0 V,在溶液低速搅拌下记录I-t曲线,测量紫外灯照射(或关闭)时的光电流I(或I0),除特殊情况外,每个数据为3次测量的平均值。
3 结果与讨论
3.1配合物的表征
由图1可见,PAN与镍结合形成配合物后,在3448.4 cm-1处的CO伸缩振动发生移动,移动至3442.8 cm-1,因为氧原子参与配位导致红外吸收移动,3000.9 cm-1处的OH伸缩振动消失,H解离,O与Ni2+发生配位,1620.72 cm-1处的CN 的伸缩振动移动至1610.2 cm-1,N与Ni2+发生配位,使得CN的伸缩振动发生移动,说明配合物已经合成。
3.2合成量子点的表征及激发波长选择
CdTe量子点由于其禁带宽度较小[29],较长波长幅照即可产生光电流,量子点直径一般在2~20 nm之间,根据紫外吸收光谱图(图 2a)产生的紫外可见吸收光谱波长计算量子点的直径[30]D=(9.8127×10-7)λ3-(1.7147×10-3)λ2+(1.0064)λ-194.84,可以得出直径约为4 nm。为使量子点的光电效率达到最高的水平,根据文献[31,32],选取365 nm这个较短波长的紫外光作为激发光。在此波长照射下,量子点的荧光强度仅为25(图2b),量子点的空穴-电子复合几率较小,光电效应比较强[33]。
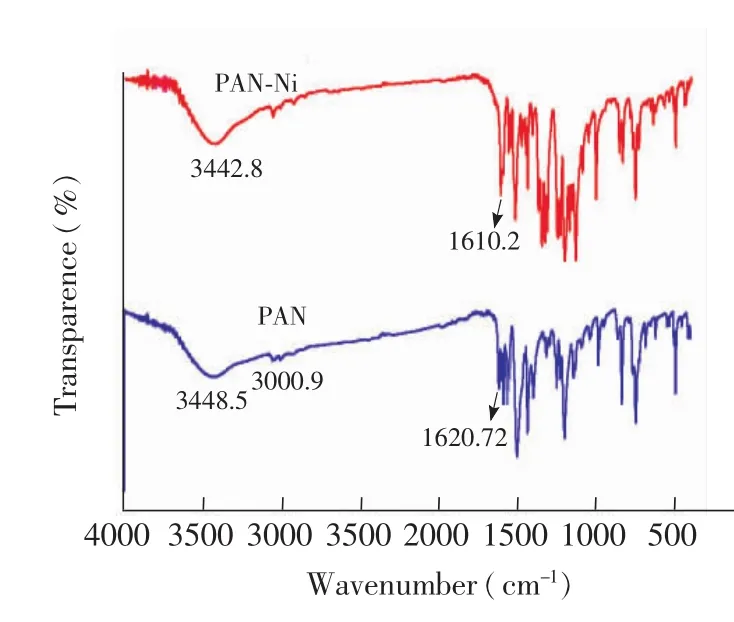
图1 PAN与Ni-PAN的红外光谱图Fig.1 Fourier transform infrared(FTIR)spectroscopy of 1-(2-pyridylazo)-z-naphthol(PAN)and Ni-PAN
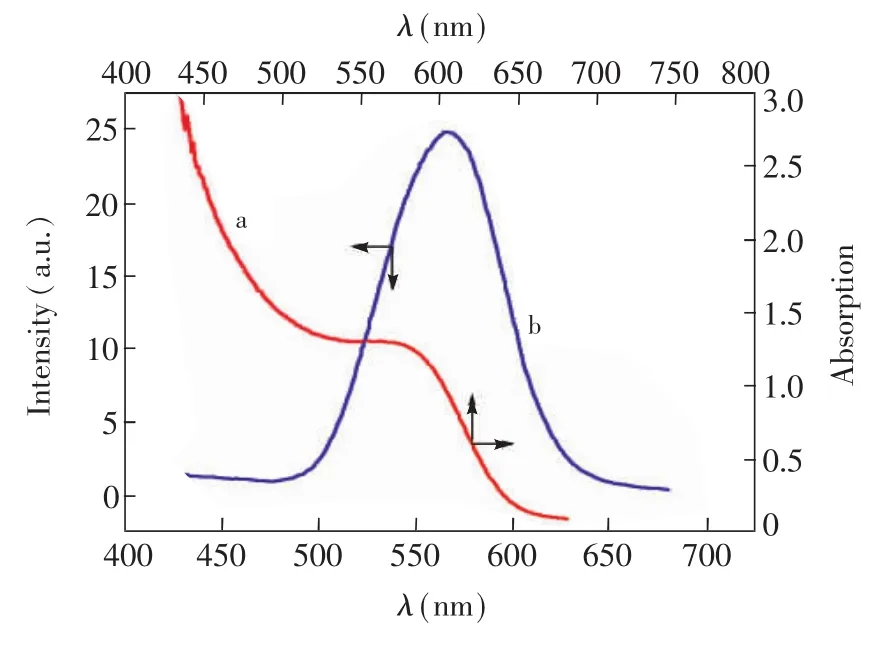
图2 CdTe量子点的紫外可见吸收(a)和荧光(b)图谱Fig.2 Ultraviolet-visible absorption spectrum(a)and fluorescence emission spectrum(b)of CdTe QDs
3.3MIP与非分子印迹膜(NIP)对比
将制作好的MIP与NIP进行洗脱和重吸附对比实验,MIP在洗脱前的光电流仅为0.15μA (图3A-a),洗脱模版分子后为1.8μA(图3A-b),表明形成了可供供电子体通过的通道[24]。吸附5 nmol/L Ni-PAN后,光电流减小至0.75μA(图3A-c),说明印迹孔穴又被配合物分子堵塞。NIP膜聚合后光电流为0.125μA(图3B-a'),大小与MIP的近似。洗脱后以及再吸附5 nmol/L Ni-PAN后电流分别为0.20μA(图3A-b')和0.16μA(图3A-c'),远小于MIP的对应的电流值,推测可能是少量的配合物在NIP膜产生物理吸附的变化引起。因此,制作的光电流分子印迹传感器对Ni-PAN具有识别吸附作用。
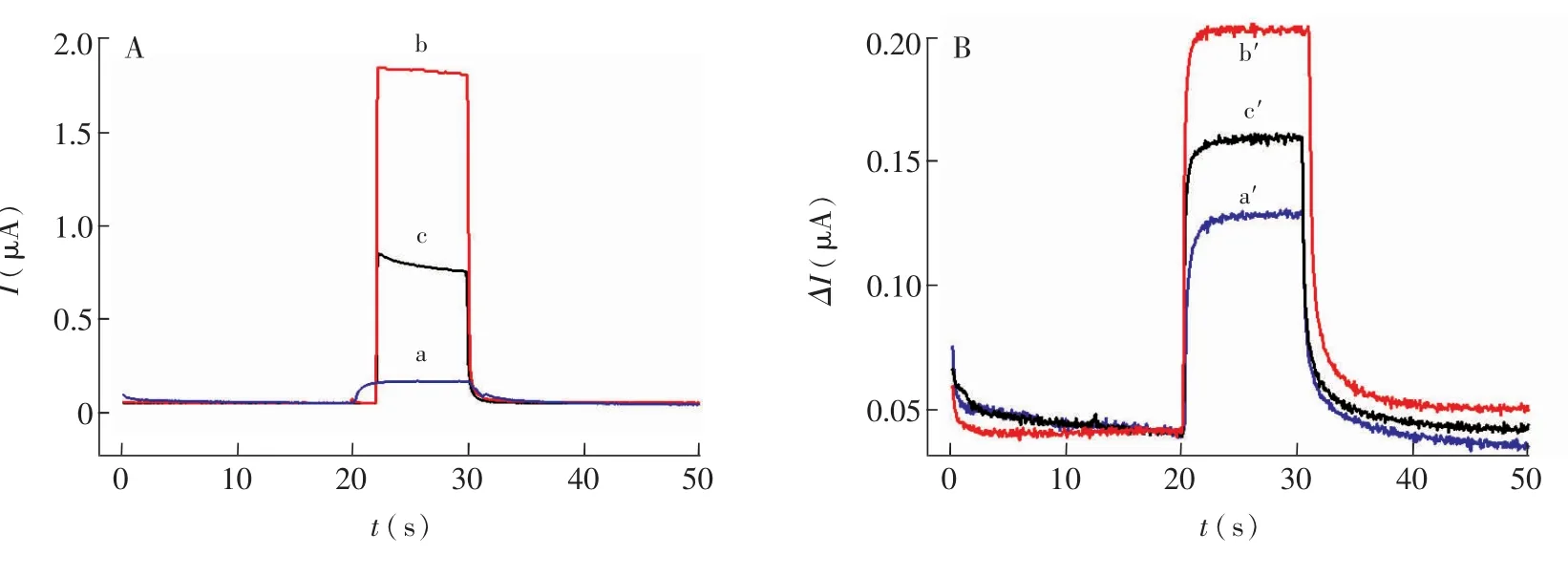
图3 分子印迹膜(MIP)(A)和非分子印迹膜(NIP)(B)电极的光电流对比Fig.3 Comparison of photocurrent response of molecularly imprinted polymer membranes(MIP)(A)and nonemolecularly imprinted polymermembranes(NIP)(B)modified electrode A:a.聚膜后MIP;b.洗脱后的MIP;c.MIP吸附5 nmol/LNi-PAN;B:a'.聚膜后NIP;b'.洗脱后的NIP;c'.NIP重吸附5 nmol/L Ni-PAN。施加电位:0 V。A:a.Polymerized MIP before elution;b.MIP removed with the template;c.MIP rebinded in 5 nmol/L Ni-PAN; B:a'.Polymerized NIP before elution;b'.NIP removed with the template;c'.NIP rebinded in 5 nmol/LNi-PAN.The applied potential is 0 V.
3.4膜厚度的优化
将配置好的聚膜液分多次滴加到ITO电极上进行聚合,每次滴加20μL,对其进行紫外光照聚合,然后测定其光电流的值。结果表明,滴加3次后,光电流几乎不再变化,洗脱后光电流值增加,说明膜层达到最佳的厚度。
3.5洗脱吸附优化
将聚合好的电极置于甲醇-乙酸(5∶1,V/V)洗脱液中,恒速搅拌下进行洗脱并测定光电流值。由图4a可见,随着洗脱时间延长,光电流值逐渐增大,这是因为洗脱液将模板分子从膜中移除,电子受体进出膜的阻力变小;洗脱5 min后,光电流几乎不变,表明MIP上的模板分子已经被全部洗脱,光电流达到最大值,故洗脱时间选择5 min。吸附1.0×10′8mol/L Ni-PAN溶液,随着时间延长,光电流减小,这是由于吸附Ni-PAN溶液后,配合物与膜重新结合阻止电子受体进出电极表面。由图4b可见,吸附5 min后,光电流几乎不变,表明传感器对Ni-PAN吸附达到平衡,因此选择吸附时间为5 min。
3.6抗坏血酸浓度影响
选取不同浓度的电子受体抗坏血酸进行实验,由图5可见,抗坏血酸浓度在0~0.1 mol/L范围内,光电流随其浓度增加而增大;抗坏血酸浓度大于0.1 mol/L时,光电流随其浓度的增加而逐渐减小,可能是高浓度抗坏血酸对光电流有淬灭作用,这与文献[24]一致。因此,抗坏血酸浓度选用0.1 mol/L。

图4 MIP的洗脱(a)与吸附(b)时间优化曲线Fig.4 Optimal curves of elution time(a)and rebind time(b)formolecularly imprinted film
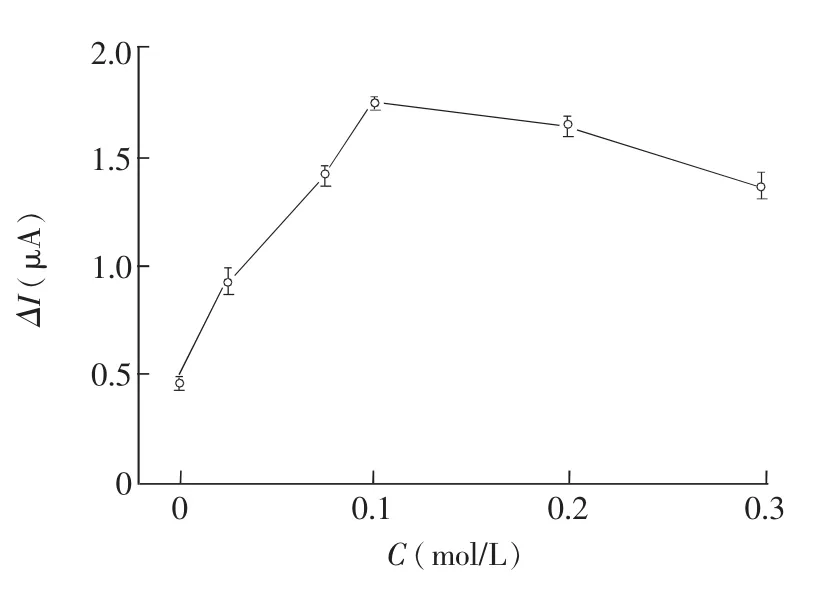
图5 抗坏血酸浓度变化的影响Fig.5 Effects of ascorbic acid concentration on photocurrent intensity
3.7工作曲线
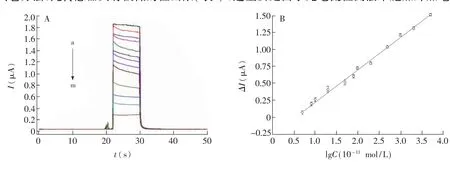
图6 工作曲线(A)和校正曲线(B)Fig.6 Working curves(A)and calibration curves(B) a→m:CNi2+(10′11mol/L)were 0,5,8,10,20,50,80,100,200,500,1000,2000,5000,respectively.
制作好的MIP修ITO电极在含不同浓度Ni2+的Ni-PAN溶液中吸附5 min,可以观察到随Ni2+浓度的增大,光电流减小,由图6可见,Ni2+浓度在5×10′11~5×10′8mol/L范围内,其对数值与光电流变化值ΔI(即与空白溶液光电流值之差)呈线性关系,线性方程为ΔI(μA)=0.4764lg c(10′11mol/L)-0.2497(r=0.997),说明传感器对Ni-PAN具有很好的响应,利用检出限LOD=3σ/S计算得到LOD为对比其它方法,此传感器具有极低的检出限(表1),这主要是由于光电流检测法未施加外加电压,因而8.3×10-12mol/L。背景值低。因此产生的电信号完全是由光激发产生,信噪比高。
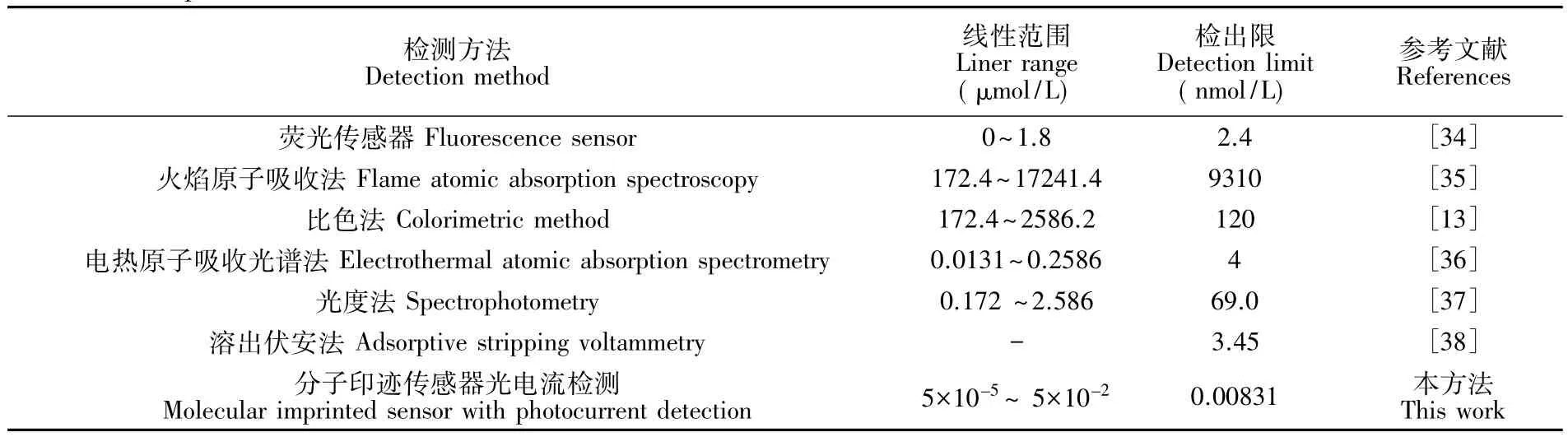
表1 测定Ni2+不同方法对比Table 1 Comparison of detection methods of Ni2+
3.8传感器选择性
在1.0×10-8mol/L Ni2+溶液中加入干扰离子,再加入3×10-5mol/L PAN混合均匀,使Ni2+形成配合物。放置5 min后,用制作好的传感器吸附溶液,并进行测定,比较传感器的响应电流。结果表明,最大干扰倍数分别为1000倍的500倍的Mg2+,Cr3+;300倍的Fe3+,Fe2+;200倍的Cu2+;100倍的Co2+,Pb2+,Zn2+。由图7可见,此传感器对Ni2+测定具有非常好的选择性。究其原因,形成配合物时配体对金属离子进行的第一次识别,以及分子印迹孔穴对具有特异结构的配合物进行的第二次识别,两次识别过程使得传感器的选择性极大提高[39]。另一方面,由于PAN是大大过量的,PAN可与Cu2+等部分金属离子形成稳定配合物,避免了通常情况下可以猝灭光电流的金属离子的干扰,传感器的选择性进一步提升。
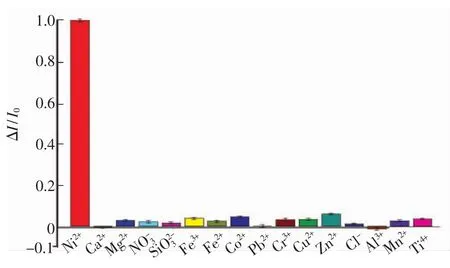
图7 干扰存在下的信号响应图Fig.7 Response signals of the sensor with interferences
3.9传感器的稳定性和重现性
同一批次制作5支电极,对同一浓度Ni2+配制的配合物溶液进行重吸附测定,发现其相对偏差不超过5%,将电极保存在4℃环境中存放一周后进行重吸附测定,其信号值为原来的97.2%,说明传感器有良好的重现性和稳定性。
3.10样品测定
对水样进行简单过滤处理后,在烧杯中静置,取上层清液 5 mL置于烧杯中,加入1×10-5mol/L PAN摇匀后静置反应5 min,将制作好的传感器置于其中进行吸附,按照实验方法测定光电流响应值,计算样品中Ni2+的含量。同时加入适量的标准溶液进行加标回收实验(表2),回收率为98.9%~106.2%,说明传感器对实际样品的检测具有良好的效果。
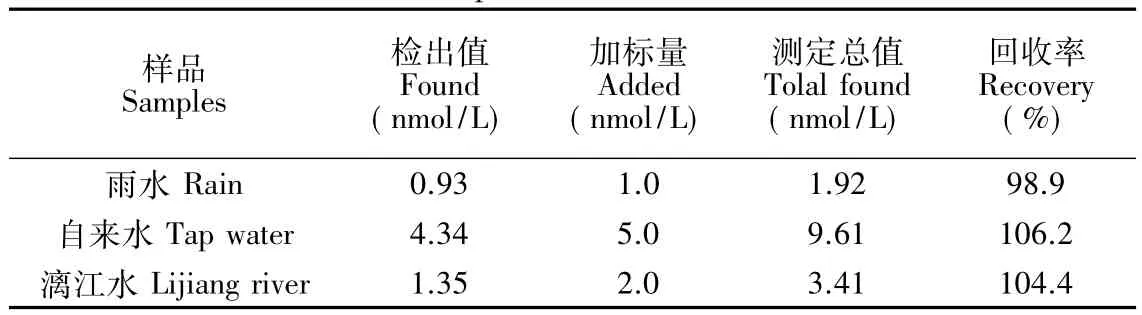
表2 实际样品的测定Table 2 Detection of real sample
4 结论
制作了一种分子印迹光电流型传感器,以光电流作为检测信号,显著地提高了传感器的灵敏度。同时将配合物作为模版分子,分子印迹传感器的选择性明显改善。此传感器制作简单,响应时间短,且具有良好的稳定性和重现性,适用于超痕量金属离子的测定。
References
1Aksuner N,Henden E,Yilmaz I,Cukurovalic A.Sens.Actuators,B:Chem.,2012,166:269-274
2DrewsW,Weber G,Tlg G.Anal.Chim.Acta,1990,231:265-271
3Aragay G,Pons J,Merkoi A.Chem Rev.,2011,111(5):3433-3458
4Bahadir Z,Ozdes D,Bulut V N,Duran C,Elvan H,Bektes H,Soylak M.Toxicol.Environ.Chem.,2013,95(5): 737-746
5Scaccia S.Talanta,1999,49(2):467-472
6Batista B L,Rodrigues JL,Nunes JA,Tormen L,Cürtius A J,Jr F B.Talanta,2008,76(3):575-579
7Sahan Y,Basoglu F,Gücer S.Food Chem.,2007,105(1):395-399
8Rahmi D,Takasaki Y,Zhu Y,Kobayashi H,Konagaya S,Haraguchi H,Umemura T.Talanta,2010,81(4): 1438-1445
9Neodo S,Nie M,Wharton JA,Stokesa K R.Electrochim.Acta,2013,88:718-724
10Leesutthiphonchai W,Dungchai W,Siangproh W,Ngamrojnavanichd N,Chailapakuld O.Talanta,2011,85(2): 870-876
11Segura R,Pradena M,Pinto D,Godoya F,Naglesb E,Arancibia V.Talanta,2011,85(5):2316-2319
12BO Hong-Yan,ZENGWen-Jing,ZHANGMi,DU Qing-Lan,GUO Qing-Yu,GAO Qiang.Chinese J.Anal.Chem.,2011,39(12):1893-1897薄红艳,黄绍峰,曾文静,张宓,杜青兰,郭庆羽,高强.分析化学,2011,39(12):1893-1897
13Kiatkum jorn T,Rattanarata P,Siangprohb W,Chailapakula O,Praphairaksita N.Talanta,2014,128:215-220
14Li X,Li JP,Yin W L,Zhang LM.J.Solid State Electrochem.,2014,18(7):1815-1822
15Li JP,Jiang F Y,Wei X P.Anal.Chem.,2010,82(14):6074-6078
16Li JP,Ma F,Wei X P,Fu C,Pan H C.Anal.Chim.Acta,2015,871:51-56
17Luo X B,Liu L L,Deng F,Luo S L.J.Mater.Chem.A,2013,1:8280-8286
18Shirzadmehr A,Afkhami A,Madrakian T.J.Mol.Liq.,2015,204:227-235
19Bahrami A,Besharati-Seidani A,Abbaspour A,Shamsipur M.Mater.Sci.Eng.,C,2015,48:205-212
20Wang G L,Xu J J,Chen H Y.Sci.China.Ser.B:Chem.,2009,52(11):1789-1800
21Zhang X R,Guo Y S,Liu M S,Zhang SS.RSC Adv.,2013,3(9):2846-2857
22Kang Q,Chen Y F,Li C C,CaiQ Y,Yao SZ,Grimes C A.Chem.Commun.,2011,47(46):12509-12511
23Wang P,Ma X Y,Su M Q,Hao Q,Lei JP,Ju H X.Chem.Commun.,2012,48(82):10216-10218
24Wang Y H,Zang D J,Ge SG,Ge L,Yu JH,Yan M.Electrochim.Acta,2013,107:147-154
25Han H Y,Sheng Z H,Liang JG.Anal.Chim.Acta,2007,596(1):73-78
26Li R,Jiang Z T,Mao L Y,Shen H X.Anal.Chim.Acta,1998,363(2):295-299
27Ferreira S L C,de Brito C F,Dantas A F,Araújo N M L,Costa A C S.Talanta,1999,48(5):1173-1177
28Betteridge D,Fernando Q,Freiser H.Anal.Chem.,1963,35(3):294-298
29LiW L,Sheng P T,Cai J,Feng H Y,Cai Q Y.Biosens.Bioelectron.,2014,61:209-214
30Yu W W,Qu L H,GuoW Z,Peng X G.Chem.Mater.,2003,15(14):2854-2860
31Wang W J,Hao Q,WangW,Lei B,Lei JP,Wang Q B,Ju H X.Nanoscale,2014,6(5):2710-2717
32Yan T,Liu H Y,Gao P C,Sun M,Wei Q,Xu W G,Wang X D,Du B.New J.Chem.,2015,39(5):3964-3972
33Pang X H,Pan JH,Gao P C,Wang Y Y,Wang LG,Du B,Wei Q.Biosens.Bioelectron.,2015,74:49-58
34Lei Y X,Li H,GaoW X,Liu M C,Chen JX,Ding JC,Huang X B,Wu H Y.J.Mater.Chem.C,2014,2(35):7402-7410
35Chandio ZA,Talpur FN,AfridiH I,Khan H,KhaskheliGQ,KhaskheliM I.Anal.Methods,2013,5(17):4425-4429
36Danuta D A,Teresa L,PaweK.J.Anal.Toxicol.,2015,39(8):1-5
37Bahram M,Khezri S,Khezri S.Curr.Chem.Lett.,2013,2(1):49-56
38Hurtadoa J,Naglesa E,ArancibiaaV,Rojasa R,Valderramaa M,Frhlichb R.J.Coord.Chem.,2013,66(4):592-601
39Li JP,Zhang LM,WeiG,Zhang Y,Zeng Y.Biosens.Bioelectron.,2015,69:316-320
This work was supported by the National Natural Science Foundation of China(No.21375031)and the Natural Science Foundation ofGuangxi Province,China(Nos.2015GXNSFFA139005,2015GXNSFAA139029)
2016全国生命分析化学学术大会通知(第一轮)
为进一步促进我国生命分析化学研究的发展,加深学者之间的交流,强化学科交叉,由国家自然科学基金委员会化学科学部主办,南京大学、北京大学、清华大学和中国科学院化学研究所共同承办的“2016全国生命分析化学学术大会”将于2016年12月23-26日在南京召开。与前三届会议的宗旨一致,本次会议仍然以形成自由研讨的氛围,让思想撞击出火花,使创造力突涌为目的,集小智为大智,化零散为整体,逐渐形成我国生命分析化学研究的独特战略思路,壮大具有特殊战斗力的我国生命分析化学研究队伍,开创生动活泼的生命分析化学研究新局面。
本次会议除有关学术报告外,还将设立5-8个生命分析化学重大学术问题主题讨论会,和青年科学家专场报告。欢迎代表们提出您认为有价值的讨论主题或建议。
拟讨论的主题:(1)生命分析样品处理方法,(2)生物及环境复杂样品分析,(3)组学分析方法,(4)单细胞、单分子及活体分析,(5)临床、医药与法庭分析,(6)化学生物学分析方法,(7)生物成像分析,(8)新仪器与新技术,(9)食品、药品安全及突发公共事件应对。有意参加研讨会的各方代表请尽快报名并将回执和论文摘要通过会议网站或者通过E-mail邮件方式直接发送给会议联系人。
论文摘要提交截止日期:2016年10月30日。
报到日期:2016年12月23日全天,地点:南京金陵会议中心
会议时间:2016年12月24-26日,26日下午2:00后可以离会。
会议地点:南京金陵会议中心(南京江东中路300号)
稿件联系人:鞠熀先教授,南京大学生命分析化学国家重点实验室,hxju@nju.edu.cn。
会务联系人:徐静娟教授,南京大学生命分析化学国家重点实验室,xujj@nju.edu.cn。
Study on Molecularly Im printed Sensor Based on Photocurrent Response for Ni-com plex
WEIXiao-Ping,LIANG Shun-Chao,HUANGWen-Gang,LI Jian-Ping*
(Electromagnetic Functional Material Key Laboratory in Guangxi,Guilin University of Technology,College of Chemistry and Bioengineering,Guilin 541004,China)
A novel molecularly imprinted sensor for Ni2+detection was fabricated based on photocurrent method.CdTe quantum dot(QDs)was selected as photoelectricmaterial and modified in ITO electrode,then the nickel-1-(2-pyridylazo)-2-naphthol molecularly imprinted filmwas formed on the QDs layer by photopolymerization.By using 365 nm ultraviolet light as excitation light,the QDs generated electron-hole,and the electron donor-ascorbic acid combined with electron to form the photocurrent signals.Based on this evidence,Ni2+was detected according to“gate-effect”.The complex was characterized by Fourier transform infrared spectrum and the CdTe QDs was characterized by ultraviolet absorption spectrum and fluorescence emission spectrum,the time for elution and rebinding and the concentration of ascorbic acid in base solution were optimized.The experiment showed that there was a liner relationship between the photocurrent and the concentration of Ni2+at 5×10-11-5×10-8mol/L,with the detection limit of 8.3×10-12mol/L.The sensor also had good selectivity,and itwas applied in real water samples analysis.
Molecularly imprinted sensor;Photocurrent;Nickel-1-(2-pyridylazo)-2-naphthol;Quantum dot; Nickel ion
16 October 2015;accepted 24 November 2015)
10.11895/j.issn.0253-3820.150918
2015-10-16收稿;2015-11-24接受
本文系国家自然科学基金(No.21375031)和广西自然科学基金(Nos.2015GXNSFFA139005,2015GXNSFAA139029)项目资助
*E-mail:likianping@263.net
