“物质结构”和“元素周期律”典例导学
2016-11-09安徽省界首一中张登
安徽省界首一中 张登
“物质结构”和“元素周期律”典例导学
安徽省界首一中 张登
物质结构和元素周期律是化学中的重要理论知识,也是中学化学学习的重要内容。原子结构理论能帮助我们进一步认识元素与物质的关系;元素周期律和元素周期表的知识有助于我们整合元素化合物知识;化学键概念的建立,能使我们了解化学反应中物质变化和能量变化的实质。因此,这部分内容在必修模块学习中起到承上启下的作用。
一、学习目标
(1)了解元素、核素和同位素的含义。
(2)了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数及其相互关系。
(3)了解原子核外电子排布。
(4)掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。
(5)以第3周期为例,掌握同一周期元素性质的递变规律与原子结构的关系。
(6)以ⅠA族和ⅦA族为例,掌握同一主族元素性质的递变规律与原子结构的关系。
(7)了解金属、非金属元素在元素周期表中的位置及其性质的递变规律。
(8)了解化学键的定义。了解离子键、共价键的形成。
二、典例导学
掌握元素周期律知识有利于指导我们学习元素化合物知识,而化学键知识又是学习电解质以及化学反应中的能量变化的基础。在学习元素周期律、元素周期表内容时,我们应注意掌握元素的变化规律及其实质,在学习化学键时,注意概念间的对比。笔者参照全国高考新课标Ⅰ卷考试大纲和近年高考试题,归纳出相关的主要考点。
类型一:元素、核素、同位素、同素异形体之间的区别与联系
例1下列关于20728Pt的说法正确的是()。
解析根据同位素定义中的两个限制条件进行分析判断。
答案A
类型二:有关原子结构的考查
例2已知R2+核内共有N个中子,R的质量数为A,m g R2+中含有电子的物质的量为()mol。

答案D
总结升华解答上述两道典型例题,一要弄清微粒结构的特点,二要明确阴、阳离子中核电荷数(质子数)、电子数、离子所带电荷数之间的关系。
知识链接1原子的基本构成微粒及其相互关系
(1)基本构成微粒
质子、中子、电子。质子数决定元素的种类;中子数决定一种元素的核素的种数;质子数和中子数共同决定核素的种类;互为同位素的原子的质子数和电子数都分别相等,其化学性质几乎完全相同。
质量关系:质量数(A)=质子数(Z)+中子数(N)
电性关系:a.对于中性原子,核电荷数=质子数=核外电子数
b.对于阳离子,质子数>核外电子数,质子数=核外电子数+所带电荷数
c.对于阴离子,质子数<核外电子数,质子数=核外电子数-所带电荷数(3)核素、同位素
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:同一元素的不同核素之间的关系互称。
区别与联系:同位素必是不同的核素,但不同的核素未必是同位素。
类型三:核外电子排布规律
例3在第n层电子层中,当它作为原子的最外层时,其最多容纳的电子数与第(n-1)层相同,当它作为原子的次外层时,其最多容纳的电子数比第(n-1)层多10个。则此电子层是()。
A.K层B.L层C.M层D.可为任意层
解析根据核外电子排布规律,当第n层为最外层时,最多可容纳8个电子,而第(n-1)层也可容纳8个电子,则第(n-1)层为次外层,故第n层应为M层;当第n层为次外层时,其最多容纳的电子数比第(n-1)层多10个,则第n层最多可容纳18个电子,即也为M层。
答案C
总结升华核外电子排布规律常常作为原子结构推断题的突破口,我们在应用时应注意区分几个概念:最外层电子数、最内层电子数、内层电子数、次外层电子数、电子层数、电荷数等。
类型四:元素周期律及其实质
例4下列关于元素周期律的叙述正确的是()。
A.随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现
B.元素的性质随着原子序数的递增而呈周期性变化
C.随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现
D.元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果
解析掌握元素周期律及其实质。
答案BD
总结升华元素周期律概括了元素性质的变化规律及其原子结构的关系,是学习、研究物质结构和元素化合物知识的主要理论依据。
知识链接2元素周期律及其实质
(1)电子层数相同(同周期)的元素,随着原子序数的递增,下列性质呈现周期性变化
①最外层电子数从1个递增至8个(K层为最外层时,从1个增至2个);
②元素原子半径从大至小(稀有气体元素除外);
③元素的最高正价从+1至+7价(O、F除外),最低负价从-4至-1价再至0价。
(2)元素周期律的实质
元素性质随着原子序数递增呈现的周期性变化,是元素的原子核外电子排布周期性变化的必然结果。即原子结构的周期性变化是元素性质周期性变化的实质,这充分体现了“结构决定性质”的规律,结构变化是因,性质变化是果。
知识链接3元素化合价与结构和位置的关系
(1)在原子结构中,与化合价有关的电子叫价电子。主族元素的最外层电子即为价电子,但过渡金属元素的价电子还与其原子的次外层或倒数第三层的部分电子有关。对于一般非金属元素,最高正价+最低负价的绝对值=8(H、O、F例外),最高正价=价电子数=主族族序数。
(2)化合价与原子序数、原子的最外层电子数以及族序数的奇偶关系
价(主要化合价)奇序(原子序数)奇、价偶序偶(谐音“嫁鸡随鸡,嫁狗随狗”)
原子序数为奇数的元素,原子的最外层电子数为奇数,族序数为奇数,其主要化合价也多为奇数,如氯元素。原子序数为偶数的元素,原子的最外层电子数为偶数,族序数为偶数,其主要化合价也常为偶数,如硫元素。
知识链接4单核微粒半径大小比较规律
(1)同一周期元素从左至右(稀有气体元素除外),原子半径渐小。
(2)同一主族元素自上而下,电子层数增多,原子半径渐大。
(3)电子层结构相同的粒子,核电荷数越大,半径越小。
(4)同种元素的阴离子半径大于其原子半径、阳离子半径小于其原子半径。
类型五:元素周期表的结构
例5若把长式元素周期表原先的主、副族及族号取消,由左至右改为18列,ⅠA族为第1列,0族为第18列。按此规定,下列说法错误的是()。
A.第9列元素中没有非金属元素B.只有第2列元素原子最外层有2个电子
C.第1列元素均为金属元素D.在整个18列元素中,第3列的元素种类最多
解析尽管主、副族及族号取消,但每种元素在周期表中的位置不变,答题时应克服思维定式,根据题目中给出的信息和元素周期表的结构进行解答。
答案BC
总结升华解决此类问题,关键是了解元素周期表的结构,明确族序数与原子序数的关系。

?
知识链接5推断原子序数的方法
(1)同周期时,要特别注意ⅡA族和ⅢA族元素原子
(2)A、B为同主族元素,A所在周期有m种元素,B所在周期有n种元素,A在B的上一周期,设A的原子序数为a
a.若A、B在ⅠA族、ⅡA族(过渡元素左边),则B的原子序数为(a+m);
b.若A、B在ⅢA~ⅦA族(过渡元素右边),则B的原子序数为(a+n)。
类型六:同周期、同主族元素性质的递变规律
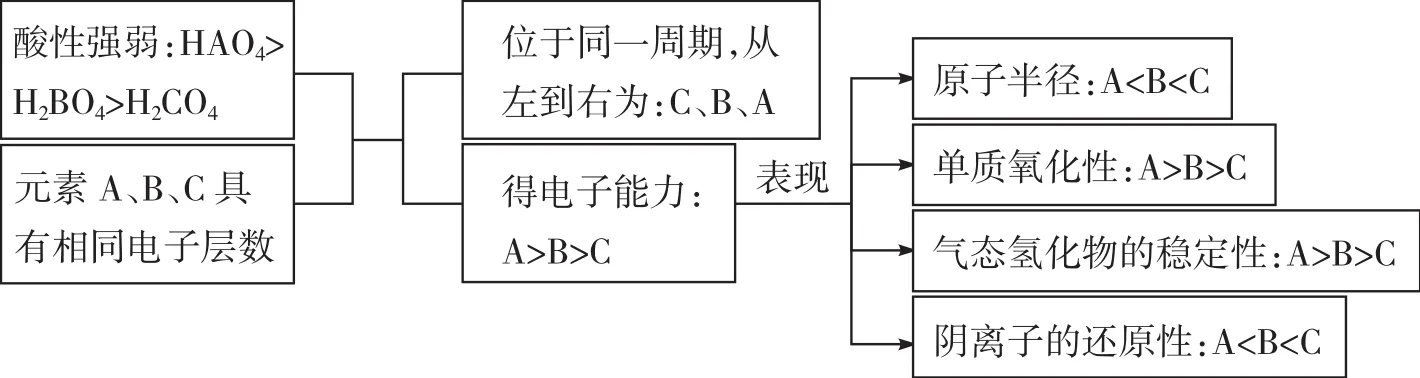
例6具有相同电子层数的A、B、C三种元素,已知它们最高价氧化物对应水化物的酸性强弱的顺序是HAO4>H2BO4>H3CO4,则下列判断正确的是()。
A.原子半径:A>B>CB.单质的氧化性:A>B>C
C.气态氢化物的稳定性:A 解析 答案BD 总结升华解答此类题目,一般先要根据性质判断元素在元素周期表中的位置,进而根据元素性质、位置与结构的关系进行解答。 知识链接6元素性质、位置与结构的关系 (1)同一周期元素从左至右(位置),随着核电荷数增多(结构),原子半径减小,失电子能力减弱,得电子能力增强;金属性减弱、非金属性增强(性质)。 (2)同一主族元素从上往下(位置),随着核电荷数增多,电子层数增多(结构),原子半径增大,失电子能力增强,得电子能力减弱;金属性增强、非金属性减弱(性质)。 知识链接7元素原子得失电子能力(金属性、非金属性)强弱的判断方法 (1)元素原子失电子能力(元素金属性)强弱的判断方法 ①根据物质的性质 a.比较其单质与水(或酸)反应置换出氢的难易程度(如剧烈程度等):置换反应越容易进行,元素原子的失电子能力越强; b.比较其最高价氧化物对应的水化物的碱性强弱:一般情况下,碱性越强,其原子失电子的能力越强; c.单质间的置换反应:一般失电子能力强的元素能把失电子能力弱的元素从其盐溶液中置换出来。 ②根据元素在元素周期表中的位置,利用元素周期律 同一周期从左到右,元素原子失电子能力逐渐减弱;同一主族从上到下,元素原子失电子能力逐渐增强。 (2)元素原子得电子能力(元素非金属性)强弱的判断方法 ①根据物质的性质 a.比较其单质与氢气化合的难易程度(如反应的剧烈程度或对反应条件的要求)以及气态氢化物的稳定性。一般情况下,反应越容易进行,生成的气态氢化物越稳定,元素原子得电子的能力越强; b.比较其最高价氧化物对应的水化物(最高价含氧酸)的酸性强弱:一般情况下,酸性越强,元素原子得电子的能力越强; c.利用单质间的置换反应:得电子能力强的元素能把得电子能力弱的元素从其盐溶液中置换出来; d.利用其简单阴离子还原性的强弱:简单阴离子还原性越强,其原子得电子能力就越弱; e.利用不同非金属单质与同一金属单质反应的剧烈程度或产物中金属化合价的高低:一般情况下,反应越剧烈或生成物中金属化合价越高,则其原子得电子能力越强。 ②根据元素在元素周期表中的位置,利用元素周期律 同一周期从左到右,元素原子得电子能力逐渐增强;同一主族从上到下,元素原子得电子能力逐渐减弱。 类型七:化学键 例7已知元素X、Y和Z可结合形成化合物XYZ3,X、Y和Z的原子序数之和为26,Y和Z在同一周期。下列有关推测正确的是()。 A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3 解析首先根据题干中的限制条件及物质XYZ3的类别,推测XYZ3中可能存在的元素,然后分析X、Y、Z形成化合物的类别。 答案B 总结升华解答此类题目,首先判断X、Y和Z所代表的具体元素,再根据化学键、离子化合物、共价化合物的概念,对A、B、C、D逐一进行分析即可。 原子结构理论是学习元素周期律、认识元素周期表的结构、建立化学键概念的理论基础;元素周期律和元素周期表的学习能进一步发展我们对元素化合物性质的认识;化学键概念的建立,也为我们今后学习有机化学知识打下基础。