荧光定量PCR及酶联免疫吸附试验检测HBV方法比较
2016-11-09林牧龚亚东高绍莹丁政马庆庆
林牧,龚亚东,高绍莹,丁政,马庆庆
(贵州航天医院中心实验室,贵州遵义563000)
·综述·
荧光定量PCR及酶联免疫吸附试验检测HBV方法比较
林牧,龚亚东,高绍莹,丁政,马庆庆△
(贵州航天医院中心实验室,贵州遵义563000)
目的探讨荧光定量PCR(FQ-PCR)与酶联免疫吸附试验(ELISA)检测乙型肝炎病毒(HBV)的区别,并分析其临床应用价值。方法选取2015年8~12月在该院就诊的221例疑似乙型肝炎患者的血清标本,分别使用FQ-PCR及ELISA法对HBV进行检测,探讨FQ-PCR的检测方法、阳性率及临床意义。结果FQ-PCR检测共检出134例阳性标本,阳性率为60.63%;ELLSA检测乙型肝炎表面抗原、乙型肝炎e抗原、乙型肝炎核心抗体、乙型肝炎e抗体和乙型肝炎表面抗体阳性率(36.20%、6.33%、33.48%、15.32%、43.90%)均低于FQ-PCR对HBV-DNA检出的阳性率(60.63%),且分别与大三阳组和小三阳组比较,差异均有统计学意义(P<0.01)。结论FQ-PCR能够直观地反映HBV在肝细胞内的复制情况,适合早期诊断并指导临床用药,其诊断和指导意义高于ELISA法,且操作快速简便,值得临床推广。
聚合酶链反应;酶联免疫吸附测定;肝炎病毒,乙型;DNA,病毒;荧光定量PCR
乙型肝炎病毒(hepatitis B virus,HBV)是一种嗜肝DNA病毒,可引发肝脏炎性损伤,且传播途径复杂、流行面广、感染率高[1]。疾病早期症状不明显,发病缓慢、易被忽视,常使患者终身携带病毒,引发肝细胞坏死、纤维化,是导致肝硬化和肝癌的重要原因[2,3]。我国是HBV感染的高发区,乙型病毒性肝炎的发病率和患病人数均居世界首位,对我国居民的健康造成了严重危害,故加强对该病的诊断及治疗意义重大[4]。
目前,临床多采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)进行乙型肝炎五项检测[分别为乙型肝炎表面抗原(HBsAg)、乙型肝炎表面抗体(HBsAb)、乙型肝炎e抗原(HBeAg)、乙型肝炎e抗体(HBeAb)、乙型肝炎核心抗体(HBcAb)],但血清标志物检测易受乙型肝炎五项复杂组合模式的影响,诊断准确率不高[5]。荧光定量PCR(fluorescence quantitative PCR,FQ-PCR)操作方便、检测速度快,是在PCR基础上进行荧光标记定量,其浓度高低可直接判断病毒复制水平、传染性强弱、抗病毒药物疗效等,在提高灵敏度和特异性的同时降低了假阳性率。故探讨FQ-PCR对HBV检测的临床意义显得尤为重要[6]。
1 资料与方法
1.1一般资料选取2015年8月至2015年12月在本院就诊的疑似乙型肝炎患者221例,其中男135例,女86例,男女比例约为1∶1.5;年龄20~78岁,平均约36.7岁。
1.2方法早晨空腹采集所有患者静脉血3 mL(标本质量合格),分别采用FQ-PCR及ELLSA检测乙型肝炎五项。根据检测结果将HBsAg、HBsAb、HBeAg、HBeAb、HBcAb的阳性率分别与乙肝核酸定量DNA的阳性率比较;再将“大三阳”(HBsAg阳性、HBeAg阳性、HBcAb阳性)和“小三阳”(HBsAg阳性、HBeAb阳性、HBcAb阳性)的阳性率分别与乙肝核酸定量DNA结果比对。
1.2.1判定标准ELLSA检测乙型肝炎五项时,若样本的吸光度值(optical density,OD值)≥1则结果为阳性,OD值小于1则结果为阴性;而HBV-DNA浓度检测中,若其浓度大于或等于500 copy/mL则为阳性,小于500 copy/mL则为阴性[7]。
1.2.2观察指标(1)对比ELISA法及FQ-PCR法对乙型肝炎五项的检测结果,分析FQ-PCR检测阳性率;(2)按照乙型肝炎五项检测结果进行分组(大三阳组、小三阳组),分析FQ-PCR检测HBV-DNA病毒含量与ELISA检测结果的相关性。
1.2.3检测方法
1.2.3.1乙型肝炎五项检测采用ELISA法来检测HBsAg、HBsAb、HBeAg、HBeAb、HBcAb等乙型肝炎标志物(由本院检验科完成检测及结果发布)。
1.2.3.2HBV-DNA定量检测采取221例患者的空腹静脉血,收集于真空惰性分离胶促凝管内,使用离心机以3 500 r/min离心5 min以制备血浆标本,4℃保存(24 h内测定)。(1)仪器设备:FQ-PCR仪为美国ABI公司7500型、HBV核酸定量检测试剂盒由艾康生物技术(杭州)有限公司提供。(2)核酸提取血清标本50 μL,加入等量提取液(吸取前吹打以便吸取固体沉淀颗粒物)50 μL并震荡混匀,瞬时离心后100℃金属浴10 min,12 000 r/min离心10 min,留取上清液(可4℃暂存)。(3)FQ-PCR检测:配制PCR反应液(35.6 μL HBV反应混合液+0.4 μL Taq酶),每管分别加入待测样本HBV-DNA、阳性对照和阴性对照各2 μL,混匀后瞬时离心,置入ABI 7500型实时FQ-PCR仪中,以95℃3 min、94℃15 s、60℃30 s(40个循环)扩增,每次延伸结束进行FAM、HEX通道荧光信号收集,记录HBV-DNA FQ-PCR检测结果。
1.3统计学处理应用SPSS17.0统计软件进行数据分析,计数资料以率表示,采用χ2检验,检验水准α= 0.05,P<0.05为差异有统计学意义。
2 结果
2.12种方法检测阳性率比较FQ-PCR确诊134例,阳性率较高为60.63%;ELISA检测中乙型肝炎五项的阳性率分别为6.33%、36.20%、33.48%、15.32%、43.89%。见表1。

表12 种方法检测阳性率比较[n=221,n(%)]
2.2大三阳、小三阳组与HBV-DNA组检测阳性率比较HBV-DNA组检测阳性率最高,与大三阳组比较,差异有统计学意义(χ2=14.63,P<0.01);与小三阳组比较,差异有统计学意义(χ2=9.60,P<0.01),见表2。

表2 大三阳、小三阳组与HBV-DNA组检测阳性率比较[n=221,n(%)]
2.3定量检测标准曲线扩增曲线处除未出现特异性扩增的阴性对照曲线外大致分为3种形态:(1)Ct值从18开始上扬的曲线,形状呈标准的“S”形,说明该样本中含有的HBV-DNA很多;(2)Ct值从24~28区间开始上扬的曲线,形状基本呈“S”形,说明该样本中含有的HBV-DNA较多;(3)Ct值从32开始上扬的曲线,形状暂无法看出呈现“S”形,但若再经过数个循环后便会出现“S”形曲线,说明该样本中含有较少的HBV-DNA,见图1。
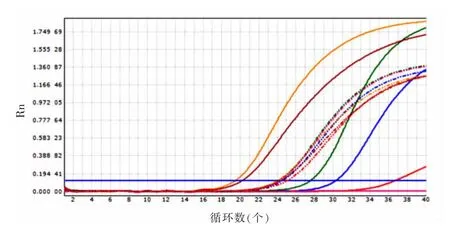
图1 FQ-PCR法检测HBV-DNA的扩增曲线
3 讨论
目前,HBV在我国的感染率高达60%~70%,易通过持续感染诱导机体持续免疫耐受状态而造成肝脏损伤,因此高效和早期的确诊降低该病死亡率的关键[8]。我国现阶段多采用乙型肝炎五项检测结果来判断是否存在HBV感染,该方法对患者体内病毒的复制水平及传染程度无判断意义,且部分患者因HBV感染复制状况难以判断而漏诊[9-10]。FQ-PCR可从分子水平直接检测HBV-DNA的存在,直观地反映HBV存活及复制水平、活动性及传染性等指标[11]。本研究检测结果显示,FQPCR对HBV-DNA检出的阳性率(60.63%)高于ELLSA(HBsAg 36.20%,HBeAg 6.33%,HBcAb 33.48%,HBeAb 15.38%,HBsAb 43.90%);大三阳组和小三阳组检测阳性率(6.33%、15.38%)分别与HBV-DNA组(60.63%)比较,差异均有统计学意义(χ2=14.63、9.60,P<0.01),说明FQ-PCR检测的诊断价值较高。其中大三阳组的阳性率为6.33%,该组HBV大量存在且高度复制,具有较强的传染性,应及时确诊,予以长期、足量的抗病毒治疗[12-13]。小三阳组阳性率为15.32%,该组HBV数量较少且复制较弱,传染性不强,其机制可能与前C区和基本核心启动子区变异引发的终止密码子形成有关,此类患者处于感染潜伏状态,除积极监测病情外,应及时予以抗病毒治疗等[14-15]。
综上所述,乙型肝炎五项ELLSA检测和FQ-PCR检测均能有效检出乙型病毒性肝炎,但HBV-DNA检测还能实时反映患者HBV感染的变化情况,有利于指导临床用药,可对ELISA测定结果做出补充修正[16-17]。ELISA法对机体免疫状态有较好的检测作用,而FQ-PCR法对HPV感染状态可做到客观表达,可认为FQ-PCR对抗病毒治疗和疗效评价均有较大的应用价值[18]。因此,FQPCR的诊断和指导意义高于ELISA法,值得临床广泛应用。当然,FQ-PCR法检测HBV-DNA含量的方法也存在一定的局限性,与ELISA检测法联合应用可为乙型病毒性肝炎的确诊提供可靠、全面的判定依据,在防控和临床治疗上具有重要意义。
[1]Mak LY,Seto WK,Lai CL,et al.DNA polymerase inhibitors for treating hepatitis B:a safety evaluation[J].Expert Opin Drug Saf,2016,15(3):383-392.
[2]Zhang ZH,Wu CC,Chen XW,et al.Genetic variation of hepatitis B virus and its significance for pathogenesis[J].World J Gastroenterol,2016,22(1):126-144.
[3]Biazar T,Yahyapour Y,Hasanjani Roushan MR,et al.Relationship between hepatitis B DNA viral load in the liver and its histology in patients with chronic hepatitis B[J].Caspian J Intern Med,2015,6(4):209-212.
[4]Zhang X,Zhai L,Rong C,et al.Association of ghrelin gene polymorphisms and serum ghrelin levels with the risk of hepatitis B virus-related liver diseases in a chinese population[J].PLoS One,2015,10(11):e0143069.
[5]Bose PP,Mandal G,Kumar D,et al.Visual detection of serum asialohaptoglobin by plasmonic sandwich ELLSA-a new platform for cirrhosis diagnosis[J].Analyst,2016,141(1):76-84.
[6]Ghosh M,Nandi S,Dutta S,et al.Detection of hepatitis B virus infection:A systematic review[J].World J Hepatol,2015,7(23):2482-2491.
[7]Lin WY,Peng CY,Lin CC,et al.General and abdominal adiposity and risk of death in HBV versus non-HBV carriers:a 10-year population-based cohort study[J].Medicine(Baltimore),2016,95(2):e2162.
[8]Borzooy Z,Jazayeri SM,Mirshafiey A,et al.Identification of occult hepatitis B virus(HBV)infection and viral antigens in healthcare workers who presented low to moderate levels of anti-HBs after HBV vaccination[J]. Germs,2015,5(4):134-140.
[9]Caligiuri P,Cerruti R,Icardi G,et al.Overview of hepatitis B virus mutations and their implications in the management of infection[J].World J Gastroenterol,2016,22(1):145-154.
[10]Jarcuska P,Drazilova S,Fedacko J,et al.Association between hepatitis B and metabolic syndrome:Current state of the art[J].World J Gastroenterol,2016,22(1):155-164.
[11]Ruan P,Yang C,Su J,et al.Histopathological changes in the liver of tree shrew(Tupaia belangeri chinensis)persistently infected with hepatitis B virus[J].Virol J,2013(10):333.
[12]Bivigou-Mboumba B,François-Souquière S,Deleplancque L,et al.Broad range of hepatitis B virus(HBV)patterns,dual circulation of quasisubgenotype A3 and HBV/E and heterogeneous HBV mutations in HIV-positive patients in gabon[J].PLoS One,2016,11(1):e0143869.
[13]Lao X,Wang X,Liu Y,et al.Association of paraoxonase 1 gene polymorphisms with the risk of hepatitis B virus-related liver diseases in a guangxi population:a case-control study[J].Medicine(Baltimore),2015,94(48):e2179.
[14]Borzooy Z,Jazayeri SM,Mirshafiey A,et al.Identification of occult hepatitis B virus(HBV)infection and viral antigens in healthcare workers who presented low to moderate levels of anti-HBs after HBV vaccination[J]. Germs,2015,5(4):134-140.
[15]Talha SM,Salminen T,Juntunen E,et al.Europium nanoparticle-based simple to perform dry-reagent immunoassay for the detection of hepatitis B surface antigen[J].J Virol Methods,2016(229):66-69.
[16]Mohammadi A,Tajik N,Shah-Hosseini A,et al.FAS and FAS-ligand promoter polymorphisms in hepatitis B virus infection[J].Hepat Mon,2015,15(10):e26490.
[17]Fu X,Song X,Li Y,et al.Hepatitis B virus X protein upregulates DNA methyltransferase 3A/3B and enhances SOCS-1CpG island methylation[J]. Mol Med Rep,2016,13(1):301-308.
[18]Chen YS,Chu CH,Wang JH,et al.Predictors of booster response to hepatitis B vaccine at 15 years of age:a cross-sectional school-based study[J]. Pediatr Neonatol,2015-11-24[2015-12-25].http://www.ncbi.nlm.nih.gov/ pubmed/?term=Chen+YS%2C+Chu+CH%2C+Wang+JH%2C+Lin+JS% 2C+Chang+YC.+Predictors+of+Booster+Response+to+Hepatitis+B+Vaccine+at+15+years+of+age%3A+A+Cross-Sectional+SchoolBased+Study.
Comparison of FQ-PCR and ELISA for detecting HBV
Lin Mu,Gong Yadong,Gao Shaoying,Ding Zheng,Ma Qingqing
(Central Laboratory,Guizhou Spaceflight Hospital,Zunyi,Guizhou 563000,China)
ObjectiveTo investigate the difference between fluorescence quantitative PCR(FQ-PCR)and enzyme-linked immunosorbent assay(ELISA)in detecting hepatitis B virus(HBV),and to analyze their clinical values.MethodsThe serum samples in 221 cases of suspected hepatitis B in our hospital from August to December 2015 were selected and HBV was respectively detected by using FQ-PCR and ELISA for exploring FQ-PCR detection method,positive rate and clinical significance.ResultsTotally 134 cases of positive samples were detected by FQ-PCR,with the positive rate of 60.63%;the detection positive rates of HBsAg,HBeAg,HBcAb,HBeAb and HBsAb by ELISA were 36.20%,6.33%,33.48%,15.32%and 43.90%respectively,which were lower than 60.63%by FQ-PCR,moreover which were compared with the"large 3-positve"group and"small 3-positive" group,the differences were statistically significant(P<0.01).ConclusionFQ-PCR can intuitively reflect the HBV replication situation in liver cells,is suitable for the early diagnosis and guides clinical medication,its diagnosis and guidance significance are higher than those of the ELISA method,moreover its operation is simple and rapid,which deserves to be promoted in clinic.
Polymerase chain reaction;Enzyme-linked immunosorbent assay;Hepatitis B virus;DNA,viral;Fluorescence quantitative PCR
10.3969/j.issn.1009-5519.2016.09.017
A
1009-5519(2016)09-1329-03
林牧(1987-),硕士研究生,主要从事分子诊断研究。△
,E-mail:1053596072@qq.com。
(2016-01-16)
