壳寡糖对低温胁迫下小麦幼苗的保护作用及相关代谢产物的影响
2016-11-08王梦雨王文霞赵小明
王梦雨,王文霞,赵小明,尹 恒
(1.中国科学院大连化学物理研究所,辽宁大连 116023; 2.中国科学院大学,北京 100049)
壳寡糖对低温胁迫下小麦幼苗的保护作用及相关代谢产物的影响
王梦雨1,2,王文霞1,赵小明1,尹 恒1
(1.中国科学院大连化学物理研究所,辽宁大连 116023; 2.中国科学院大学,北京 100049)
为了解壳寡糖对低温胁迫下小麦的保护作用,对两个小麦品种(小偃22和西农9871)幼苗喷施100 mg·L-1壳寡糖和0℃低温胁迫96 h,检测叶片的损伤面积及丙二醛、脯氨酸、可溶性糖、还原糖含量,并调查复温后返青率。结果表明,与常温对照组相比,低温胁迫48 h后壳寡糖处理的小麦叶片损伤面积和丙二醛含量增幅较低,其中小偃22和西农9871的损伤面积相对于低温对照分别减少了25.3%和28.8%,丙二醛含量分别降低了16.9%和33.7%;同时,两个品种叶片脯氨酸含量分别提高了15.8%和26.7%,还原糖含量分别提高了25.6和14.3%,可溶性糖含量也表现出增高的趋势。经过复温培养,壳寡糖处理下小偃22和西农9871的返青率分别提高了4.6%和5.9%。说明壳寡糖可通过促进小麦苗脯氨酸、还原糖等低温抗性相关次生代谢物的表达,提高其对低温寒害的抵抗能力。
壳寡糖;小麦;低温胁迫;次生代谢物
低温冻害是农业生产中主要的自然灾害之一,严重影响作物正常的生长发育和经济产量[1]。冬小麦是我国北方主要的粮食作物,因其冬前播种、越冬休眠、冬后返青拔节的生长特点,极易受到低温冻害的影响[2-4]。低温胁迫会使小麦的脂质过氧化,质膜结构受到破坏,造成光合作用效率降低,能量产生和物质合成受阻,同时为了维持正常的代谢活动,植株的呼吸作用增强,能量消耗增加,会严重抑制小麦的正常生长发育,甚至导致植株死亡,使小麦生产遭受巨大损失[5]。因此,研究能够提高小麦抗寒性的技术手段,以保证植株正常生长发育,对小麦高产稳产具有重要意义。
壳寡糖[Chitooligosaccharide(COS)]是几丁质脱乙酰基后,经酸解或酶解得到的可溶性碱性寡糖[6],是一种具有植物激发子效应的天然产物,可诱导和提升植物对病虫害的抗性,因而其应用效果和机制已经得到广泛而深入的研究[7]。壳寡糖不仅可激发植物应对病虫害的生物胁迫抗性,还可以提高植物的非生物胁迫抗性。研究表明,壳寡糖能够诱导油菜等作物抗旱,干旱胁迫下喷施壳寡糖后油菜幼苗叶片净光合速率、气孔导度、胞间CO2浓度显著提高[8]。壳寡糖对镉胁迫下的小麦幼苗生长有促进作用,受到壳寡糖处理的小麦抗氧化酶活性显著增加[9]。在低温下壳寡糖处理后水稻幼苗的叶绿素含量和根系活力均显著提高[10]。本实验室的研究发现,壳寡糖对低温胁迫下小麦有一定的保护作用,可以减少低温对小麦产量造成的损失[11],但壳寡糖的作用机制尚不明确。本试验检测了壳寡糖处理后麦苗在低温胁迫下的损伤和次生代谢物含量的变化,以期揭示壳寡糖提高小麦低温抗性的机制。
1 材料与方法
1.1材 料
供试小麦品种为小偃22和西农9871,均由西北农林科技大学农学院提供。壳寡糖粉剂由中国科学院大连化学物理研究所制备,用去离子水溶解后壳寡糖水溶液中脱乙酰度> 95%,聚合度为3~10。
1.2处理方法
1.2.1幼苗培养
小麦种子用去离子水浸种8 h后,播种于直径15 cm、高18 cm的花盆中,盆中装泥炭土与蛭石3∶1(v/v)的混合介质,泥炭土中有机质含量70%±5%,pH 5.0~6.0,胡敏酸含量40%±2%,总氮含量1%~2.5%,总P2O5含量0.3%,总K2O含量0.21%,总 Fe 含量1%~3%,C/N 15~20,C.E.C 80~150 me·100 mg-1(Panda peat,China),每个花盆种植15棵麦苗。将麦苗置于气候室内生长,生长条件:昼夜温度22±1 ℃,昼夜时间16 h/8 h,光照强度400 μmol·m-2·s-1,相对湿度50%。待麦苗出现第4 片真叶(第三片叶全展)时,用15 mL浓度为100 mg·L-1的壳寡糖水溶液喷施叶片(浓度由之前的预试验得到),对照组喷施等量去离子水。喷施24 h后将壳寡糖和对照处理的一半小麦幼苗移入到低温气候室进行低温胁迫。这样形成4个处理组:常温壳寡糖处理组、常温对照组、低温壳寡糖处理组和低温对照组,各处理组重复3次。
1.2.2低温胁迫处理
低温胁迫从22 ℃始,以2 ℃·h-1的速率逐渐降温至0 ℃。昼夜时间16 h/8 h,光照强度400 μmol·m-2·s-1。温度降至0±1 ℃胁迫处理4 d,每2 d取样一次,取样时间为当天气候室内进入白昼后的第2小时,样品液氮冻存备用。
消费者食品安全意识淡薄。正是因为消费者食品安全意识淡薄,导致食品生产企业对食品质量安全不够重视。当前,我国居民大多为中低收入消费者,他们的消费能力没有那么高,并且尚未树立正确的食品安全意识,在部分人的认知中,只追求低价格,轻视了食品的质量安全问题。
1.3测定项目与方法
1.3.1 叶片损伤面积的测定
低温胁迫48 h后,利用Evans blue法[12]染色4个处理组,用ImageJ软件计量叶片面积与染上颜色的损伤面积。损伤面积比率=染色面积/叶片面积×100%。
1.3.2代谢产物含量的测定
丙二醛含量采用硫代巴比妥酸反应法测定[13],脯氨酸含量采用磺基水杨酸比色法测定[14],可溶性糖含量采用蒽酮法测定[15],还原糖含量用3,5-二硝基水杨酸法[16]。
1.3.3小麦返青率的测定
幼苗培养与胁迫处理同1.2.1和1.2.2,各处理组分别取50株形态均一的小麦苗,经过4 d 0±1 ℃低温胁迫后,放置于4±1 ℃培养室内平衡24 h,之后再放入22±1 ℃培养。小麦生长3 d后调查其存活的植株数。
返青率=返青株数/处理前株数×100%
数据用SPSS Statistics Program 19.0 (IBM,New York,USA)进行ANOVA 检验,利用最小显著性差异法 (LSD,Least-significant difference)确定不同处理组之间的显著性差异。
2 结果与分析
2.1壳寡糖对低温胁迫下小麦幼苗叶片损伤的影响
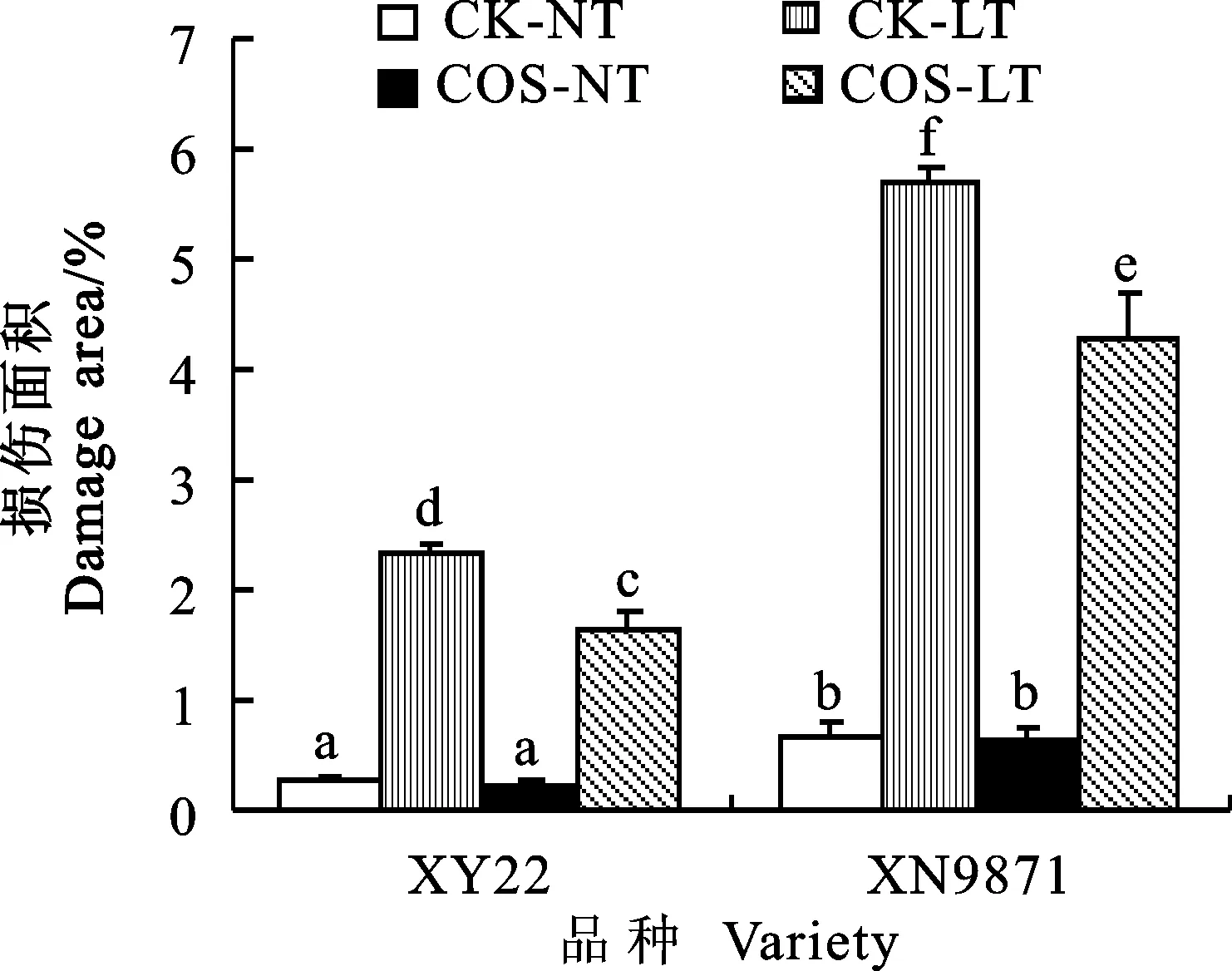
喷施壳寡糖和低温胁迫48 h后,与低温对照组相比,小麦品种小偃22和西农9871的叶片损伤程度分别降低了25.3%和28.8%,说明壳寡糖预处理后小麦的低温抗性显著提高。两个品种对低温均有明显的反应,且存在显著差异,经过低温胁迫后,小偃22的叶片损伤程度比西农9871低59%(图1和图2)。

XY22: 小偃22;XN9871:西农9871;CK-NT: 常温对照组;CK-LT:低温对照组;COS-NT: 常温壳寡糖处理组;COS-LT:低温壳寡糖处理组。下同
XY22: Xiaoyan 22; XN9871: Xinong 9871; CK-NT: CK-normal temperature; CK-LT: CK-low temperature; COS-NT: COS-normal temperature; COS-LT: COS-low temperature. The same as below
图1通过Evans blue染色法显示低温胁迫对小麦幼苗叶片的损伤
Fig.1Damage area of wheat seedling under low temperature stress detected by Evans blue
图柱上的字母不同表示处理间差异显著(P<0.05)。下同
Different letters on the columns indicate the significant differences among the treatments at 0.05 level.The same as below
图2壳寡糖对低温胁迫下小麦幼苗叶片损伤的影响
Fig.2Effect of COS on damage area of wheat seedling under low temperature stress
2.2壳寡糖对低温胁迫下小麦幼苗叶片丙二醛含量的影响
低温胁迫后,小偃22和西农9871幼苗的丙二醛(MDA)含量均显著上升(图3)。低温胁迫48 h时两个小麦品种壳寡糖处理的MDA含量都显著低于低温对照组, 降幅分别为16.9%和33.7%。而低温胁迫96 h时,壳寡糖处理与低温对照组没有显著差异。两个小麦品种MDA含量对低温胁迫的反应有显著差异,西农9871的MDA含量在低温胁迫后均高于小偃22,而且这种差异无论经壳寡糖处理与否均存在。
2.3壳寡糖对低温胁迫下小麦幼苗叶片脯氨酸含量的影响
在常温条件下喷施壳寡糖24 h后,小麦品种小偃22和西农9871的脯氨酸含量显著提高,增幅分别为15.8%和26.7%,并且随后续的生长,小麦的脯氨酸含量呈增加的趋势。经过48 h的低温胁迫,两个品种壳寡糖处理的脯氨酸含量均显著高于低温对照组,增幅分别为7.7%和10.1%。经过96 h的低温胁迫后,壳寡糖处理组和低温对照组没有显著的区别。经过低温胁迫48 h后,小偃22的脯氨酸含量比西农9871高26.1%,说明两个品种的脯氨酸对低温胁迫的响应存在显著差异(图4)。
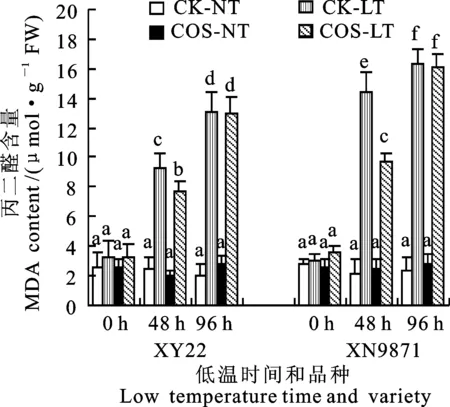
图3 壳寡糖对低温胁迫下小麦幼苗叶片 丙二醛(MDA)含量的影响Fig.3 Effect of COS on MDA content of wheat seedling under low temperature stress
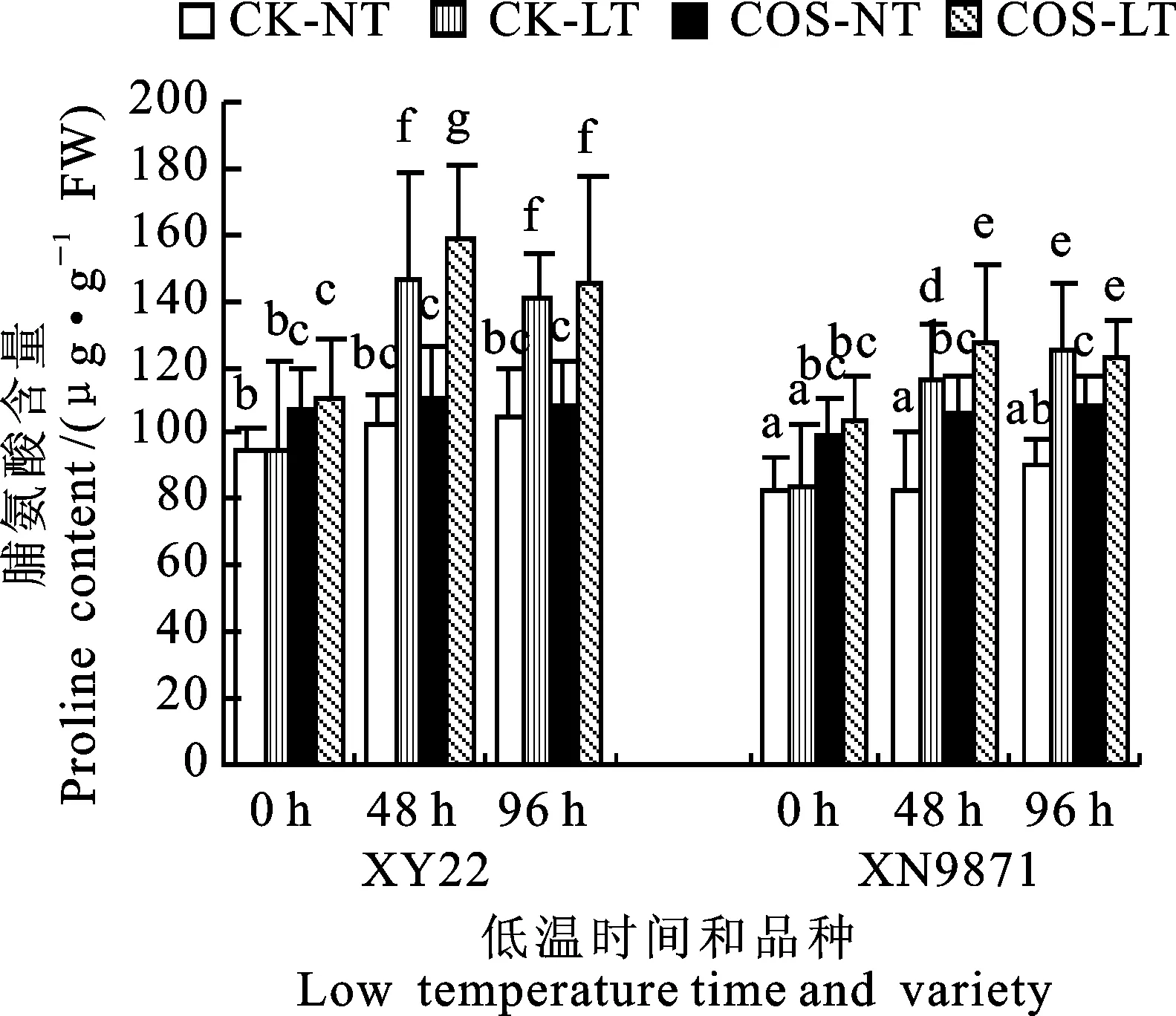
图4 壳寡糖对低温胁迫下小麦幼苗 叶片脯氨酸含量的影响Fig.4 Effect of COS on proline of wheat seedling under low temperature stress
2.4壳寡糖对低温胁迫下小麦幼苗叶片可溶性糖含量的影响
经壳寡糖处理24 h后,小偃22和西农9871的可溶性糖含量都无显著性变化(图5)。低温胁迫48 h后,两个小麦品种的可溶性糖含量较常温对照组都显著增加,增幅分别为25.6%和14.3%,而壳寡糖处理与低温对照组相比表现出增加的趋势,但没有显著性差异。在低温胁迫96 h后,麦苗的可溶性糖含量相对于低温48 h时有所降低,壳寡糖处理与低温对照组也没有显著性差异。
2.5壳寡糖对低温胁迫下小麦幼苗叶片还原糖含量的影响
经壳寡糖处理24 h后,小偃22和西农9871的还原糖含量都比常温对照组显著提高,增幅分别为19.2%和14.1%(图6)。经过低温胁迫48和96 h后,两个品种的还原糖含量表现出增加的趋势,但壳寡糖处理组与低温对照组相比都没有表现出显著性差异。而小麦品种间还原糖含量的差异比较明显,小偃22在低温胁迫48和96 h后比西农9871分别高出10.2%和12.5%。此外,常温下不同处理组间还原糖含量没有明显的差异。

图5 壳寡糖对低温胁迫下小麦 幼苗叶片可溶性糖含量的影响Fig.5 Effect of COS on water soluble(WSS) sugar of wheat seedling under low temperature stress
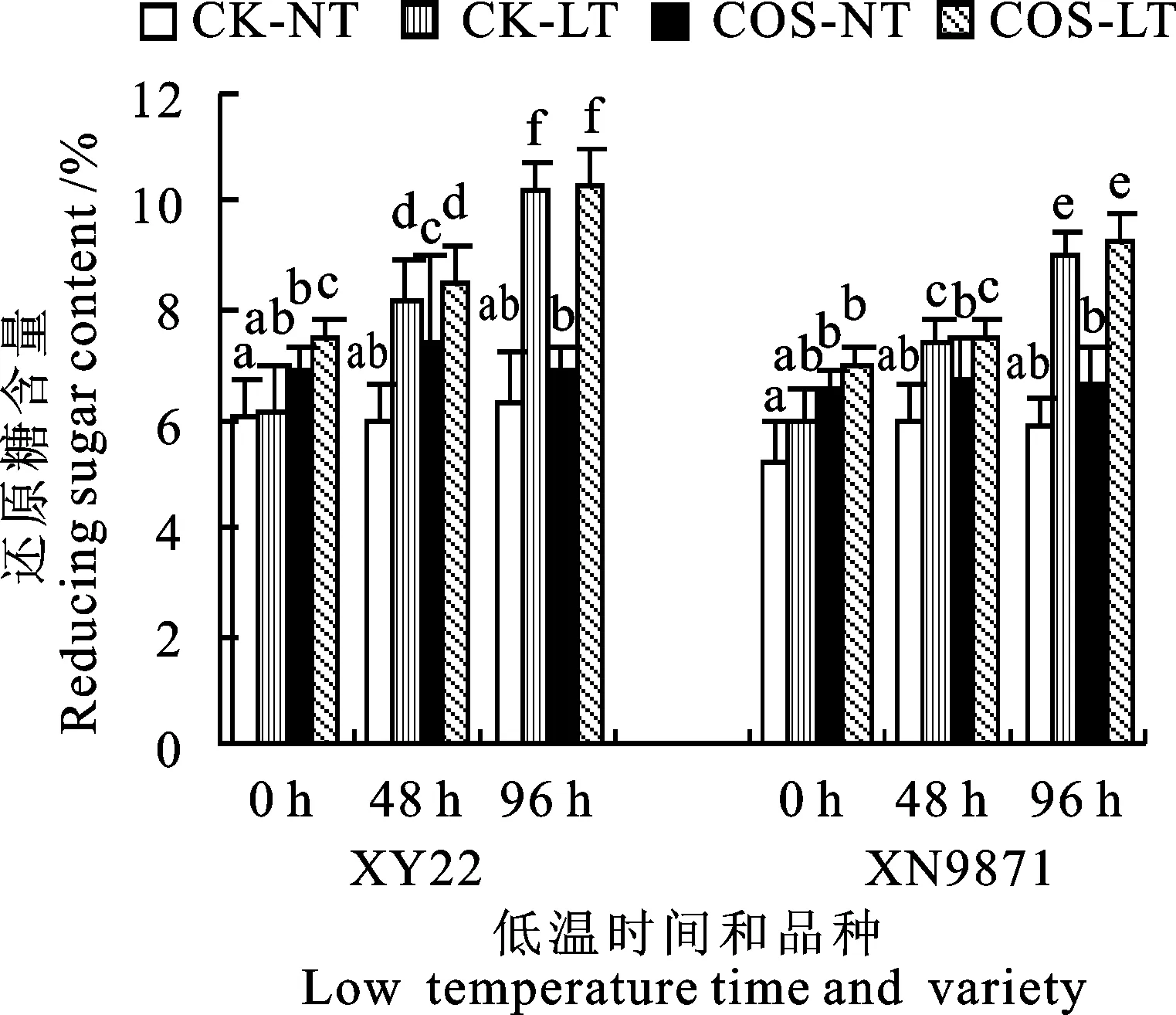
图6 壳寡糖对低温胁迫下小麦幼苗 叶片还原糖含量的影响Fig.6 Effect of COS on reducing sugar of wheat seedling under low temperature stress
2.6壳寡糖对低温胁迫下麦苗返青率的影响
调查结果(图7)表明,低温胁迫96 h的麦苗再复温3 d后,虽然两个小麦品种都受到了严重的低温损伤,但壳寡糖处理的小麦返青率明显高于低温对照组。其中,小偃22的返青率提高了的4.6%,西农9871的返青率提高了5.9%。
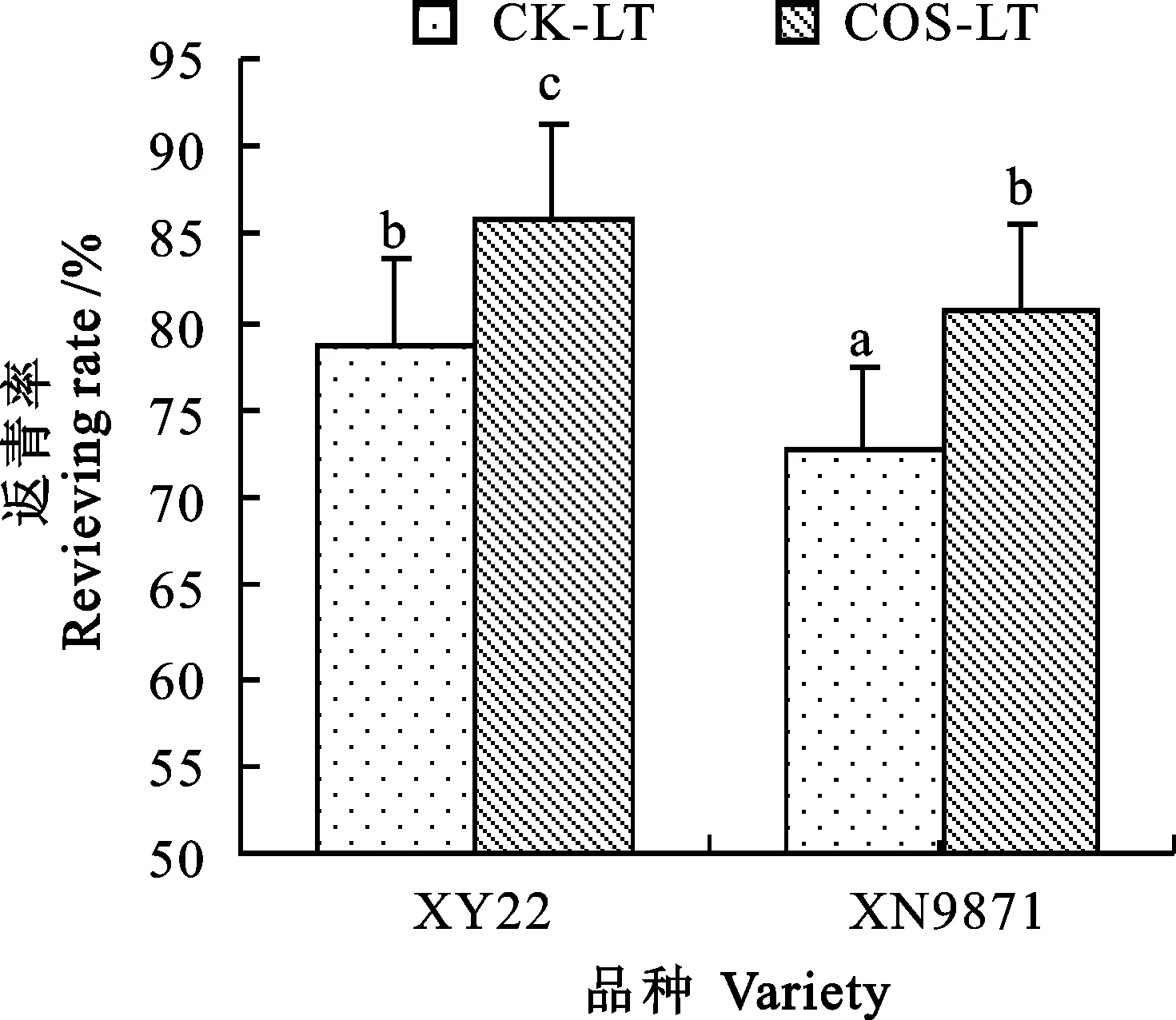
图7 壳寡糖对低温胁迫下小麦幼苗死亡率的影响Fig.7 Effects of COS on reviving rate of wheat seedling under low temperature stress
3 讨 论
壳寡糖作为一种植物激发子,其作用机制已经得到广泛研究。本研究结果表明,壳寡糖有增强小麦抗寒能力的作用。低温会直接破坏细胞膜,造成细胞内物质的流失和细胞膜脂类的氧化,利用Evans blue染色和检测脂质过氧化的产物MDA,可以显示叶片细胞膜受到低温损伤的程度[12-13]。本研究中,壳寡糖喷施处理的小麦在经过低温胁迫后,受到的损伤面积明显低于没有经过壳寡糖处理的低温对照组。此外,经过壳寡糖处理的小麦经过低温胁迫后,生理生化指标的变化显示出低温抗性得到了增强。脯氨酸和糖含量的增加可以减弱低温对植物组织液的冷滞效应,保证植物细胞中溶质的流动性[17],同时脯氨酸合成过程中产生的NADPH及还原糖可以为细胞提供还原力[18-19],降低低温下产生的氧化自由基的损伤,并对维持低温胁迫下光合作用的稳定起到重要作用。经过壳寡糖处理后,小麦脯氨酸合成量在低温胁迫初始阶段就显著提高,说明壳寡糖可以促进小麦的脯氨酸合成,这为减少后续到来的低温胁迫所造成的损伤提供了预保护的作用。这与干旱条件下油菜上壳聚糖的处理效果相一致。在本实验中,壳寡糖对低温胁迫下小麦的可溶性糖含量没有显著的影响,但经过96 h的低温胁迫后,壳寡糖处理的小麦可溶性糖含量与低温对照组相比有增高的趋势。先前的研究显示,壳寡糖对小麦的叶绿素含量有显著的影响[9],这表明壳寡糖可能存在保护低温下植物光合作用,进而维持植株物质代谢的效应。壳寡糖处理后的小麦在低温胁迫发生前就表现出较高的还原糖含量,这同样为减少后续到来的低温胁迫所造成的损伤提供了预保护的作用。
此外,通过考察小麦的返青率发现,经过低温胁迫并复温生长后,壳寡糖处理的麦苗成活率明显高于低温对照组,这直接表现了壳寡糖对小麦低温抗性的提高效应。
在试验中,小偃22表现出较强的低温抗性,其低温损伤水平明显低于西农9871,同时各种有利于提高低温抗性的次生代谢物含量也高于西农9871。经过壳寡糖处理后,西农9871的低温损伤显著减少,低温抗性得到了显著的提升,这说明壳寡糖对两个小麦品种都有明显增强低温抗性的效果。
综上所述,壳寡糖处理后可以减少小麦叶片受到的低温损伤,增加植株脯氨酸、还原糖等次生代谢物的含量,提高了小麦经受低温胁迫后的返青率,这些都说明壳寡糖可以增强小麦对低温胁迫的抵抗能力。在低温胁迫初始,植物未及启动应对的调控机制,此时的低温对植物伤害最严重[20],而喷施处理后就显著提高脯氨酸和还原糖含量,说明壳寡糖可以为小麦提供预保护的作用,以应对即将到来的低温胁迫。这种效果为壳寡糖应用于早冬寒害和倒春寒提供了良好思路。为了更好地利用壳寡糖对小麦的低温保护作用,其调控低温抗性相关基因的作用机制、品种的响应差异以及小麦不同的生长阶段的作用效果都有待进一步研究。
[1]Chen L J,Xiang H Z,Miao Y,etal.An overview of cold resistance in plants [J].JournalofAgronomyandCropScience,2014,200(4):237-245.
[2]Peng J H H,Sun D F,Nevo E.Domestication evolution,genetics and genomics in wheat [J].MolecularBreeding,2011,28(3):281-301.
[3]陈襄礼,李林峰,王重锋,等.小麦倒春寒发生特点及防御措施初探 [J].河南农业科学,2014(2):35-37,42.
Chen X L,Li L F,Wang C F,etal.Preliminary study on characteristics of late spring coldness and its defensive measures in wheat [J].JournalofHenanAgriculturalSciences,2014(2):35-37,42.
[4]赵 虹,王西成,胡卫国,等.黄淮南片麦区小麦倒春寒冻害成因及预防措施 [J].河南农业科学,2014(8):34-38.
Zhao H,Wang X C,Hu W G,etal.Genetic analysis and countermeasures of wheat late-spring-coldness injury in South Huang-huai wheat region [J].JournalofHenanAgriculturalSciences,2014(8):34-38.
[5]Li X N,Topbjerg H B,Jiang D,etal.Drought priming at vegetative stage improves the antioxidant capacity and photosynthesis performance of wheat exposed to a short-term low temperature stress at jointing stage [J].PlantandSoil,2015,393(1-2):307-318.
[6]Blagodatskikh I V,Kulikov S N,Vyshivannaya O V,etal.Influence of glucosamine on oligochitosan solubility and antibacterial activity [J].CarbohydrateResearch,2013,381:28-32.
[7]Yin H,Zhao X M,Du Y G.Oligochitosan:A plant diseases vaccine-A review [J].CarbohydratePolymers,2010,82(1):1-8.
[8]李 艳,曾秀娥,李洪艳,等.壳寡糖对干旱胁迫下油菜叶片生理指标的影响 [J].生态学杂志,2012(12):3080-3085.
Li Y,Zeng X E,Li H Y,etal.Effects of oligochitosan on the leaf physiological indices ofBrassicanapusL.under drought stress [J].ChineseJournalofEcology,2012(12):3080-3085.
[9]马莲菊,张 阳,卜 宁,等.壳寡糖缓解小麦镉毒害的某些生理特性研究 [J].环境科学与技术,2010(6):31-34.
Ma L J,Zhang Y,Pu N,etal,Physiological characters of oligochitosan on alleviating Cd toxicity of wheat seedling [J].EnvironmentalScience&Technology,2010(6):31-34.
[10]匡银近,叶桂萍,覃彩芹.壳寡糖浸种对水稻幼苗抗冷性的影响 [J].湖北农业科学,2009(7):1568-1571.
Kuang Y J,Ye G P,Qin C X.Influence of oligochitosan on cold resistance of rice seedling [J].HubeiAgriculturalSciences,2009(7):1568-1571.
[11]王梦雨,王文霞,赵小明,等.壳寡糖提高小麦低温抗性的作用效果初探[C]//2014年中国植物保护学会学术年会论文集.2014:228-234.
Wang M Y,Wang W X,Zhao X M,etal.Effects of chitosan oligosaccharides on improving cold resistance in crops[C]//Proceedings of China Society of Plant Protection in 2014.2014:228-234.
[12]Baker C J,Mock N M.An improved method for monitoring cell-death in cell-suspension and leaf discassays using evans blue [J].PlantCellTissueandOrganCulture,1994,39(1):7-12.
[13]Predieri S,Norman H A,Krizek D T,etal.Influence of UV-B radiation on membrane lipid-composition and ethylene evolution in Doyenne D’Hiver pear shoots growninvitrounder different photosynthetic photon fluxes [J].EnvironmentalandExperimentalBotany,1995,35(2):151-160.
[14]Bates L S,Waldren R P,Teare I D.Rapid determination of free proline for water-stress studies [J].PlantandSoil,1973,39(1):205-207.
[15]Bailey M J,Biely P,Poutanen K.Interlaboratory testing of methods for assay of xylanase activity [J].JournalofBiotechnology,1992,23(3):257-270.
[16]Miller G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar [J].AnalyticalChemistry,1959,31(3):426-428.
[17]Kielbowicz-Matuk A,Rey P,Rorat T.The organ-dependent abundance of a solanum lipid transfer protein is up-regulated upon osmotic constraints and associated with cold acclimation ability [J].JournalofExperimentalBotany,2008,59(8):2191-2203.
[18]Lu S Y,Wang X H,Guo Z F.Differential responses to chilling inStylosanthesguianensis(Aublet) Sw.and its mutants [J].AgronomyJournal,2013,105(2):377-382.
[19]Chen J J,Guo Z F,Fang J Y,etal.Physiological responses of a centipedegrass mutant to chilling stress [J].AgronomyJournal,2013,105(6):1814-1820.
[20]Mutlu S,Karadaolu Ö,Atici Ö,etal.Protective role of salicylic acid applied before cold stress on antioxidative system and protein patterns in barley apoplast [J].BiologiaPlantarum,2013,57(3):507-513.
Effect of Chitooligosaccharide on Reducing Cryoinjury and Improving Metabolite of Winter Wheat Seedlings under Low Temperature Stress
WANG Mengyu1,2,WANG Wenxia1,ZHAO Xiaoming1,YIN Heng1
(1.Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian,Liaoning 116023,China;2.University of the Chinese Academy of Sciences,Beijing 100049,China)
In order to study the effects of Chitooligosaccharide (COS) on protecting wheat from low temperature stress,two cultivars,Xiaoyan 22 (XY22) and Xinong 9871 (XN9871),were pretreated with 100 mg·L-1COS under 0 ℃ low temperature stress for 96 hours. The area of cold damage,the content of malonaldehyde (MDA),proline,water soluble sugar (WSS),reducing sugar and reviving rate were detected every 48 hours during the study. The results showed that COS decreased the low temperature damage area by 25.3% in XY22 and 28.8% in XN9871,respectively. Meanwhile,COS improved metabolite of the both wheat seedlings under the low temperature stress: the content of MDA was reduced by 16.9% in XY22 and 33.7% in XN9871; proline was increased by 15.8% in XY22 and 26.7% in XN9871; and reducing sugar was increased by 25.6% in XY22 and 14.3% in XN9871,respectively. In addition,the reviving rate raised by 4.6% in XY22 and 5.9% in XN9871,which revealed COS have remarkable effect on protecting wheat from low temperature stress. It is worth noting that the expression level of proline and reducing sugar in wheat seedling significantly accumulated when pretreated with COS in 24 hours before low temperature stress,which implied that COS provide pre-protection for wheat seedlings to the upcoming low temperature stress. The study indicates that COS could reduce cryoinjury and increase the secondary metabolism production of winter wheat seedlings under low temperature stress.
Chitosan oligosaccharides (COS); Wheat; Low temperature stress; Secondary metabolites
时间:2016-05-10
2015-12-01
2016-01-05
海洋公益性行业科研专项(201305016-2);中科院青年创新促进会项目(2015144);中国科学院科技服务网络计划-山东省主要设施蔬菜绿色安全种植及保鲜 (技术集成与示范KFJ-EW-STS-085)
E-mail:huawusuo@126.com
尹 恒(E-mail:yinhengi@dicp.ac.cn)
S512.1;S311
A
1009-1041(2016)05-0653-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160510.1625.034.html
