滨麦蔗糖:果聚糖6-果糖基转移酶(6-SFT)基因全长cDNA的克隆与生物信息学分析
2016-11-08贺晓岚王建伟赵继新李文旭陈新宏
贺晓岚,王建伟,赵继新,李文旭,武 军,陈新宏
(1.西北农林科技大学农学院/陕西省植物遗传工程育种重点实验室,陕西杨凌 712100; 2.凯里学院环境与生命科学学院,贵州凯里 556011; 3.河南省农业科学院小麦研究所,河南郑州 450002)
滨麦蔗糖:果聚糖6-果糖基转移酶(6-SFT)基因全长cDNA的克隆与生物信息学分析
贺晓岚1,王建伟2,赵继新1,李文旭3,武 军1,陈新宏1
(1.西北农林科技大学农学院/陕西省植物遗传工程育种重点实验室,陕西杨凌 712100; 2.凯里学院环境与生命科学学院,贵州凯里 556011; 3.河南省农业科学院小麦研究所,河南郑州 450002)
为了挖掘和利用滨麦(Leymusmollis,2n=4x=28,JJNN)的优良基因,以拓宽小麦非生物胁迫抗性基因资源,以滨麦为材料,利用RT-PCR结合RACE技术从滨麦叶片中克隆到 6-SFT基因cDNA的全长序列,并对其进行生物信息学分析。结果表明,其cDNA全长为2 086 bp,开放阅读框为1 866 bp(命名为 Lm-6-SFT),编码621个氨基酸;其推导的蛋白分子量为69.1 kDa,理论等电点(pI)为5.18,属于酸性蛋白。保守结构域分析表明,该基因推导的氨基酸序列含有SDPDG、RDP和EC结构域。多序列比对及进化树分析表明,滨麦6-SFT与冰草6-SFT在氨基酸水平具有高度的序列相似性。
滨麦; 6-SFT基因;克隆;序列分析
果聚糖是蔗糖与一个或多个果糖分子相连接形成的不同链长的多聚体[1]。果聚糖是生物体内一种重要物质,不仅为植物提供生长所需能量,还在干旱、冷及高盐等非生物胁迫下参与渗透调节[1-2]、细胞膜稳定性维护[3]及信号传导等生理过程[4-5]。在麦类作物中有三种酶参与果聚糖的合成[6],其中,蔗糖:果聚糖6-果糖基转移酶(Sucrose:fructan 6-fructosyltransferase,6-SFT)是禾本科植物果聚糖合成过程的关键酶[7]。非生物胁迫因子是制约植物生长发育、影响作物产量和品质的关键因子。据估计,约70%的作物产量损失可归因于非生物胁迫,尤其是干旱胁迫[8]。滨麦(Leymusmollis,2n=4x=28,JJNN)属于禾本科小麦族大麦亚族赖草属的一个异源四倍体野生种,它具有耐旱、耐寒、耐盐碱,大穗多花、茎秆粗壮,抗多种真菌、细菌病害等优良性状,是小麦品种改良的优异种质资源之一[9]。因此,分离并利用来自滨麦的 6-SFT基因对增强作物非生物胁迫抗性具有十分重要的意义。
国内外对果聚糖的研究可追溯到1804年,迄今为止已有两百多年的历史[10]。果聚糖的生理及生化特性是早期的研究焦点,自1995年Sprenger等[7]首次从大麦中分离到 6-SFT基因以来,目前已在多种植物如冰草[11]、小麦[12]、猫尾草[13]、雀麦草[14]、华山新麦草[15]和大赖草[16]中分离到该基因,并进行功能验证研究。 6-SFT基因家族是糖基水解酶32(GH32)家族的一个分支,广泛分布在菊科、百合科、禾本科以及主要的谷类作物[17]。虽然 6-SFT基因存在于不同物种中且不同物种中序列长度存在差异,但它们编码的蛋白在结构上仍有高度相似性,都具有SDPNG、RDP和EC保守结构域及TIPL液泡定位信号[18-19]。其中,SDPNG是蔗糖结合域的活性位点,而天冬氨酸D是该区域的活性中心[14];RDP是果糖基转移反应中的过渡态稳定剂,D是其催化中心;EC主要参与蔗糖的裂解,而谷氨酸E是其活性中心,起质子供体的作用[20-21]。麦类作物果聚糖合成酶基因的另一个特征是含有4个外显子和3个内含子,并且第二个外显子仅有9 bp,是目前植物中发现的最小外显子[22-23]。此外,大量研究还表明,在非果聚糖积累植物中表达 6-SFT基因可提高植物的抗旱[24-25]、抗寒[14,26]及抗盐性[25]。
目前,对禾本科植物 6-SFT基因的研究多集中在小麦、大麦和黑麦等植物上,尚缺乏在小麦近缘野生植物滨麦中有关 6-SFT基因的研究报道。由于 6-SFT基因在禾本科植物中广泛分布,且结构和功能上具有高度的保守性,由此可以推测,滨麦中的 6-SFT基因也可能参与对非生物逆境胁迫的抗性反应。本研究以滨麦为材料,通过RT-PCR结合RACE法分离 6-SFT基因的cDNA序列,并对所分离的序列进行生物信息学分析,以期为作物抗逆育种提供理论依据及新的候选基因。
1 材料与方法
1.1植物材料
供试材料滨麦(Leymusmollis,2n=4x=28,JJNN)由西北农林科技大学农学院赵继新老师提供,于2013年种植于西北农林科技大学原西北植物所试验地供基因克隆所用。
1.2滨麦蔗糖:果聚糖6-果糖基转移酶基因( 6-SFT)的克隆
1.2.1滨麦叶片总RNA提取
利用总RNA提取试剂盒RNeasy Plant Minikit(Qiagen,Germany)提取滨麦叶片总RNA。使用SuperScript III Reverse Transcriptase(Invitrogen) cDNA第一链合成试剂盒合成cDNA第一链。
1.2.2cDNA中间保守区的克隆
根据GenBank已报道的小麦、西尔斯山羊草、大麦、冰草、雀麦、梯牧草、偏生早熟禾、草地早熟禾、毒麦和黑麦草6-SFT蛋白氨基酸序列比对结果设计简并引物DPsen/DPantisen(DPsen:5′-AAYGARATGYTNCARTGG-3′;DPantisen: 5′-N CCRTCNARNACNGGNAC-3′。其中,N=AcgT,Y=CT,R=Ag)。选用TaKaRa公司的LATaqwith GC Buffer进行PCR扩增。扩增程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,35个循环;72 ℃延伸10 min。PCR扩增产物经琼脂糖凝胶电泳后,回收、纯化目的片段,然后将目的片段与pMD19-T载体(TaKaRa公司)连接,并转化至大肠杆菌DH5α感受态细胞,最后将菌落PCR和质粒单双酶切鉴定正确的重组质粒送上海生工生物工程有限公司测序。
1.2.3滨麦 6-SFT基因全长cDNA序列的克隆
参考3′-Full RACE Core Set Ver.2.0与5′-Full RACE Kit产品说明书设计3′-RACE和5′-RACE的特异性PCR引物GSOP3-Lm3、GSIP3-Lm3、GSOP5-Lm3和GSIP5-Lm3(GSOP3-Lm3:5′-TGAGGCTGATGTGGGCTAT-3′;GSIP3-Lm3:5′-CCTCGTCCTCGCTGCTGGTA-3 ′;GSOP5-Lm3:5′-GGTGACCAGATGACGGGATT-3′;GSIP5-Lm3: 5′-TGCACTGGACCTCAACAGC-3′),并进行滨麦 6-SFT基因cDNA 3′与5′端序列的克隆。其中,PCR扩增、克隆及测序方法同1.2.2。
将中间保守区序列与5′-RACE和3′-RACE获得的序列进行拼接后,根据拼接序列设计用于克隆滨麦 6-SFT基因cDNA编码区的引物Lm-6-SFT-F/Lm-6-SFT-R(Lm-6-SFT-F:5′-TCACAA TCTACCAAACTCTCTTA-3′;Lm-6-SFT-R:5′-CACTCTCCCAAACAACAATA-3′)。以1.2.1中合成的cDNA第一链为模板,以Lm-6-SFT-F/Lm-6-SFT-R为引物,通过PCR法扩增滨麦 6-SFT基因编码区序列,并通过测序进行验证。
1.3生物信息学分析
用NCBI ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)查找基因的开放读码框;用ProtParam (http://www.expasy.ch/tools/protparam.html)分析编码蛋白的基本理化性质;用WoLF PSORT (http://psort.hgc.jp/form.html)、MitoProt (http://ihg.gsf.de/ihg/mitoprot.html)对蛋白进行亚细胞定位预测;用BlastP预测保守区和蛋白家族;用SignalP (http://www.cbs.dtu.dk/services/SignalP)分析蛋白信号肽序列;通过InterProscan 5(http://www.ebi.ac.uk/Tools/pfa/iprscan/)分析蛋白保守结构域;选取相似性高的序列用ClustalX2进行多序列比对;用MEGA 5.0构建系统发育树,设Bootstrap值为1 000。
2 结果与分析
2.1滨麦 6-SFT基因的克隆及序列分析
通过RT-PCR结合RACE法扩增到滨麦 6-SFT基因的全长cDNA,其长度约2 000 bp(图1)。序列分析表明,滨麦 6-SFT基因的ORF长为1 866 bp,编码621个氨基酸残基(图2),含有5个N端糖基化位点(Asn-Xaa-Ser/Thr),预测分子量为69.1 kDa,理论等电点为5.18(表1)。比较滨麦 6-SFT基因与小麦族(不同基因组)其他物种 6-SFT基因,发现不仅存在单碱基变异,而且序列长度也存在差异。小麦族其他物种 6-SFT基因的序列长度大多数一致,除大赖草外,均为1 851 bp,而滨麦 6-SFT基因的序列长度为1 866 bp,比小麦族其他物种该基因的序列长。滨麦与小麦族其他物种 6-SFT基因编码蛋白分子量及等电点也存在差异,但等电点均小于6,为酸性蛋白。

M: Marker Ш; 1~7: 滨麦 6-SFT基因
1-7: 6-SFT gene fromLeymusmollis
图1滨麦 6-SFT基因全长PCR扩增结果
Fig.1Image of the full-length cDNA sequence of 6-SFT gene amplified fromLeymusmollis
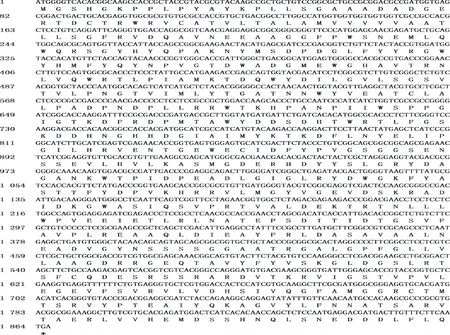
图2 滨麦 6-SFT基因的cDNA序列及预测的氨基酸序列Fig.2 cDNA sequence and predicted amino acid sequence of 6-SFT gene from Leymus mollis
2.2滨麦6-SFT蛋白的结构域、保守区及系统进化分析
结构功能域分析表明,滨麦6-SFT蛋白属于糖基水解酶32家族,N端为β-螺旋模型,由5个刀片状结构组成,并含有伴刀豆球蛋白A凝集素/葡聚糖酶域(Concanavalin A-like lectin/glucanase domain)(图3)。将滨麦6-SFT蛋白序列与已报道的几个物种的6-SFT蛋白序列进行比对,发现滨麦6-SFT蛋白含有MSDPDG、RDP和EC结构域,与冰草6-SFT蛋白的结构域完全一致,而与通常认为的糖基水解酶32家族的3个高度保守的结构域MSDPNG、RDP和EC存在差异(图4),说明6-SFT在进化过程中相对较活跃。系统进化树分析结果(图5)表明,滨麦6-SFT蛋白序列与冰草 6-SFT基因推导的氨基酸序列亲缘关系最近,相似性达87%,推测滨麦6-SFT蛋白与冰草6-SFT蛋白的功能相近。

图3 保守模体预测结果Fig.3 Conserved motifs prediction

a: MSDPDG结构域;b: RDP结构域;c: EC结构域; Ph、Lr、Lm、Ta、As、BA、Ac、Bp、PH、Ps、Pp、Lt和Lp表示对应的序列分别来自华山新麦草、大赖草、滨麦、普通小麦、西尔斯山羊草、大麦、冰草、金雀花、猫尾草、偏生早熟禾、草地早熟禾、毒麦和多年生黑麦草。图5中同
a:MSDPDG domain;b: RDP domain; c: EC domain; Ph,Lr,Lm,Ta,As,BA,Ac,Bp,PH,Ps,Pp,Lt and Lp represent the corresponding sequence derived fromPsathyrostachyshuashanica,Leymusracemosus,Leymusmollis,Triticumaestivum,Aegilopssearsii,Hordeumvulgaresubsp.vulgare,Agropyroncristatum,Bromuspictus,Phleumpratense,Poasecunda,Poapratensis,Loliumtemulentum,andLoliumperenne,respectively. The same as in Fig. 5
图4滨麦6-SFT与其他物种6-SFT蛋白MSDPDG、RDP和EC结构域序列比对
Fig.4Alignment of MSDPDG,RDP and EC domains of 6-SFT protein fromLeymusmollisand
6-SFT-like proteins from other plant species
2.3滨麦 6-SFT基因编码蛋白的亚细胞定位
用WoLF PSORT软件进行亚细胞定位预测,结果(表2)显示,滨麦6-SFT蛋白主要定位在液泡内。因此,推测该蛋白可能在液泡内发挥作用。
3 讨 论
本研究首次从滨麦中克隆到含完整编码区序列的 6-SFT基因,序列分析表明,滨麦 6-SFT基因和小麦族其他禾本科物种中已克隆得到的 6-SFT基因相似性很高,但本研究克隆到的 6-SFT基因其cDNA编码区序列长度(1 866 bp)与小麦族其他禾本科物种 6-SFT基因存在差异。Gao等[18]从小麦族不同基因组中分离的 6-SFT基因序列长度均为1 851 bp,岳爱琴等[23]从6份普通小麦和10份二倍体小麦分离的 6-SFT基因序列长度均为1 863 bp,He等[15]从华山新麦草中分离的 6-SFT基因序列长度为1 851 bp,贺晓岚等[16]从大赖草中分离的 6-SFT基因序列长度为1 863 bp,Wei和Chatterton[11]从冰草分离的 6-SFT基因序列长度为1 872 bp,均与本研究克隆到的 6-SFT基因序列长度存在差异,这表明6-SFT基因在进化过程中相对较活跃,具有物种特异性。结构域分析结果显示,该基因的N端为β-螺旋模型,由5个刀片状结构组成,含有一个伴刀豆球蛋白A凝集素/葡聚糖酶域,C末端存在一个β-夹心模型。蛋白质结构分析结果表明,6-SFT蛋白属于植物糖基水解酶家族32(GH32)。序列比对结果显示,滨麦 6-SFT基因核苷酸序列所推导的氨基酸序列包含SDPDG、RDP和EC保守结构域,与Wei和Chatterton[11]分离到的冰草 6-SFT基因核苷酸序列所推导的氨基酸序列保守结构域完全相同,与其他物种的保守结构域SDPNG、RDP和EC略存在差异。系统进化树分析结果显示,滨麦 6-SFT基因推导的氨基酸序列与冰草6-SFT蛋白序列亲缘关系最近。因此,推测本研究分离到的滨麦 6-SFT基因功能可能与冰麦 6-SFT基因相似。蛋白亚细胞定位分析结果表明,滨麦6-SFT蛋白分布在液泡中的可能性最大,并且滨麦 6-SFT基因推导的氨基酸序列存在液泡定位信号TLPI。因此,推测该基因可能在液泡中发挥作用。此外,序列相似性分析结果表明,滨麦6-SFT与冰草 6-SFT基因推导的氨基酸序列相似性达87%,存在多处氨基酸替换、插入和缺失。以上研究结果表明,虽然 6-SFT基因在进化过程中保持了较高的遗传稳定性,但是不同物种的 6-SFT基因序列差异较大。因此,分离并进一步分析滨麦 6-SFT基因的多态性及其表达方式对揭示其抗逆性差异具有重要的研究意义。本研究为进一步研究滨麦 6-SFT基因的结构和功能奠定了基础。
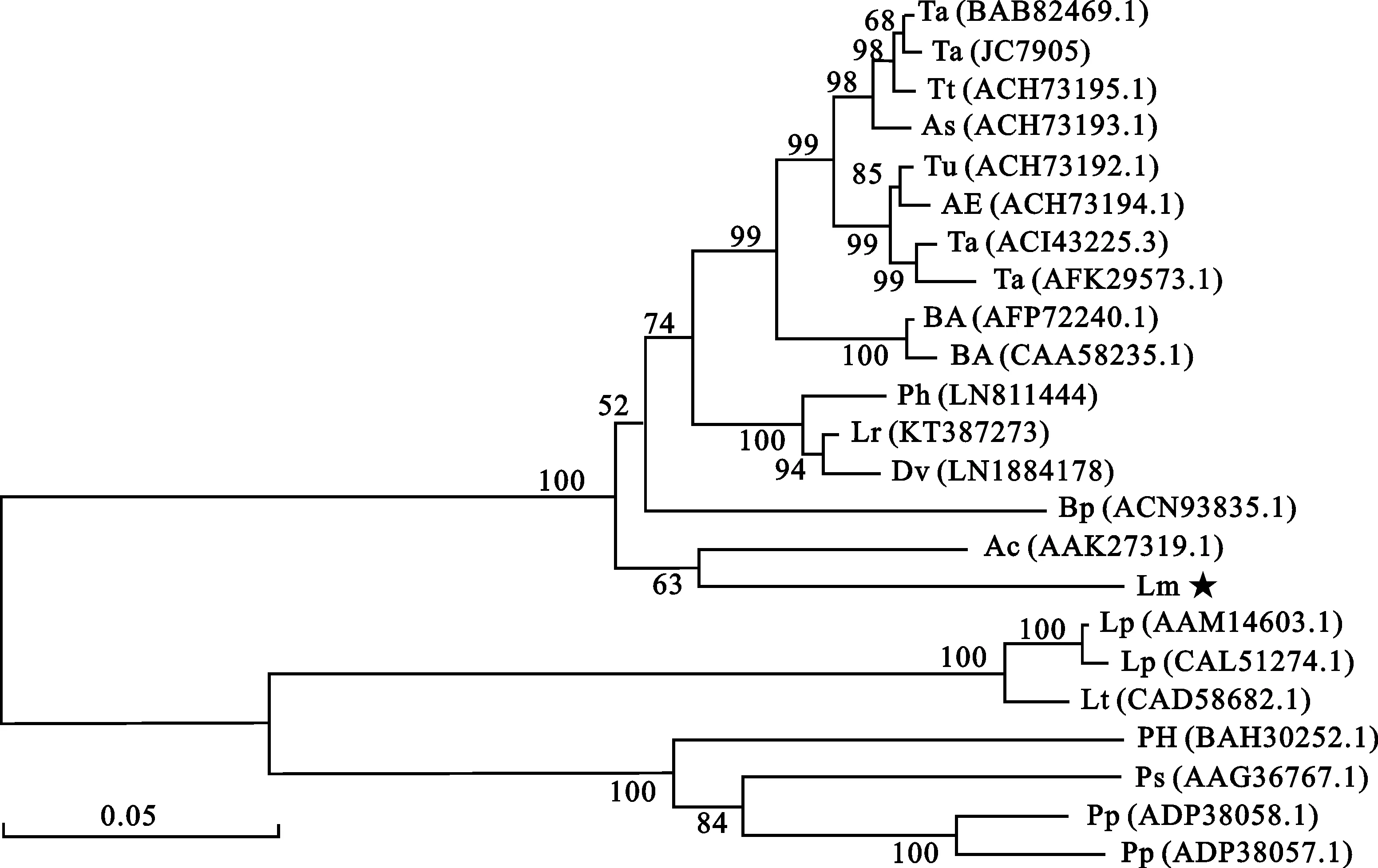
“★”表示本研究得到的滨麦6-SFT蛋白;Dv、Tt、Tu和AE表示对应的序列分别来自簇毛麦、圆锥小麦、乌拉尔图小麦和粗山羊草
“★” represents 6-SFT protein fromLeymusmollisin this study;Dv,Tt,Tu and AE represent the corresponding sequence derived fromDasypyrumvillosumL.,Triticumturgidumsubsp.durum,Triticumurartu,andAegilopstauschii,respectively
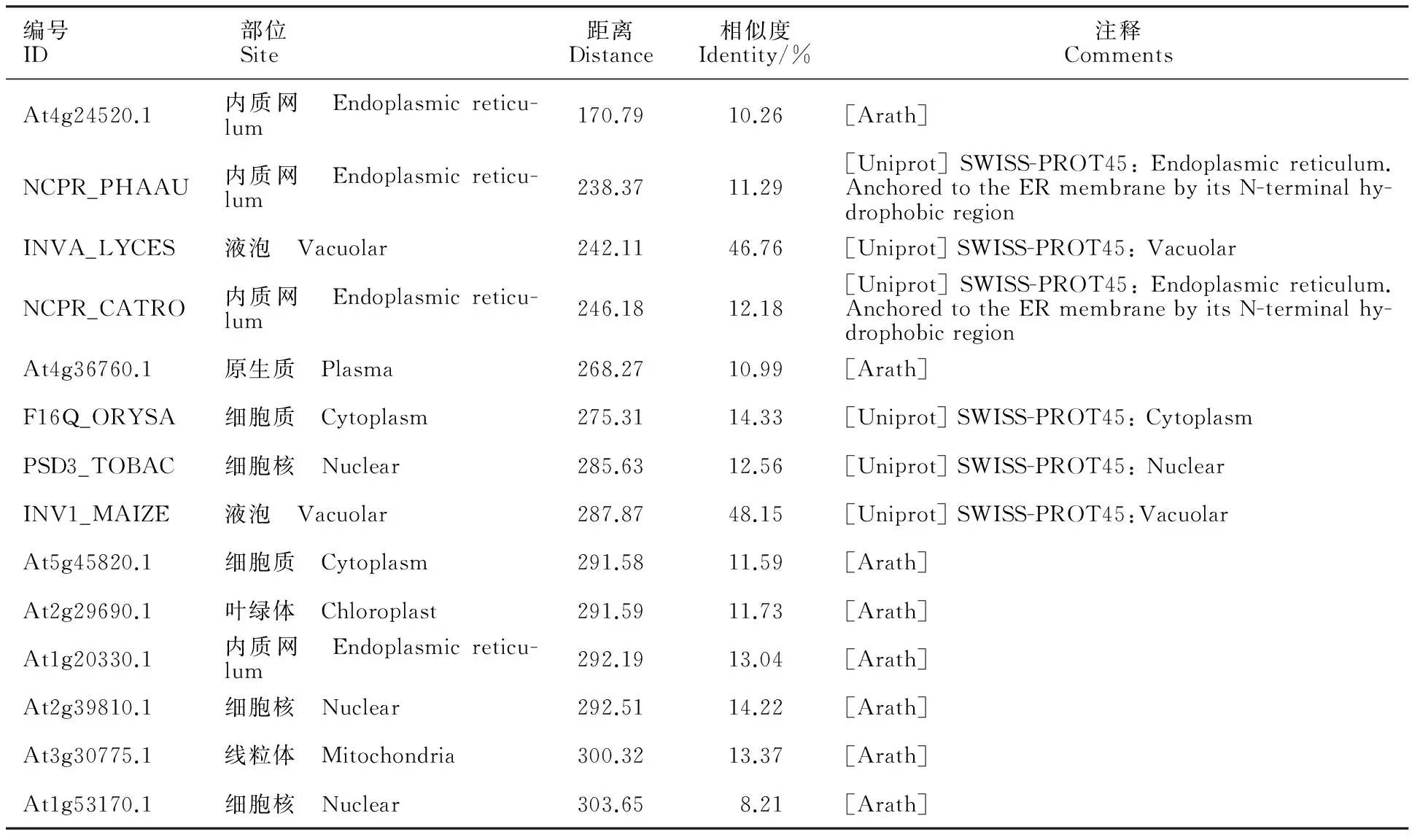
图5 滨麦6-SFT蛋白与其他物种6-SFT蛋白系统进化树分析Fig.5 Phylogenic tree analysis of 6-SFTs from various species based on amino acid sequences表2 滨麦6-SFT蛋白亚细胞定位预测结果Table 2 The subcellular localization of 6-SFT protein from Leymus mollis
[1]van Arkel J,Sévenier R,Hakkert J C,etal.Tailor-made fructan synthesis in plants:a review [J].CarbohydratePolymers,2013,93(1):48-56.
[2]Hisano H,Kanazawa A,Kawakami A,etal.Transgenic perennial ryegrass plants expressing wheat fructosyltransferase genes accumulate increased amounts of fructan and acquire increased tolerance on a cellular level to freezing [J].PlantScience,2004,167(4):861-868.
[3]Demel R A,Dorrepaal E,Ebskamp M J,etal.Fructans interact strongly with model membranes [J].BiochimicaetBiophysicaActa(BBA)-Biomembranes,1998,1375(1-2):36-42.
[4]Bolouri-Moghaddam M R,Le R K,Xiang L,etal.Sugar signalling and antioxidant network connections in plant cells [J].FEBSJournal,2010,277(9):2022-2037.
[5]van den Ende W.Multifunctional fructans and raffinose family oligosaccharides [J].FrontiersinPlantScience,2013,4(247):1-11.
[6]李婷婷.外源NO对低温胁迫下小麦果聚糖合成代谢及其基因表达调控的研究 [D].新乡:河南师范大学,2012.
Li T T.Exogenous nitric oxide effect on fructan anabolism and gene [D].Xinxiang:Henan Normal University,2012.
[7]Sprenger N,Bortlik K,Brandt A,etal.Purification,cloning,and functional expression of sucrose:fructan 6-fructosyltransferase,a key enzyme of fructan synthesis in barley [J].ProceedingsoftheNationalAcademyofSciences,1995,92(25):11652-11656.
[8]Bray E A,Bailey-Serres J,Weretilnyk E.Responses to abiotic stresses [J].BiochemistryandMolecularBiologyofPlants,2000,1158:e1203.
[9]赵继新,陈新宏,武 军,等.普通小麦-滨麦-簇毛麦三属杂交后代的细胞遗传学研究 [J].西北农林科技大学学报:自然科学版,2002,30(5):1-6.
Zhao J X,Chen X H,Wu J,etal.Studies on cytogenetics of the progenies of trigeneric hybridization involvingTriticumaestivum,LeymusmollisandHaynaldiavillosa[J].JournalofNorthwestA&FUniversity:NaturalScienceEdition,2002,30(5):1-6.
[10]Kussmaul A,Maier R.Ueber eine bisher nicht beschriebene eigenthümliche Arterienerkrankung (Periarteritis nodosa),die mit Morbus Brightii und rapid fortschreitender allgemeiner Muskellähmung einhergeht [J].DeutschesArchivFürKlinischeMedizin,1866,3:217-219.
[11]Wei J Z,Chatterton N J.Fructan biosynthesis and fructosyltransferase evolution:expression of the 6-SFT (sucrose:fructan 6-fructosyltransferase) gene in crested wheatgrass (Agropyroncristatum) [J].JournalofPlantPhysiology,2001,158(9):1203-1213.
[12]Kawakami A,Yoshida M.Molecular characterization of sucrose:sucrose 1-fructosyltransferase and sucrose:fructan 6-fructosyltransferase associated with fructan accumulation in winter wheat during cold hardening [J].Bioscience,Biotechnology,andBiochemistry,2002,66(11):2297-2305.
[13]Tamura K I,Kawakami A,Sanada Y,etal.Cloning and functional analysis of a fructosyltransferase cDNA for synthesis of highly polymerized levans in timothy (PhleumpratenseL.) [J].JournalofExperimentalBotany,2009,60(3):893-905.
[14]del Viso F,Puebla A F,Fusari C M,etal.Molecular characterization of a putative sucrose:fructan 6-fructosyltransferase ( 6-SFT) of the cold-resistant Patagonian grassBromuspictusassociated with fructan accumulation under low temperatures [J].PlantandCellPhysiology,2009,50(3):489-503.
[15]He X L,Chen Z Z,Wang J W,etal.A sucrose:fructan-6-fructosyltransferase (6-SFT) gene fromPsathyrostachyshuashanicaconfers abiotic stress tolerance in tobacco [J].Gene,2015,570(2):239-247.
[16]贺晓岚,王建伟,李文旭,等.大赖草 6-SFT基因的克隆及其转基因烟草抗旱和抗寒性分析 [J].作物学报,2016,42(3):372-381.
He X L,Wang J W,Li W X,etal.Cloning of 6-SFT gene fromLeymusracemosusand analysis of tolerance to drought and cold stresses in transgenic tobacco [J].ActaAgronomicaSinica,2016,42(3):372-381.
[17]田尚衣.松嫩草地芦苇种群无性繁殖过程中果聚糖代谢组成的分布格局及调控机理 [D].长春:东北师范大学,2011.
Tian S Y.Acllocation patterns and regulation mechanisms of fructans metabolism compositions in clone reproductive process ofPhragmitescommunispopulation in Songnen grassland of China [D].Changchun:Northeast Normal University,2011.
[18]Gao X,She M Y,Yin G X,etal.Cloning and characterization of genes coding for fructan biosynthesis enzymes (FBEs) in Triticeae plants [J].AgriculturalSciencesinChina,2010,9(3):313-324.
[19]岳爱琴,李 昂,毛新国,等.小麦果聚糖合成酶基因 6-SFT-A单核苷酸多态性分析及其定位 [J].中国农业科学,2011,44(11):2216-2224.
Yue A Q,Li A,Mao X G,etal.Single nucleotide polymorphism and mapping of 6-SFT-A gene responsible for fructan biosynthesis in common wheat [J].ScientiaAgriculturaSinica,2011,44(11):2216-2224.
[20]高 翔,佘茂云,殷桂香,等.小麦果聚糖合成酶基因 6-SFT的克隆和功能验证 [J].科技导报,2009(23):70-75.
Gao X,She M Y,Yin G X,etal.Isolation and functional determination of fructan biosynthesis enzyme encoding gene 6-SFT from common wheat (TriticumaestivumL.) [J].ScienceandTechnologyReview,2009(23):70-75.
[21]Ritsema T,Verhaar A,Vijn I,etal.Using natural variation to investigate the function of individual amino acids in the sucrose-binding box of fructan:fructan 6G-fructosyltransferase (6G-FFT) in product formation [J].PlantMolecularBiology,2005,58(5):597-607.
[22]高 翔.小麦族植物果聚糖合成酶基因克隆及功能验证 [D].北京:中国农业科学院,2010.
Gao X.Cloning and functional analysis of genes encoding fructan biosynthesis enzymes in Triticeae plants [D].Beijing:Chinese Academy of Agricultural Sciences,2010.
[23]Huynh B,Mather D E,Schreiber A W,etal.Clusters of genes encoding fructan biosynthesizing enzymes in wheat and barley [J].PlantMolecularBiology,2012,80(3):299-314.
[24]Pilon-Smits E,Ebskamp M,Paul M J,etal.Improved performance of transgenic fructan-accumulating tobacco under drought stress [J].PlantPhysiology,1995,107(1):125-130.
[25]Bie X M,Wang K,She M Y,etal.Combinational transformation of three wheat genes encoding fructan biosynthesis enzymes confers increased fructan content and tolerance to abiotic stresses in tobacco [J].PlantCellReports,2012,31(12):2229-2238.
[26]Del V F,Casabuono A C,Couto A S,etal.Functional characterization of a sucrose:fructan 6-fructosyltransferase of the cold-resistant grassBromuspictusby heterelogous expression inPichiapastorisandNicotianatabacumand its involvement in freezing tolerance [J].JournalofPlantPhysiology,2011,168(5):493-499.
Cloning and Bioinformatics Analysis of cDNA of Sucrose:Fructan-6-Fructosyltransferase (6-SFT) Gene fromLeymusmollis
HE Xiaolan1,WANG Jianwei2,ZHAO Jixin1,LI Wenxu3,WU Jun1,CHEN Xinhong1
(1.Shaanxi Key Laboratory of Plant Genetic Engineering Breeding,College of Agronomy,Northwest A&F University,Yangling,Shaanxi 712100,China; 2.College of Environment and Life Science,Kaili University,Kaili,Guizhou 556011,China;3.Institute for Wheat Research,Henan Academy of Agricultural Sciences,Zhengzhou,Henan 450002,China)
In order to explore the abiotic stress resistance gene ofLeymusmollis(2n=4x=28,JJNN) and broaden the abiotic stress resistance gene resources in wheat,the reverse transcription PCR (RT-PCR) and rapid-amplification of cDNA ends (RACE) techniques were used to clone a full-length cDNA sequence of Lm-6-SFT gene fromL.mollisleaves,and the bioinformatics analysis was conducted. The results showed that the full-length cDNA sequence,designated as Lm-6-SFT,with 2 086 bp in length,contains an open reading frame (ORF) with 1 866 bp. Lm-6-SFT was predicted to encode a 621 amino acids protein with molecular weight of 69.1 kDa and isoelectric point of 5.18,which belongs to the acidic protein. The deduced amino acids contain SDPDG,RDP,and EC conservative domains. Multiple sequence alignment and phylogenetic analysis showed that the Lm-6-SFT protein shared high similarity with 6-SFT proteins fromAgropyroncristatum.
Leymusmollis; 6-SFT gene; Clone; Sequence analysis
时间:2016-05-10
2016-01-11
2016-02-16
国家自然科学基金项目(31571650);西北农林科技大学唐仲英育种基金项目
E-mail:helingzhi123@126.com
陈新宏(E-mail:cxh2089@126.com)
S512.1;S330
A
1009-1041(2016)05-0549-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160510.1623.004.html
