3种不同血瘀证动物模型的建立与评价
2016-11-08梁耀月李佳佳董世芬袁悦莹孙建宁
梁耀月,李佳佳,董世芬,张 荣,袁悦莹,孙建宁
(北京中医药大学中药学院中药药理系,北京 100102)
◇实验方法学◇
3种不同血瘀证动物模型的建立与评价
梁耀月,李佳佳,董世芬,张荣,袁悦莹,孙建宁
(北京中医药大学中药学院中药药理系,北京100102)
目的建立痰浊血瘀、气滞血瘀、痰浊+气滞血瘀大鼠模型,研究不同血瘀状态动物模型的特征。方法选用SD大鼠,随机分为正常对照组、高脂饲料组、慢性刺激组(chronic unpredictable mild stress,CUMS)、高脂饲料+慢性刺激组,分别采用相应因素干预6周。于2、4、6周动态监测动物体重、旷场行为、血脂和血清皮质酮指标;实验终点(6周)采用小动物超声和左心室插管法检测心功能,采用黏度仪、红细胞变形/聚集测试仪检测血液流变性相关指标。结果与正常对照组大鼠相比,采用高脂饲料、慢性不可预知性刺激后均可引起血瘀状态,对动物的行为学、血脂、心脏功能、血液黏度造成了不同程度的影响,当两因素叠加时,血瘀相关指标变化最明显,表现为:与正常对照组比较,体重明显降低(P<0.01),2周时水平运动、垂直运动、运动时间均减少(P<0.01或P<0.05),2周、4周时,血清皮质酮上升(P<0.01或P<0.05),4周、6周时TG明显上升(P<0.01)。6周时,血流速度减慢(P<0.01),收缩末期左室前壁、后壁厚度均增厚(P<0.01或P<0.05),舒张期左心室指数上升(P<0.01),左心室最大收缩速率降低(P<0.05),全血黏度上升(P<0.01)。结论高脂饲料喂养和慢性不可预知性刺激均可形成血瘀状态,但是具有不同的特点。当两因素叠加时,动物可明显出现行为学、血液黏度、心脏功能、血脂等指标的异常,可为血瘀证以及相关药物的研究提供依据。
慢性不可预知刺激;高脂饲料;气滞;痰浊;血瘀证;动物模型
血瘀证是临床常见的症候状态,与冠心病、高血压、高血脂、肿瘤等多种疾病形成有关。稳定可靠的动物模型的构建对阐述中医证候状态的病理生理机制以及相关药物干预具有重要的意义。目前已经有关于寒凝、痰浊、气滞、气虚等血瘀证动物模型的探讨[1]。但是所获得的数据主要为终点判断,少有动态观测血瘀过程的报道。本研究采用高脂饲料和/或慢性不可预知性刺激建立不同状态的血瘀大鼠模型,结合动态观测和终点指标,综合评价模型,以期为相关研究提供科学依据。
1 材料与方法
1.1动物SPF级SD大鼠40只,体质量120 g,♂,由斯贝福(北京)实验动物科技有限公司提供,合格证号:[SCXK(京)2011-0004]。
1.2药品与试剂高脂饲料(88%基础饲料、2%胆固醇和10%猪油),北京科澳协力饲料有限公司提供,许可证编号:[SCXK(京)2014-0010]。水合氯醛(批号:20140619)购自国药集团化学试剂有限公司。甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)均购自南京建成生物工程研究所,批号分别是20151224、20151224、20151225和20151224。红细胞变形性试剂(批号:20150610)购自北京世帝科学仪器公司。血清皮质酮(corticosterone,CORT)放免试剂盒(批号:20160115)购自北京华英生物技术研究所。
1.3仪器LG-R-80A型自动冲洗血液黏度仪(北京世帝科学仪器公司);LG-B190型红细胞变形/聚集测试仪(北京世帝科学仪器公司);GL-21M高速冷冻离心机(上海卢湘仪离心机仪器有限公司);KH-100 DE型数控超声波清洗器(昆山禾创超声仪器有限公司); 自制敞箱(80 cm×80 cm×40 cm);小动物行为分析系统(Ethovision XT 9);XH-6020全自动放免计数仪(西安核仪器厂);Epoch 酶标仪(美国伯腾仪器有限公司Bio Tek Instruments Inc.Serial#:130315A);Vevo 2100(维胜有限公司);HZQ-C空气浴振荡器(哈尔滨市东明医疗仪器厂);RM6240C多通道生理信号采集处理系统(成都仪器厂)。
1.4实验方法
1.4.1造模方法适养3 d,将动物随机分为正常对照组(control)、高脂饲料组(high fat diet)、慢性刺激组(chronic unpredictable mild stress,CUMS)、高脂饲料+慢性刺激组(high fat diet+CUMS)4组,每组10只。高脂饲料组,高脂饲料+慢性刺激组大鼠采用高脂饲料喂养,其余2组常规饲养。另外,慢性刺激组、高脂饲料+慢性刺激组大鼠给予CUMS的干预,刺激因素包括噪声、夹尾、禁食禁水、电刺激、昼夜颠倒,具体操作见Tab 1。

Tab 1 The specific operation table of chronic unpredictable mild stress(CUMS)
One kind of the stimulation above was randomly arranged every day, which could not be predicted by the animals the next day,and the duration was 6 weeks.
1.4.2实验指标测定
1.4.2.1体重测定分别于大鼠造模0、2、4、6周对大鼠进行体重测定。
1.4.2.2旷场实验将动物置于高40 cm,边长80 cm,四周及底部均为黑色的封闭方形旷场中心位置,用摄像系统观察并记录动物在旷场内5 min的行为表现,包括水平活动距离、垂直运动次数、运动时间,其中水平活动距离、运动时间可以通过行为学分析系统获得数据。分别于造模2、4以及6周对大鼠进行水平运动、垂直运动、运动时间的测定。
1.4.2.3生化指标测定于大鼠造模2、4周后眼眶取血,根据试剂盒说明书操作流程酶标仪测TC、TG、HDL-C、LDL-C,放免法测CORT;造模6周后,质量分数为10%的水合氯醛按0.3 mL·(100 g)-1麻醉动物,颈总取血5 mL,静置,3 500 r·min-1离心10 min,取血清酶标法测定TC、TG、HDL-C、LDL-C,放免法测定CORT。
1.4.2.4心脏超声检测于取材前1 d进行动物心脏超声检测(Vevo 2100,探头MS250),腹腔注射质量分数为10%的水合氯醛,按0.3 mL·(100 g)-1麻醉大鼠后,左胸上至锁骨下至肋骨下缘处备皮。分别对大鼠的射血分数(ejection fraction,EF)、短轴缩短率(fractional shortening,FS)、流出道峰速(AV Peak Velocity)、舒张末期左室前壁厚度(left ventricular anterior wall thickness at end-diastolic,LVAWd)、舒张末期左室后壁厚度(left ventricular posterior wall thickness at end-diastolic,LVPWd)、舒张末期左室内径(left ventricular internal diameter at end-diastolic,LVIDd)、收缩末期左室内径(left ventricular internal diameter at end-systolic,LVIDs)、收缩末期左室前壁厚度(left ventricular anterior wall thickness at end-systolic,LVAWs)、收缩末期左室后壁厚度(left ventricular posterior wall thickness at end-systolic,LVPWs)。
舒张期左心室指数(m/g)=舒张期左室内径(LVIDd)(m)/心室重量(m)(g)
收缩期左心室指数(m/g)=收缩期左室内径(LVIDs)(m)/心室重量(m)(g)
1.4.2.5左心室插管测定心功能于造模6周后,腹腔注射质量分数为10%的水合氯醛,按0.3 mL/100 g麻醉大鼠,固定后将右侧颈总动脉分离,远心端结扎,近心端插管,即用20 G静脉留置针经颈总动脉插管至左心室,连接生物信号记录仪记录心率(heart rate,HR)、左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末期压力(left ventricular end diastolic pressure,LVEDP)和左心室最大收缩/舒张速率(the maximum rate of myocardial contraction and the maximum rate of myocardial diastole,±dp/dt max)。
1.4.2.6血液流变性相关指标测定于造模6周后麻醉,颈总取血4 mL加入肝素钠抗凝管,取全血血样0.8 mL在LG-R-80A型自动冲洗血液黏度仪上测定全血黏度。另取全血血样40 μL加悬浮液(红细胞变形性试剂加入100 mL蒸馏水配制而成)1 mL混匀,取混合好的样品0.8 mL在LG-B190型红细胞变形/聚集测试仪上测定红细胞最大变形指数(maximum deformation index,MAXDI)及曲线下的积分面积(SSS)。取全血血样0.8 mL在LG-B190型红细胞变形/聚集测试仪上测定红细胞最大聚集指数(maximum aggregation index,MAXD)及曲线下的积分面积(SS)。

2 结果
2.1各组刺激因素对体重的影响如Tab 2所示,与正常对照组(Control)大鼠相比,造模2周开始,慢性刺激组(CUMS)大鼠、高脂饲料+慢性刺激组(High fat diet+CUMS)大鼠体重明显降低(P<0.01),而高脂饲料组(High fat diet)大鼠体重无明显变化(P>0.05)。
Tab 2 Effects of different stimulation factors on body weight changes of ±s,n=10)
**P<0.01vscontrol

Tab 3 Effects of different stimulation factors on behavior index changes of rats in open ±s,n=10)
*P<0.05,**P<0.01vscontrol
2.2各组刺激因素对旷场试验行为学的影响旷场试验是评价动物模型在新环境中自主行为、探究行为和紧张度的一种方法。如Tab 3所示,与正常对照组大鼠相比,在造模2周后,接受慢性刺激大鼠和高脂饲料+慢性刺激组大鼠的水平运动距离、垂直运动次数、运动时间均明显减少(P<0.05或P<0.01),而高脂饲料喂养组大鼠仅仅在水平运动距离上减少(P<0.05)。造模4、6周后,只有慢性刺激组大鼠的水平距离、运动时间明显减少(P<0.05)。结果提示,慢性不可预知刺激可导致情志异常,高脂饲料对情志有一定影响,但并不明显。
2.3各组刺激因素对血清皮质酮的影响情志异常会引起神经内分泌系统紊乱,血清皮质酮(CORT)是其重要指标。如Tab 4所示,与正常对照组大鼠相比,造模2周后,各模型组大鼠CORT含量明显上升(P<0.01)。造模4周后,高脂饲料组大鼠、高脂饲料+慢性刺激组大鼠CORT含量仍明显上升(P<0.05或P<0.01),而慢性刺激组大鼠CORT的含量差异消失。造模6周后,各模型组大鼠CORT含量均无明显变化。
Tab 4Effects of different stimulation factors


GroupCORT/mg·L-1wk2wk4wk6Control0.308±0.0270.309±0.0280.336±0.015Highfatdiet0.347±0.025∗∗0.348±0.032∗∗0.324±0.027CUMS0.351±0.026∗∗0.328±0.0210.352±0.024Highfatdiet+CUMS0.352±0.025∗∗0.333±0.022∗0.354±0.025
*P<0.05,**P<0.01vscontrol
2.4各组刺激因素对血脂水平的影响如Tab 5所示,与正常对照组大鼠相比,各模型组大鼠HDL-C含量无明显变化,但造模4周后,慢性刺激组大鼠、高脂饲料+慢性刺激组大鼠LDL-C含量出现明显降低(P<0.05)。在造模2、4周后,各模型组大鼠TC含量明显升高(P<0.05或P<0.01),但6周后,慢性刺激组大鼠TC含量明显降低(P<0.05),其他两组模型鼠TC含量差异消失。造模4、6周后,高脂饲料+慢性刺激组大鼠TG含量明显升高(P<0.01);6周后,高脂饲料组大鼠TG含量也出现明显升高(P<0.05);而慢性刺激组大鼠在造模2、6周后TG含量却出现明显降低(P<0.05或P<0.01)。结果提示各模型组大鼠的脂代谢出现紊乱,但变化趋势有所不同。
2.5各组刺激因素对心脏超声检测结果的影响如Tab 6所示,与正常大鼠比较,各模型组大鼠AV Peak Velocity明显下降(P<0.05或P<0.01),此外高脂饲料+慢性刺激组大鼠收缩末期左室前壁厚度(LVAWs)、收缩末期左室后壁厚度(LVPWs)、舒张期左心室指数(LVIDd/m)明显增加(P<0.05或P<0.01),而高脂饲料组大鼠仅舒张末期左室后壁厚度(LVPWd)明显增加(P<0.05),慢性刺激组大鼠仅LVIDd/m明显增加(P<0.01)。结果提示高脂饲料复合慢性刺激对心脏功能的影响较单一因素更为明显。
2.6各组刺激因素对血流动力学的影响心脏的收缩能力用LVSP和+dp/dtmax来表征,心脏的舒张能力用LVEDP和-dp/dtmax来表征。如Tab 7所示,与正常对照组大鼠比较,各模型组大鼠+dp/dtmax明显下降(P<0.05),此外高脂饲料组大鼠LVEDP的绝对值也出现了明显下降(P<0.05)。结果提示高脂饲料可能对心脏的收缩和舒张功能有一定的影响,慢性刺激、高脂饲料复合慢性刺激可能仅对心脏的收缩功能有影响。
Tab 5 Effects of different stimulation factors on changes of blood lipids levels ±s,n=10)
*P<0.05,**P<0.01vscontrol
Tab 6 Effects of different stimulation factors on cardiac ultrasound examination in ±s,n=10)
*P<0.05,**P<0.01vscontrol
Tab 7 Effects of different stimulation factors on hemodynamics in ±s,n=10)
*P<0.05vscontrol
2.7各组刺激因素对全血黏度的影响如Tab 8所示,造模6周后,与正常对照组大鼠比较,各模型组大鼠全血黏度1/s明显升高(P<0.05或P<0.01),但高脂饲料+慢性刺激组大鼠在全血黏度50/s、100/s上也明显升高(P<0.05),其他2个模型组无明显差异。结果提示,高脂饲料复合慢性刺激对全血黏度的影响较单一因素更为明显。


GroupWholebloodviscosity/mPa·s-1200/s100/s50/s1/sControl6.2±0.86.9±0.97.8±1.042.1±5.4Highfatdiet6.7±1.07.5±1.28.6±1.350.1±9.2∗CUMS6.7±1.17.5±0.88.5±0.947.9±5.0∗Highfatdiet+CUMS7.1±0.97.9±1.0∗9.0±1.2∗51.2±6.9∗∗
*P<0.05,**P<0.01vscontrol
2.8各组刺激因素对红细胞变形性/聚集性的影响如Tab 9所示,造模6周后,与正常对照组大鼠比较,除慢性刺激组大鼠的MAXDI、SSS明显降低(P<0.01)外,其余2个模型组大鼠仅有降低趋势,差异无统计学意义。各模型大鼠的MAXD、SS与Control大鼠比较,也仅有上升趋势,差异无统计学意义。
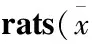
Tab 9 Effects of different stimulation factors on
**P<0.01vscontrol
3 讨论
根据中医传统思维及临床症状所见,血瘀证有不同的中医分型,兼有气虚、气滞、血虚和痰阻等情况。从西医角度看,血瘀证可造成冠心病、高血压、高血脂、肿瘤等严重疾病[2-5]。其中,气滞血瘀证的主要病因是情志异常,血瘀兼有精神活动异常[6]。中医认为,情志异常会引起肝失疏泄,气机不畅,气郁不行,肝气郁结或肝气瘀滞。气为血之帅,气行则血行,气滞则血停,从而导致气滞血瘀之证。故气滞可导致血瘀,血瘀也可引起气滞。
气滞病机与抑郁症病理状态相近。由Katz等[7]提出的慢性温和刺激法是目前较成熟的抑郁情绪造模方法。王婷婷等[8]采用多种慢性刺激联合应用的方法造模4周后,模型大鼠全血高、中、低切黏度与血浆黏度明显升高,纤维蛋白原含量明显升高,成功建立气滞血瘀证动物模型。下丘脑-垂体-肾上腺(HPA)轴的功能亢进与抑郁症关系密切[9]。长期应激导致情志异常,会使HPA轴持续激活,糖皮质激素大量分泌,从而引起神经内分泌系统紊乱[10],其中血清皮质酮(CORT)是其重要指标并且含量呈上升趋势[11]。
据统计,痰浊阻遏和血瘀证约占高脂血症的39.03%,气滞和血瘀证约占高脂血症的24.66%[12]。高脂血症在中医学中多归于痰浊血瘀范畴。嗜食肥甘,化生痰浊,痰浊凝聚注入血脉是高脂血症的关键病机。赵玲等[13]使用高脂饲料喂养大鼠,8周后,全血黏度、血浆黏度均明显升高,成功建立痰浊血瘀模型。气滞血瘀证是血脂异常在中医症型中常见的一类,若脏腑功能失调,脾失健运,肾失气化,肝失疏泄,肺失宣肃,则气血运行不畅,津液不归正化,从而凝聚成痰生脂,阻塞脉道,导致气滞血瘀,脉络痹阻,随之形成高脂血症。传统中医认为心主血脉,心脏功能正常,血液才能在脉中周流不息,为全身提供营养,以维持人体正常的生理功能。其中血脂异常可引起心脏的病变,高脂膳食可影响心脏的重构[14]。Velaqaleti等[15]研究认为总胆固醇水平的升高会使血压升高、冠状动脉硬度增加以及左心室体积与室壁厚度增加。此外,还会造成左心室舒张末期容量和压力的升高[16]。Rubinstein等[17]研究同样认为血清和心肌内胆固醇水平的升高与心肌收缩和舒张功能降低明显相关。
本研究采用高脂饲料饲养和/或慢性不可预知刺激分别复制痰浊/气滞血瘀大鼠模型,在模型建立过程中,我们发现高脂饲料和CUMS干预均可能造成情志损伤,且加重动物血瘀的状态(如血脂、血液黏度增加、心功能下降等),且情志的损伤随应激的适应,具有一定的时间窗。
综上所述,我们发现高脂饲料、慢性不可预知刺激以及两因素的叠加可以模拟出3种不同的血瘀证状态,分别是痰浊、气滞、痰浊兼有气滞。3种模型可见不同的病理表征,分别为:痰浊血瘀动物模型的血脂水平出现异常,可能与大鼠的心功能异常形成有关;气滞血瘀动物模型由于长期的不可预知性刺激,造成情志出现异常,血脂水平下降,红细胞变形性、心功能均发生异常。而复合因素模型由于长期受到应激加上高脂饲料长期喂养,可见痰浊和气滞血瘀症状,不仅情志出现异常,而且血脂水平上升,心功能异常,且心功能异常较其他两个模型明显。
(致谢:本实验是在北京中医药大学完成。感谢北京中医药大学为本实验提供仪器设备的支持,感谢实验过程中给予帮助和辅导的同学、老师们)
[1]颜琳琳, 周利红, 李琦. 中医血瘀证动物模型研究概况[J].中医杂志, 2014, 55(3): 255-8.
[1]Yan L L, Zhou L H, Li Q. Study on animal model of blood stasis syndrome[J].JTraditChinMed, 2014, 55(3): 255-8.
[2]Zhou S F, Liu R X, Luo H W, et al. Effect of Zishen Huoxue Recipe on pathomorphology in coronary heart disease rats with shen deficiency blood stasis syndrome[J].ZhongguoZhongXiYiJieHeZaZhi, 2016, 36(1): 85-9.
[3]He L, Fang M X, Chen L G, et al. Transcriptome analysis of blood stasis syndrome in subjects with hypertension[J].JTraditChinMed, 2016, 36(2): 173-80.
[4]杜宝俊, 涂秀华, 张华健, 等. 降脂通络软胶囊治疗高脂血症气滞血瘀型313例临床观察[J]. 中医杂志, 2013, 54(16): 1398-400.
[4]Du B J, Tu X H, Zhang H J, et al. A clinical observation on Jiangzhi Tongluo Soft Capsules for 313 cases of hyperlipidemia with qi-stagnation blood-stasis pattern[J].JTraditChinMed, 2013, 54(16): 1398-400.
[5]Guan Y S, He Q. Liver cancer: zheng classification of qi stagnation and blood stasis[J].PharmacolPharm, 2014, 5(1): 75-82.
[6]刘燕池, 雷顺群. 中医基础理论[M]. 2版. 北京: 学苑出版社, 2005: 207.
[6]Liu Y C, Lei S Q.BasictheoryoftraditionalChineseMedicine[M]. 2 edition. Beijing: Academic Press, 2005:207.
[7]Katz R J, Roth K A, Carroll B J. Acute and chronic stress effects on open field activity in the rat: implications for a model of depression[J].NeurosciBiobehavRev,1981, 5(2): 247-51.
[8]王婷婷,贾乘,宁天一,等. 两种气滞血瘀证造模方法的比较[J]. 中华中医药学刊, 2013, 31(1): 157-8.
[8]Wang T T, Jia C, Ning T Y, et al.Comparison of the two modeling methonds for Qi Stagnation and blood stasis[J].ChinArchTraditChinMed, 2013, 31(1): 157-8.
[9]Petrowski K, Wintermann G B, Kirschbaum C, et al. A comorbid major depression in patients with panic disorder affects the HPA axis response in the DEX-CRH test[J].JPsychophysiol, 2014, 28(4): 257-64.
[10]陈姣, 楚世峰, 陈乃宏. 糖皮质激素与抑郁发病相关机制研究进展[J]. 中国药理学通报, 2013, 29(11): 1493-5.
[10]Chen J, Chu S F, Chen N H. Research progress in glucocorticoid and pathophysiology of depression[J].ChinPharmacolBull, 2013, 29(11): 1493-5.
[11]陈力, 薛瑞, 于能江, 等. 小补心汤总黄酮对获得性无助小鼠的抗抑郁作用及其对HPA轴功能的影响[J]. 中国药理学通报, 2015, 31(6): 815-21.
[11]Chen L, Xue R, Yu N J, et al. Total flavonoids extracted from xiaobuxin-tang on hyperactivity of hypothalamic-pituitary-adrenal axis in mouse learned helplessness model[J].ChinPharmacolBull, 2015, 31(6): 815-21.
[12]唐大晅, 张敬峰, 曹征, 等. 原发性高脂血症中医证候规律研究[J]. 北京中医药大学学报(中医临床版), 2011, 18(3): 11-3.
[12]Tang D X, Zhag J F, Cao Z, et al. Law of TCM syndrome types of primary hyperlipidemia[J].JBeijingUnivTradChinMed(ClinMed), 2011, 18(3):11-3.
[13]赵玲, 魏海峰, 张丽, 等. 中医痰浊血瘀证候的生物学基础研究[J]. 中华中医药杂志, 2008, 23(8): 680-3.
[13]Zhao L, Wei H F, Zhang L, et al. Study on biological basis of phlegm and blood stasis syndromes in TCM[J].JTraditChinMed, 2008, 23(8): 680-3.
[14]Martins F, Campos D H, Martinez P F, et al. High-fat diet promotes cardiac remodeling in an experimental model of ofbesity[J].ArqBrasCardiol, 2015, 105(5): 479-86.
[15]Velaqaleti R S, Massaro J, Vasan R S, et al. Relations of lipid concentrations to heart failure incidence: the Framingham Heart Study[J].Circulation, 2009, 120(23):2345-51.
[16]Maczewski M, Maczewska J. Hypercholesterolemia exacerbates ventricular remodeling in the rat model of myocardial infarction[J].JCardFail, 2006, 12(5): 399-405.
[17]Rubinstein J, Pelosi A, Vedre A, et al. Hypercholesterolemia and myocardial function evaluated via tissue doppler imaging[J].CardiovascUltrasound, 2009, 7(1): 56.
The establishment and evaluation of three different kinds of animal model of blood stasis syndrome
LIANG Yao-yue, LI Jia-jia, DONG Shi-fen,ZHANG Rong, YUAN Yue-ying, SUN Jian-ning
(DeptofTraditionalChineseMedicinePharmacology,SchoolofChineseMateriaMedica,BeijingUniversityofChineseMedicine,Beijing100102,China)
AimTo establish phlegm and blood stasis, qi-stagnation and blood stasis, phlegm turbid+qi-stagnation and blood stasis model in rats and to study the characteristics of animal models with different blood stasis.MethodsSD rats were randomly divided into normal group, high fat diet group, chronic unpredictable mild stress group(CUMS) and high fat diet+chronic unpredictable mild stress group. Different states of blood stasis rat models were established by corresponding factors for 6 weeks. Indexes of weight, open field behavior, serum lipids and corticosterone were monitored dynamically at the 2nd, 4th, 6th weeks. At the end of the experiment(6th week), the heart function was detected by small animal ultrasound and the left ventricular intubation. The blood rheology indexes were detected by the viscosity tester and red blood cell deformation/aggregation test instrument.ResultsCompared with the normal group, blood stasis could be induced by high fat diet and chronic unpredictable mild stress, introducing the influence of different degree on animal behavior, blood lipids, heart function and blood viscosity. When the two factors were superimposed, the changes of the indexes about blood stasis were the most significant. Performance as: compared with normal control group, a significant reduction was observed in body weight(P<0.01); horizontal movement, vertical movement and movement time were reduced(P<0.01 orP<0.05) at the 2 nd week; at the 2 nd and 4 th week, serum corticosterone was increased(P<0.01 orP<0.05) as well as TG at the 4 th and 6 th week (P<0.01); at the 6 th week, velocity of blood was slowed down(P<0.01); left ventricular anterior wall and posterior wall thickness at end-systolic was increased(P<0.01 orP<0.05); left ventricular diastolic index was increased(P<0.01); the maximum rate of myocardial contraction was decreased(P<0.05); the whole blood viscosity was increased(P<0.01).ConclusionsBlood stasis could be formed by high fat diet and chronic unpredictable mild stress, which has different characteristics. When the two factors are superimposed, the abnormal behavior, blood viscosity, heart function, blood lipid and other indexes of the animal could obviously appear, which can provide the basis for the study of blood stasis syndrome and related drugs.
CUMS; high fat diet; qi-stagnation; phlegm; blood stasis syndrome; animal model
时间:2016-9-22 11:14
http://www.cnki.net/kcms/detail/34.1086.R.20160922.1114.052.html
2016-06-03,
2016-08-16
国家自然科学基金资助项目(No 81503287,81430094);教育部博士点基金项目(No 20130013120002)
梁耀月(1989-),女,硕士,研究方向:中药防治心脑血管疾病,E-mail:lyy2610@163.com;
孙建宁(1952-),女,教授,博士生导师,研究方向:中药防治心脑血管疾病,通讯作者,E-mail:jn_sun@sina.com
10.3969/j.issn.1001-1978.2016.10.026
A
1001-1978(2016)10-1468-06
R-332;R228;R255.7; R363-332
