人参皂苷Rg1通过抗氧化应激保护冈田酸诱导的PC12细胞损伤
2016-11-08王莹莹宋修云陈乃宏
王莹莹,宋修云,王 奇,陈乃宏, 2
(1. 中国医学科学院,药物研究所&神经科学中心,北京 100050; 2. 湖南中医药大学药学院,湖南 长沙 4102083. 广州中医药大学,临床药理研究所,广东 广州 510000)
人参皂苷Rg1通过抗氧化应激保护冈田酸诱导的PC12细胞损伤
王莹莹1,3,宋修云1,王奇3,陈乃宏1, 2
(1. 中国医学科学院,药物研究所&神经科学中心,北京100050; 2. 湖南中医药大学药学院,湖南 长沙 4102083. 广州中医药大学,临床药理研究所,广东 广州510000)
目的体外细胞水平研究人参皂苷Rg1在冈田酸(Okadaic Acid,OKA)诱导的阿尔茨海默病(Alzheimer’s disease, AD)样神经毒性模型中的保护作用,并初步探索其作用机制。方法选用PC12细胞模拟神经元,采用OKA造模的同时给予Rg1(1、5、10 μmol·L-1-),选用褪黑素 (Melatonin, Melat) 10 μmol·L-1-作为阳性对照。分别采用MTT、LDH法检测细胞存活率及死亡率,采用流式细胞术检测细胞凋亡情况,用DCFH-DA荧光探针法检测胞内ROS的堆积,并用试剂盒检测细胞内一系列抗氧化酶活性的变化。结果与对照组相比,OKA组细胞存活率明显降低、死亡率明显增加,细胞早期凋亡数量明显增多(P<0.01);氧化应激相关指标检测发现,OKA组胞内ROS堆积明显增多(P<0.01),总抗氧化能力(ABTS)明显降低(P<0.01),过氧化物酶(Catalase, CAT) (P<0.01),超氧化物歧化酶(Superoxide Dismutase, SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)活性都明显降低(P<0.05),GSSG/GSH比率明显升高(P<0.01)。与模型组相比,Rg1不同剂量组均能显著提高OKA模型中PC12细胞的存活率,降低细胞死亡率,并抑制胞内ROS水平、提高抗氧化酶活力增强抗氧化能力。结论人参皂苷Rg1在OKA诱导的AD样病理模型中可以通过抗氧化应激作用发挥抗细胞死亡、保护神经细胞的作用。
人参皂苷Rg1;冈田酸;阿尔茨海默病;氧化应激;凋亡;神经保护
阿尔茨海默病(Alzheimer’s disease,AD)是一种多发于老年和老年前期的中枢神经系统退行性病变。在临床上,AD 以渐进性记忆障碍、认知功能障碍、人格改变和语言障碍等为主要表现,是一种严重影响老年人社交、工作与生活,给家庭和社会带来沉重负担的疾病[1]。AD发病机制复杂,目前临床常用的抗AD药物只能一定程度延缓AD的发病进程却不能彻底治疗AD,因此开发新的治疗AD的药物迫在眉睫。人参历来被视为百草之王。人参皂苷Rg1是人参的主要活性成分,已有研究发现,人参皂苷Rg1具有抗衰老[2]、抗氧化[3]、改善Tau蛋白以及Aβ神经毒性[4]、改善神经退行性疾病的作用[5]。因此,本实验的研究目的和意义是观察人参皂苷Rg1是否可以在细胞水平通过抗凋亡以及抗氧化途径改善神经毒性,为抗AD新药的研发提供数据支持。
1 材料与方法
1.1材料
1.1.1细胞本实验选用的PC12细胞株(购自ATCC,本实验室长期留用)来源于一种可移植的大鼠嗜铬细胞瘤,是常用的神经细胞株。选用DMEM培养基加5%ES和5%FBS,37℃,5%CO2孵箱为适宜培养条件。
1.1.2药品与试剂人参皂苷Rg1(云南极粹生物科技有限公司提供,纯度≥98%),Melat(Sigma),OKA(伊普瑞斯科技有限公司),LDH细胞毒性检测试剂盒(碧云天,C0016),Annexin V-FITC/PI 细胞凋亡检测试剂盒(BD,556547),活性氧(ROS)测定试剂盒(南京建成,E004),ABTS总抗氧化能力检测试剂盒(碧云天,S0119),过氧化氢酶检测试剂盒(碧云天,S0051),总超氧化物歧化酶(SOD)测定试剂盒(WST-1 法)(南京建成,A001-3),谷胱甘肽过氧化物酶检测试剂盒(碧云天,S0056),GSH和GSSG检测试剂盒(碧云天,S0053),BCA蛋白定量试剂盒(北京普利莱(APPLYGEN)基因技术有限公司,P1511)。1.1.3主要仪器流式细胞仪(BD,FACSCalibur),倒置荧光显微镜(北京锐驰恒业仪器科技有限公司,Nikon Eclipse Ti)。
1.2方法
1.2.1OKA最佳造模时间和浓度的摸索OKA作为实验室常用神经毒性剂,多在体内外用来模拟AD样病变模型[6]。前期研究发现,OKA可以诱导细胞凋亡、氧化应激等多种损伤[7],因此本实验选用OKA模拟AD样病理损伤。选用PC12细胞,每毫升5×104个接种于96孔板中,用DMEM完全培养基将OKA母液(DMSO配制,浓度为30 μmol·L-1-)稀释成15、30、40、50、60、80、120、160 nmol·L-1-后与细胞共孵育36h,MTT法检测细胞生存率。
1.2.2MTT检测细胞生存率前期研究已经证实Melat是一种有效的自由基清除剂,在体内外都具有良好的抗氧化应激的作用,因此本实验选用Melat作为阳性对照[8-9]。实验分为control组、OKA组、OKA+Rg1 0.01 μmol·L-1组、OKA+Rg1 0.1 μmol·L-1组、OKA+Rg1 1 μmol·L-1组、OKA+Rg1 10 μmol·L-1组,阳性药分为OKA+Melat 0.01 μmol·L-1组、OKA+Melat 0.1 μmol·L-1组、OKA+Melat 1 μmol·L-1组、OKA+Melat 10 μmol·L-1组。细胞接种条件不变,接种24 h后给药,药物孵育36 h后MTT法检测细胞生存率。
1.2.3LDH检测细胞死亡率实验选用LDH细胞毒性检测试剂盒,细胞分组不变。药物刺激结束前1 h时,阳性对照组加入150 μL用PBS稀释了10倍的试剂盒提供的LDH释放试剂适当摇晃培养板混匀,然后继续在细胞培养箱中孵育1 h。分别取各孔的上清液120 μL,加入到一新的96孔板中,随即根据试剂盒说明进行测定。
1.2.4流式细胞术检测细胞凋亡实验选用Annexin V-FITC/PI 细胞凋亡检测试剂盒。细胞接种密度为每毫升5×105个,6孔板操作,给药条件不变。药物刺激24 h后,弃掉细胞上清,1×PBS洗1次,0.25%不含EDTA胰酶500 μL消化1 min,后加入1 mL DMEM完全培养基终止消化,收集细胞,3000 r·min-1×5 min离心,弃掉培养基,1×PBS洗1次。每个样品中加入100 μL 1×Binding buffer,轻轻吹打细胞4次。每个样品中加入5 μL Annexin V-FITC,轻轻混匀。随后每个样品中加入5 μL PI轻轻混匀(以上两步需避光操作)。室温反应10~15 min,每个样品中各加入400 μL 1×Binding buffer混匀,筛网过滤细胞,上机检测。
1.2.5DCFH-DA荧光探针标记ROS实验选用活性氧(ROS)测定试剂盒。细胞接种密度为每毫升5×104个,12孔板操作,给药条件不变。根据实验摸索,药物刺激12 h后,37℃1×PBS洗1次,用DMEM无血清培养基1000倍稀释DCFH-DA成10 μmol·L-1后每孔加入500 μL,重新放入孵箱孵育30 min,后取出用37℃ DMEM无血清培养基洗两次。放置于倒置荧光显微镜下观察(10×)。
1.2.6试剂盒检测抗氧化酶活性细胞接种密度为每毫升5×105个,6孔板操作,给药条件不变。药物刺激24 h,用细胞刮直接收集细胞至EP管,1000 r·min-1×10 min离心,弃上清,加入400 μL 1×PBS轻轻重悬,1000 r·min-1×10 min离心,弃上清,加入100 μL 1×PBS超声裂解(间隔10 s,裂解2 s×4次),BCA蛋白定量试剂盒测定蛋白浓度。根据各试剂盒操作说明进行检测和计算。
2 结果
2.1Rg1对OKA模型中PC12细胞生存率的影响首先采用MTT法筛选OKA的最佳造模浓度,结果显示EC50≈30 nmol·L-1,因而实验中采用OKA 30 nmol·L-1作用36 h模拟AD样病理模型,见Fig 1。
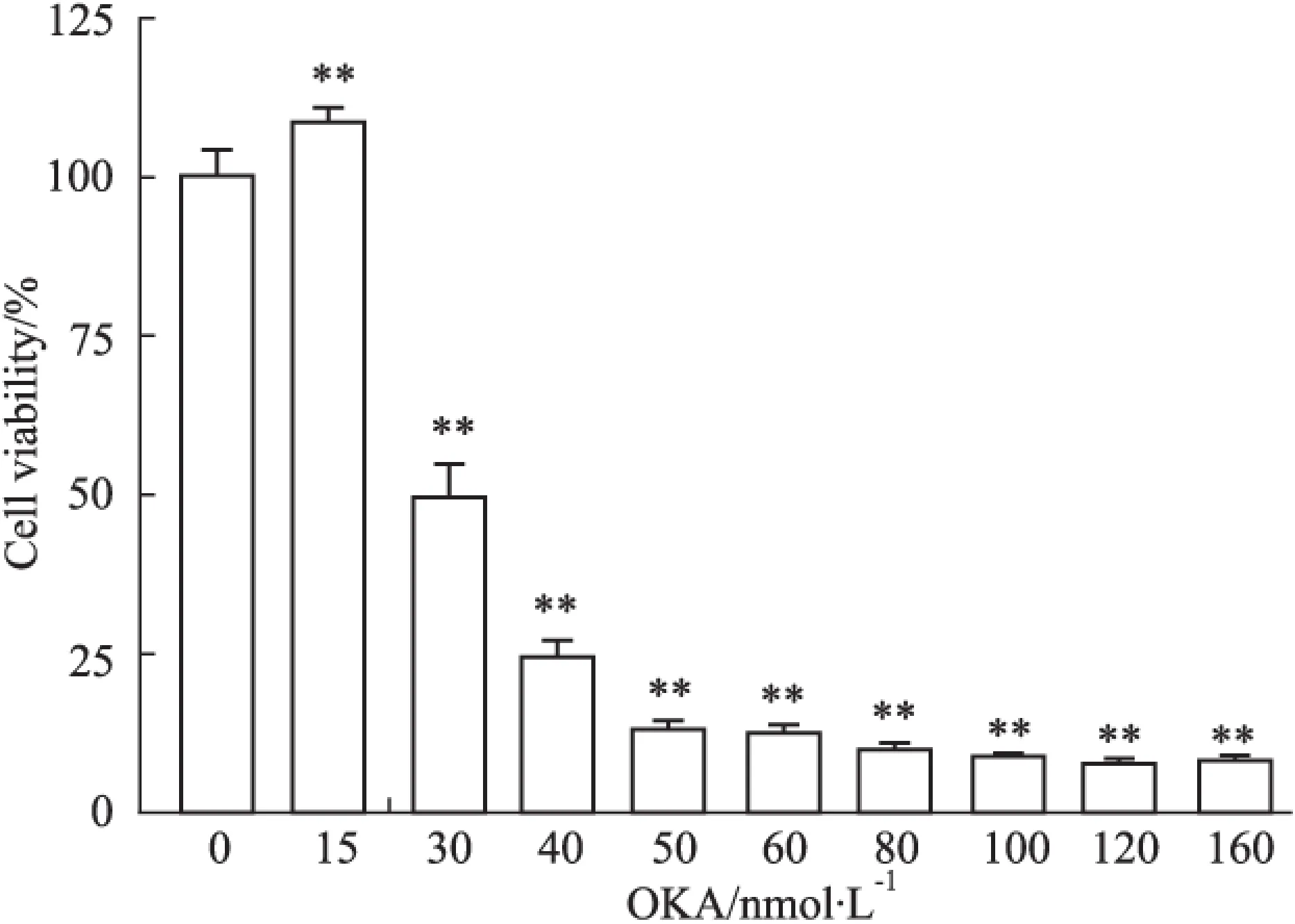
Fig 1 Appropriate concentration selection of ±s)
**P< 0.01vs0 nmol·L-1group.
MTT结果显示(Fig 2A),与Control组相比,OKA造模组细胞生存率明显降低(P<0.01),Rg1不同剂量组均能提高细胞生存率(P<0.05),并且结果呈现剂量依赖性。其中Rg1 10 μmol·L-1组能明显提高PC12细胞的生存率(P<0.01)。LDH释放被看做细胞膜完整性的重要指标,并被广泛用于细胞死亡率检测。本实验LDH结果显示(Fig 2B),与OKA组相比,Rg1高剂量组能明显降低细胞毒性,降低PC12细胞的死亡率(P<0.01)。

Fig 2 Effects of Rg1 on cell viability and
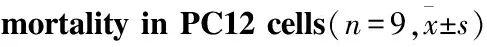
##P<0.01vscontrol;*P<0.05,**P<0.01vsOKA group.
2.2Rg1对OKA诱导PC12细胞凋亡的影响Annexin V-FITC细胞凋亡检测是用FITC标记重组人Annexin V来检测细胞凋亡时出现在细胞膜表面的磷酯酰丝氨酸(phosphatidylserine,PS)的一种细胞凋亡检测法。磷酯酰丝氨酸主要分布在细胞膜内侧,即与细胞质相邻的一侧。在细胞发生凋亡的早期,不同类型的细胞都会把磷酯酰丝氨酸外翻到细胞表面,即细胞膜外侧,Annexin V则选择性结合磷酯酰丝氨酸。流式细胞术检测结果显示(Fig 3A,B),与Control组相比,OKA组早期凋亡细胞明显增多,Rg1 5 μmol·L-1以及10 μmol·L-1组均可以明显减少OKA诱导的PC12细胞早期凋亡数量,且结果呈现剂量依赖性。
2.3Rg1对OKA模型中PC12内ROS堆积的影响本实验所采用的活性氧(Reactive oxygen spe-cies, ROS)检测是一种基于荧光染料DCFH-DA的荧光强度变化,定量检测细胞内活性氧水平的方法。ROS是一类含有氧的活性分子的总称,在生理条件下,ROS通常是有氧呼吸及有氧代谢的天然副产物,在细胞信号转导以及维持细胞稳恒中扮演着重要的角色;而在某些环境刺激下ROS会激烈产生,进而引起细胞内蛋白、细胞器以及DNA等相关生物结构的破坏[10]。DCFH-DA本身没有荧光,但它可以自由穿过细胞膜。进入细胞内后,可以被细胞内的酯酶水解生成DCFH。而DCFH不会通透细胞膜,因此探针很容易被积聚在细胞内。细胞内的活性氧能够氧化无荧光的DCFH生成有荧光的DCF。绿色荧光强度与活性氧的水平成正比。实验结果显示,与Control组相比,OKA组PC12细胞内ROS的堆积明显增多,Rg1的不同剂量组均能明显减少OKA诱导的PC12细胞内ROS的堆积(Fig 4A,B),其中Rg1 10 μmol·L-1效果最佳,且结果呈现剂量依赖性。

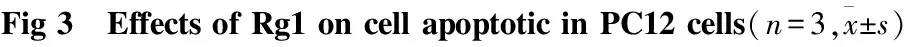
##P<0.01vscontrol;*P<0.05,**P<0.01vsOKA group.


##P<0.01vscontrol;*P<0.05,**P<0.01vsOKA group,scale bar=50μm.
2.4Rg1对OKA模型中PC12内抗氧化酶活性的影响过氧化物酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)是生物体内主要的抗氧化酶,它们各自针对不同的自由基发挥清除作用。如CAT主要作用于过氧化氢,SOD善于清除氧自由基,而GSH-Px则主要清除过氧化物。此外,谷胱甘肽(glutathione, GSH)作为机体内重要的自由基清除剂同样在抗氧化过程中发挥着重要的作用[11]。
ABTS法检测总抗氧化能力实验结果显示(Fig 5A),与Control组相比,OKA组总抗氧化能力明显降低,Rg1的5 μmol·L-1、10 μmol·L-1剂量组的总抗氧化能力均有明显提升。CAT检测结果显示(Fig 5B),与Control组相比,OKA组细胞内CAT活性明显降低,Rg1的不同剂量组均能显著提升PC12细胞中CAT的活性,并且结果呈现剂量依赖性。SOD检测结果显示(Fig 5C),与Control组相比,OKA组细胞内SOD活性明显降低,Rg1高剂量组可以明显提升PC12细胞内SOD活性。GSH-Px检测结果显示(Fig 5D),与Control组相比,OKA组内GSH-Px活性明显降低,Rg1的5 μmol·L-1、10 μmol·L-1剂量组均能提升细胞内GSH-Px的活性,且结果呈现剂量依赖性。GSSG/GSH检测结果显示(Fig 5E),与Control组相比,OKA组GSSG/GSH比率明显升高,Rg1的5 μmol·L-1、10 μmol·L-1剂量组可明显降低PC12细胞内GSSG/GSH比率,且结果呈现剂量依赖性。
3 讨论
AD是一种慢性进行性中枢神经系统退行性疾病。伴随着人口的老龄化,AD的发病率呈现上升的趋势。AD患者脑内关键性病理变化为胆碱能神经元为主的中枢神经细胞大量变性和丢失、Aβ大量沉积为主的老年斑( senileplaques,SP) 以及磷酸化tau 蛋白为主的神经纤维缠结( neurofibrillary tangle,NFT) 的形成,这些病理损伤被认为是AD 的主要特征。
AD 的发病机制复杂多样,由多种因素共同作用导致。其中,氧化应激在AD的发生发展过程中发挥着重要的影响。氧化应激在生理情况下即存在,是机体内不可避免的一种状态。多种有害刺激可以打破氧化应激的平衡状态,促使细胞凋亡甚至导致病理损伤。前期研究发现,活性氧所致的氧化应激是造成细胞凋亡的重要环节[12]。氧化应激通过线粒体、死亡受体、内质网应激等途径介导细胞凋亡;也可能通过激活丝裂原活化蛋白激酶通路、活化核转录因子κB并诱导其表达、激活caspases等途径诱导细胞凋亡[13]。与此同时,机体内以抗氧化系统为主的一系列适应机制保护细胞免于受损伤。例如CAT,主要是通过清除过氧化氢发挥抗氧化作用;SOD是机体内主要的氧自由基清除剂;GSH的结构中含有一个活泼的巯基-SH易被氧化脱氢,这一特异结构便使其成为体内主要的自由基清除剂;GSH-Px则主要通过能催化GSH变为GSSG,使有毒的过氧化物还原成无毒的羟基化合物。
人参皂苷Rg1是传统中药人参的主要活性成分之一,前期本实验室已对Rg1在AD中可能发挥的作用进行了大量研究,结果证实,人参皂苷Rg1可以改善认知功能,提高突触可塑性和神经发生,并且Rg1具有抑制Tau蛋白异常磷酸化,减少神经纤维缠结的功能[4],以上研究结果都证明了Rg1具有改善认知功能障碍,修复神经损伤的作用。

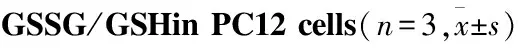
#P<0.05,##P<0.01vscontrol;*P<0.05,**P<0.01vsOKA group
本实验采用OKA在PC12细胞中诱导细胞凋亡和氧化应激损伤,观察人参皂苷Rg1是否可以起到抵抗OKA毒性,修复凋亡和氧化应激损伤,发挥神经保护作用。我们的实验结果表明,人参皂苷Rg1的低、中、高剂量组均能提高OKA模型中细胞的存活率,减少细胞损伤,并且凋亡结果显示Rg1中、高剂量组均可以明显改善OKA诱导的PC12细胞早期凋亡情况。人参皂苷Rg1的低、中、高剂量均能明显减少OKA诱导的细胞内ROS异常堆积的情况,且Rg1 5 μmol·L-1、10 μmol·L-1剂量组总抗氧化能力较OKA组均有明显提升;Rg1的不同剂量组均能明显提升PC12细胞中CAT的活性,并且结果呈现剂量依赖性;Rg1高剂量组可以明显提升PC12细胞内SOD活性;Rg1的5 μmol·L-1、10 μmol·L-1剂量组均能明显提升细胞内的GSH-Px活性,且结果呈现剂量依赖性;Rg1的5 μmol·L-1、10 μmol·L-1剂量组可明显降低PC12细胞内GSSG/GSH比率,且结果呈现剂量依赖性。这其中,人参皂苷Rg1对CAT活性的改善作用尤为明显,提示Rg1主要通过提升CAT活性,清除过氧化氢途径发挥其抗氧化作用。
本实验在细胞水平研究了人参皂苷Rg1在OKA诱导的AD样病理模型中的作用,与前期的研究成果共同验证了Rg1可以改善AD样病理改变[4,14],进一步证明了Rg1具有良好的抗凋亡、抗氧化的神经保护作用,为抗AD新药的研发提供了前期数据支持,对治疗AD具有一定的意义。
(本实验在中国医学科学院药物研究所药理室陈乃宏研究员课题组实验室完成,主要参与人员有:王莹莹,宋修云,王奇,陈乃宏。)
[1]段磊,司继刚,刘萍. 阿尔茨海默病药物治疗研究进展[J]. 河北医药,2015,7:1077-80.
[1]Duan L, Si J P, Liu P. Progress in Drug Therapy for Alzheimer's Disease [J].HebeiMedJ, 2015, 07: 1077-80.
[2]周玥,姜蓉,姚欣,等. 人参皂苷Rg_1在造血干/祖细胞连续移植中抗细胞衰老的作用机制[J]. 中草药,2013,44(21):3172-5.
[2]Zhou Y, Jiang R, Yao X, et al. Mechanism of ginsenoside Rg1 against hematopoietic stem/progenitor cells senescence during serial transplantation[J].ChinTradHerbDrugs,2013,44(21):3172-5.
[3]李成鹏,张梦思,刘俊,等. 人参皂苷Rg_1延缓脑衰老机制研究[J]. 中国中药杂志,2014,22:4442-7.
[3]Li C P, Zhang M C, Liu J, et al. Research of anti-aging mechanism of ginsenoside Rg1 on brain[J].ChinaJChinMaterMed, 2014, 22: 4442-7.
[4]Song X Y, Hu J F, Chu S F, et al. Ginsenoside Rg1 attenuates okadaic acid induced spatial memory impairment by the GSK3β/tau signaling pathway and the Aβ formation prevention in rats[J].EurJPharmacol, 2013,710(1-3):29-38.
[5]李娜. 人参皂苷Rg1治疗神经退行性疾病的研究进展[J]. 中国老年学杂志,2012,32(15):1-5.
[5]Li N.Research progress of ginsenoside Rg1 in the treatment of neurodegenerative diseases[J].ChinJGerontol,2012,32(15):1-5.[6]Kamat P K, Rai S, Swarnkar S,et al. Molecular and cellular mechanism of okadaic acid (OKA)-induced neurotoxicity: a novel tool for Alzheimer's disease therapeutic application[J].MolNeurobiol, 2014,50(3):852-65.
[7]Kamat P K, Nath C. Okadaic acid: a tool to study regulatory mechanisms for neurodegeneration and regeneration in Alzheimer's disease[J].NeuralRegenRes, 2015,10(3):365-7.
[8]Pandi-Perumal S R,BaHammam A S,Brown G M,et al.Melatonin antioxidative defense:therapeutical implications for aging and neurodegenerative processes[J].NeurotoxRes,2013,23(3):267-300.[9]Deng Y, Jiao C, Mi C,et al. Melatonin inhibits manganese-induced motor dysfunction and neuronal loss in mice: involvement of oxidative stress and dopaminergic neurodegeneration[J].MolNeurobiol, 2015, 51(1):68-88.
[10] Navarro-Yepes J, Zavala-Flores L, Anandhan A,et al. Antioxidant gene therapy against neuronal cell death[J].PharmacolTher, 2014,142 (2):206-30.
[11] Lipton P. Ischemic cell death in brain neurons[J].PhysiolRev, 1999, 79(4):1431-568.
[12] Shen L,Zhang J. NMDA receptor and iNOS are involved in the effects of Ginsenoside Rg1 on hippocampal neurogenesis in ischemic gerbils[J].NeurolRes,2007,29(3):270-3.
[13] 廖永晖,汤雨,千年松,等. 氧化应激与细胞凋亡[J]. 新乡医学院学报,2011,28(1):110-3.
[13] Liao Y H,Tang Y,Qian N S, et al. Oxidative stress and apoptosis[J].JXinxiangMedColl, 2011,28(1):110-3.
[14] 黄天文,何饶丽,周梦,等. 人参皂苷Rg1对寡聚肽Aβ_(1-42)增加JNK活性及诱导凋亡的影响[J]. 中国药理学通报,2015,31(1):60-3.
[14] Huang T W, He R L, Zhou M, et al. Effect of ginsenoside Rg1 on JNK and oligomeric Aβ1-42induced apoptosis[J].ChinPharmacolBull, 2015,31(1):60-3.
The protective effects of Ginsenosides Rg1 in AD-like pathological model induced by okadaic acid
WANG Ying-ying1,3,SONG Xiu-yun1,WANG Qi3,CHEN Nai-hong1,2
(1.StateKeyLaboratoryofBioactiveSubstancesandFunctionsofNaturalMedicines,InstituteofMateriaMedica&NeuroscienceCenter,ChineseAcademyofMedicalSciencesandPekingUnionMedicalCollege,Beijing100050,China; 2.HunanUniversityofChineseMedicine,Changsha410208,China;3.GuangzhouUniversityofChineseMedicine,InstituteofClinicalPharmacology,Guangzhou510000,China)
AimTo the investigate the protective effect of ginsenoside Rg1 in Alzheimer's disease (AD) -like neurotoxicity model induced by okadaic acid (OKA) in the cellular level, and explore the mecha-nism preliminarily. MethodsThe PC12 cells model, simulate neurons, induced by OKA was given Rg1 (1,5,10 μmol·L-1), and melatonin (Melat) 10 μmol·L-1was given as a positive control. MTT and LDH were carried out to assess the cell viability and mortality. To detect the accumulation of ROS, the DCFH-DA fluorescent probe was conducted. And to assess the change of the activity of a variety of antioxidant enzymes, various kits were used, including ABTS、CAT、SOD、GSH-Px and GSSG/GSH. ResultsCompared with the control group, the survival rate of PC12 cell in OKA group reduces significantly, the mortality rate was increased significantly , the number of early apoptotic cells was increased significantly (P<0.01). Oxidative stress-related indicators show that ROS accumulation within the cells of OKA group increases significantly (P<0.01), and the total antioxidant capacity (ABTS) decreases significantly (P<0.01), the activity of peroxidase (Catalase, CAT) (P<0.01), glutathione peroxidase (glutathione peroxidase, GSH-Px) and superoxide dismutase (superoxide dismutase, SOD) decreased significantly (P<0.05), the rate of GSSG/GSH increased significantly (P<0.01). Compared with the model group, the different doses of Rg1 could improve the survival rate and decrease the mortality rate of PC12 cell significantly in the group of OKA, and could decrease the level of the accumulation of ROS, improve the activity of antioxidant enzymes. ConclusionGinsenoside Rg1 can decrease PC12 cell apoptosis by exerting antioxidant effects, and protect the nerve cells in AD-like pathology model induced by OKA.
Ginsenosides Rg1; okadaic acid; Alzheimer’s disease; oxidative stress; apoptosis; neuroprotection
时间:2016-9-22 11:14
http://www.cnki.net/kcms/detail/34.1086.R.20160922.1114.016.html
2016-08-10,
2016-09-10
国家自然科学基金项目(81274122、81373997、81273629、21272278、U1402221、81573640、81573636、81260650);北京市自然科学基金项目(7131013、7142115);湖南省重点研发计划项目(2015SK2029-1);湖南省教育厅高校科研经费开放基金项目(15K091);新药作用机制研究与药效评价北京市重点实验室资助项目(BZ0150)
王莹莹(1992-),女,硕士生;E-mail:wangyingyingwangye@163.com;
陈乃宏(1961-),男,博士后,研究员,研究方向:神经药理学和神经分子生物学,通讯作者,Tel:010-63165177,E-mail:chennh@imm.ac.cn;
10.3969/j.issn.1001-1978.2016.10.008
A
1001-1978(2016)10-1364-07
R 284.1; R 329.24;R329.25;R745.7;R977.3
王奇(1963-),男,研究员,研究方向:临床流行病学/DME应用研究以及中药临床试验、老年性痴呆临床与实验研究,E-mail:wqitcm@qq.com
