晚期糖基化终末产物对UVA照射皮肤成纤维细胞组织蛋白酶D表达及其活性的影响
2016-11-06许新雅许庆芳郑跃黄云芬赖维龚子鉴陆春
许新雅 许庆芳 郑跃 黄云芬 赖维 龚子鉴 陆春
510630广州,中山大学附属第三医院皮肤病与性病科
晚期糖基化终末产物对UVA照射皮肤成纤维细胞组织蛋白酶D表达及其活性的影响
许新雅 许庆芳 郑跃 黄云芬 赖维 龚子鉴 陆春
510630广州,中山大学附属第三医院皮肤病与性病科
目的研究晚期糖基化终末产物(AGE)对长波紫外线(UVA)照射皮肤成纤维细胞组织蛋白酶D(CatD)表达和活性的影响。方法原代培养来自儿童包皮成纤维细胞。CCK⁃8法筛选对成纤维细胞无细胞毒性的AGE⁃牛血清白蛋白(BSA)浓度。分别以50、100、200 mg/L AGE⁃BSA孵育细胞24 h,以未处理细胞作为对照组,采用RT⁃PCR、Western印迹及荧光法检测AGE⁃BSA对细胞CatD表达和活性影响。将部分成纤维细胞分为6组,即对照组(正常皮肤成纤维细胞,不接受任何处理)、AGE⁃BSA组、BSA组、UVA组、UVA⁃AGE⁃BSA组、UVA⁃BSA组。AGE⁃BSA组加入最大无细胞毒性浓度AGE⁃BSA孵育24 h,BSA组加入相同浓度BSA孵育24 h,后3组除分别接受上述处理外再接受10 J/cm2UVA照射。处理结束后,收集细胞mRNA和蛋白,采用RT⁃PCR、Western印迹及荧光法检测细胞CatD表达和活性。结果50、100、200 mg/L AGE⁃BSA对皮肤成纤维细胞增殖活性无显著影响。50 mg/L组、100 mg/L组、200 mg/L组细胞CatD mRNA水平分别为0.267±0.007、0.348±0.007、0.418±0.006,CatD蛋白水平分别为1.403±0.181、2.233±0.090、2.477±0.111,CatD活性分别为1.760±0.080、2.330±0.060、2.890±0.080,较相应对照组CatD mRNA(0.161±0.006)、CatD蛋白(0.903±0.200)以及CatD活性水平(1.100±0.090)均显著升高,均P<0.05。AGE⁃BSA呈剂量依赖性地刺激细胞CatD表达和活性。对照组、UVA组和UVA⁃AGE⁃BSA组细胞中CatD mRNA表达水平分别为0.155±0.005、0.480±0.005、0.394±0.008,蛋白表达水平分别为0.920±0.235、2.583±0.199、2.070±0.125,CatD活性分别为1.110±0.040、2.970±0.110、2.560±0.060;UVA组CatD mRNA水平、蛋白表达水平、酶活性均明显高于对照组(P<0.05),但UVA⁃AGE⁃BSA组3种指标水平均显著低于UVA组(P<0.05)。结论AGE可升高未接受UVA照射的皮肤成纤维细胞CatD表达和活性,但AGE却抑制UVA照射上调的CatD表达和酶活性。
成纤维细胞;糖基化终产物,高级;紫外线;组织蛋白酶D
晚期糖基化终末产物(advanced glycation end products,AGE)是指蛋白质、脂类、核酸等大分子物质的游离氨基与还原糖发生缓慢非酶糖化反应,最终形成结构稳定、不易降解的大分子棕色产物。AGE与衰老、氧化应激密切相关[1]。新近研究发现,AGE在光老化皮肤中堆积,并在光老化中起重要作用[2]。组织蛋白酶D(cathepsin D,CatD)是降解AGE的重要蛋白酶之一[3],在光老化皮肤及皮肤成纤维细胞中表达降低[4],机制未明。AGE是否影响光损伤皮肤成纤维细胞CatD表达和活性,目前还不清楚。我们对比检测AGE⁃牛血清白蛋白(BSA)对UVA照射和未照射的皮肤成纤维细胞CatD表达和活性的影响,探讨CatD在光老化皮肤AGE堆积中的作用机制。
材料与方法
一、实验材料
1.皮肤成纤维细胞:分离自中山大学附属第三医院泌尿外科健康儿童包皮环切术后的包皮组织。
2.试剂和仪器:DMEM(Dulbecco′s modified eagle′s media)高糖培养基、胰酶、胎牛血清、磷酸盐缓冲液(PBS)、青霉素和链霉素均产自美国Gibco公司;BSA、AGE⁃BSA及CatD活性检测试剂盒产自美国Biovision公司;一抗兔抗人CatD⁃IgG抗体、内参兔抗人内参基因(GAPDH)多克隆IgG抗体、二抗辣根过氧化物酶(HRP)标记羊抗兔IgG抗体均产自美国Cell Signaling Technology公司。BCA蛋白定量试剂盒产自美国Pierce公司。ECL显色试剂盒产自美国Millipore公司,预染蛋白标记物(Marker)产自加拿大MBI Fermentas公司。总RNA提取试剂Trizol产自美国Invitrogen公司。Primescript RT预混液、逆转录试剂盒和Sybrpremix ex taqTM试剂盒产自日本Takara公司。UVA紫外线辐射仪(Sigma ss⁃03A)、UVA辐照计(Sigma ss⁃03A)两者均产自上海希格玛高科技有限公司。酶联免疫检测仪产自美国Biotek公司;CO2细胞培养箱产自美国Thermo Scientific公司;普通光学显微镜产自日本Nikon公司;荧光倒置显微镜产自德国Leica公司;ABI Prism 7500型实时荧光定量PCR仪产自美国ABI公司;多功能酶标仪SpectraMax M5产自美国Molecular Devices公司。
二、方法
1.原代皮肤成纤维细胞培养:取儿童包皮(本研究经过中山大学附属第三医院伦理委员会批准且患者及家属已签署知情同意书),参照文献[5]分离培养皮肤成纤维细胞,第3代细胞冻存。细胞复苏后培养10代以内的细胞行后续实验。
2.CCK⁃8法检测AGE⁃BSA对皮肤成纤维细胞增殖活性的影响:将成纤维细胞按5×103细胞/孔接种于96孔培养板中,每孔含100 μl细胞培养液,每组各设3个复孔。37℃孵育24 h后分别加入50、100、200、400 mg/L AGE⁃BSA,对照组加入等量不含AGE的培养基。继续培养24 h后,每孔加入10 μl CCK⁃8试剂,37℃孵育4 h,在酶联免疫检测仪上测定450 nm处吸光度(A值,以空白试剂孔调零)。
3.不同浓度AGE⁃BSA对皮肤成纤维细胞CatD表达和活性的影响:实验分为无处理对照组、50 mg/L AGE⁃BSA组、100 mg/L AGE⁃BSA组、200 mg/L AGE⁃BSA组。接种1×106成纤维细胞于直径6 cm细胞培养皿,24 h后加入不同浓度AGE⁃BSA,孵育24 h后提取各组细胞RNA和蛋白。RT⁃PCR、Western印迹及荧光法检测各组细胞CatD表达和活性,实验重复3次。
4.AGE⁃BSA对UVA照射皮肤成纤维细胞CatD表达和活性的影响:实验分为6组,即对照组(正常皮肤成纤维细胞)、AGE⁃BSA组、BSA组、UVA组、UVA⁃AGE⁃BSA组、UVA⁃BSA组,AGE⁃BSA组加入最大无细胞毒性浓度AGE⁃BSA孵育24 h,BSA组加入相同浓度BSA孵育24 h,后3组除分别接受上述处理外再接受10 J/cm2UVA照射。根据CCK⁃8法选择一无细胞毒性最大AGE⁃BSA浓度作为本实验浓度。将3~10代成纤维细胞按每皿1×106接种于直径为6 cm的细胞培养皿,24 h后向BSA组、UVA⁃BSA组、AGE⁃BSA组和UVA⁃AGE⁃BSA组培养皿中分别加入相同浓度BSA和AGE⁃BSA,孵育24 h。将细胞从培养箱取出,吸弃培养液,PBS洗2次后,每皿加入等量薄层PBS,并分别加入相同浓度BSA和AGE⁃BSA。培养皿置于UVA紫外线辐射仪下,UVA照射剂量为10 J/cm2。无照射细胞置于超净台避光。照射后细胞放置半小时,吸弃PBS溶液,加入新鲜培养液(含或不含BSA及AGE⁃BSA),置于培养箱中培养24 h后,提取各组细胞RNA和蛋白。RT⁃PCR、Western印迹及底物荧光法检测各组细胞CatD表达和活性,实验重复3次。
5.RT⁃PCR检测皮肤成纤维细胞CatD mRNA表达:取各组细胞,按照Trizol试剂盒说明提取总RNA。按试剂盒说明书配制逆转录反应体系,总体积 20 μl,37 ℃下反转录 15 min,85 ℃ 5 s,获得cDNA,置-20℃冰箱中保存。采用染料法(SYBR GreenⅠ)进行相对定量分析。PCR反应体系共20 μl,包括 SYBR®Premix Ex TaqTMⅡ 10 μl,ROXDyeⅡ0.4 μl,双蒸水 6 μl,上游和下 游引物各 0.8 μl,cDNA 2 μl。两步法实时定量PCR:95 ℃ 5 s,1个循环;95℃ 5 s,60℃ 30 s,40个循环。CatD上游引物序列5′⁃AGAAGCTGGTGGACCAGAACATC⁃3′,下游引物序列5′⁃TCCAGGTGGACCTGCCAGTA⁃3′,扩增片段长度163 bp。GAPDH上游引物序列5′⁃GCACCGTCAAGGCTGAGAAC⁃3′,下游引物序列5′⁃TGGTGAAGACGCCAGTGGA⁃3′,扩增片段长度138 bp。在实时荧光定量PCR仪上读取扩增曲线、熔解曲线和Ct值。实验重复3次,结果取平均值,用2⁃ΔΔCt法计算目的基因和内参基因相对表达值。
6.Western印迹检测皮肤成纤维细胞CatD蛋白表达变化:提取各组细胞总蛋白,-80℃保存。二喹啉甲酸(BCA)法蛋白定量。总蛋白经10%十二烷基硫酸钠⁃聚丙烯凝胶电泳(SDS⁃PAGE)分离后,电转移到聚偏氟乙烯(PVDF)膜上。分别加入一抗兔抗人CatD⁃IgG(浓度1∶1 000),内参兔抗人GAPDH IgG(浓度1∶4 000),4℃孵育过夜,三羟甲基氨基甲烷缓冲氯化钠溶液+吐温(TBST)溶液洗膜,加入HRP标记羊抗兔IgG(浓度1∶1 000)37 ℃ 孵育1 h,TBST液洗膜3次。ECL显色、压片、定影及显影。所有实验重复3次。
7.皮肤成纤维细胞CatD活性检测:使用CatD活性检测试剂盒完成。提取各组细胞总蛋白,BCA法蛋白定量。取50 μl细胞裂解上清液加入50 μl反应缓冲液,混合后加入7⁃甲氧基⁃4⁃乙酰基香豆素(MCA)标记的CatD酶底物,使其终浓度为200 μmol/L,37℃孵育1.5 h。设置多功能酶标仪在激发光328 nm,吸收光460 nm模式下检测游离MCA水平。酶标仪检测的每组细胞的荧光强度值与其蛋白浓度的比值即为该组细胞CatD相对活性。所有实验重复3次。
8.统计学处理:数据均以x±s表示,采用SPSS 13.0统计软件分析。多组间比较采用单因素方差分析(ANOVA),两两多重比较采用LSD⁃t检验,P<0.05表示差异有统计学意义。
结 果
一、AGE⁃BSA对皮肤成纤维细胞增殖活性的影响
50、100、200、400 mg/L AGE⁃BSA孵育细胞24 h后,细胞增殖活性分别为对照组的98.4%、95.4%、92.9%、84.8%,400 mg/L AGE⁃BSA使细胞活性明显下降(F=186.13,P< 0.05)。因此,本实验选用50、100、200 mg/L作为AGE⁃BSA后续实验浓度。
二、AGE⁃BSA对皮肤成纤维细胞CatD表达及其活性的影响
见图1、表1。50、100、200 mg/L AGE⁃BSA分别孵育成纤维细胞24 h后,细胞CatD mRNA和蛋白表达以及CatD活性均较相应对照组显著升高(均P<0.05),且随AGE⁃BSA浓度增加而升高。对照组、50 mg/L组、100 mg/L组、200 mg/L组间两两比较,上述3个指标差异均有统计学意义(均P<0.05)。AGE⁃BSA呈剂量依赖性地刺激皮肤成纤维细胞CatD表达和活性。
三、AGE⁃BSA对UVA照射皮肤成纤维细胞CatD表达和活性的影响
见图2、表2。对照组、BSA组、AGE⁃BSA组、UVA组、UVA⁃BSA组和UVA⁃AGE⁃BSA组间CatD 蛋白、CatD mRNA和CatD活性差异均有统计学意义(P<0.05)。LSD⁃t检验发现,UVA组和UVA⁃BSA组CatD mRNA表达明显高于其他组(P<0.05);UVA⁃AGE⁃BSA组明显低于UVA组(P<0.05),但仍显著高于对照组(P<0.05);对照组与BSA组间、UVA组与UVA⁃BSA组间、AGE⁃BSA组与UVA组间差异均无统计学意义(P>0.05)。CatD蛋白表达、活性统计比较结果与CatD mRNA表达一致。
讨 论
AGE主要累及更新率缓慢、富含赖氨酸的蛋白质。人皮肤胶原蛋白、弹性蛋白代谢缓慢,并含较多赖氨酸及羟赖氨酸,它们是皮肤发生非酶糖化反应的主要蛋白。非酶糖化反应是一缓慢、漫长过程,然而紫外线可加速其反应[6]。Jeanmaire等[6]通过免疫组化发现,AGE在曝光部位皮肤及光老化皮肤明显多于非曝光部位。AGE不仅通过与蛋白质、脂类、核酸等大分子物质交联、结合直接破坏该大分子物质的结构和功能,还通过与细胞表面特异性受体结合,引发生物学效应[7]。现有研究揭示,AGE主要通过以下机制在光老化中起重要作用:①促进活性氧族ROS生成,抑制超氧化歧化活性[8];②促进角质形成细胞、成纤维细胞凋亡:增加紫外线光毒性,通过上调ROS损伤角质形成细胞、成纤维细胞,并促进细胞凋亡[9];③导致基质金属蛋白酶系统失衡[10];④使胶原纤维变性[2];⑤使弹性纤维变性,抑制弹性蛋白酶降解[11]。

图1 不同浓度AGE⁃BSA对皮肤成纤维细胞CatD蛋白表达的影响 1:对照组;2:50 mg/L AGE⁃BSA组;3:100 mg/L AGE⁃BSA组;4:200 mg/L AGE⁃BSA组。CatD:组织蛋白酶D;GAPDH:3⁃磷酸甘油醛脱氢酶;AGE⁃BSA:晚期糖基化终末产物⁃牛血清白蛋白

表1 不同浓度AGE⁃BSA对皮肤成纤维细胞CatD表达和活性的影响(x±s)
AGE在光老化皮肤中的堆积机制目前还不清楚。AGE结构稳定,不易被降解。既往研究认为,AGE主要通过单核巨噬细胞吞噬作用经肾脏清除。新近发现,溶酶体内CatD具很强的降解AGE的功能,在机体清除AGE中起重要作用[3]。CatD属于天冬氨酸组织蛋白酶,参与调控皮肤角化、屏障功能及皮肤颜色等[12]。我们的前期研究发现,无论是光老化成纤维细胞还是人体光老化皮肤,CatD基因和蛋白表达均降低[4]。CatD表达下调很可能使其活性降低,从而影响AGE降解,进而促进AGE在光老化皮肤中堆积。CatD表达如何在光老化皮肤及皮肤成纤维细胞中降低,光老化皮肤中堆积的AGE是否影响CatD表达,目前仍不清楚。研究已揭示,AGE会影响皮肤成纤维细胞基质金属蛋白酶表达,我们推测AGE也很可能影响CatD表达。我们发现,AGE⁃BSA呈剂量依赖性刺激皮肤成纤维细胞CatD表达和提高其活性,表明成纤维细胞可能通过上调CatD表达和活性增强机体对AGE降解。Grimm等[13]也报道,AGE⁃BSA上调RAW 264.7细胞 CatD表达和活性。皮肤成纤维细胞膜表面有AGE受体表达[14],AGE⁃BSA是否通过与AGE受体结合上调成纤维细胞CatD表达和活性,有待进一步研究。
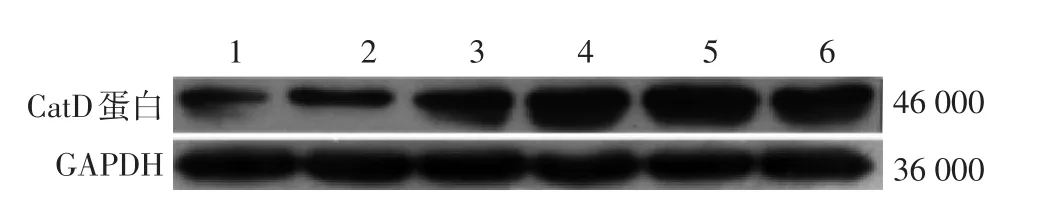
图2 AGE⁃BSA对10 J/cm2UVA照射的皮肤成纤维细胞CatD蛋白表达的影响 1:对照组;2:BSA组;3:AGE⁃BSA组;4:UVA组;5:UVA⁃BSA 组;6:UVA⁃AGE⁃BSA 组。CatD:组织蛋白酶 D;GAPDH:3⁃磷酸甘油醛脱氢酶;AGE⁃BSA:晚期糖基化终末产物⁃牛血清白蛋白

表2AGE⁃BSA对UVA照射的皮肤成纤维细胞CatD表达和活性的影响
Wondrak等[9]发现,AGE通过促进UVA照射成纤维细胞ROS生成增加UVA光毒性。所以,我们以AGE⁃BSA孵育细胞,再以UVA照射,研究AGE⁃BSA对UVA照射成纤维细胞CatD表达和活性影响。在UVA照射细胞过程中,按照Wondrak等[9]的方法,于PBS中加入AGE⁃BSA,并且照射后放置半小时才更换新鲜培养液,以保证AGE⁃BSA光毒性作用于细胞。本实验发现,UVA⁃AGE⁃BSA组细胞CatD表达和活性明显低于UVA组,而UVA组CatD表达和活性显著高于对照组,提示急性UVA照射上调成纤维细胞CatD表达和活性,但是AGE⁃BSA却抑制UVA上调的CatD表达和活性。本研究设立了BSA组,以排除BSA对细胞CatD表达和活性影响。结果显示,CatD表达和活性在对照组和BSA组之间、UVA组和UVA⁃BSA组之间差异无统计学意义,从而排除了BSA对细胞的作用。我们通过建立体外急性UVA光损伤细胞模型发现,AGE⁃BSA可抑制UVA上调CatD表达和活性。另一方面,UVA⁃AGE⁃BSA组与AGE⁃BSA组间CatD表达和活性差异有显著性,且均高于对照组,提示AGE⁃BSA可以促进皮肤成纤维细胞CatD表达上调和活性增强,表明成纤维细胞可能通过上调CatD表达和活性增强机体对AGE降解。然而,在光老化过程中,皮肤长期暴露于UVA,逐渐堆积的AGE进一步抑制成纤维细胞CatD表达和活性,最终导致CatD在光老化皮肤成纤维细胞中表达和活性低于年轻正常成纤维细胞。CatD表达和活性的降低,减少了机体对AGE的降解清除,加速了AGE在光老化皮肤的堆积。AGE堆积又进一步降低CatD表达和活性,从而形成恶性循环并在光老化中起作用。
AGE可促进UVA照射成纤维细胞ROS生成,ROS升高又可激活细胞促丝裂原活化蛋白激酶(MAPK)信号通路及核因子(NF)⁃κB信号通路[15]。AGE⁃BSA抑制UVA照射成纤维细胞CatD表达及活性机制是否与ROS下调细胞膜RAGE表达,干扰AGE⁃BSA与RAGE结合,抑或AGE⁃BSA与UVA共同激活一些细胞信号通路有关,尚未深入研究,故AGE⁃BSA如何导致UVA照射成纤维细胞CatD表达及活性降低及其具体机制,尚需进一步研究。
[1]Gkogkolou P,Böhm M.Advanced glycation end products:key players in skin aging?[J].Dermatoendocrinol,2012,4(3):259⁃270.DOI:10.4161/derm.22028.
[2]Pageon H,Bakala H,Monnier VM,et al.Collagen glycation triggers the formation of aged skinin vitro[J].Eur J Dermatol,2007,17(1):12⁃20.DOI:10.1684/ejd.2007.0102.
[3] Grimm S,Ernst L,Grötzinger N,et al.Cathepsin D is one of the major enzymes involved in intracellular degradation of AGE⁃modified proteins[J].Free Radic Res,2010,44(9):1013⁃1026.DOI:10.3109/10715762.2010.495127.
[4]Zheng Y,Lai W,Wan M,et al.Expression of cathepsins in human skin photoaging[J].Skin Pharmacol Physiol,2011,24(1):10⁃21.DOI:10.1159/000314725.
[5]许庆芳,侯巍,刘晨,等.UVA照射对皮肤成纤维细胞组织蛋白酶K表达的影响[J].中华皮肤科杂志,2013,46(9):652⁃655.DOI:10.3760/cma.j.issn.0412⁃4030.2013.09.013.Xu QF,Hou W,Liu C,et al.Effects of ultraviolet A irradiation on the expression of cathepsin K in human dermal fibroblasts[J].Chin J Dermatol,2013,46(9):652 ⁃655.DOI:10.3760/cma.j.issn.0412⁃4030.2013.09.013.
[6]Jeanmaire C,Danoux L,Pauly G.Glycation during human dermal intrinsic and actinic ageing:anin vivoandin vitromodel study[J].Br J Dermatol,2001,145(1):10⁃18.
[7]Höhn A,König J,Grune T.Protein oxidation in aging and the removal of oxidized proteins[J].J Proteomics,2013,92:132⁃159.DOI:10.1016/j.jprot.2013.01.004.
[8]Yim MB,Yim HS,Lee C,et al.Protein glycation:creation of catalytic sites for free radical generation[J].Ann N Y Acad Sci,2001,928:48⁃53.
[9]Wondrak GT,Roberts MJ,Jacobson MK,et al.Photosensitized growth inhibition of cultured human skin cells:mechanism and suppression of oxidative stress from solar irradiation of glycated proteins[J].J Invest Dermatol,2002,119(2):489 ⁃498.DOI:10.1046/j.1523⁃1747.2002.01788.x.
[10]Molinari J,Ruszova E,Velebny V,et al.Effect of advanced glycation endproducts on gene expression profiles of human dermal fibroblasts[J].Biogerontology,2008,9(3):177⁃182.DOI:10.1007/s10522⁃008⁃9129⁃7.
[11]Yoshinaga E,Kawada A,Ono K,et al.N(ɛ)⁃(carboxymethyl)lysine modification of elastin alters its biological properties:implications for the accumulation of abnormal elastic fibers in actinic elastosis[J].J Invest Dermatol,2012,132(2):315 ⁃323.DOI:10.1038/jid.2011.298.
[12]Zheng Y,Chen H,Lai W,et al.Cathepsin D repairing role in photodamaged skin barrier[J].Skin Pharmacol Physiol,2015,28(2):97⁃102.DOI:10.1159/000363248.
[13]Grimm S,Horlacher M,Catalgol B,et al.Cathepsins D and L reduce the toxicity of advanced glycation end products[J].Free Radic Biol Med,2012,52(6):1011 ⁃1023.DOI:10.1016/j.freeradbiomed.2011.12.021.
[14]Lohwasser C,Neureiter D,Weigle B,et al.The receptor for advanced glycation end products is highly expressed in the skin and upregulated by advanced glycation end products and tumor necrosis factor⁃alpha[J].J Invest Dermatol,2006,126(2):291⁃299.DOI:10.1038/sj.jid.5700070.
[15]许庆芳,侯巍,郑跃,等.MAPK信号通路调控长波紫外线诱导的皮肤成纤维细胞组织蛋白酶K表达[J].中华皮肤科杂志,2014,47(8):543⁃547.DOI:10.3760/cma.j.issn.0412⁃4030.2014.08.003.Xu QF,Hou W,Zhen Y,et al.MAPK pathway regulates ultraviolet A⁃induced cathepsin K expression in human dermal fibroblasts[J].Chin J Dermatol,2014,47(8):543 ⁃547.DOI:10.3760/cma.j.issn.0412⁃4030.2014.08.003.
Effects of advanced glycation end products on the expressions and activity of cathepsin D in ultraviolet A⁃irradiated human dermal fibroblasts
Xu Xinya,Xu Qingfang,Zheng Yue,Huang Yunfen,Lai Wei,Gong Zijian,Lu Chun
Department of Dermatology and Venereology,Third Affiliated Hospital,Sun Yat⁃sen University,Guangzhou 510630,China
ObjectiveTo investigate the effects of advanced glycation end products(AGE)on the expressions and activity of cathepsin D(CatD)in ultraviolet A(UVA)⁃irradiated human dermal fibroblasts.MethodsHuman dermal fibroblasts were isolated and harvested from the circumcised foreskin of children,and subjected to a primary culture.CCK⁃8 assay was performed to screen non⁃cytotoxic concentrations of AGE⁃bovine serum albumin(BSA).Some fibroblasts were incubated with 50,100 and 300 mg/L AGE⁃BSA separately for 24 hours,with untreated cells as the control group.Then,reverse transcription(RT)⁃PCR,Western⁃blot analysis and a fluorimetric assay were performed to measure the mRNA and protein expressions as well as activity of CatD,respectively.Some fibroblasts were classified into six groups:control group receiving no treatment,AGE⁃BSA group and BSA group treated with the highest non⁃cytotoxic concentration of AGE⁃BSA and the same concentration of BSA respectively for 24 hours,UVA group irradiated by 10 J/cm2UVA,UVA⁃AGE⁃BSA group and UVA⁃BSA group treated with AGE⁃BSA and BSA at the above non⁃cytotoxic concentration respectively for 24 hours both before and after UVA radiation at 10 J/cm2.After the treatments,RT⁃PCR,Western⁃blot analysis and a fluorimetric assay were conducted to detect mRNA and protein expressions and activity of CatD respectively.ResultsAGE⁃BSA of 50-200 mg/L exhibited no obvious influence on cellular proliferation of fibroblasts.The fibroblasts incubated with AGE⁃BSA of 50,100 and 200 mg/L showed a significant increase in the mRNA expression(0.267±0.007,0.348±0.007,and 0.418±0.006 respectively),protein expression(1.403±0.181,2.233±0.090 and 2.477±0.111 respectively),and activity(1.760±0.080,2.330±0.060 and 2.890±0.080 respectively)of CatD compared with the control group(mRNA:0.161± 0.006;protein:0.903± 0.200;activity:1.100 ± 0.090,allP< 0.05).AGE⁃BSA increased CatD expressions and activity in a dose⁃dependent manner.The mRNA and protein expressions as well as activity of CatD were significantly higher in the UVA group than in the control group(mRNA expression:0.480±0.005vs.0.155±0.005;protein expression:2.583±0.199vs.0.920±0.235;activity:2.970 ± 0.110vs.1.110 ± 0.040,allP< 0.05),but significantly lower in the UVA⁃AGE⁃BSA group than in the UVA group(mRNA expression:0.394±0.008vs.0.480±0.005;protein expression:2.070±0.125vs.2.583±0.199;activity:2.560±0.060vs.2.970±0.110,allP<0.05).ConclusionAGEs could increase CatD expressions and activity in human dermal fibroblasts not receiving UVA irradiation,but inhibit their increase in UVA⁃induced human dermal fibroblasts.
Fibroblasts;Glycosylation end products,advanced;Ultraviolet rays;Cathepsin D
Xu Qingfang,Email:xqf69@163.com
许庆芳,Email:xqf69@163.com
10.3760/cma.j.issn.0412⁃4030.2016.08.013
国家自然科学基金(81201241);广东省第一批产业技术研究与开发资金计划项目(2012B031800057)
Fund programs:National Natural Science Foundation of China(81201241);The First Batch of Planning Program for Industrial Technology Research and Development of Guangdong Province(2012B031800057)
2015⁃11⁃02)
(本文编辑:尚淑贤)
