谷氨酸受体拮抗剂对恶性黑素瘤WM451LU细胞增殖、迁移的调控作用及相关机制研究
2016-11-06李丽丽陈显峰黄琦涛潘南楠徐文英谢治
李丽丽 陈显峰 黄琦涛 潘南楠 徐文英 谢治
530021南宁,广西壮族自治区人民医院皮肤科(李丽丽、黄琦涛、潘南楠、徐文英、谢治);广西医科大学第一附属医院重症医学科(陈显峰)
谷氨酸受体拮抗剂对恶性黑素瘤WM451LU细胞增殖、迁移的调控作用及相关机制研究
李丽丽 陈显峰 黄琦涛 潘南楠 徐文英 谢治
530021南宁,广西壮族自治区人民医院皮肤科(李丽丽、黄琦涛、潘南楠、徐文英、谢治);广西医科大学第一附属医院重症医学科(陈显峰)
目的探讨谷氨酸受体拮抗剂对恶性黑素瘤WM451LU细胞增殖、迁移的调控作用及相关机制。方法取对数生长期人侵袭性恶性黑素瘤WM451LU细胞,分为3组,分别接受100 μmol/L谷氨酸受体拮抗剂MK⁃801(MK⁃801组)、10 μmol/L谷氨酸受体拮抗剂CPCCOEt(CPCCOEt组)或单纯培养基(对照组)处理。24 h后,噻唑蓝(MTT)法检测细胞增殖率,划痕实验检测细胞迁移能力,免疫印迹法检测增殖细胞核抗原(PCNA)、细胞膜及胞质中蛋白激酶Cα(PKCα)以及磷酸化MAPK(p⁃MAPK)表达水平。结果处理24 h后,对照组、MK⁃801组以及CPCCOEt组细胞增殖率分别为100%±1.1%、63%±3.1%、60%±2.4%,后两组与对照组比较,差异均有统计学意义(P<0.05)。划痕实验结果显示,对照组无细胞带随着时间的推移而逐渐变窄,划痕趋于愈合状态,而经MK⁃801及CPCCOEt作用后,无细胞带的变窄速度要明显缓慢,培养24 h后无细胞带仍然较宽,缩窄程度不明显。MK⁃801及CPCCOEt组细胞PCNA蛋白表达水平分别为77.0%±5.4%和72.0%±4.2%,显著低于对照组(100.0%±1.3%),差异均有统计学意义(P<0.05)。对照组、MK⁃801组以及CPCCOEt组细胞膜上PKCα表达水平分别为0.38±0.01、0.12±0.02、0.14±0.02,后两组与对照组比较,差异均有统计学意义(P<0.05)。MK⁃801组及CPCCOEt组p⁃MAPK表达水平分别为0.48±0.03、0.36±0.04,显著低于对照组(1.00±0.02),差异均有统计学意义(P<0.05)。结论体外阻滞谷氨酸受体能够抑制WM451LU细胞增殖、迁移,该作用可能部分由PKCα⁃MAPK信号通路介导。
黑色素瘤,实验性;受体,谷氨酸;细胞增殖;蛋白激酶Cα;丝裂原激活蛋白激酶类
谷氨酸信号通路是近年发现的与恶性黑素瘤(malignant melanoma,MM)发生相关的信号通路[1],谷氨酸受体是其主要的作用靶点。谷氨酸受体分为两大类,一类是离子型谷氨酸受体(iontropic glutamate receptors,iGluR),属于配体门控离子通道,通道的启闭受谷氨酸调控。iGluR中甲基⁃D⁃天冬 氨 酸 受 体(N ⁃methyl⁃D ⁃aspartate receptor,NMDAR)为Ca2+通道[2]。另一类是代谢型谷氨酸受体(metabotropie glutamate receptors,mGluR),属于G蛋白偶联受体,可间接调节离子通道。最近研究表明,谷氨酸受体在多种外周组织有表达[3],且在良、恶性黑素细胞中均有表达。许多研究发现,谷氨酸受体拮抗剂可抑制MM细胞增殖及转移,但谷氨酸受体调控MM细胞增殖、迁移及浸润的信号转导途径及分子机制尚不明确。WM451LU是一株具有高迁移及侵袭能力的人恶性黑素瘤细胞系在裸鼠体内易成瘤,因此我们选择WM451LU探讨谷氨酸受体拮抗剂对恶性黑素瘤WM451LU细胞增殖、迁移的调控作用及相关机制。
材料与方法
一、材料
1.细胞株:人侵袭性恶性黑素瘤细胞株WM451LU购自北京大学医学部病理学系。
2.主要试剂:谷氨酸受体拮抗剂MK⁃801产自美国Sigma公司(纯度≥99%),谷氨酸受体拮抗剂CPCCOEt产自英国Tocris公司(纯度≥99%);以二甲基亚砜(DMSO)分别溶解MK⁃801及CPCCOEt,配制成10 mol/L的母液,再以培养基依次稀释至相应的工作浓度。增殖细胞核抗原(PCNA)、磷酸化丝裂原活化蛋白激酶1/2(p⁃MAPK1/2)、蛋白激酶Cα(PKCα)一抗产自美国Cell Signaling公司。β肌动蛋白和β微管蛋白单克隆抗体产自武汉博士德生物工程有限公司,羊抗兔IgG⁃HRP、羊抗鼠IgG⁃HRP产自北京中杉金桥生物工程公司,ECLTM试剂产自英国Amersham Pharmacia Biotech公司。细胞膜蛋白与细胞质蛋白抽提试剂盒产自上海碧云天生物技术研究所。
二、实验方法
1.细胞培养:WM451LU细胞用 Iscove′s Modified Dulbecco′s Media(IMDM)培养基于常规条件下培养,并加入含0.1 mmol/L L⁃谷氨酸的培养液中培养,使谷氨酸受体保持激活状态,以确保MK⁃801及CPCCOEt的受体拮抗作用。
2.谷氨酸受体拮抗剂作用浓度的筛选:将WM451LU细胞按照5×103/孔接种于96孔培养板中,37℃、5%CO2条件下培养24 h。加入拮抗剂MK⁃801或CPCCOEt,设置6组浓度梯度,终浓度为10 000、1 000、100、10、1、0.1 μmol/L,每组6个孔,对照组加入相同体积的细胞培养液,作用细胞24 h。检测前4 h加入5g/L噻唑蓝(MTT,20μl/孔)。弃上清,加入DMSO(200 μl/孔),酶标仪测定490 nm处吸光度(A值)。细胞生长抑制率=(A对照组-A实验组)/A对照组×100%。计算50%抑制率时拮抗剂作用浓度,即IC50。
3.细胞分组处理:将处于对数生长期的WM451LU细胞以浓度为5×104/ml的密度接种于96孔板中,200μl/孔,培养24h后换液。细胞分为3组:对照组(以培养基处理),MK⁃801组(以100 μmol/L MK⁃801处理),CPCCOEt组(以10 μmol/LCPCCOEt处理),每组6孔,药物作用24 h后,进行相应检测。
4.MTT法检测细胞增殖率:检测前4 h,加入5 g/L MTT(20 μl/孔)。弃上清,加入DMSO(200 μl/孔),待结晶溶解后,全自动酶标仪测定490 nm处A值。细胞相对增殖率(%)=实验组A值/对照组A值×100%。
5.划痕实验检测细胞迁移:取对数生长期WM451LU细胞,接种于6孔板中,待细胞接近100%融合状态时,用10 μl短移液器吸头在孔板直线刮除细胞,按照方法3中细胞分组处理后,继续培养24 h后,倒置显微镜下观察。
6.免疫印迹法检测PCNA、细胞膜及胞质中PKCα蛋白表达水平:按照上述分组,药物作用24 h后,胰酶消化收集细胞,加入细胞裂解液收集细胞蛋白,分别抽提细胞总蛋白、胞膜蛋白与胞质蛋白。制备10%十二烷基硫酸钠⁃聚丙烯酰胺凝胶电泳(SDS⁃PAGE)凝胶,取100 μg蛋白上样,电泳1.5 h;室温、恒压220 V条件下,半干转移法转聚偏二氟乙烯膜(PVDF膜,美国Hybond公司)。室温封闭1 h后加入PCNA、p⁃MAPK或PKCα一抗(1∶1 000),4℃孵育过夜;PBST漂洗3次后,加入HRP抗兔IgG或HRP抗鼠IgG(1∶5 000)33℃摇床中孵育1 h,PBST漂洗后ECL显影。用凝胶成像系统对胶片进行薄层密度扫描,记录相应条带的透射光积分光密度(IOD)。

表1 谷氨酸受体拮抗剂对WM451LU细胞增殖率、增殖细胞核抗原(PCNA)蛋白表达及PKCα转位激活和p⁃MAPK蛋白表达水平的影响(x±s)
7.数据处理:用SPSS13.0统计软件进行统计分析,结果以x±s表示,作方差齐性检验,采用单因素方差分析统计数据,组间比较采用LSD检测,以P<0.05为差异有统计学意义。
结 果
一、谷氨酸受体拮抗剂作用浓度
MTT法检测显示,拮抗剂MK⁃801及CPCCOEt对WM451LU细胞的IC50值分别为100、10 μmol/L。选择100、10 μmol/L分别作为这两种拮抗剂的作用浓度。
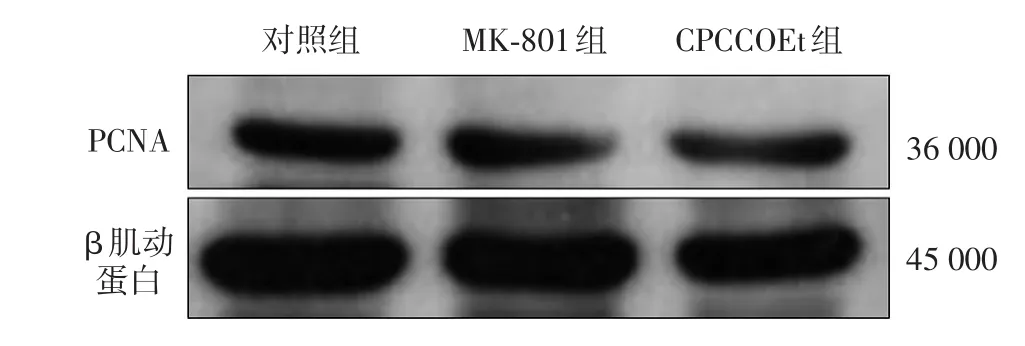
图1 谷氨酸受体拮抗剂对WM451LU细胞中增殖细胞核抗原(PCNA)蛋白表达的影响
二、谷氨酸受体信号通路对WM451LU细胞增殖及PCNA表达的影响
见表1、图1。MK⁃801和CPCCOEt组细胞增殖率均显著低于对照组,差异均有统计学意义(P<0.05)。以 MK⁃801及 CPCCOEt作用后,细胞中PCNA蛋白相对表达量显著低于对照组,差异均有统计学意义(P<0.05)。
三、谷氨酸受体信号通路对WM451LU细胞迁移的影响
划痕实验结果如图2所示,随着时间的推移,对照组进入到划痕内的细胞逐渐增多,细胞呈不规则状态,无细胞带随着时间的推移而逐渐变窄,划痕趋于愈合状态。而经过MK⁃801及CPCCOEt作用后,无细胞带的变窄速度要明显缓慢,培养24 h后无细胞带仍然较宽,缩窄程度不明显。
四、谷氨酸受体拮抗剂对PKCα⁃MAPK信号通路的影响
如图3及表1所示,对照组细胞胞质中PKCα能够转位于细胞膜上,而经过MK⁃801及CPCCOEt处理后,细胞中PKCα的转位激活作用受到显著抑制。与对照组相比,MK⁃801及CPCCOEt组细胞膜上PKCα表达水平下降,胞质中PKCα表达水平上升,差异均有统计学意义(P<0.05)。经过MK⁃801及CPCCOEt处理后,细胞中p⁃MAPK的表达与对照组相比均明显降低(P<0.05)。

图2 划痕实验检测谷氨酸受体拮抗剂作用24 h对WM451LU细胞迁移的影响(×20;标尺示划痕原始距离) 2A:对照组;2B:MK⁃801组;2C:CPCCOEt组
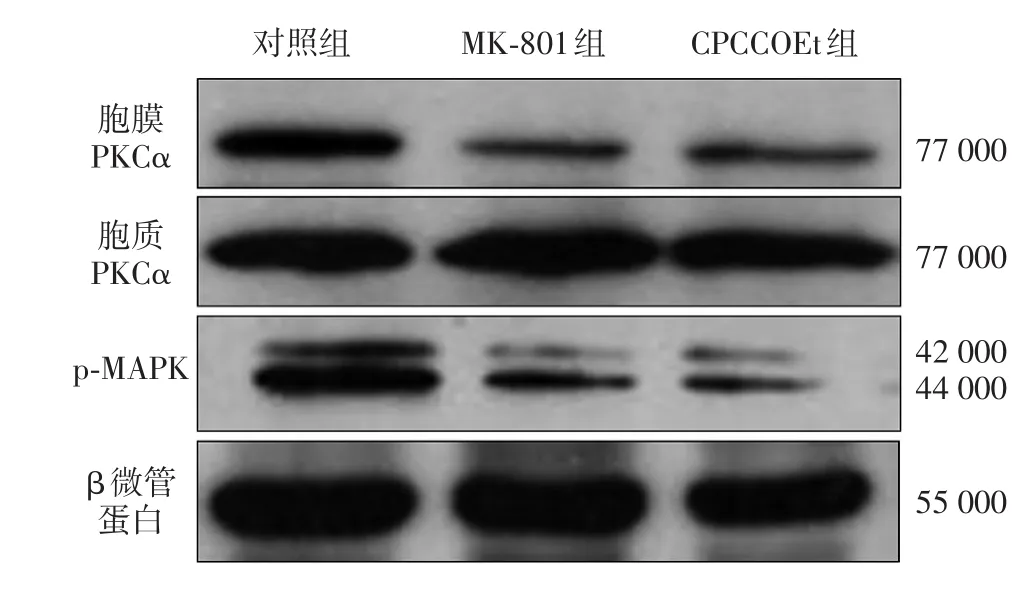
图3 免疫印迹法检测谷氨酸受体拮抗剂对WM451LU细胞PKCα转位激活及p⁃MAPK蛋白表达的影响
讨 论
Namkoong等[4]和Lee等[5]在人类黑素瘤细胞系及组织切片中发现mGluR1异常表达。抑制表皮内黑素细胞中NMDAR的表达,可以下调小眼畸形相关转录因子(microphthalmia⁃associated transcription factor,MITF)基因表达[1]。而多种谷氨酸受体拮抗剂可抑制神经系统肿瘤增殖。在非神经系统中,mGluR4拮抗剂可逆转直肠癌对氟尿嘧啶化疗的耐药性[6]。NMDAR拮抗剂可抑制肺癌等肿瘤增殖,且可减少肿瘤细胞膜的褶皱样运动及伪足形成[7⁃8]。有研究发现,谷氨酸受体拮抗剂能够抑制黑素瘤的增殖,对黑素细胞树突形态具有调节作用[9]。我们的研究结果与以往的研究结果一致,谷氨酸受体拮抗剂MK⁃801及CPCCOEt处理均能显著降低细胞增殖率,并能抑制细胞迁移。
肿瘤的发生发展与细胞增殖周期调控密切相关,PCNA是DNA复制所必需的调节蛋白。研究表明,PCNA表达与MM浸润及转移有密切关系[10]。我们的实验结果也同样证明,PCNA与MM的增殖和凋亡有密切关系,抑制谷氨酸受体作用可显著降低PCNA的表达水平,抑制黑素瘤细胞增殖以细胞迁移能力。
研究表明,神经系统中NMDA受体过度激活会导致Ca2+内流增多,使PKCα活化。也有研究发现,抑制mGluR1的表达亦会引起PKCα表达降低[11]。MAPK通路被认为是由PKCα激活的主要信号通路之一[12⁃13]。MAPK级联激活,在许多细胞增殖相关信号通路中具有关键作用。研究表明,抑制MAPK级联反应可以抑制肿瘤细胞的迁移及浸润[14]。本研究中谷氨酸受体拮抗剂可能是通过改变Ca2+浓度,影响PKCα转位激活,抑制其下游p⁃MAPK信号通路活性,进而抑制WM451LU细胞增殖及细胞迁移。谷氨酸受体拮抗剂是否通过其他细胞增殖或凋亡信号途径起作用,有待进一步研究。
[1] Hoogduijn MJ,Hitchcock IS,Smit NP,et al.Glutamate receptors on human melanocytes regulate the expression of MiTF[J].Pigment Cell Res,2006,19(1):58⁃67.DOI:10.1111/j.1600⁃0749.2005.00284.x.
[2] ReganMC,Romero⁃HernandezA,FurukawaH.Astructuralbiology perspective on NMDA receptor pharmacology and function[J].Curr Opin Struct Biol,2015,33:68⁃75.DOI:10.1016/j.sbi.2015.07.012.
[3] Kang SG,Das P,McGrane SJ,et al.Molecular recognition of metabotropic glutamate receptor type 1(mGluR1):synergistic understanding with free energy perturbation and linear response modeling[J].J Phys Chem B,2014,118(24):6393⁃6404.DOI:10.1021/jp410232j.
[4] Namkoong J,Shin SS,Lee HJ,et al.Metabotropic glutamate receptor 1 and glutamate signaling in human melanoma[J].Cancer Res,2007,67(5):2298⁃2305.DOI:10.1158/0008⁃5472.CAN⁃06⁃3665.
[5] Lee HJ,Wall BA,Wangari⁃Talbot J,et al.Glutamatergic pathway targeting in melanoma:single⁃agent and combinatorial therapies[J].Clin Cancer Res,2011,17(22):7080⁃7092.DOI:10.1158/1078⁃0432.CCR⁃11⁃0098.
[6] Brocke KS,Staufner C,Luksch H,et al.Glutamate receptors in pediatric tumors of the central nervous system[J].Cancer Biol Ther,2010,9(6):455⁃468.DOI:10.4161/cbt.9.6.10898.
[7] Malsy M,Gebhardt K,Gruber M,et al.Effects of ketamine,s⁃ketamine,and MK 801 on proliferation,apoptosis,and necrosis in pancreatic cancer cells[J].BMC Anesthesiol,2015,15:111.DOI:10.1186/s12871⁃015⁃0076⁃y.
[8] Deiana S,Watanabe A,Yamasaki Y,et al.MK⁃801⁃induced deficitsinsocialrecognitioninrats:reversalbyaripiprazole,butnot olanzapine,risperidone,orcannabidiol[J].BehavPharmacol,2015,26(8 Spec No):748⁃765.DOI:10.1097/FBP.0000000000000178.
[9] 李丽丽,单路娟,张媛,等.谷氨酸信号通路对黑素细胞树突形态的调节作用[J].大连医科大学学报,2010,32(6):615⁃619.Li LL,Shan LJ,Zhang Y,et al.Regulated effects of glutamate signaling on dendritic morphology of melanocyte[J].J Dalian Med Univ,2010,32(6):615⁃619.
[10] Teixeira TF,Gentile LB,da STC,et al.Cell proliferation and expression of connexins differ in melanotic and amelanotic canine oral melanomas[J].Vet Res Commun,2014,38(1):29⁃38.DOI:10.1007/s11259⁃013⁃9580⁃z.
[11] Gao SH,Wen HZ,Shen LL,et al.Activation of mGluR1 contributes to neuronal hyperexcitability in the rat anterior cingulate cortex via inhibition of HCN channels [J].Neuropharmacology,2016,105:361⁃377.DOI:10.1016/j.neuropharm.2016.01.036.
[12] Tang JM,Yuan J,Li Q,et al.Acetylcholine induces mesenchymal stem cell migration via Ca2+/PKC/ERK1/2 signal pathway[J].J Cell Biochem,2012,113(8):2704 ⁃2713.DOI:10.1002/jcb.24148.
[13] Yuan X,Chen H,Li X,et al.Inhibition of protein kinase C by isojacareubin suppresses hepatocellular carcinoma metastasis and induces apoptosisin vitroandin vivo[J].Sci Rep,2015,5:12889.DOI:10.1038/srep12889.
[14] Xian J,Shao H,Chen X,et al.Nucleophosmin mutants promote adhesion,migration and invasion of human leukemia THP⁃1 cells through MMPs up⁃regulation via Ras/ERK MAPK signaling[J].Int J Biol Sci,2016,12(2):144⁃155.DOI:10.7150/ijbs.13382.
Regulatory effects of glutamate receptor antagonists on the proliferation and migration of WM451LU malignant melanomacellsandtheirrelatedmechanisms
LiLili,ChenXianfeng,HuangQitao,PanNannan,XuWenying,XieZhi Department of Dermatology,People′s Hospital of Guangxi Zhuang Autonomous Region,Nanning 530021,China(Li LL,Huang QT,Pan NN,Xu WY,Xie Z);Department of Critical Care Medicine,First Affiliated Hospital,Guangxi Medical University,Nanning 530021,China
ObjectiveTo evaluate regulatory effects of glutamate receptor antagonists on the proliferation and migration of WM451LU malignant melanoma cells,and to explore their related mechanisms.MethodsWM451LU cells at exponential growth phase were classified into 3 groups to be treated with the glutamate receptor antagonist MK⁃801 at 100 μmol/L(MK⁃801 group),the glutamate receptor antagonist CPCCOEt at 10 μmol/L(CPCCOEt group),or culture medium(control group).After 24⁃hour treatment,methyl thiazolyl tetrazolium(MTT)assay was performed to determine cell proliferation rates,scratch assay to evaluate the migration activity of cells,and Western⁃blot analysis to measure expression levels of proliferating cell nuclear antigen(PCNA),protein kinase Cα(PKCα)both on cell membrane and in cytoplasm,and phosphorylated mitogen⁃activated protein kinase(p⁃MAPK).ResultsAfter 24⁃hour treatment,cell proliferation rates were significantly decreased in the MK⁃801 group and CPCCOEt group compared with the control group(63% ±3.1%and 60% ±2.4%vs.100%±1.1%,bothP<0.05).The scratch assay showed that cell⁃free zones in the control group gradually narrowed over time,and the scratch wound tended to close.However,the cell⁃free zones in the MK⁃801 group and CPCCOEt group narrowed more slowly compared with the control group,and were still wide after 24⁃hour culture with no obvious closure of the scratch.The MK⁃801 group and CPCCOEt group both showed significantly decreased expressions of PCNA(77.0% ± 5.4%and 72.0% ±4.2%respectively),PKCα on the cell membrane(0.12 ± 0.02 and 0.14 ± 0.02 respectively),and p⁃MAPK(0.48 ± 0.03 and 0.36 ± 0.04 respectively)compared with the control group(PCNA:100.0% ± 1.3%;PKCα:0.38 ± 0.01;p⁃MAPK:1.00± 0.02;allP< 0.05).ConclusionIn vitrosuppression of glutamate receptors can inhibit the proliferation and migration of WM451LU cells,likely through the mediation of the PKCα⁃MAPK signaling pathway.
Melanoma,experimental;Receptors,glutamate;Cell proliferation;Protein kinase C⁃alpha;Mitogen⁃activated protein kinases
Xie Zhi,Email:xiezhi11@aliyun.com
谢治,Email:xiezhi11@aliyun.com
10.3760/cma.j.issn.0412⁃4030.2016.08.012
广西壮族自治区卫生厅自筹经费科研课题(Z2013377)
Fund program:Self⁃financed Scientific Research Program of Health Department of Guangxi Zhuang Autonomous Region(Z2013377)
2015⁃09⁃09)
(本文编辑:尚淑贤)
