PD-1在骨髓增生异常综合征中的表达及意义*
2016-10-29蒙珊赵万红张亦琳王芳侠田村秀人山下泰史
蒙珊 赵万红 张亦琳 王芳侠 田村秀人 山下泰史
(1.西安交通大学第二附属医院血液内科, 陕西 西安 710004;2.日本医科大学附属病院血液内科, 日本 东京 113-860)
PD-1在骨髓增生异常综合征中的表达及意义*
蒙珊1赵万红1张亦琳1王芳侠1田村秀人2山下泰史2
(1.西安交通大学第二附属医院血液内科, 陕西 西安 710004;2.日本医科大学附属病院血液内科, 日本 东京 113-860)
目的检测负性共刺激分子PD-1在骨髓增生异常综合征(MDS)患者中的表达,分析其表达水平与相关临床指标之间的关系,探讨其在MDS发病过程中所起的作用。方法收集44例MDS患者外周血标本(MDS组)和25例健康者外周血作阴性对照(NC组),采用流式细胞术检测PD-1在T细胞上的表达, RT-PCR检测T细胞亚群中PD-1 mRNA的表达,同时ELISA法检测MDS患者血清中可溶性PD-1的水平。收集MDS患者相关临床指标,线性相关分析法分析PD-1mRNA水平与各项临床指标之间的关系。结果MDS组患者中PD-1mRNA表达阳性率为(11.31±0.18)%,而NC组阳性率为(6.46±0.25)%,与NC组相比,MDS患者中CD3+、CD4+及 CD8+ T 细胞上PD-1表达水平及PD-1 mRNA水平显著升高。MDS组患者血清sPD-1水平较NC组明显升高。在MDS组患者中,CD3+、CD8+ T细胞上PD-1的表达水平与LDH水平呈显著正相关,CD4+T细胞上的表达水平与CRP呈显著正相关。 结论 T细胞表面PD-1分子的高表达可能在MDS发病过程中起到一定作用。
PD-1;骨髓增生异常综合征(MDS);T细胞;LDH;CRP
骨髓增生异常综合征(myelodysplastic syndromes, MDS)是一种造血干细胞异常克隆所致的血液系统恶性疾病,目前国内外公认的观点认为,自身免疫因素在其发病中起了重要作用[1,2]。该观点认为由于多种免疫负调控机制的参与,使患者自身免疫细胞不能有效清除异常克隆,从而导致本病的发生[3]。
近年来,PD-1(programmed death-1)/B7-H1信号通路作为重要的免疫负调控通路,由于其在多种自身免疫病及恶性肿瘤的免疫耐受中的作用而备受关注[4]。PD-1分子属于免疫球蛋白超家族的一员,在T、B淋巴细胞抗原受体激活后呈诱导性的表达于T、B细胞表面。PD-1有两个属于B7家族的配体,分别为B7-H1(又称为PD-L1或CD274)和B7-DC(也称PD-L2或CD273)。PD-1与B7-H1结合后,与T细胞受体共同传递抑制性信号给T细胞,抑制T细胞增殖、活化和细胞因子的分泌,从而诱导T细胞的凋亡[5]。
目前多项研究证实,PD-1与B7-H1的相互作用在多种血液系统疾病如白血病、淋巴瘤、骨髓瘤、再生障碍性贫血中起着重要作用[6],但关于MDS患者中PD-1/B7-H1通路的研究较少,该通路在MDS发生发展中的作用仍不明确[7]。因此,本研究拟通过检测MDS患者体内PD-1的表达水平,分析其表达水平与相关临床指标之间的关系,以探讨PD-1在MDS发生发展中可能的作用。
1 材料与方法
1.1材料FITC标记的抗PD-1单抗及PE标记的抗CD8单抗购自eBioscience公司,PE标记的抗CD3、抗CD4单抗购自美国BD公司;FACScan双色流式细胞仪(美国BD公司);SuperscriptⅡ反转录试剂盒购自Invitrogen公司;SYBR Priemix Ex TaqTM试剂盒购自TAKARA公司;CD3免疫磁珠分选试剂盒购自德国Miltenyi公司;ELISA试剂盒购自美国R&D公司。
1.2方法
1.2.1标本收集收集2007~2009年日本医科大学附属病院血液内科收治的44例MDS患者(MDS组),其诊断及分型符合WHO标准[8],患者一般临床资料(见表1)。获得相关知情同意后,收集上述患者的肝素抗凝外周血及其血清(-80℃保存)用于下一步实验。另选25例健康者(NC组)的外周血作阴性对照(negative control, NC)。同时收集患者的相关临床指标,包括血红蛋白、血小板、LDH、C反应蛋白(C-reactive protein, CRP)等指标。
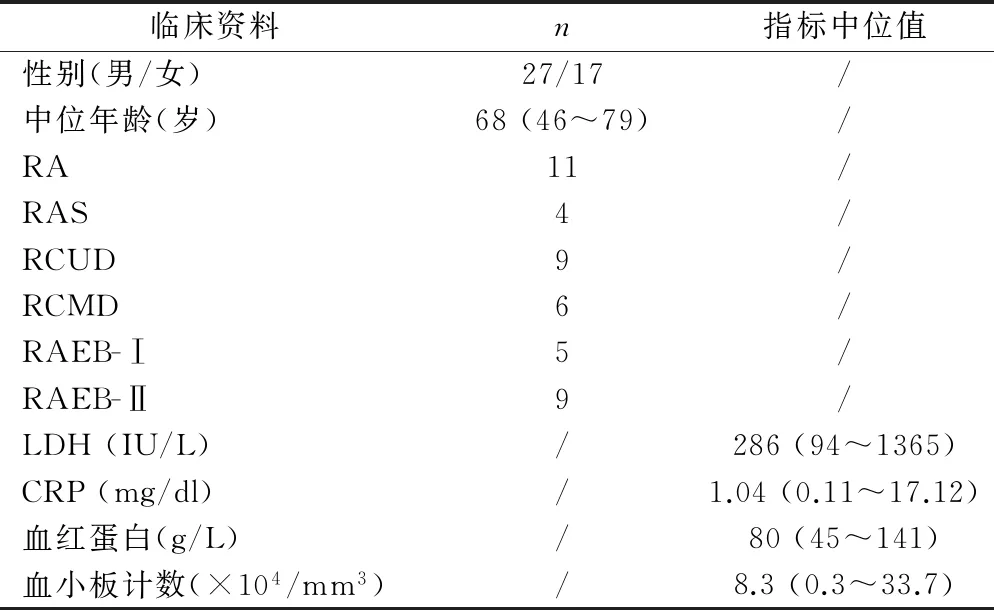
表1 44例MDS患者一般临床资料
1.2.2流式细胞术检测MDS患者及健康者外周血T细胞上PD-1的表达每个流式检测管中分别加入50 μl稀释好的FITC标记的抗PD-1单抗及PE标记的抗CD3单抗(或抗CD4、抗CD8的单抗),同型对照管中加入50 μl缓冲液,随后每管分别加入100 μl全血轻轻混匀后,避光孵育15~30 min,每管分别加入2 ml红细胞裂解液,混匀后室温避光孵育10 min,室温300 g离心5 min,弃上清后缓冲液洗涤细胞2次,重悬后上机检测,采用仪器自带的Cellquest software 软件进行数据分析。
1.2.3RT-PCR检测MDS患者及健康者外周血T细胞上PD-1mRNA的表达水平取5例健康者及2例MDS患者的外周血,密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cells, PBMNCs),采用免疫磁珠分选法分离CD3+T细胞,纯度达98%以上。健康者的CD3+T细胞使用植物血凝素刺激2 d(终浓度为10 μg/ml)后作为阳性对照。提取CD3+T细胞的总RNA,使用SuperscriptⅡ 反转录试剂盒反转录为cDNA,随后采用SYBR Priemix Ex TaqTM试剂盒进行基因扩增,扩增引物为PD-1上游:CGCACGAGGGACAATAGGAG,PD-1下游:GGTCTTCTCTCGCCACTGGAA,内参基因ACTB引物上游:TGGCACCCAGCACAATGAA,下游CTAAGTCATAGTCCGCCTAGAAGCA。PD-1 mRNA表达水平使用ABI PRISM 7500快速实时荧光定量PCR系统进行分析,2-ΔΔCt法分析PD-1mRNA的相对含量。每个实验重复3次。
1.2.4ELISA法检测MDS及其健康者血清中可溶性PD-1(soluble PD-1, sPD-1)的水平取出-80℃保存的血清,室温融化,取出4 ℃保存的试剂盒,室温平衡后按照试剂盒说明书进行操作,随后采用酶标仪测定各孔在450 nm处的OD值。参照试剂盒说明书计算各样本sPD-1的浓度。
1.3统计学分析应用SPSS 17.0软件及GraphPad Prism5.0对数据进行统计分析。各变量数值采用均值±标准差进行表示,两组之间连续变量的比较采用Student’st检验,采用线性相关分析法分析PD-1水平与各项临床指标之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1PD-1在MDS患者T细胞上的表达水平流式细胞术检测结果表明,PD-1在MDS患者CD3+T细胞、CD4+T、CD8+T细胞上的表达水平均明显高于对照组(P<0.05),两组PD-1表达水平,见表2。
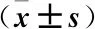
表2 两组病例PD-1 在T细胞上的表达
注:与NC组相比①P<0.05
2.2PD-1mRNA在MDS患者CD3+T细胞中的表达水平显著升高从5例健康者及2例MDS患者血标本中分离出了高纯度的CD3+T细胞,并对CD3+T细胞上PD-1的表达水平进行了定量研究。结果显示,1例MDS患者的PD-1mRNA表达水平明显高于阳性对照组,另外1例MDS患者PD-1mRNA表达水平与NC组中最高者的表达水平相似,见图1。
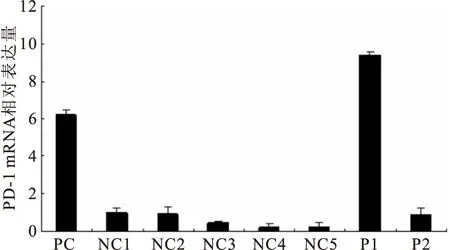
图1PD-1mRNA在CD3+T细胞上的相对表达量
Figure 1Expression of D-1 mRNA in CD3+ T cells
注:PC. 阳性对照细胞(PHA刺激后的健康者CD3+T细胞); NC. 阴性对照(健康者); P. MDS患者
2.3MDS患者血清sPD-1的表达水平明显升高对20例MDS患者及11例健康者的血清,采用ELISA法检测了血清中sPD-1的水平。结果显示,MDS组患者血清中sPD-1水平较NC组明显升高(P<0.05),见图2。
2.4PD-1高表达与LDH、CRP水平密切相关采用线性相关分析法对PD-1的表达水平与各项临床指标之间的关系进行了分析。结果显示,在MDS组患者中,PD-1在CD3+、CD8+T细胞上的表达水平与LDH水平呈显著正相关(见图3),在CD4+T细胞上的表达水平与CRP呈显著正相关(见图4)。同时发现PD-1表达水平与血小板水平趋势一致,但两者之间无明显相关性(P>0.05,见图5),未发现PD-1表达水平与血红蛋白之间存在相关性。
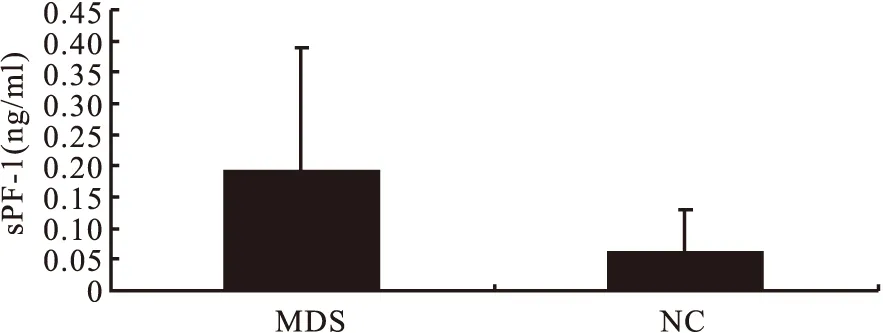
图2两组病例血清sPD-1水平比较
Figure 2 Serum sPD-1
3 讨论
PD-1为近年来新发现的负性共刺激分子之一,通过与其配体B7-H1相结合,在T细胞免疫应答的初始阶段及效应阶段抑制T细胞的活化、促进T细胞凋亡,从而介导免疫耐受。MDS为恶性克隆性疾病,目前已有研究表明,MDS患者体内细胞免疫功能低下,T细胞数量明显降低,CD8+T细胞、NK细胞数量减少、功能受抑[9]。因此我们推测PD-1/B7-H1信号通路可能在MDS的发病中起着一定作用。
本课题组前期采用MDS细胞系及患者标本进行的相关研究发现,MDS原始细胞表面B7-H1表达水平较健康者明显增高,细胞的侵袭能力增强,抑制T细胞增殖、诱导T细胞凋亡的能力越强,且其表达水平与MDS患者疾病危险度密切相关。体外实验发现,这些B7-H1能与正常T细胞上表达的PD-1相结合,从而诱导T细胞的凋亡[10]。由此推测,T细胞表面可能存在PD-1的过度表达,其接受B7-H1介导的负性共刺激信号后, T细胞增殖受抑制、凋亡过度,从而导致MDS的发生。
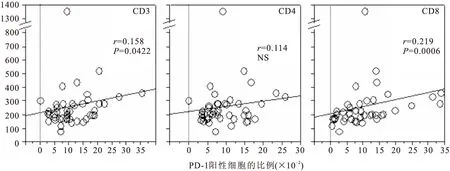
图3T细胞上PD-1表达与LDH水平之间的相关性
Figure 3Relationship of expression of PD-1 and LDH in T cell
注:NS.无显著性差异
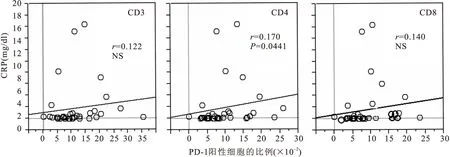
图4T细胞上PD-1表达与CRP水平之间的相关性
Figure 4Relationship of expression of PD-1 and CRP in T cell
注:NS.无显著性差异
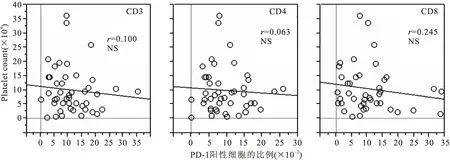
图5T细胞上PD-1表达与血小板水平之间的相关性
Figure5Relationship of expression of PD-1 and platelet
注:NS.无显著性差异
本研究进一步证实,MDS患者T细胞通常存在PD-1的过度表达,其表达阳性率和mRNA表达水平均明显高于健康者,且在不同T细胞亚群中的表达水平具有一定的差异性。其可能原因是在负性免疫调节的过程中,不同的T细胞亚群起着不同的作用[11]。另外我们还发现,PD-1mRNA表达水平与患者血浆LDH及CRP水平呈显著正相关,与血小板水平趋势一致,但无统计学意义;而与血红蛋白水平无明显相关性。
LDH是一种常用的肿瘤标志酶,其活性水平很大程度上可以反映恶性细胞的增殖、代谢等生物学性状[12]。而CRP作为一种炎症蛋白,已被证实与多种恶性疾病的预后相关[13]。由此推测,PD-1表达水平也与MDS患者的预后相关,其表达水平越高,与B7-H1结合后传递的负性免疫调控作用越强,抑制T细胞增殖、促进T细胞凋亡的作用越强,预后越差。国内学者曾慧等研究认为,MDS患者PD-1表达水平升高的同时,伴随着其他一些负性信号,从而共同起到抑制T细胞活化的作用;另外他们还发现,PD-1表达水平随着MDS疾病的进展而升高[14]。本课题组研究结论与该结论一致[15]。
多项研究证实,除了细胞模型之外,PD-1还存在可溶型,即sPD-1。机体内的sPD-1通过血液循环到达靶器官或作用靶点,从而在免疫应答中发挥作用[16]。研究发现肾癌患者血清中sPD-1水平明显升高,且与患者淋巴结转移、分期及预后相关[17]。本研究发现,MDS患者sPD-1水平较健康对照组明显升高,据此推测,MDS患者血清sPD-1水平可能在MDS患者的诊断及预后中具有一定的价值。
随着对PD-1/B7-H1信号通路在恶性疾病中负性免疫调控作用的逐步揭示,针对PD-1/B7-H1的靶向治疗逐渐成为研究热点[18-19]。目前为止,PD-1/B7-H1通路阻断剂和抗PD-1和PD-L1 单克隆抗体的研究已在相关领域取得了突破性进展。多项荷瘤动物实验表明,阻断PD-1/B7-H1通路可以增强抗肿瘤效应、延长生存期、改善预后。Rosenblatt等[20]使用CT-011阻断多发性骨髓瘤中的PD-L1通路,取得了良好效果,Hallett等[21]发现在小鼠多发性骨髓瘤模型中,联合造血干细胞移植及PD-1/B7-H1阻断治疗,可使荷瘤小鼠存活率提高至40%。且在上述实验中并未观察到明显毒性和致死性不良反应。目前,多种针对PD-1/B7-H1通路阻断的单克隆抗体用于进展期恶性肿瘤的临床试验都在进行中[22-23]。因为该通路在MDS发病中可能起着类似的作用,由此推测,在不久的将来,该疗法可能也将为MDS的治疗提供新的思路。
4 结论
本文资料提示,PD-1在MDS患者T细胞上呈高表达,其表达水平与患者LDH及CRP水平呈正相关。研究结果为进一步揭示MDS的临床发病机制提供了基础。
[1]Lee SJ, Park JK, Lee EY,etal. Certain Autoimmune Manifestations Are Associated With Distinctive Karyotypes and Outcomes in Patients With Myelodysplastic Syndrome: A Retrospective Cohort Study[J]. Medicine (Baltimore), 2016, 95(13):3091.
[2]Komrokji RS, Kulasekararaj A, Al Ali NH,etal. Autoimmune diseases and myelodysplastic syndromes[J]. Am J Hematol, 2016, 91(5):280-283.
[3]Braun T, Fenaux P. Myelodysplastic Syndromes (MDS) and autoimmune disorders (AD): cause or consequence [J]. Best Pract Res Clin Haematol, 2013, 26(4):327-336.
[4]Yao S, Chen L. PD-1 as an immune modulatory receptor[J]. Cancer J, 2014, 20(4):262-264.
[6]杨浩, 饶莉. 程序性细胞死亡因子1信号通路研究进展[J]. 西部医学, 2013, 25(9):1422-1425.
[7]Rivera GA, Saramipoor Behbahan I, Greenberg PL. Immune checkpoint pathways: perspectives on myeloid malignancies[J]. Leuk Lymphoma, 2016, 57(5):995-1001.
[8]Brunning RD, Orazi A, Germing U,etal. Myelodysplastic Syndromes. In: Swerdlow SH, Campo E, Harris NL,etal, eds. WHO Classification of Tumors of Haematopoietic and Lymphoid Tissues[J]. Lyon, France: International Agency for Research on Cancer, 2008:87-103.
[9]王秀丽, 邵宗鸿. 骨髓增生异常综合征患者T淋巴细胞功能研究进展[J]. 中华血液学杂志, 2004, 25(1): 59-60.
[10] Kondo A, Yamashita T, Tamura H,etal. Interferon-gamma and tumor necrosis factor-alpha induce an immunoinhibitory molecule, B7-H1, via nuclear factor-kappaB activation in blasts in myelodysplastic syndromes[J]. Blood, 2010, 116(7):1124-1131.
[11] 彭辉, 乔丹, 李琴, 等. 正常人PBMCs中T细胞的PD-1表达及其表型分析[J]. 热带医学杂志, 2012, 12(4): 426-428.
[12] Sotirova T, Stojanovic A, Genadieva-Stavric S,etal. Influence of Prognostic Factors on OverallSurvival in Myelodysplastic Syndromes[J]. Mater Sociomed, 2014, 26(5):292-296.
[13] Gu S, Song X, Zhao Y,etal. The evaluation of iron overload through hepcidin level and its related factors in myelodysplastic syndromes[J]. Hematology, 2013, 18(5):286-294.
[14] 曾慧, 吴德沛, 欧阳建, 等. 骨髓增生异常综合征CD3+ CD4+ T细胞共刺激分子表达的研究[J]. 中华血液学杂志, 2008, 16: 5(5):1082-1085.
[15] Nakanishi J, Wada Y, Matsumoto K,etal. Overexpression of B7-H1 (PD-L1) significantly associates with tumor grade and postoperative prognosis in human urothelial cancers[J]. Cancer Immunol Immunother, 2007, 56(8):1173-1182.
[16] Xu CH, Yu LK. Diagnostic value of soluble B7-H4 in malignant pleural effusion[J]. Zhong hua Yi Xue Za Zhi, 2012, 92(2):117-118.
[17] Frigola X, Inman B A, Lohse CM,etal. Identification of a soluble form of B7-H1 that retains immunosuppressive activity and is associated with aggressive renal cell carcinoma[J]. Clin Cancer Res, 2011, 17(7):1915-1923.
[18] Prestwich RJ, Errington F, Hatfield P,etal. The immune system--is it relevant to cancer development, progression and treatment[J]. Clin Oncol (R Coll Radiol), 2008, 20(2):101-112.
[19] Flies DB, Sandler BJ, Sznol M,etal. Blockade of the B7-H1 /PD-1 pathway for cancer immunotherapy[J]. Yale J Biol Med, 2011, 84(4):409-421.
[20] Rosenblatt J, Glotzbecker B, Mills H,etal. Ct-011, anti-pd-1 antibody, enhances ex-vivo t cell responses to autologous dendritic /myeloma fusion vaccine developed for the treatment of multiple myeloma[J]. Blood, 2009, 114(22):322-323.
[21] Hallett WH, Jing W, Drobyski WR,etal. Immunosuppressive effects of multiple myeloma are overcome by PD-L1 blockade[J]. Biol Blood Marrow Transplant, 2011, 17(8):1133-1145.
[22] Brahmer JR, Tykodi SS, Chow LQ,etal. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer[J]. N Engl J Med, 2012, 366(26):2455-2465.
[23] Topalian SL, Hodi FS, Brahmer JR,etal. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer[J]. N Engl J Med, 2012, 366(26):2443-2454.
PD-1 expression in myelodysplastic syndromes and its clinical significance
MENG Shan1, ZHAO Wanhong1, ZHANG Yilin1,et al
(1.DepartmentofHematology,TheSecondHospitalAffiliatedMedicalCollegeofXi’anJiaotongUniversity,Xi’an710004,Shanxi; 2.DivisionofHematology,DepartmentofMedicine,NipponMedicalSchool,Tokyo113-8603,Japan)
ObjectiveTo examine PD-1 expression in myelodysplastic syndromes (MDS) patients, analyze its correlation with some selected clinical parameters and explore its role in MDS pathophysiology. MethodsBlood specimens from 44 MDS patients were collected, and specimens from 25 healthy volunteers were used as negative control (NC). Flow cytometry assay and RT-PCR were used to detect PD-1 expression on T cells and PD-1 mRNA expression in different T cell subsets, respectively, and ELISA was applied to detect soluble PD-1 (sPD-1) in MDS patients serum. Then linear correlation analysis was performed to analyze the relationship between PD-1mRNA level and selected clinical parameters. ResultThe expression rate of PD-1 of MDS patients and NC were 11.31±0.18% and 6.46±0.25%. Compared with NC, MDS patients had high expression of PD-1 and PD-1mRNA in T cell subset including CD3+, CD4+ and CD8+T cells. sPD-1 in MDS patients was significantly high than that in NC group. In MDS patients, PD-1mRNA levels in CD3+ and CD8+T cells had positive correlation with LDH levels, whereas it mRNA level on CD4+T cells showed a positive correlation with CRP level. ConclusionPD-1 overexpresses on T cells of MDS patients, which may play some role in the genesis of MDS.
PD-1; Myelodysplastic Syndromes; T cells; LDH; CRP
陕西省自然科学基础研究重点项目(2013JZ011)
赵万红, 医学博士,E-mail: 13991365406@163.com.
R 551.3
Adoi:10.3969/j.issn.1672-3511.2016.10.004
2016-06-01; 编辑: 陈舟贵)
