三螺旋多糖的链结构与功能研究进展
2016-10-26刘青业许小娟中北大学化工与环境学院太原03005武汉大学化学与分子科学学院武汉43007
刘青业, 许小娟(.中北大学化工与环境学院,太原03005;.武汉大学化学与分子科学学院,武汉43007)
特约综述
三螺旋多糖的链结构与功能研究进展
刘青业1, 许小娟2
(1.中北大学化工与环境学院,太原030051;2.武汉大学化学与分子科学学院,武汉430072)
三螺旋多糖是自然界中存在的具有特殊链结构的一类生物大分子,它不仅具有较高的生物活性,而且具有特殊的分子识别能力以及其他多糖无法比拟的功能特性。本文主要概述三螺旋多糖的链结构及其构象转变,分析其变性和复性过程中分子链间的相互作用,阐明三螺旋结构形成和形态变化的科学规律。同时,综述了三螺旋多糖的链构象与其生物活性之间的构效关系,以及基于螺旋构象转变构建的多糖基功能材料的最新研究进展。
三螺旋多糖;链结构;功能
多糖不仅是细胞的结构支撑和能源存储物质,还是参与生命有机体新陈代谢的基本物质之一,它参与细胞与细胞之间的识别和调控、细胞生物信息的携带和传递、免疫应答以及蛋白质转移等各种生命活动[1],已成为生物体内除核酸和蛋白质外又一重要的生物大分子。近年来,随着生物高分子研究技术的发展及其在多糖领域的应用,多糖及糖复合物结构、构象以及功能的研究有了空前的发展。与核酸和蛋白质相比,多糖结构复杂多样,如糖苷键的多种键接方式、支化结构、支化度、分子内和分子间多重相互作用,导致多糖分子链在溶液中能以不同的链形态存在,如无规线团链、单螺旋、双螺旋、三螺旋、蠕虫状、棒状和聚集体等[2-4]。其中,三螺旋多糖尤为引人注目。三螺旋结构不仅赋予多糖更高的生物活性[5-7],而且基于三螺旋结构的变性-复性特征可构建独特的功能材料,如一维纳米复合材料[8-10]、基因载体[11]、化学传感器以及偏光材料[12]。由此,多糖的结构与功能研究将成为未来生命科学以及纳米材料科学的重要研究课题之一。
1 三螺旋多糖的链结构及其溶液行为
在自然界中,三螺旋多糖来源广泛,种类较多。迄今已报道的三螺旋多糖主要有裂褶菌多糖(schizophyllan,SPG)[14-15]、硬葡聚糖(scleroglucan)[16]、香菇多糖(lentinan,LNT)[17-19]、木聚糖(β-(1→3)-D-xylan)[20-21]、凝胶多糖(curdlan)[22]、霉菌多糖(cinerean)[23]、海带多糖(laminarin)[24-25]和长裙竹荪多糖[26]等。其中,三螺旋多糖的主链大多为β-(1→3)-D-葡聚糖,如图1所示[13]。结构最简单的三螺旋多糖,即凝胶多糖和木聚糖,是一种由β-(1→3)-D键接的直链聚糖;而裂褶菌多糖、硬葡聚糖、霉菌多糖、海带多糖和香菇多糖是一类主链为β-(1→3)-D,含有β-(1→6)侧链的葡聚糖。糖残基侧链是否存在及其存在频率会显著影响多糖的物理性质,例如:凝胶多糖无侧链存在,即使分子量很小在水中也几乎不溶,而侧链的存在导致三螺旋多糖能溶于水,溶解度的大小取决于侧链的多少和长短。

图1 不同来源三螺旋多糖的重复单元结构示意图[13]Fig.1 Repeating units of triple helical polysaccharides from various species[13]
自然界中已发现的三螺旋多糖有一个共同的特点,具有极其相似的X-射线衍射图谱,即基本上都以右手三螺旋构象存在,主要依靠分子内和分子间氢键来维持和稳定三螺旋结构。Sakurai以及Kony等[10,27]通过分子模拟分别得到凝胶多糖和裂褶菌多糖可能存在的三螺旋构象模型图,以及它们在x、y轴平面的投影(图2)。主链葡萄糖环上C-4和C-6上的-OH通过分子内氢键作用形成螺旋结构;3条多糖分子主链则通过分子间的氢键,即每股链的糖环上C-2位-OH围绕螺旋结构的中心形成一个封闭的三角氢键网络,每一个三角氢键网络都被固定于同一个x-y平面上,并沿着螺旋中心轴线垂直排列,使三股链紧紧地结合在一起,形成稳定的三螺旋结构。这种氢键网络结构是目前公认的比较合理的构象模型。糖环上C-2位的-OH被认为具有较强的疏水性,而C-6上的-OH则表现为亲水性[21],由于C-2位-OH形成的氢键位于三螺旋结构中心,导致其中心空腔相当疏水[10]。而且,多糖侧链越多,三螺旋结构的螺距越小,三螺旋链形成的疏水空腔则越大。例如,裂褶菌多糖的三螺旋空腔直径大小为0.35 nm,而无侧链结构的凝胶多糖则不存在螺旋空腔[28]。此外,Okobira等[28]通过分子模拟研究观察到,水分子易与多糖侧链以及主链形成两种氢键作用,导致多糖在水溶液中存在旋光色散的热波动现象。
多糖带有大量羟基,非常容易形成氢键网络[29]。因此,三螺旋结构之间存在强烈的聚集趋势。如图3 (a)所示,低分子量的三螺旋香菇多糖(Mw=4.6×105)由于强烈的氢键作用在水中以三螺旋链和三螺旋链的聚集体共存,原子力显微镜(图3(b))显示三螺旋棒状短链平行排列形成 “柴捆”状聚集体(图3(c))[30]。研究表明,较低分子量的裂褶菌多糖(Mw=4.0×105)因其氢键作用聚集导致多糖溶液具有一定的液晶行为[31];而较高分子量三螺旋多糖链相互缠结,形成三维网状结构,导致凝胶化。张俐娜等[32-34]通过SECMALLS-Visco三联用技术研究了较高分子量的香菇多糖(Mw=1.03×106)在0.15 mol/L NaCl溶液中的溶液性质,研究表明香菇多糖即使在稀溶液中也以三螺旋链及其聚集体形式共存,这种聚集体由可逆的三维网络凝胶构成。因此,随着浓度增加,香菇多糖溶液很容易形成凝胶。
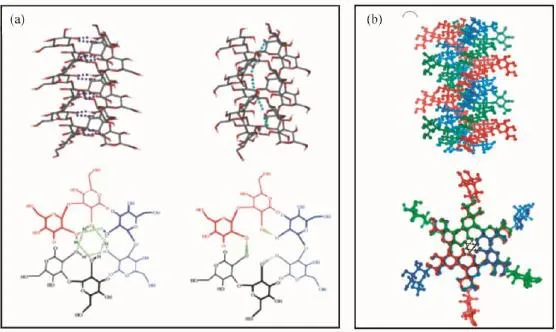
图2 凝胶多糖(a)和裂褶菌多糖(b)中可能存在的氢键模型[10,27]Fig.2 Proposed types of hydrogen bonds in triple helical curdlan(a)and schizophyllan(b)[10,27]

图3 香菇多糖在水溶液中25℃时的自相关函数曲线(散射角θ=90°)(a);香菇多糖在水溶液中25℃条件下的原子力三维图谱(b);香菇多糖在水溶液中的结构形态示意图[30](c)Fig.3 Typical autocorrelation function of Lentinan in water as measured by DLS at at 25℃(scattering angleθ=90°)(a);The 3D image of MAC mode AFM topographic images of Lentinan aqueous solution at 25℃(b);Schematic of triple helical Lentinan in water solution(c)[30]
2 三螺旋多糖的链构象转变
2.1三螺旋低温区构象转变
分子内和分子间的氢键是维系多糖三螺旋结构的主要驱动力。对于含有侧链的三螺旋多糖,在水溶液中侧链与主链以及侧链与水分子形成的氢键是稳定其三螺旋构象的因素[28],这也是具有侧链的三螺旋多糖易溶于水的主要原因。大量实验证明,裂褶菌多糖、硬葡聚糖以及香菇多糖等三螺旋多糖侧基上的羟基与周围环境中的水分子在低于室温下形成氢键,使侧链基团以三螺旋主链为核心规整排列,使侧链保持高度有序的结构,与主链形成更刚性的三螺旋结构,即三螺旋Ⅰ;而在室温以上这种氢键作用被破坏,侧链相对自由,此时的三螺旋称之为三螺旋Ⅱ[35-41]。Kitamura等[38]利用超灵敏微量热法和旋光测量证明裂褶菌多糖在水溶液中的低温构象转变(低温区氢键破坏)温度为7.4℃,而当溶液中c(KOH)=0.01 mol/L时,该转变温度升高至37.2℃;随着溶液中碱浓度的增加,多糖链低温构象区转变的协同单元尺寸逐渐减小,多糖链的刚性逐渐降低。Yoshiba等[42]用介电色散证明三螺旋裂褶菌多糖分子链周围的水分子以3种形式存在,按照两者相互作用的强弱将其分为结合水(最强)、结构水(较强)以及自由水(弱),并将多糖低温区构象的转变归结于结构水和自由水之间的转换。
张俐娜[41]等利用差示扫描微量热法(US-DSC)对三螺旋香菇多糖在DMSO-水的二元溶剂体系中低温区构象转变进行了系统研究,如图4(a)所示。第1个吸热峰为多糖分子链从三螺旋Ⅰ到三螺旋Ⅱ的转变,此时三螺旋的结构并未被破坏,只是三螺旋链的侧链从相对有序转变到无序;当ωDMSO<80%时,多糖在DMSO-水混合溶液中的转变温度随ωDMSO增加而升高;当ωDMSO>80%时,转变温度随ωDMSO增加而降低,该转变对应于多糖在低温区三螺旋Ⅰ到Ⅱ的可逆构象变化,如图4(b)所示。这主要是因为水通常以团簇状存在,容易与其他含-OH的分子结合形成氢键缔合复合物,而且在低温时较为稳定;当温度升高,这种氢键作用被破坏,结构水转变成了自由水,构象发生转变,导致三螺旋主链和侧链活动性增加[43]。

图4 香菇葡多糖在DMSO-水混合溶剂中的热容变化(a);三螺旋构象Ⅰ到Ⅱ的低温区转变示意图(b)[41]Fig.4 Temperature dependence of the specific heat capacity(Cp)for lentinan in DMSO-H2O mixtures(a);Schematic diagram of a model declaring the conformation transition from triple-helicalⅠtoⅡ(b)[41]
2.2三螺旋链-单链构象转变
三螺旋多糖依靠氢键网络稳定存在于水溶液中。然而,它们在一定条件(强碱条件、强极性溶剂及高温)下,分子内和分子间氢键被破坏,三螺旋结构解螺旋转变成无规线团,该过程称为三螺旋结构的变性。例如,裂褶菌多糖在水溶液中以三螺旋构象存在,而当ωDMSO约为80%时,三螺旋构象发生突变;ωDMSO≥87%时,多糖链则完全以无规线团构象存在,并且构象区的转变是一种非热力学平衡的不可逆转变[44]。香菇多糖在ωDMSO为80%~85%时也发生三螺旋构象转变,即三螺旋多糖的变性,在此相对窄的区间内,多糖的三螺旋构象与无规线团共存[45]。张俐娜等[46]还观察到,当香菇多糖的DMSO体系中加入LiCl后,多糖在LiCl-DMSO溶剂中具有更高的黏度和较大的黏度指数;这主要是由于Li+具有较高的电荷密度,很容易与DMSO中亚硫氧基上的氧紧密缔合形成[Li-DMSO]+阳离子,Cl-则与多糖分子链上的羟基形成氢键,多糖分子链上的Cl-以及与大阳离子[Li-DMSO]+缔合的Cl-之间的电荷排斥作用,阻碍了多糖分子链上的葡糖基自由旋转,导致主链刚性增加。
强碱溶液也可以破坏三螺旋结构,然而对其构象转变的报道却大相径庭。Matsumoto等[47-48]研究表明,凝胶多糖在室温下,0.05 mol/L NaOH溶液中以三螺旋构象存在;当c(NaOH)=0.1 mol/L时,则以双螺旋构象存在;当温度升高到60℃时,则全部转变为无规线团链。Zhang等[49]则认为凝胶多糖存在一个构象转变区(c(NaOH)为0.19~0.24 mol/L),在该区域螺旋链被逐股剥离,即三螺旋的一股链从三螺旋慢慢脱落,进而形成双螺旋,最后双螺旋解旋形成单股无规线团链;当c(NaOH)<0.19 mol/L时为三螺旋构象,而c(NaOH)>0.24 mol/L时以无规线团存在。对于裂褶菌多糖,当c(NaOH)>0.15 mol/L时,三螺旋转变为单链无规线团,且多糖溶液的黏度会随时间增加而降低[38]。Norisuye等[15]认为黏度随时间的降低反映了多糖的降解,在这个区间多糖的变性和降解同时发生。然而,Gawronski等[23,50]认为在转变区黏度的变化反映了多糖变性的动力学过程,即螺旋破坏程度的大小,不存在降解现象。甚至,有人认为裂褶菌多糖用NaOH处理后,三螺旋构象不是转变为单无规线团链,而是转变为单螺旋[51-53]。类似地,香菇多糖在c(NaOH)为0.05~0.08 mol/L溶液中时,其分子量、均方根旋转半径以及特性黏度值等参数降低,且不可逆[19]。为了阐明多糖在碱性条件下分子链构象参数转变是由多糖主链断裂降解还是高级结构变化导致,张俐娜等[19]通过考察比旋光的变化,证明香菇多糖在NaOH溶液中分子链构象参数的改变是由多糖链有序向无序的转变造成的,即三螺旋构象向单股无规线团的转变;同时,依据蠕虫状链模型理论进一步阐明,当香菇多糖的分子量超过2.33×105时,排除体积效应较为明显,OH-和多糖分子链的相互作用导致其主链更加伸展,刚性增加。
加热也是螺旋结构变性的有效途径。由于较强的氢键作用,三螺旋多糖的变性需要更高的温度,其在水溶液中完全解螺旋变性所需要的温度为135~140℃[41,54]。少量DMSO或者NaOH的加入不会明显改变三螺旋的解螺旋温度,当溶剂中ωDMSO<70%时,三螺旋的高温构象转变温度一直维持在130℃左右。导致这种现象的原因可能与DMSO、水及多糖分子内和分子间的氢键竞争作用有关[44-55]。当溶剂中ωDMSO>70%时,多糖分子更倾向于与DMSO形成新的氢键,从而破坏多糖侧链与水分子以及多糖与多糖间的相互作用。图5示出三螺旋香菇多糖在DMSO-H2O混合溶剂中的相图[41],诠释了温度以及溶剂对三螺旋多糖构象的影响。与裂褶菌多糖[44,56]相似,香菇多糖在DMSO-水混合溶液中,于0~40℃(ωDMSO=0~85%)时以三螺旋Ⅰ构象存在,对应于A区,在该区间,侧链糖基上的羟基与溶液中水分子之间的氢键作用维持其侧链和主链高度有序,即三螺旋Ⅰ构象;由于形成缔合水网络的氢键较弱,因此温度升高则容易被破坏,导致香菇多糖从A区进入B区,即三螺旋Ⅱ构象;只有当温度很高(140℃以上)或DMSO含量很高(ωDMSO>85%)时,香菇多糖才会从三螺旋解聚为单股柔顺链,即香菇多糖由B区转变为C区。

图5 香菇多糖在DMSO-水混合溶液中的相图变化[41]Fig.5 The phase diagram for Lentinan in DMSO-water mixtures[41]
2.3三螺旋结构的复性
多糖的三螺旋结构变性成单链后是否能再组装形成三螺旋结构?本文把三螺旋再形成的过程称为三螺旋结构的复性。有人认为三螺旋多糖高温构象的变性行为是一个不可逆过程,因为解螺旋后的单链,完全匹配的三股链依靠氢键重新构建新的三螺旋的几率几乎为零[44]。也有人提出类似于DNA双螺旋的复性,变性的三螺旋多糖可以发生复性,但复性过程和产物更为复杂。实验证明,多糖的三螺旋结构破坏后在一定条件下可复性成为三螺旋。例如,将三螺旋硬葡聚糖在160℃加热15 min变性成为单链后,在低于构象转变温度的某一高温下退火,然后冰浴淬火至室温可以复性;退火温度越高,直链三螺旋成分越多;而且当退火时间大于18 h,复性多糖会出现大的“团簇”聚集体[57]。由此可见,退火温度和时间严重影响多糖的复性。退火温度与变性温度之差越小,直至退火温度逐渐减小到室温,多糖越易复性为直链三螺旋构象。多糖分子量的均一性也是影响复性产物结构的重要因素。一般分子量分布越窄,复性后多糖的直链三螺旋结构越多;多糖的分子量越低,直链三螺旋也会相应增加,分子量太高反而会引起分子链之间的“团簇”聚集。
多糖的浓度也是复性多糖结构多样性的影响因素之一。三螺旋香菇多糖质量浓度太高,在DMSO-H2O混合溶液中(ωDMSO=5%)的复性产物容易出现大的“团簇”聚集体;质量浓度太低,多糖单链各自孤立存在,难以相互作用复性成为三螺旋。因此1×10-3~2×10-3g/m L被认为是变性香菇多糖复性的最佳质量浓度[58]。此外,混合溶液中DMSO的含量也会影响多糖的复性行为,当ωH2O<15%时,多糖分子链仍然以无规线团存在;当ωH2O≥25%时,单股分子链由于分子内氢键的增强导致链的收缩和塌陷,进而形成球形结构和聚集体;只有当ωH2O>50%时,多糖链才可能重组形成三螺旋构象;复性后多糖的黏度、杨氏模量以及旋光度比复性前螺旋多糖都有减小,进一步证明复性过程的不可逆性以及复性多糖构象的多样性[59]。

图6 硬葡聚糖经变性-复性后的原子力显微镜图(a);变性硬葡聚糖复性后可能存在的结构示意图(b)[65]Fig.6 Tapping-mode AFM height topographs of renatured scleroglucan samples(a);Schematic illustration of possible structural imperfections in renatured triplex structure(b)[65]
三螺旋多糖复性产物的形态复杂多样,主要以直链和环状的三螺旋结构存在,同时还出现Y形支链状、发簪状三螺旋和团簇多种结构[57]。环状三螺旋多糖的出现(图6(a)),如同DNA复性过程中环状双螺旋结构的出现,引起了研究者的极大兴趣。Stokke等[60-63]通过原子力显微镜对变性裂褶菌多糖和硬葡聚糖复性后的链形态进行观察,复性后的多糖存在着大量的环状结构,且环状结构会随着退火温度的增加而逐渐减少。他们还首次利用动态光散射和SEC-MALLS证明复性多糖的环状结构也是一种三螺旋结构体[63-64]。环状三螺旋比直链三螺旋具有更自由的连接组合方式,可通过熵增的方式弥补刚性链弯曲造成的能量损失。因此,三螺旋的刚性直链结构并不是其能量最稳定的构象。他们还认为,在复性过程中硬葡聚糖的单链分子首先会形成一个“有缺陷的线性三螺旋链”结构(图6(b)),随着复性时间的增加,这些区域的分子链会通过氢键自动排列逐渐形成完整的三螺旋结构[65]。可见,三螺旋结构的复性过程非常复杂,导致复性产物的构象也呈多样变化。
如何控制多糖的复性构象,在复性过程中得到完整的三螺旋构象,这对多糖的生物活性及其功能应用具有重要意义。许小娟等[66]利用Nano-DSC对三螺旋多糖在ωDMSO=5%的混合溶液中的复性过程及链形态进行了较系统的研究。结果表明,香菇多糖复性产物中除含三螺旋(图7(a)中的T 1吸热峰)和单链外,还存在不完整的双螺旋片段(图7(c)),即图7(a)中的T 2吸热峰,且该双螺旋片段随复性时间的推移逐渐形成完整三螺旋结构;同时,研究证明通过调控混合溶剂极性的改变速率可获得完整的三螺旋构象(图7(b),ML)。该实验结果可以通过两种假设来解释水交换速率对多糖构象的影响,即“先自组装再伸展”和“先伸展再匹配组装”(图7(d))。当把大量的水瞬间加入到多糖-DMSO溶液中时,处于无规线团构象的多糖链瞬时被加入的水分子通过氢键作用所固定,导致多糖链无法及时伸展,随后分子链之间通过氢键重组,发生链与链之间错误匹配的几率增大,导致形成具有缺陷的三螺旋结构的可能性增大;当以透析或者模拟透析(溶剂替换比透析更慢)的方式进行复性时,水分子慢慢渗透到多糖分子链之间,有利于多糖分子链在水分子作用下慢慢伸展,然后发生链与链之间的匹配重组,形成具有完整三螺旋结构的多糖。
3 多糖的分子识别与生物活性
多糖大分子链在溶液中的空间三维结构对生物功能的影响以及对生命科学的发展都具有十分重要的意义。由于其较高的免疫调节[67]、抗肿瘤[68-69]以及抗炎[70]等活性,已经作为一种免疫反应修饰剂和调节剂广泛用于医学领域,并成为新药研究的前沿领域和研究热点[71-72]。然而,究竟是三螺旋多糖的单链还是三螺旋构象使其具有较高的生物活性仍然存在争议。三螺旋多糖的单链需要在高温、强碱或者极性溶剂DMSO中才能获得,这些条件在生物体内难以获得。因此,研究三螺旋多糖在单链状态下的生物功能非常困难。Kojima等[73]利用凝胶渗透色谱从裂褶菌多糖中分离出具有单链和三螺旋结构的多糖试样,并将其水溶液分别注射到小鼠体内。结果显示,三螺旋多糖表现出较强的抗S-180肿瘤生物活性,而单链多糖的抗肿瘤效果几乎消失;该结果充分表明三螺旋构象对于多糖生物活性的重要性。Stokke等[74]通过对硬葡聚糖免疫活性的研究表明,完整的线性三螺旋结构是保持多糖较高免疫活性的前提条件,用高浓度NaOH溶液将其变性,再用酸中和复性后,形成的富含环状结构的复性多糖却显示较低的刺激肿瘤坏死因子(TNF-α)分泌的能力。张俐娜等[68]的研究表明,三螺旋香菇多糖具有较高的抗S-180肿瘤的活性,抑制率达到50.5%;而变性后的单链多糖则显示较低的抑制率(12.3%)。在机体的免疫应答过程中,巨噬细胞中NO的合成以及鲎因子G的活化刺激都显著依赖于多糖的三螺旋构象[75]。综上所述,适当的分子量和三螺旋链构象均有利于三螺旋多糖抗癌活性的提高。

图7 复性香菇多糖在DMSO-H2O(ωDMSO=5%)混合溶液中不同复性时间下的热容曲线(a);复性香菇多糖在不同复性模式下的热容曲线,第2个吸热峰(35~48℃)在图中用箭头进行了标记(b);复性香菇多糖结构体中可能存在的双螺旋片段示意图(c)[66];香菇多糖链在混合溶剂中可能存在的2种复性机制(d)Fig.7 Temperature dependence of excess heat capacity for r-LNT at different storage time in DMSO-H2O(ωDMSO= 5%)solutions(a);DSC thermograms for r-LNT against different renaturation mode,the second endothermic peak(35~48℃)in DSC curves was indicated by arrow(b);Schematic illustration of possible duplex segment in the renatured triplex(c)[66];Schematic illustration of possible renaturation mechanisms for denatured polysaccharide in binary solvents(d)
4 三螺旋β-葡聚糖构象转变诱导糖基功能化材料的构建
4.1纳米功能材料的构建
多糖螺旋结构的破坏与转变对于其生物活性的高效表达是不利的,因此保持多糖螺旋结构的完整性尤为重要。有趣的是,Shinkai等[8]却充分利用裂褶菌多糖以及凝胶多糖的三螺旋构象转变特性,构建了一系列纳米复合功能材料,极大地拓宽了螺旋多糖的应用领域。具有大π键共轭体系的聚合物,比如聚苯胺、聚噻吩等,是一类新型的导电高分子,分子之间容易发生无规聚集,严重影响其卓越的物理性能。Shinkai等利用变性三螺旋裂褶菌多糖可复性形成疏水空腔的特点,在一维尺度上构建了有序结构的聚苯胺纳米纤维[76]以及手性聚噻吩纳米线[77](图8(a))。同时,由于构建的超分子体系是多糖链通过非共价键作用包裹客体分子而形成的,对裸露在表面的多糖进行功能化修饰,还可以赋予超分子体系更加丰富的功能。比如,将多糖进行甘露糖化修饰,可用于伴刀豆球蛋白A的分子识别[76]。如图8(b)所示,荧光标记的伴刀豆球蛋白A被超分子纳米纤维表面甘露糖基化的多糖分子识别,并紧密地结合在一起。

图8 手型聚噻吩纳米线在裂褶菌多糖三螺旋空腔中的构建示意图(a)[77];超分子聚苯胺-多糖复合材料的构建示意图,从左到右依次为甘露糖修饰的复合材料与FITC标记的伴刀球蛋白A相互作用的共聚焦显微图、光学显微图和两者的叠加图(b)[76];利用变性的三螺旋裂褶菌多糖构建聚烷氧基硅烷纳米线的示意图(c)[78];三螺旋裂褶菌多糖疏水空腔作为纳米反应容器的示意图(d)[81-82];利用变性三螺旋香菇多糖制备Au纳米粒子和纳米线的示意图(e)[83]Fig.8 Schematic illustration of the chirally insulated PT-N+in the helical SPG cavity(a)[77];Concept of the supramolocular functionalization of the entrapped PANIs(up),CLSM images of PANIs/mannose-modified SPG composite binded with FITC-Con A(down),form left to right:fluorescence image,optical microscope image and overlapped image(b)[76];Schematic illustration of the composite formation of s-SPG with PMDS (c)[78];Schematic illustration of our concept to utilize SPG as the reaction vessels(d)[81-82];Scheme of synthesis and dispersion of Au NPs by s-LNT at different concentrations(e)[83]
三螺旋多糖不仅可以在水体系和强极性的有机溶剂中进行纳米材料的构建,也可以与一些只能溶于非极性有机溶剂的高聚物相互作用,并将其包裹在空腔内形成一维纳米复合材料。如图8(c)所示,将癸硅烷的环己烷溶液与变性的三螺旋多糖强碱溶液互混超声分散后,用酸中和复性,癸硅烷分子链即被包裹在复性的三螺旋结构空腔内,形成新的纳米复合材料[78]。此外,染料小分子也可与三螺旋多糖在复性过程中形成包合物。偶氮苯[79]和吡咯衍生物[80]小分子在三螺旋裂褶菌多糖的空腔里通过π-π堆叠或者偶极相互作用定向排列,形成具有不同光学特性的纳米分子器件。甚至,二苯丁二炔衍生物[81]以及烷氧基硅烷[82]等一些聚合物单体也能以相同的方式进入疏水空腔,在外界条件下引发聚合,形成一维尺度的聚合物纳米纤维(图8(d))。多糖本身具有相对较高的化学惰性,为聚合物单体提供了一个纳米级的反应环境。
三螺旋多糖不仅可以利用疏水空腔包覆多种客体分子,而且含大量羟基的多糖链还是一种良好的分散剂和还原剂。许小娟等[83]提出了一种利用三螺旋香菇多糖在水溶液中“一锅法”合成和分散金纳米粒子(Au NPs)的“绿色”方法。如图8(e)所示,高温(140℃)变性得到的三螺旋香菇多糖单链(s-LNT)在无还原剂的条件下,能将Au3+还原形成Au NPs;而且通过改变多糖的浓度、反应温度以及时间还可调控Au NPs的形状和尺寸;Au3+在低s-LNT浓度下首先主要形成纳米带结构,随着反应的进行,金纳米带进一步分散成球形纳米粒子;而较高的多糖浓度则能够迅速促进球状Au NPs的形成,且Au NPs被诱导紧密排列在复性的三螺旋疏水空腔内,形成稳定的纳米线。Au NPs与多糖链上羟基基团之间的相互作用和Au NPs被包裹进复性多糖的疏水空腔为其在水溶液中的稳定分散提供了保障。Bae等[84]利用羟胺化学还原和激光诱导熔融相结合技术,以变性裂褶菌多糖糖链为分子模板,也成功构建了Au纳米线一维纳米材料。相比之下,前者提出的方法更为绿色、简单。基于该特性,将多糖链作为反应位点,经NaBH4还原形成的纳米Se粒子[85]和Ag粒子[86]也可均匀地分散在多糖的水溶液中,形成稳定的糖基复合物;制备得到的Se-香菇多糖复合物显示出较高的抗肿瘤特性,而Ag-香菇多糖复合物则具有特殊的紫外吸收效应。此外,香菇多糖三螺旋刚性链向柔顺链的转变可影响多糖链上邻近Ag纳米粒子的电磁场耦合效应,导致产生新的紫外吸收峰。因此,可通过UV-Vis光谱的变化指示多糖三螺旋构象的转变[86]。
4.2胶束载体的构建
三螺旋多糖作为一类重要的天然高分子,不仅具有优良的抗肿瘤和抗炎症等生物活性[69-70],而且还具有被鼠和人的巨噬细胞、树突状细胞以及淋巴相关组织细胞特异性识别的特性[69,87],因此,其具有作为载体材料的独特优势。Numata[88]等利用三螺旋构象变性-复性的特性,将三螺旋裂褶菌多糖(SPG)溶解在极性溶剂DMSO中变性,然后与聚苯乙烯(PS)-甲苯溶液在油水复合溶剂的O/W乳化界面,通过非共价键作用力自组装构建了一种两亲性胶束载体。如图9所示,在界面处,变性SPG多糖链的复性行为使其缠绕在部分PS链上。该超分子自组装体具有PS组成的疏水核和葡聚糖形成的亲水壳。同时,将疏水分子卟啉(TMPP)加入PS溶液中,自组装形成的胶束只有核发光,且放置长时间TMPP没有沉淀,表明TMPP通过疏水作用进入到疏水核中,并稳定分散。此外,若对变性三螺旋多糖的分子链进行化学修饰,阻碍或干扰其复性行为,也可通过疏水作用构建药物载体胶束。

图9 乳化作用构建裂褶菌多糖胶束的示意图以及糖链在胶束表面缠绕部分聚苯乙烯分子链构建亲水界面的示意图[88]Fig.9 Concept proposed for the creation of microspheres on the emulsion template,and schematic representation of the partial wrapping of the hydrophobic polymer by SPG[88]
Maeda等[89]在裂褶菌多糖的侧链引入疏水基团奈,分子链通过疏水物理交联作用可以形成微凝胶,并通过受体作用将盐酸阿霉素特异性运送到免疫细胞内。Nasrollahi等[90]在凝胶多糖分子链上引入阿霉素和曲妥单抗双官能团,构建的药物载体纳米颗粒可靶向运送盐酸阿霉素,显著改善Her2+乳腺癌治疗的效果。
4.3杂交螺旋结构功能材料的构建
三螺旋多糖在复性过程中,不仅可通过分子链的自我识别以及重组形成三螺旋结构,还可在一定条件下特异性识别其他高分子链杂化形成新的三螺旋复合物。Shinkai等[12]将变性的凝胶三螺旋多糖(Curorg)与具有共轭体系的噻吩聚合物(PT1)相互作用(图10(a)),构建了一种新型的复合物;复合物中,2条高分子链相互缠绕,形成较松散的、右旋双螺旋结构,赋予共轭聚合物链运动的自由性和共轭长度的有效性;该复合物显示新颖的热敏性,可以作为一种潜在的“分子温度计”器件。

图10 聚噻吩阳离子PT1、PEG化凝胶多糖以及两性化凝胶多糖的化学结构(a);PT1/Cur-oeg复合物在溶液中5~85℃下的光学照片(b);PT1/Cur-oeg复合物膜分别在潮湿空气、甲醇蒸汽以及真空干态下的图片(左),不同溶剂蒸汽诱导复合物膜颜色变化的机制示意图(右)(c)[12];ACs/PT1复合物在不同p H溶液中紫外光下的光学图片(d)[91]Fig.10 Chemical structures of a cationic polythiophene(PT1),a PEGylated Curdlan(Cur-oeg)and an amphoteric curdlan(ACs)(a);Photographs of the PT1/Cur-oeg complex solution under the temperature control from 5~85℃(b);Photographs of PT1/Cur-oeg film which was subjected to humid air and methanol vapor and then dried in vacuo again(left);Schematic representation of the vapor-induced color change in PT1/Cur-oeg complex film(right)(c)[12];Photos of the emission color change for ACs/PT-1 complex aqueous solution with the p H change under the UV irradiation(d)[91]
在5~85℃,复合物的颜色随温度变化而发生明显改变,由橙色转变成黄色,且具有可逆性(图10(b));同时,该复合物干态膜还可以作为一种潜在的“湿度或者有机气体的传感器”(图10(c)),当把复合膜暴露在潮湿的空气中时,膜由橙色转变成紫红色。这种颜色的变化是由于复合膜与水蒸气接触时,不良溶剂导致松散的双螺旋结构中PT1分子链部分片段的解离与聚集。因此,这种变化是不可逆的,当把膜真空干燥后也不会恢复原来的橙色。然而,将膜浸润在甲醇蒸气后,膜由紫红色恢复转变成原来的颜色。这主要是因为甲醇作为PT1的良溶剂,可促进PT1分子链的解聚,并与糖链重组形成初始结构。若在凝胶多糖糖单元引入不同的功能基团,如-NH2,其与PT1构建的复合物则具有p H响应性[91]。基于凝胶多糖的两性特性,该复合物在不同的p H条件下结构会发生变化,继而产生不同颜色的荧光,并且肉眼可见。复合物在溶液中会随p H由低到高的转变依次显示绿色→黄色→橙黄色→淡粉色→淡紫色→蓝色的荧光变化(图10(d))。由此,该复合物可以作为一种检测p H变化的荧光分子探针。
5 三螺旋多糖与核酸之间的特异性分子识别与功能
5.1三螺旋多糖与核酸分子之间的特异性识别
多糖能够通过氢键作用实现对客体分子的特异性识别[92-93]。如前所述,变性的三螺旋多糖可以依靠较强的分子间氢键作用,重新实现三螺旋结构的构建。三螺旋多糖的这种复性行为与核酸分子之间的碱基配对极其相似。文献报道,当变性的三螺旋多糖与特殊序列的均聚核酸分子混合时,多糖链上的羟基和核酸链上的碱基之间依靠较强的氢键作用能够实现彼此的特异性识别,形成一种新的复合物[93-95]。例如,三螺旋香菇多糖的单链(s-LNT)与聚脱氧腺嘌呤核苷酸(poly(d A))相互作用,导致poly(d A)的圆二色谱和紫外吸收光谱发生显著变化(图11(a,b))。这主要是由于s-LNT通过氢键诱导poly(d A)在复合物中以螺旋的形态存在,导致相邻碱基之间的堆叠作用增强。Sakurai等[93]认为碱基和糖单元之间的疏水和氢键作用在复合物的形成过程中起关键作用,形成的复合物与线性三螺旋多糖结构极其相似。与多糖的三螺旋结构相比,复合物可以看作是一条聚脱氧腺嘌呤核苷酸链替代了其中一条多糖链,和另外两条多糖链构建的三螺旋结构(图11(c))。Sakurai等[96]通过分子模拟对凝胶多糖与聚胞嘧啶核苷酸(poly(C))形成的复合物进行计算,分析得出复合物中多糖链与核苷酸链主要依赖两种氢键作用维持其结构稳定,碱基上的N3与糖单元的C2-OH以及N4上的质子与另外一条多糖链上的O-2之间形成氢键(图11(d))[96];同时,证明复合物的圆二色谱最大吸收峰强度与两者的化学计量比具有显著的依赖关系[93]。通过对平衡点计量比例的计算,进一步揭示复合物由两条多糖链与一条核酸链构成,形成的三螺旋复合物在原子力显微镜下呈现棒状链结构[97]。此外,光散射和小角X-射线散射也证明两者形成的复合物是一种棒状链结构[98]。多糖链与均聚核苷酸分子链之间的特异性分子识别能力是三螺旋多糖所特有的。除poly(d A)外,聚腺嘌呤核苷酸(poly (A))、聚胞嘧啶核苷酸(poly(C))和聚脱氧胸腺嘧啶核苷酸(poly(d T))都可以与变性的三螺旋多糖相互作用形成三螺旋复合物。然而,聚尿嘧啶核苷酸(poly(U))、聚鸟嘌呤核苷酸(poly(G))、聚次黄嘌呤核苷酸(poly(I))、聚脱氧胞嘧啶核苷酸(poly(dC))和聚脱氧鸟嘌呤核苷酸(poly(d G))都不能和变性的三螺旋多糖单链相互作用形成复合物,因为这些核苷酸链在水溶液中通过分子内氢键形成了二聚或者三聚体,导致与多糖链相互作用的氢键位点被占据[93-94]。此外,复性后的三螺旋香菇多糖与poly(d A)也可以相互作用形成复合物[95],这主要是因为复性后的多糖存在大量不完整三螺旋结构,裸露的氢键键合位点可以与核苷酸作用。然而,当变性多糖以透析或者模拟透析的方式进行复性后,复性的多糖主要以完整的三螺旋结构存在[66],其与核苷酸几乎不发生作用。该结果进一步证明,在复性过程中,溶剂水含量改变的速率对于调控三螺旋结构形成的重要性,多糖与聚核苷酸分子链中裸露的氢键键合位点是两者相互作用的基础。
荧光共振能量转移和荧光各向异性分析技术的快速发展也为研究多糖链与均聚核苷酸链之间的相互作用提供了更加快速的方法。许小娟等[99]利用氧化石墨烯(GO)作为猝灭平台,以荧光FAM标记的核苷酸poly(d A)作为分子探针P1,构建了一种检测β-葡聚糖与聚核苷酸相互作用的传感器。如图12(a)所示,香菇多糖链s-LNT显著增强了溶液的荧光强度,表明poly(d A)与变性的香菇多糖形成了三螺旋复合物;与此同时,s-LNT在极短时间内引起P1各向异性值的剧烈增加(图12(b)),进一步证实多糖链与核苷酸链之间的特异性相互作用。此外,研究表明,具有不同侧链结构的三螺旋多糖与核苷酸形成的复合物在氧化石墨烯表面具有不同的自组装行为。如图12(c)所示,带侧链的s-LNT选择性识别分子探针P1形成刚性结构的复合物,远离GO表面,促使荧光强度恢复;而直链凝胶多糖s-CUR水溶性差,选择性识别P1形成复合物后仍通过疏水作用附着在疏水的GO表面,引起较弱的荧光恢复。由此,利用荧光共振能量转移与荧光各向异性分析方法检测三螺旋多糖单链与聚核苷酸相互作用具有更高的灵敏度。

图11 poly(d A)、t-LNT以及复合物poly(d A)/s-LNT在DMSO-H2O(ωDMSO=5%)混合溶液中的紫外图谱(a)[95];poly(d A)、t-LNT以及复合物poly(d A)/s-LNT在DMSO-H2O(ωDMSO=5%)混合溶液中的圆二色谱谱图(b)[95];分子模拟方法获得的复合物poly(C)/s-SPG最稳定的结构形态(c)[96];凝胶多糖与poly(C)之间的两种氢键作用(d)[96];poly(C)与s-SPG相互作用的工作绘制曲线,Ms-SPG和Mpoly(C)分别为裂褶菌多糖重复单元与核酸单元的摩尔浓度(e)[93]Fig.11 UV spectra for poly(d A),t-LNT,and poly(d A)/s-LNT in DMSO-H2O(ωDMSO=5%)solution(a)[95];CD spectra for poly(d A),t-LNT,poly(d A)/s-LNT,and poly(d A)/t-LNT in DMSO-H2O(ωDMSO=5%)solution(b)[95];The most stable structure for the poly(C)/s-SPG complex obtained by molecular mechanics calculations(c)[96];Hydrogen bonds between Curdlan and poly(C)in the complex(d)[96];The job plot for the poly(C)+s-SPG system,where Ms-SPGand Mpoly(C)are the molar concentrations of poly(C)and s-SPG,respectively(e)[93]
5.2三螺旋多糖-核酸复合物的功能
三螺旋多糖单链对聚核苷酸分子的特异性识别是三螺旋多糖所特有的功能,它作为一种新型材料在m RNAs的分离提取[100]以及基因转染方面[11,101-102]都具有应用前景。具有蛋白质编码功能的m RNAs序列的分析和检测是基因工程和DNA重组技术的关键步骤[103],简单且快速地从RNA(tRNAs、r RNAs和mRNAs)序列中分离提取mRNAs非常重要。大多数真核生物的mRNAs中都含有一个具有150~300碱基数的聚腺嘌呤核苷酸poly(A)片段,为变性三螺旋多糖提供了作用位点。将变性三螺旋多糖与色谱柱填料通过共价键连接作为固定相,含m RNAs的缓冲液经过色谱柱时,m RNAs上的poly(A)片段与多糖形成复合物,从而达到分离的目的。键合在色谱柱上的m RNAs经过70℃热水处理后,会从固定相上解离下来。因此,依赖多糖与核酸分子的识别作用可以实现mRNAs高效快速的分离。
变性三螺旋多糖与核酸形成的复合物还可作为一种潜在的基因载体,是此类复合物最具特色的功能。多糖与核酸构建的复合体系作为一种优秀的基因载体具备以下几个特点:首先,三螺旋多糖是一种具有良好生物相容性且无细胞毒性的多糖,同时还具有多种生物活性;其次,三螺旋多糖本身对巨噬细胞具有靶向性,可以被细胞表面的受体识别,进而被细胞摄取达到基因转染的目的;第三,通过对三螺旋多糖侧链的功能化修饰,可以达到多糖的特异性靶向识别,尤其是肿瘤细胞,可以较大程度地提高基因治疗的效果;第四,多糖与核酸构建的复合物具有较高的稳定性,同时复合物的形成还可以在转染过程中有效地保护核酸,避免酶对转染基因的降解;第五,两者形成的复合物体系在内体或者溶酶体较低的p H环境中可以解离,释放的基因序列经内体逃逸后可以进行表达。
Shinkai和Sakurai等将目标DNA序列与poly(d A)40片段以3种方式通过共价键连接,如图13所示,然后利用变性的裂褶菌多糖s-SPG与poly(d A)40片段相互作用,构建了一种新型的基因载体,成功用于Cp G DNA[11]、反义DNA[104-105]、siRNA[106]以及双螺旋DNA[101-102]的转染。

图12 分子探针P1在不同条件下的荧光光谱(a);荧光分子探针P1在分别加入变性多糖s-LNT以及三螺旋多糖t-LNT后的荧光各向异性值随时间的变化曲线(b);分子探针P1与不同类型的变性三螺旋多糖在氧化石墨烯表面的相互作用机制示意图(c)[99]Fig.12 Fluorescence emission spectra of P1 at different conditions(a);Fluorescence anisotropy changes of P1 in Tris-HCl buffer by adding s-LNT and t-LNT as a function of time(b);Schematic illustration of in situ molecular probing the interaction between P1 and denatured triple-helicalβ-glucans(c)[99]
许小娟等[107-108]在转染体系中引入二硫键,并基于三螺旋香菇多糖单链与poly(d A)50的相互作用成功构建了一种新颖的基因载体。如图14(a)所示,将Cp G DNA与poly(d A)50通过二硫键结合,然后与s-LNT相互作用,形成DNA-SS-poly(d A)50/s-LNT复合物;二硫键可以在不同的氧化还原势能下发生断裂,即在细胞外,二硫键可以稳定存在;而在细胞内,在较多还原性物质(如半胱氨酸、γ-干扰素诱导的巯基还原酶(GILT)以及谷胱甘肽(GSH)等)作用下可发生断裂[109]。因此,二硫键的引入使复合物具备了刺激响应性,能够在细胞内实现智能释放,从而避免poly(d A)片段对目标基因转染的干扰。同时,通过对不同分子量多糖构建的基因载体转染效率的考察,分子量为7.0×104的多糖构建的基因载体显示出较高转染效率(图14 (b)),这主要归因于适当分子量多糖构建的基因载体不仅具备一定的稳定性,而且具有适当大小的粒径尺寸,从而能被细胞摄取。转染体系进入细胞后,Cp G DNA从体系中释放出来,并被钟样受体TLR-9识别,促进细胞因子IL-12p40的大量分泌(图14(c))。二硫键的引入显著提高了复合物载体的转染效率。

图13 两端修饰双链DNA的示意图(a)[101];仿病毒结构修饰DNA的示意图(b)[102];SPG与d A-siTNFa的特异性识别与复合物的构建示意图,用于基因转染体系(c)[106]Fig.13 Proposed methods to modify the end of double-stranded DNAs(a)[101];The DNA design concept for increasing transfection by imitating viral genomes(b)[102];Schematic illustration to show a complex structure made from d A-siTNFa and SPG and its molecular specificity(c)[106]

图14 将目标基因与poly(d A)50通过二硫键键合,s-LNT与poly(d A)50构建Cp G DNA基因载体的示意图(a);流式细胞检测空白样品与Cy3标记的复合物基因载体在RAW264.7细胞中的摄取效率(b);RAW264.7细胞在不同化学物质刺激作用下,细胞因子的释放含量(c)[107]Fig.14 Concept proposed for the CpG DNA delivery system fabricated by s-LNT and poly(d A)50via disulfide bonding (a);Flow cytometry images of the blank and complexes Cy3-DNA1-SS-poly(d A)50/s-LNT iuptaken by RAW264.7(b);The cytokine secretions from RAW264.7 cells stimulated by various chemicals(c)[107]
此外,对多糖的功能性修饰也可显著提高三螺旋多糖作为载体的优越性。修饰后的多糖与聚核苷酸形成的复合物与细胞之间的特异性识别功能更加灵敏,可显著提高转染基因的表达效果。比如,精胺和R8多肽(精氨酸)修饰的裂褶菌多糖有效提高复合物载体与抗原呈现细胞的识别能力,从而大幅度提高了CpG DNA转染效率[11,110];叶酸[111]和β-乳糖苷基团[112]的引入还可以提高复合物分别对肿瘤细胞以及肝细胞的选择性识别能力;对多糖PEG化修饰[113]还能有效避免基因转染过程中溶酶体对基因序列的降解,较大程度地提高基因转染效率。
三螺旋多糖与poly(d A)构建的功能复合物不仅能够促进免疫因子的释放,引起人体相应的免疫应答,而且,实验研究显示K Cp G DNA与裂褶菌多糖构建的复合物还能靶向作用于核内体,诱导外周血浆单核细胞产生大量的Ⅰ和Ⅱ型干扰素[114]。复合物能够在淋巴结的巨噬细胞和树突状细胞中富集,因此,该复合物可以作为一种有效的免疫佐剂,与抗原一起诱导人体的体液和细胞免疫应答,尤其刺激杀伤性T细胞的免疫分化。随着合成化学技术的迅速发展,三螺旋多糖基复合物还成功地用于蛋白多肽分子的转运,并在癌症和传染病的治疗中表现出优异性能[115]。例如,卵清蛋白多肽片段(OVA257-264)与poly(d A)40通过共价键结合,可与变性裂褶菌多糖构建功能复合物。同时,它与Cp G DNA/裂褶菌多糖复合物能够协同作用,显著降低肿瘤细胞的数量以及延缓肿瘤细胞的生长。
6 展 望
多糖作为继蛋白质和核酸之后的第三大生物高分子,其糖苷键键型和键接方式的多样性导致多糖的高级结构复杂多样,因此多糖能够承载更多的生物信息。三螺旋多糖的高级结构直接决定其生物功能,由此,剖析并精准调控多糖螺旋结构的形成,阐明它们与蛋白质、核酸之间的相互作用将成为揭开生命奥秘的钥匙。同时,变性三螺旋多糖对客体分子的识别,以及以螺旋链构象为模板诱导自组装构建的糖基功能材料,在生物医药、化学传感、手性聚合以及纳米材料领域具有无可比拟的优势和应用前景。
[1] GABIUS H J.Biological Information Transfer Beyond the Genetic Code:The Sugar Code[M].Germany:Springer,2008,223-246.
[2] RINAUDO M.Non-covalent Interactions in polysaccharide systems[J].Macromolecular Bioscience,2006,6(8):590-610.
[3] 张俐娜,许小娟,周金平,等.天然高分子科学与材料[M].北京:科学出版社,2007:114.
[4] 李盛,许淑琴,张俐娜.菌类多糖链构象及其表征方法研究进展[J].高分子学报,2010(12):1359-1375.
[5] YANAKI T,ITOH W,TABATA K.Correlation between the antitumor activity of schizophyllan and its triple helix[J]. Agricultural and Biological Chemistry,1986,50(9):2415-2416.
[6] YANAKI T,ITO W,TABATA K,et al.Correlation between the antitumor activity of a polysaccharide schizophyllan and its triple-helical conformation in dilute aqueous solution[J].Biophysical Chemistry,1983,17(4):337-342.
[7] MUELLER A,RAPTIS J,RICE P J,et al.The influence of glucan polymer structure and solution conformation on binding to(1→3)-β-D-glucan receptors in a human monocyte-like cell line[J].Glycobiology,2000,10(4):339-346.
[8] CHO B K,SHIMIZU T.Self-assembled Nanomaterials[M].Germany:Springer,2008:65-122.
[9] KIM O K,JE J,BALDWIN J W,et al.Solubilization of single-wall carbon nanotubes by supramolecular encapsulation of helical amylose[J].Journal of the American Chemical Society,2003,125(15):4426-4427.
[10] SAKURAI K,UEZU K,NUMATA M,et al.β-1,3-Glucan polysaccharides as novel one-dimensional hosts for DNA/ RNA,conjugated polymers and nanoparticles[J].Chemical Communications,2005(35):4383-4398.
[11] MIZU M,KOUMOTO K,ANADA T,et al.A polysaccharide carrier for immunostimulatory Cp G DNAs to enhance cytokine secretion[J].Journal of the American Chemical Society,2004,126(27):8372-8373.
[12] SHIRAKI T,DAWN A,TSUCHIYA Y,et al.Thermo-and solvent-responsive polymer complex created from supramolecular complexation between a helix-forming polysaccharide and a cationic polythiophene[J].Journal of the American Chemical Society,2010,132(39):13928-13935.
[13] 刘青业.变性三螺旋β-葡聚糖的复性及其与DNA的相互作用和功能[D].湖北武汉:武汉大学,2014.
[14] YANAKI T,NORISUYET,FUJITA H.Triple helix of Schizophyllum commune polysaccharide in dilute solution.3. Hydrodynamic properties in water[J].Macromolecules,1980,13(6):1462-1466.
[15] KASHIWAGI Y,NORISUYE T,FUJITA H.Triple helix of Schizophyllum commune polysaccharidein dilute solution.4. Light scattering and viscosity in dilute aqueous sodium hydroxide[J].Macromolecules,1981,14(5):1220-1225.
[16] WANG Yuchun,MCNEIL B.Scleroglucan[J].Critical Reviews in Biotechnology,1996,16(3):185-215.
[17] BLUHM T L,SARKO A.The triple helical structure of lentinan,a linearβ-(1→3)-D-glucan[J].Canadian Journal of Chemistry,1977,55(2):293-299.
[18] ZHANG Lina,ZHANG Xufeng,ZHOU Qi,et al.Triple helix ofβ-D-glucan from Lentinus edodes in 0.5 M NaCl aqueous solution characterized by light scattering[J].Polymer Journal,2001,33(4):317-321.
[19] ZHANG Xufeng,ZHANG Lina,XU Xiaojuan.Morphologies and conformation transition of lentinan in aqueous NaOHsolution[J].Biopolymers,2004,75(2):187-195.
[20] DESLANDES Y,MARCHESSAULT R,SARKO A.Triple-helical structure of(1→3)-β-D-glucan[J].Macromolecules,1980,13(6):1466-1471.
[21] MIYOSHI K,UEZU K,SAKURAI K,et al.Proposal of a new hydrogen-bonding form to maintain curdlan triple helix [J].Chemistry and Biodiversity,2004,1(6):916-924.
[22] SAITÔH,TABETA R,YOSHIOKA Y,et al.A high-resolution solid-state13C NMR study of the secondary structure of branched(1→3)-β-D-glucans from fungi:Evidence of two kinds of conformers,curdlan-type single-helix and laminarantype triple-helix forms,as manifested from the conformation-dependent13C chemical shifts[J].Bulletin of the Chemical Society of Japan,1987,60(12):4267-4272.
[23] GAWRONSKI M,DONKAI N,FUKUDA T,et al.Triple helix of the polysaccharide cinerean in aqueous solution[J]. Macromolecules,1997,30(22):6994-6996.
[24] YOUNG S H,DONG Wenji,JACOBS R R.Observation of a partially opened triple-helix conformation in 1→3-β-glucan by fluorescence resonance energy transfer spectroscopy[J].Journal of Biological Chemistry,2000,275(16):11874-11879.
[25] DUNSTAN D E,GOODALL D G.Terraced self assembled nano-structures from laminarin[J].International Journal of Biological Macromolecules,2007,40(4):362-366.
[26] WANG Jiatang,XU Xiaojuan,ZHENG Hua,et al.Structural characterization,chain conformation,and morphology of a β-(1→3)-D-glucan isolated from the fruiting body of dictyophora indusiata[J].Journal of Agricultural and Food Chemistry,2009,57(13):5918-5924.
[27] KONY D B,DAMM W,STOLL S,et al.Explicit-solvent molecular dynamics simulations of the polysaccharide schizophyllan in water[J].Biophysical Journal,2007,93(2):442-455.
[28] OKOBIRA T,MIYOSHI K,UEZU K,et al.Molecular dynamics studies of side chain effect on theβ-1,3-D-glucan triple helix in aqueous solution[J].Biomacromolecules,2008,9(3):783-788.
[29] BURCHARD W.Structure formation by polysaccharides in concentrated solution[J].Biomacromolecules,2001,2(2):342-353.
[30] ZHANG Yangyang,LI Sheng,ZHANG Lian.Aggregation behavior of triple helical polysaccharide with low molecular weight in diluted aqueous solution[J].The Journal of Physical Chemistry B,2010,114(15):4945-4954.
[31] VAN K,NORISUYE T,TERAMOTO A.Liquid crystal formation in aqueous solutions of a polysaccharide schizophyllan [J].Molecular Crystals and Liquid Crystals,1981,78(1):123-134.
[32] LI Sheng,HUANG Yao,WANG Sen,et al.Determination of the triple helical chain conformation ofβ-glucan by facile and reliable triple-detector size exclusion chromatography[J].The Journal of Physical Chemistry B,2014,118(3):668-675.
[33] ZHANG Yangyang,XU Xiaojuan,ZHANG Lina.Gel formation and low-temperature intramolecular conformation transition of a triple-helical polysaccharide lentinan in water[J].Biopolymers,2008,89(10):852-861.
[34] ZHANG Yangyang,XU Xiaojuan,ZHANG Lian.Dynamic viscoelastic behavior of triple helical Lentinan in water:Effect of temperature[J].Carbohydrate Polymers,2008,73(1):26-34.
[35] ITOU T,TERAMOTO A,MATSUO T,et al.Ordered structure in aqueous polysaccharide:Cooperative order-disorder transition in aqueous schizophyllan[J].Macromolecules,1986,19(4):1234-1240.
[36] KITAMURA S,KUGE T.A differential scanning calorimetric study of the conformational transitions of schizophyllan in mixtures of water and dimethylsulfoxide[J].Biopolymers,1989,28(2):639-654.
[37] KITAMURA S,OZASA M,TOKIOKA H,et al.A differential scanning calorimetric study of the conformat ional transitions of several kinds of(1→6)branched(1→3)-β-D-glucans in a mixture of water and dimethylsulfoxide[J]. Thermochimica Acta,1990,163:89-96.
[38] KITAMURA S,HIRANO T,TAKEO K,et al.Conformational transitions of schizophyllan in aqueous alkaline solution [J].Biopolymers,1996,39(3):407-416.
[39] TERAMOTO A,GU H,MIYAZAKI Y,et al.Dielectric study of the cooperative order-disorder transition in aqueous solutions of schizophyllan,a triple-helical polysaccharide[J].Biopolymers,1995,36(6):803-810.
[40] YOSHIBA K,ISHINO T,TERAMOTO A,et al.Ordering in aqueous polysaccharide solutions:Optical rotation and heat capacity of aqueous solutions of a triple-helical polysaccharide schizophyllan[J].Biopolymers,2002,63(6):370-381.
[41] WANG Xiaohua,ZHANG Yangyang,ZHANG Lian,et al.Multiple conformation transitions of triple helical Lentinan in DMSO/water by microcalorimetry[J].The Journal of Physical Chemistry B,2009,113(29):9915-9923.
[42] YOSHIBA K,TERAMOTO A,NAKAMURA N,et al.Water structures of differing order and mobility in aqueous solutions of schizophyllan,a triple-helical polysaccharide as revealed by dielectric dispersion measurements[J]. Biomacromolecules,2004,5(6):2137-2146.
[43] HARRINGTON W F,RAO N V.Collagen structure in solution:Kinetics of helix regeneration in single-chain gelatins[J]. Biochemistry,1970,9(19):3714-3724.
[44] SATO T,NORISUYE T,FUJITA H.Triple helix of Schizophyllum commune polysaccharide in dilute solution:Light scattering and refractometry in mixtures of water and dimethyl sulfoxide[J].Macromolecules,1983,16(2):185-189.
[45] ZHANG Lina,LI Xuelian,ZHOU Qi,et al.Transition from triple helix to coil of lentinan in solution measured by SEC,viscometry,and13C NMR[J].Polymer Journal,2002,34(6):443-449.
[46] WANG Xiaohua,ZHANG Xufeng,XU Xiaojuan,et al.The LiCl effect on the conformation of lentinan in DMSO[J]. Biopolymers,2012,97(10):840-845.
[47] TADA T,MATSUMOTO T,MASUDA T.Influence of alkaline concentration on molecular association structure and viscoelastic properties of curdlan aqueous systems[J].Biopolymers,1997,42(4):479-487.
[48] TADA T,MATSUMOTO T,MASUDA T.Structure of molecular association of curdlan at dilute regime in alkaline aqueous systems[J].Chemical Physics,1998,228(1):157-166.
[49] ZHANG Lu,WANG Chi,CUI Shuxun,et al.Single-molecule force spectroscopy on curdlan:Unwinding helical structures and random coils[J].Nano Letters,2003,3(8):1119-1124.
[50] GAWRONSKI M,CONRAD H,SPRINGER T,et al.Conformational changes of the polysaccharide cinerean in different solvents from scattering methods[J].Macromolecules,1996,29(24):7820-7825.
[51] OHNO N,HASHIMOTO T,ADACHI Y,et al.Conformation dependency of nitric oxide synthesis of murine peritoneal macrophages byβ-glucans in vitro[J].Immunology Letters,1996,53(2):157-163.
[52] OHNO N,MIURA N N,CHIBA N,et al.Comparison of the immunopharmacological activities of triple and single-helical schizophyllan in mice[J].Biological and Pharmaceutical Bulletin,1995,18(9):1242-1247.
[53] MIURA N N,OHNO N,ADACHI Y,et al.Comparison of the blood clearance of triple-and single-helical schizophyllan in mice[J].Biological and Pharmaceutical Bulletin,1995,18(1):185-189.
[54] ZENTZ F,VERCHÈRE J F,MULLER G.Thermal denaturation and degradation of schizophyllan[J].Carbohydrate Polymers,1992,17(4):289-297.
[55] STRAUB P R,BRANT D A.Measurement of preferential solvation of some glucans in mixed solvent systems by gelpermeation chromatography[J].Biopolymers,1980,19(3):639-653.
[56] NORISUYE T,YANAKI T,FUJITA H.Triple helix of a Schizophyllum commune polysaccharide in aqueous solution [J].Journal of Polymer Science:Polymer Physics Edition,1980,18(3):547-558.
[57] FALCH B H,ELGSAETER A,STOKKE B T.Exploring the(1→3)-β-D-glucan conformational phase diagrams to optimize the linear to macrocycle conversion of the triple-helical polysaccharide scleroglucan[J].Biopolymers,1999,50(5):496-512.
[58] XU Xiaojuan,WANG Xiaohua,CAI Fu,et al.Renaturation of triple helical polysaccharide lentinan in water-diluted dimethylsulfoxide solution[J].Carbohydrate Research,2010,345(3):419-424.
[59] XU Xiaojuan,ZHANG Xuefeng,ZHANG Lina,et al.Collapse and association of denatured Lentinan in water/ dimethlysulfoxide solutions[J].Biomacromolecules,2004,5(5):1893-1898.
[60] STOKKE B,ELGSAETER A,BRANT D,et al.Macromolecular cyclization of(1→6)-branched-(1→3)-β-D-glucans observed after denaturation-renaturation of the triple-helical structure[J].Biopolymers,1993,33(1):193-198.
[61] MCINTIRE T M,BRANT D A.Observations of the(1→3)-β-D-glucan linear triple helix to macrocycle interconversion using noncontact atomic force microscopy[J].Journal of the American Chemical Society,1998,120(28):6909-6919.
[62] STOKKE B T,ELGSAETER A,BRANT D A,et al.Supercoiling in circular triple-helical polysaccharides[J]. Macromolecules,1991,24(23):6349-6351.
[63] SLETMOEN M,CHRISTENSEN B E,STOKKE B T.Probing macromolecular architectures of nanosized cyclic structures of(1→3)-β-D-glucans by AFM and SEC-MALLS[J].Carbohydrate Research,2005,340(5):971-979.
[64] SLETMOEN M,GEISSLER E,STOKKE B T.Determination of molecular parameters of linear and circular scleroglucan coexisting in ternary mixtures using light scattering[J].Biomacromolecules,2006,7(3):858-865.
[65] FALCH B,STOKKE B.Structural stability of(1→3)-β-D-glucan macrocycles[J].Carbohydrate Polymers,2001,44(2):113-121.
[66] LIU Qingye,XU Xiaojuan,ZHANG Lina.Variable chain conformations of renaturedβ-glucan in dimethylsulfoxide/water mixture[J].Biopolymers,2012,97(12):988-997.
[67] VETVICKA V,YVIN J C.Effects of marineβ-1,3 glucan on immune reactions[J].International Immunopharmacology,2004,4(6):721-730.
[68] ZHANG Lina,LI Xuelian,XU Xiaojuan,et al.Correlation between antitumor activity,molecular weight,and conformationof lentinan[J].Carbohydrate Research,2005,340(8):1515-1521.
[69] XU Xiaojuan,YASUDA M,NAKAMURA-TSURUTA S,et al.β-Glucan from Lentinus edodes inhibits nitric oxide and tumor necrosis factor-αproduction and phosphorylation of mitogen-activated protein kinases in lipopolysaccharidestimulated murine RAW 264.7 macrophages[J].Journal of Biological Chemistry,2012,287(2):871-878.
[70] XU Xiaojuan,CHEN Pan,ZHANG Lina,et al.Immunomodulatoryβ-glucan from Lentinus edodes activates mitogenactivated protein kinases and nuclear factor-κB in murine RAW 264.7 macrophages[J].Journal of Biological Chemistry,2011,286(36):31194-31198.
[71] ALPER J,BALTER M.Searching for medicine's sweet spot[J].Science,2001,291(5512):2338-2343.
[72] WERZ D B,SEEBERGER P H.Carbohydrates as the next frontier in pharmaceutical research[J].Chemistry:A European Journal,2005,11(11):3194-3206.
[73] KOJIMA T,TABATA K,ITOH W,et al.Molecular weight dependence of the antitumor activity of schizophyllan[J]. Agricultural and Biological Chemistry,1986,50(1):231-232.
[74] FALCH B H,ESPEVIK T,RYAN L,et al.The cytokine stimulating activity of(1→3)-β-D-glucans is dependent on the triple helix conformation[J].Carbohydrate Research,2000,329(3):587-596.
[75] YADOMAE T.Structure and biological activities of fungal beta-1,3-glucans[J].Journal of the Pharmaceutical Society of Japan,2000,120(5):413-431.
[76] NUMATA M,HASEGAWA T,FUJISAWA T,et al.β-1,3-glucan(schizophyllan)can act as a one-dimensional host for creation of novel poly(aniline)nanofiber structures[J].Organic Letters,2004,6(24):4447-4450.
[77] LI Chun,NUMATA M,BAE A H,et al.Self-assembly of supramolecular chiral insulated molecular wire[J].Journal of the American Chemical Society,2005,127(13):4548-4549.
[78] HARAGUCHI S,HASEGAWA T,NUMATA M,et al.Oligosilane-nanofibers can be prepared through fabrication of permethyldecasilane within a helical superstructure of schizophyllan[J].Organic Letters,2005,7(25):5605-5608.
[79] NUMATA M,TAMESUE S,FUJISAWA T,et al.β-1,3-Glucan polysaccharide(schizophyllan)acting as a onedimensional host for creating supramolecular dye assemblies[J].Organic Letters,2006,8(24):5533-5536.
[80] MALIK S,FUJITA N,NUMATA M,et al.Creation of supramolecular assemblies from a dipolar dye molecule by the template effect of 1,3-glucan polysaccharide[J].Journal of Materials Chemistry,2010,20(41):9022-9024.
[81] HASEGAWA T,HARAGUCHI S,NUMATA M,et al.Poly(diacetylene)-nanofibers can be fabricated through photoirradiation using natural polysaccharide schizophyllan as a one-dimensional mold[J].Organic and Biomolecular Chemistry,2005,3(24):4321-4328.
[82] NUMATA M,LI Chun,BAE A H,et al.β-1,3-Glucan polysaccharide can act as a one-dimensional host to create novel silica nanofiber structures[J].Chemical Communications,2005(37):4655-4657.
[83] JIA Xuewei,XU Xiaojuan,ZHANG Lina.Synthesis and stabilization of gold nanoparticles induced by denaturation and renaturation of triple helicalβ-glucan in water[J].Biomacromolecules,2013,14(6):1787-1794.
[84] BAE A H,NUMATA M,YAMADA S,et al.New approach to preparing one-dimensional Au nanowires utilizing a helical structure constructed by schizophyllan[J].New Journal of Chemistry,2007,31(5):618-622.
[85] JIA Xuewei,LIU Qingye,ZOU Siwei,et al.Construction of selenium nanoparticles/β-glucan composites for enhancement of the antitumor activity[J].Carbohydrate Polymers,2015,117:434-442.
[86] LI Sheng,ZHANG Yangyang,XU Xiaojuan,et al.Triple helical polysaccharide-induced good dispersion of silver nanoparticles in water[J].Biomacromolecules,2011,12(8):2864-2871.
[87] QI Chunjian,CAI Yihua,GUNN L,et al.Differential pathways regulating innate and adaptive anti-tumor immune responses by particulate and soluble yeast-derivedβ-glucans[J].Blood,2011,117(25):6825-6836.
[88] NUMATA M,KANEKO K,TAMIAKI H,et al.“Supramolecular”amphiphiles created by wrapping poly(styrene)with the helix-formingβ-1,3-glucan polysaccharide[J].Chemistry:A European Journal,2009,15(45):12338-12345.
[89] MAEDA K,MOCHIZUKI S,SANADA Y,et al.Naphthalene-hydrophobizedβ-1,3-glucan nanogel for doxorubicin delivery to immunocytes[J].Bioorganic and Medicinal Chemistry Letters,2014,24(8):1880-1883.
[90] NASROLLAHI Z,MOHAMMADI S R,MOLLARAZI E,et al.Functionalized nanoscaleβ-1,3-glucan to improve Her2+breast cancer therapy:Inυitro and inυiυo study[J].Journal of Controlled Release,2015,202:49-56.
[91] TAMARU S I,HORI K,SHINKAI S.Environment-induced sequential interconversion of amphotericβ-1,3-glucans/ polythiophene complexes:A unique system applicable to a naked-eye detectable fluorogenic p H probe[J].Chemistry Letters,2015,44(12):1667-1669.
[92] DAVIS A P,WAREHAM R S.Carbohydrate recognition through noncovalent interactions:A challenge for biomimetic and supramolecular chemistry[J].Angewandte Chemie International Edition,1999,38(20):2978-2996.
[93] SAKURAI K,MIZU M,SHINKAI S.Polysaccharide-polynucleotide complexes:Complementary polynucleotide mimic behavior of the natural polysaccharide schizophyllan in the macromolecular complex with single-stranded RNA and DNA [J].Biomacromolecules,2001,2(3):641-650.
[94] SAKURAI K,SHINKAI S.Molecular recognition of adenine,cytosine,and uracil in a single-stranded RNA by a natural polysaccharide:Schizophyllan[J].Journal of the American Chemical Society,2000,122(18):4520-4521.
[95] LIU Qingye,XU Xiaojuan,ZHANG Lina,et al.Interaction between polydeoxyadenylic acid andβ-glucan from Lentinus edodes[J].European Polymer Journal,2012,48(7):1329-1338.
[96] MIYOSHI K,UEZU K,SAKURAI K,et al.Polysaccharide-polynucleotide complexes:Structural analysis of the curdlan/ poly(cytidylic acid)complex with semiempirical molecular orbital calculations[J].Biomacromolecules,2005,6(3):1540-1546.
[97] BAE A H,LEE S W,IKEDA M,et al.Rod-like architecture and helicity of the poly(C)/schizophyllan complex observed by AFM and SEM[J].Carbohydrate Research,2004,339(2):251-258.
[98] SANADA Y,MATSUZAKI T,MOCHIZUKI S,et al.β-1,3-D-glucan schizophyllan/poly(d A)triple-helical complex in dilute solution[J].The Journal of Physical Chemistry B,2011,116(1):87-94.
[99] LIU Qingye,XU Xiaojuan,ZHANG Lina,et al.Assembly of single-stranded polydeoxyadenylic acid andβ-glucan probed by the sensing platform of graphene oxide based on the fluorescence resonance energy transfer and fluorescence anisotropy [J].Analyst,2013,138(9):2661-2668.
[100] KIMURA T,BEPPU A,SAKURAI K,et al.Separation technique for messenger RNAs by use of schizophyllan/poly(A)tail complexation[J].Biomacromolecules,2005,6(1):174-179.
[101] ANADA T,MATSUNAGA H,KARINAGA R,et al.Proposal of new modification technique for linear double-stranded DNAs using the polysaccharide schizopyllan[J].Bioorganic and Medicinal Chemistry Letters,2004,14(22):5655-5659.
[102] ANADA T,KARINAGA R,KOUMOTO K,et al.Linear double-stranded DNA that mimics an infective tail of virus genome to enhance transfection[J].Journal of Controlled Release,2005,108(2):529-539.
[103] ALBERTS B,JOHNSON A,LEWIS J,et al.Molecular Biology of the Cell:Manipulating Proteins,DNA,and RNA[M]. New York:Garland Science,2002:469-546.
[104] KARINAGA R,ANADA T,MINARI J,et al.Galactose-PEG dual conjugation ofβ-(1→3)-D-glucan schizophyllan for antisense oligonucleotides delivery to enhance the cellular uptake[J].Biomaterials,2006,27(8):1626-1635.
[105] TAKEDATSU H,MITSUYAMA K,MOCHIZUKI S,et al.A new therapeutic approach using a schizophyllan-based drug delivery system for inflammatory bowel disease[J].Molecular Therapy,2012,20(6):1234-1241.
[106] MOCHIZUKI S,MORISHITA H,SAKURAI K.Macrophage specific delivery of TNF-αsiRNAcomplexed withβ-1,3-glucan inhibits LPS-induced cytokine production in a murine acute hepatitis model[J].Bioorganic and Medicinal Chemistry,2013,21(9):2535-2542.
[107] LIU Qingye,WANG Chaoqun,CAO Yan,et al.A novel gene carrier prepared from triple helicalβ-glucan and polydeoxyadenylic acid[J].Journal of Materials Chemistry B,2014,2(8):933-944.
[108] LIU Qingye,XU Hui,CAO Yan,et al.Transfection efficiency and internalization of the gene carrier prepared from a triple-helical beta-glucan and polydeoxyadenylic acid in macrophage RAW264.7 cells[J].Journal of Materials Chemistry B,2015,3(18):3789-3798.
[109] SAITO G,SWANSON J A,LEE K D.Drug delivery strategy utilizing conjugation via reversible disulfide linkages:Role and site of cellular reducing activities[J].Advanced Drug Delivery Reviews,2003,55(2):199-215.
[110] SHIMADA N,COBAN C,TAKEDA Y,et al.A polysaccharide carrier to effectively deliver native phosphodiester Cp G DNA to antigen-presenting cells[J].Bioconjugate Chemistry,2007,18(4):1280-1286.
[111] HASEGAWA T,FUJISAWA T,HARAGUCHI S,et al.Schizophyllan-folate conjugate as a new non-cytotoxic and cancer-targeted antisense carrier[J].Bioorganic and Medicinal Chemistry Letters,2005,15(2):327-330.
[112] HASEGAWA T,FUJISAWA T,NUMATA M,et al.Schizophyllans carrying oligosaccharide appendages as potential candidates for cell-targeted antisense carrier[J].Organic and Biomolecular Chemistry,2004,2(21):3091-3098.
[113] KARINAGA R,KOUMOTO K,MIZU M,et al.PEG-appendedβ-(1→3)-D-glucan schizophyllan to deliver antisenseoligonucleotides with avoiding lysosomal degradation[J].Biomaterials,2005,26(23):4866-4873.
[114] KOBIYAMA K,AOSHI T,NARITA H,et al.Nonagonistic dectin-1 ligand transforms Cp G into a multitask nanoparticulate TLR9 agonist[J].Proceedings of the National Academy of Sciences,2014,111(8):3086-3091.
[115] MOCHIZUKI S,MORISHITA H,KOBIYAMA K,et al.Immunization with antigenic peptides complexed withβ-glucan induces potent cytotoxic T-lymphocyte activity in combination with Cp G-ODNs[J].Journal of Controlled Release,2015,220:495-502.
Recent Progress in Chain Conformation and Function of Triple Helical Polysaccharides
LIU Qing-ye1, XU Xiao-juan2
(1.College of Chemical and Environmental Engineering,North University of China,Taiyuan 030051,China;2.College of Chemistry and Molecular Sciences,Wuhan University,Wuhan 430072,China)
Triple helical polysaccharides,a naturally occurring biopolymer with special structure,not only shows high biological activity,but also exhibits particular molecular recognition and incomparable features. This review mainly introduces the chain structure and multiple conformation transition of triple helical polysaccharides,analyzes the molecular chain interactions during the denaturation and renaturation process,and reveals the scientific principles for the formation and morphological changes of triple helical structure.Meanwhile,the correlation of biological activity to chain conformation of triple helical polysaccharides,and the recent progress in polysaccharide-based functional materials which were constructed based on the conformation transition were also reviewed.
triple helical polysaccharides;chain conformation;function
O631
A
1008-9357(2016)02-0137-019DOI: 10.14133/j.cnki.1008-9357.2016.02.002
2016-05-20
国家自然科学基金(20874078;21274114;21574102);中北大学2015校基金(110246)
刘青业(1984-),男,山西孝义人,博士,讲师,主要研究方向为多糖链构象与功能。E-mail:qingyeliu@126.com
许小娟,E-mail:xuxj@whu.edu.cn
