酶-超声辅助提取苦荞秆中总黄酮及抗氧化活性研究
2016-10-22杨海涛曹小燕
杨海涛,曹小燕*
(1.陕西理工大学 陕西省催化基础与应用重点实验室,陕西 汉中 723000;2.陕西理工大学 化学与环境科学学院,陕西 汉中 723000)
酶-超声辅助提取苦荞秆中总黄酮及抗氧化活性研究
杨海涛,曹小燕*
(1.陕西理工大学 陕西省催化基础与应用重点实验室,陕西 汉中 723000;2.陕西理工大学 化学与环境科学学院,陕西 汉中 723000)
以秦巴山区苦荞秆为原料,通过单因素结合正交试验研究了纤维素酶-超声辅助提取苦荞秆中总黄酮的工艺条件,并考察其对羟基自由基、超氧阴离子自由基和ABTS自由基正离子的清除活性及还原能力。结果表明,苦荞杆总黄酮的最佳提取工艺为:纤维素酶10 mg/g,乙醇体积分数40%,超声温度40℃,超声时间30 min,料液比为1∶40(g∶mL),该条件下总黄酮的得率为2.30%,苦荞秆总黄酮对羟基自由基、超氧阴离子自由基和ABTS自由基正离子的半抑制浓度IC50值分别为0.18 mg/mL、0.24 mg/mL和2.24 μg/mL,强于同浓度条件下天然抗氧化剂维生素C。
苦荞秆;黄酮;纤维素酶;超声提取;抗氧化活性
苦荞属双子叶蓼科(Polygonaceae)荞麦属(Fagopyrum)植物,又名春荞、野荞麦,学名鞑靼荞麦(F.tataricum),原产于我国东北和西南部四川凉山地区[1],是自然界中较少的药食两用作物[2]。大量研究表明苦荞具有较高的营养价值,其中维生素B2的含量是大米和小麦的3~11倍,蛋白质、脂肪和钾、镁、铁等矿物元素含量均明显高于大米和小麦。苦荞富含芦丁、叶绿素、槲皮素、桑色素、莰菲醇、金丝桃苷、白藜芦醇等[3],具有降低血糖、血脂和尿糖的“三降”作用,对糖尿病、脑血管硬化、高血脂、心血管疾病具有预防和治疗的作用。
目前,苦荞的研究多涉及种子、芽、叶、麸皮和壳中黄酮提取工艺的优化、组分鉴别及其抗氧化活性[4]。苦荞秸秆资源丰富,实验证明其含有黄酮类物质,如刘红等[5]借助微波辅助技术优化了苦荞秸秆中总黄酮的提取工艺,在最佳工艺条件下总黄酮的提取率为1.53%;王敏等[6]结合纤维素酶法优化了水提黄酮的提取工艺,优化后的总黄酮提取率为1.47%,是未经酶解提取率的3.08倍。酶法结合超声波的空化作用、机械效应、凝聚效应,能够有效地提高总黄酮的溶出效率。本研究采用秦巴苦荞秆为试验原料,以总黄酮的提取率为评价指标,纤维素酶结合超声波辅助醇提法提取苦荞秆中的总黄酮,并对其抗氧化性进行评价,为苦荞秆资源在饲料工业中的进一步开发利用提供理论依据。
1 材料与方法
1.1材料与试剂
苦荞秆:采摘于陕西省镇巴县,50℃烘干,粉碎,过80目筛备用;芦丁标准品(纯度≥98%):中国药品生物制品检定所;纤维素酶(10 000 U/g)、邻二氮菲、邻苯三酚、2,2-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate,ABTS)、维生素C、三羟甲基氨基甲烷(Tris)、无水乙醇、亚硝酸钠(均为分析纯):阿拉丁生化科技股份有限公司。
1.2仪器与设备
AL204-IC型电子分析天平:梅特勒-托利多仪器(上海)有限公司;Cary50紫外可见分光光度计:美国瓦里安公司;SB-4200DTD型超声波清洗机:宁波新芝生物科技股份有限公司;JXL-2S-6A数显恒温水浴锅:江苏省金坛市金祥龙电子有限公司;101A-1电热鼓风干燥箱:重庆银河试验仪器有限公司;SHB-Ⅲ循环水式真空泵:郑州长城科工贸有限公司;800型离心机:上海手术器械厂。
1.3试验方法
1.3.1芦丁标准曲线的绘制
依据NaNO2-Al(NO3)3比色法,于波长510nm处测定吸光度值[7],以芦丁标准品质量浓度(C,mg/mL)为横坐标,吸光度值A为纵坐标,绘制标准曲线,所得线性回归方程为:A=10.183C-0.001 2,相关系数R2=0.999 8。
1.3.2苦荞杆黄酮的提取及含量的测定
准确称取1.0000 g苦荞秆粉置于50 mL圆底烧瓶中,加入不同体积分数的乙醇溶液,再加缓冲溶液调节pH值,50℃恒温水浴酶解1 h,酶解完全后转移至超声波清洗机中设定功率为250W提取,真空泵抽滤,2 000 r/min离心5 min。取一定体积离心液于50mL容量瓶中,依据NaNO2/Al(NO3)3比色法在波长510 nm处测定苦荞杆黄酮的吸光度值,根据回归方程计算提取液中总黄酮的含量C,由下式计算超声辅助提取苦荞秆总黄酮的提取率:

式中:V为样品液体积,mL;C为苦荞秆总黄酮提取液质量浓度,mg/mL;N为提取液稀释倍数,M为称取的苦荞秆粉末质量,g。
1.3.3单因素试验
选取影响酶法-超声辅助提取苦荞秆中总黄酮提取率的6个因素,考察各个因素对苦荞秆中总黄酮提取率的影响。考察单个因素对总黄酮提取率的影响时,分别改变所对应的设定因素,固定pH值为6,超声功率为250 W。纤维素酶用量设定水平分别为:4 mg/g、6 mg/g、8 mg/g、10mg/g、12mg/g;乙醇体积分数的设定水平为:20%、30%、40%、50%、60%;料液比的设定水平为1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL);超声温度设定水平为:20℃、30℃、40℃、50℃、60℃;超声时间设定为10min、20min、30min、40min、50min。
1.3.4正交试验
依据单因素试验结果,精确称取1.000 0 g的苦荞秆粉末,设定超声波功率250 W,调节缓冲溶液pH值为6,以纤维素酶量、乙醇体积分数、料液比、超声温度和超声时间为正交试验的5个影响因子,通过L16(45)正交试验优化苦荞秆中总黄酮的提取工艺,具体因素与水平见表1。
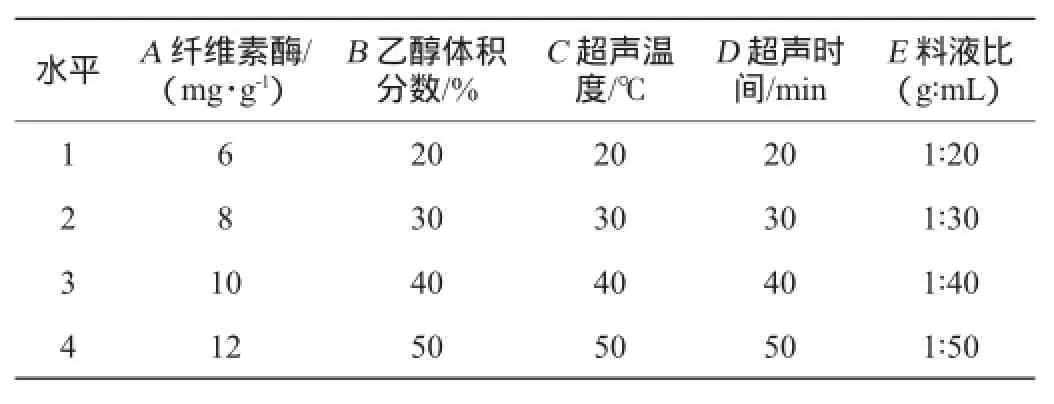
表1 总黄酮提取条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal tests for total flavonoids extraction conditions optimization
1.3.5苦荞杆总黄酮的抗氧化性研究
依据Oyaizu法[8]评价苦荞杆总黄酮的还原能力,邻苯三酚自氧化体系[9]评价苦荞杆总黄酮清除超氧阴离子自由基能力,邻二氮菲-Fe2+氧化体系[10]评价苦荞杆总黄酮清除羟自由基活性,过硫酸钾氧化ABTS法[11]评价苦荞杆总黄酮清除ABTS+·能力。各自由基的清除公式如下:
式中:A0为自由基溶液的吸光度值;A样品为测定样品的吸光度值;A1为测定黄酮溶液自身的吸光度值;A损伤为只加自由基溶液的吸光度值;A未损为不加入样品和过氧化氢溶液的吸光度值。
2 结果与分析
2.1单因素试验结果
2.1.1纤维素酶量对苦荞杆总黄酮提取率的影响
纤维素酶能够有效破坏苦荞杆的纤维素,促使总黄酮的溶出[12]。纤维素酶量对总黄酮提取率的影响结果见图1。
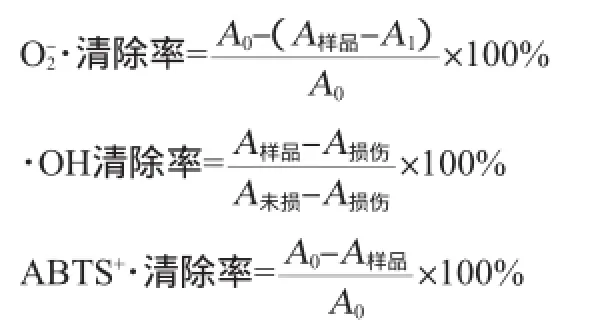

图1 纤维素酶量对总黄酮提取率的影响Fig.1 Effect of cellulase dosage on total flavonoids extraction rate
由图1可知,随着纤维素酶用量的增加,易于苦荞杆细胞壁的破碎,总黄酮的提取率逐渐增加,酶添加量为10 mg/g时,总黄酮提取率最大,进一步增加纤维素酶,提取率反而有所降低。可能的原因是随着纤维素酶量的增加,总黄酮的溶出率逐渐增加,但是过多的酶具有黏附性能,阻塞黄酮的溶出通道,因此其提取率有所下降,故最佳的纤维素酶添加量为10 mg/g。
2.1.2乙醇体积分数对苦荞杆总黄酮提取率的影响
乙醇体积分数对总黄酮提取率的影响结果见图2。由图2可知,伴随乙醇体积分数的增大,总黄酮提取率的趋势是先增大后减小。乙醇体积分数为20%~30%,提取率逐渐增大,这是因为苦荞秆总黄酮的溶出随乙醇体积分数的升高而增大,当乙醇体积分数达到30%时,提取率达到最大值,说明在该试验条件下苦荞秆总黄酮的浸出达到最大值;乙醇体积分数超过30%后,即使继续增加乙醇体积分数,总黄酮的浸出却逐步降低,可能是浓度过大,一些易溶于醇的物质与黄酮竞争性地浸出,从而致使总黄酮的提取率降低。故最佳的乙醇体积分数为30%。
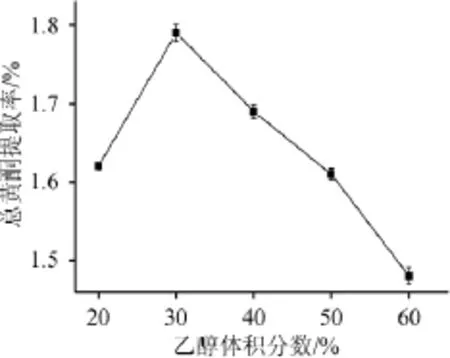
图2 乙醇体积分数对总黄酮提取率的影响Fig.2 Effect of ethanol concentration on total flavonoids extraction rate
2.1.3超声温度对苦荞杆总黄酮提取率的影响

图3 超声温度对总黄酮提取率的影响Fig.3 Effect of ultrasonic temperature on total flavonoids extraction rate
超声温度对总黄酮提取率的影响结果见图3。由图3可知,苦荞秆中总黄酮的提取率随温度的升高而增加,可能是超声波的空化作用促使植物细胞壁破裂,总黄酮的溶出效果增加,30℃时达到峰值,之后随温度的增加提取率的增加较为缓慢,这可能是升高温度促使浸提液黏度降低,黄酮在乙醇中的溶解度增大,使黄酮类化合物的提取率也随着温度的升高而增大,综合考虑苦荞秆中总黄酮的超声温度宜选取30℃。
2.1.4超声时间对苦荞杆总黄酮提取率的影响
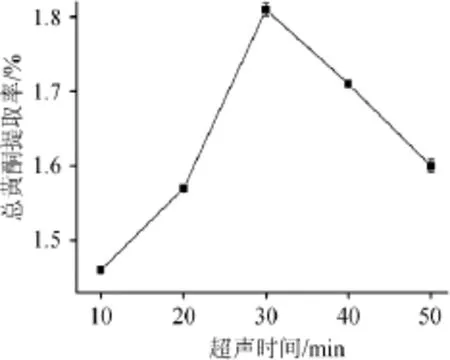
图4 超声时间对总黄酮提取率的影响Fig.4 Effect of ultrasonic time on total flavonoids extraction rate
由图4可知,随着超声时间的加长,提取率先增大后减小。在30 min以前,随着时间延长,提取率也大幅度增大,因为随着提取时间的增加总黄酮在乙醇溶液中逐渐溶出;当超声时间达到30 min时提取率达到峰值,随后提取率反而缓慢降低,这可能是由于超声时间加长,溶液黏度增大的同时增大传质阻力,对黄酮的溶出产生了影响;此外超声波的空化效应和机械效应,可能引起黄酮类分解,因此,选择超声时间30 min为宜。
2.1.5料液比对苦荞杆总黄酮提取率的影响

图5 料液比对总黄酮提取率的影响Fig.5 Effect of solid-liquid ratio on total flavonoids extraction rate
料液比对总黄酮提取率的影响见图6。由图6可知,随着液料比的增大,苦荞杆中总黄酮的提取率是先增加后降低最后趋于平缓,其原因是随着液料比的增加,超声波在液体中能够达到有效的搅动和流动,在1∶30(g∶mL)时达到峰值。随着液体的进一步增加,样品中的有效浓度逐渐降低,超声波对溶液中微粒样品的凝聚作用相对减弱,提取率逐渐下降。进一步延长提取时间,提取效果趋于平缓。综合后续处理因素,料液比选择1∶30(g∶mL)为宜。
2.2正交试验结果与分析
依据单因素试验结果,固定超声波功率250 W,柠檬酸钠缓冲溶液的pH值6,选取纤维素酶量、乙醇体积分数、超声温度、超声时间和料液比为评价因素,采用L16(45)正交试验,试验结果见表2。
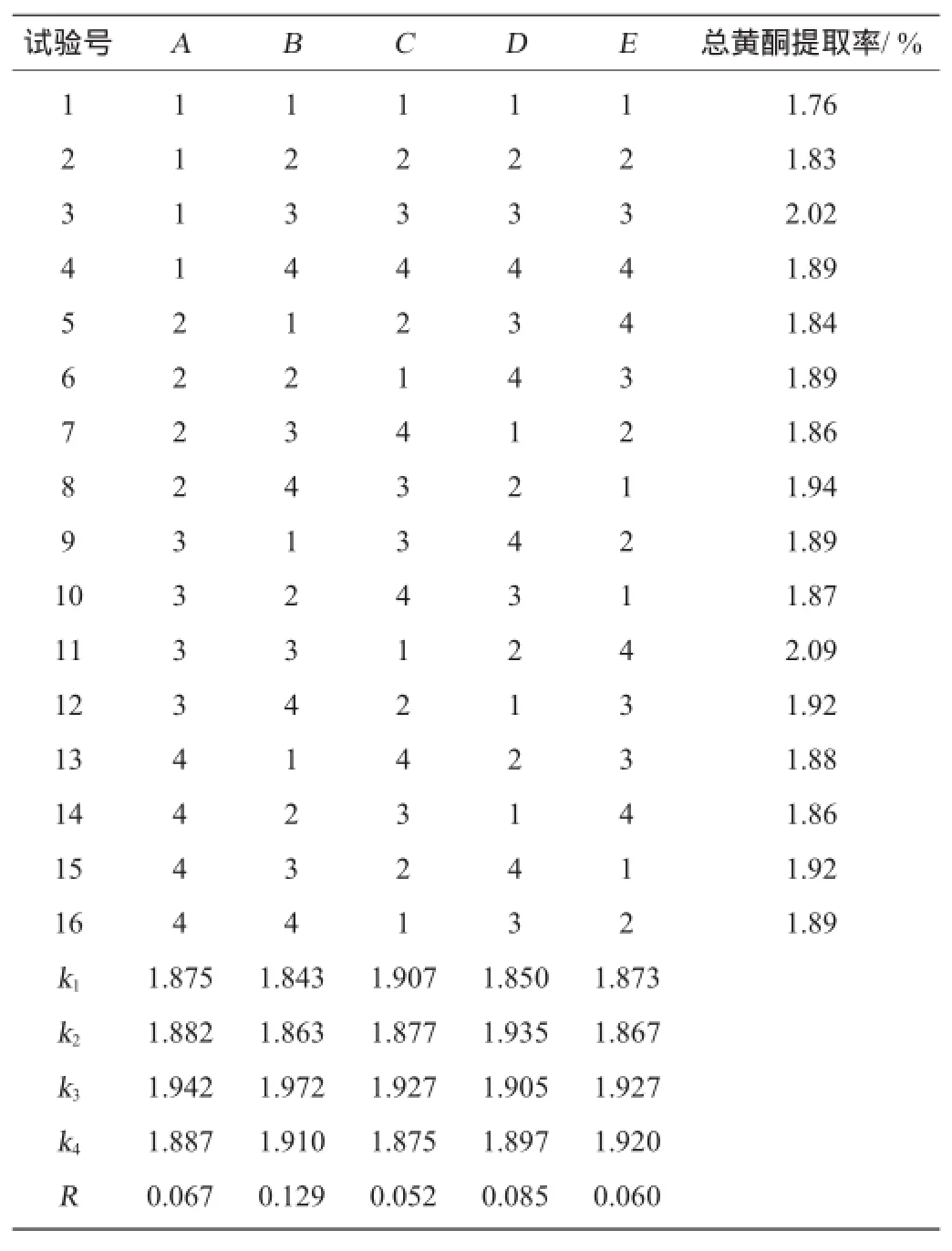
表2 总黄酮提取条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal tests for total flavonoids extraction conditions optimization
由表2可知,对苦荞秆中总黄酮提取率的影响因素主次顺序为乙醇体积分数>超声时间>纤维素酶>料液比>提取温度,最佳提取条件为A3B3C3D2E3,即纤维素酶10 mg/g,乙醇体积分数40%,超声温度为40℃,超声时间30 min,料液比为1∶40(g∶mL)。
2.3验证试验
对最佳提取工艺进行3次平行试验验证,结果得到苦荞秆总黄酮的平均得率为2.30%。以不加纤维素酶最优条件下平行试验得到苦荞杆黄酮的得率仅为1.55%,可见酶法的提取效果明显高于传统提法,为以后秸秆资源的综合利用开发提供依据。
2.4苦荞秆总黄酮的抗氧化活性研究
2.4.1清除羟自由基(·OH)

图6 苦荞秆黄酮和VC对羟基自由基的清除活性Fig.6 Scavenging activity ofFagopyrum tataricumstraw flavonoids and vitamin C on·OH
由图6可知,随着样品浓度升高,苦荞秆总黄酮对·OH的清除活性逐渐增强且存在明显的量效关系[14]。当质量浓度为0.28mg/mL时,苦荞秆黄酮对·OH的清除率为96.35%,其清除半抑制浓度(50%inhibitory concentration,IC50)值为0.18 mg/mL;而相同质量浓度下的VC对·OH的清除率为58.73%,说明苦荞秆总黄酮对·OH具有一定的清除效果,其清除效果较优于VC溶液。
超氧阴离子自由基由氧分子结合一个电子构成,通过在生物体内长期攻击靶向目标,破坏细胞DNA,导致细胞内脂或蛋白氧化损伤,诱发氧化应激,继而导致各种肿瘤、动脉粥样硬化及中枢神经系统疾病等[15]。由图7可知,随苦荞秆总黄酮质量浓度升高,其对清除活性增强,并表现为良好的剂量关系。当苦荞秆总黄酮质量浓度为0.28 mg/mL时,苦荞秆总黄酮对的清除率为62.85%,其清除IC50值为0.24 mg/mL;而相同浓度条件下的VC溶液清除率仅为25.32%。结果表明,苦荞秆总黄酮对超氧阴离子自由基的清除效果强于同浓度条件下的VC溶液。
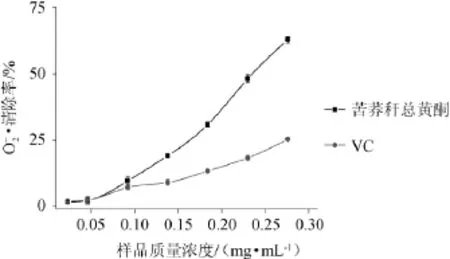
图7 苦荞秆黄酮和VC对清除活性Fig.7 Scavenging activity ofFagopyrum tataricumstraw flavonoids and vitamin C on
2.4.3清除ABTS自由基正离子(ABTS+·)
ABTS+·是一个相对稳定的自由基正离子,常用于评价抗氧化溶液的总抗氧化能力[16]。本试验以苦荞秆总黄酮提取液为反应液,随着样品质量浓度的升高,其对ABTS+·清除率逐渐增大,并且呈现出良好的量效关系。当加入苦荞提取液2.76 μg/mL时,其对ABTS+·清除率为75.41%,其清除IC50值为2.24 μg/mL;配制相同浓度的VC为参照,当加入常规抗氧化剂VC 0.46 μg/mL时,对ABTS+·清除率小于5%,随着样品质量浓度升高,清除活性缓慢增强,当质量浓度为2.76 μg/mL时,其对ABTS+·清除率为33.00%,结果显示,苦荞杆黄酮清除ABTS+·活性较优于常规自由基清除剂VC。

图8 苦荞秆黄酮和VC对ABTS+·清除活性Fig.8 Scavenging activity ofFagopyrum tataricumstraw flavonoids and vitamin C on ABTS+·
2.4.4还原能力的测定
本试验以苦荞秆总黄酮被铁氰化钾氧化来表征其还原力,其在波长700 nm处的吸光度值越大,表示其还原力越强[17]。由图9可知,随着样品质量浓度升高,总黄酮和VC于波长700 nm处的吸光度值逐渐增大,并且存在良好的线性关系,表明其还原能力逐渐增强;苦荞秆总黄酮的总体还原能力强于常规抗氧化剂VC。
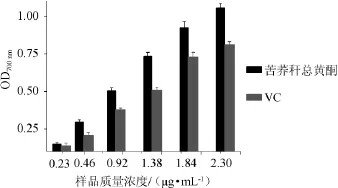
图9 苦荞秆黄酮和VC还原能力的测定Fig.9 Reducing capacity ofFagopyrum tataricumstraw and vitamin C
3 结论
采用单因素试验,评价不同提取条件下总黄酮的提取率,设定超声波功率250 W,缓冲溶液pH值6.0。结合正交试验,探索了苦荞秆总黄酮的最佳提取工艺条件为纤维素酶10 mg/g,乙醇体积分数40%,超声温度为40℃,超声时间30 min,料液比为1∶40(g∶mL)。在最佳试验条件下平行3组总黄酮的得率为2.30%,各因素的影响次序为:乙醇体积分数>超声时间>纤维素酶>料液比>提取温度。
自由基清除活性评价结果显示,苦荞秆总黄酮具有较强的清除·OH、ABTS+·能力和还原能力,总黄酮对·OH、·、ABTS+·的半抑制浓度(IC50值)为0.181 mg/mL、0.235 mg/mL和2.240 μg/mL。对ABTS·+的清除效果最强,且苦荞杆对三者的清除作用都高于VC对其的清除作用。而且在试验范围内对三者的抗氧化活性呈现良好的量效关系,结果可为苦荞秆资源在饲料工业的合理开发及应用提供科学依据。
[1]姚佳,靳秔,贾健斌.苦荞黄酮及其生理功能的研究进展[J].食品科技,2014,39(10):194-197.
[2]郭刚军,何美莹,邹建云,等.苦荞黄酮的提取分离及抗氧化活性研究[J].食品科学,2008,29(12):373-376.
[3]李二冬,黄丽珍,李波,等.苦荞黄酮的提取分离及生理活性研究进展[J].农产品加工,2014,7(13):61-64.
[4]周一鸣.苦荞麸皮中黄酮类化合物的提取、分离及其抗氧化活性的研究[D].西安:陕西师范大学,2008.
[5]刘红,陈燕芹,程霞,等.苦荞秸秆中总黄酮的提取及其抗氧化性[J].贵州农业科学,2014,42(3):150-153.
[6]王敏,高锦明,王军,等.苦荞茎叶粉中总黄酮酶法提取工艺研究[J].中草药,2006,37(11):1645-1648.
[7]杜若源,谢晶,王婷,等.超声波辅助提取银杏叶中总黄酮的工艺优化[J].食品与机械,2015,31(1):167-170.
[8]LI D,LI X,DING X.Composition and antioxidative properties of the flavonoid-rich fractions from tartary buckwheat grains[J].Food Sci Biotechnol,2010,19(3):711-716.
[9]BUETLER T M,KRAUSKOPF A,RUEGG U T.Role of superoxide as a signaling molecule[J].Physiology,2004,19(3):120-123.
[10]PRZYBYLSKI R C,LEE Y A M,ESKIN N.Antioxidant and radicalscavenging activities of buckwheat seed components[J].J Am Oil Chem Soc,1998,75(11):1595-1601.
[11]RE R,PELLEGRINI N,PROTEGGENTE A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Bio Med,1999,26(9/10):1231-1237.
[12]王晓林,钟方丽,薛健飞,等.酶法提取刺玫果总黄酮工艺研究[J].北方园艺,2015,39(4):136-139.
[13]李环宇,王敏,李五霞,等.超声波辅助酸性缓冲液浸提木枣多糖的工艺优化[J].食品与机械,2015,31(3):179-184.
[14]杨云舒,姜子涛,李荣.广枣黄酮清除自由基能力及抗氧化性能的细胞模型法评价[J].食品科学,2016,37(9):92-97.
[15]李加兴,陈选,邓佳琴,等.黄秋葵黄酮的提取工艺和体外抗氧化活性研究[J].食品科学,2014,35(10):121-125.
[16]乐薇,张思思.箬叶总黄酮体外抗氧化活性的研究[J].食品科技,2015,40(11):204-209.
[17]罗飞华,杨莉,张萍,等.杜仲叶中总黄酮抗氧化性能研究[J].应用化工,2016,45(5):858-859,865.
Enzymatic-ultrasonic assisted extraction of total flavonoids fromFagopyrum tataricum straw and its antioxidant activity
YANG Haitao,CAO Xiaoyan*
(1.Shaanxi Key Laboratory of Catalysis,Shaanxi Sci-Tech University,Hanzhong 723000,China;2.School of Chemical&Environmental Sciences,Shaanxi Sci-Tech University,Hanzhong 723000,China)
TakingFagopyrum tataricumstraw from Qinba area as raw material,based on single factor experiments and orthogonal experiments,the extraction technology of total flavonoids fromF.tataricumstraw was studied by cellulase-ultrasonic method.The scavenging activity of total flavonoids on·OH,O2-·,ABTS+·and reducing power were investigated.The results showed that the optimum flavonoid extraction technology ofF. tataricumstraw was as follows:cellulase dosage 10 mg/g,ethanol concentration 40%,ultrasonic temperature 40℃,time 30 min and solid-liquid ratio 1∶40(g∶ml).Under this condition,the extraction yield of total flavonoids was 2.30%.The IC50of total flavonoids towards·OH,O2-·,ABTS+·were 0.18 mg/ml,0.24 mg/ml and 2.24 μg/ml,respectively,which was superior to the natural antioxidants vitamin C.
Fagopyrum tataricumstraw;total flavonoids;cellulose;ultrasonic-assisted extraction;antioxidant activity
S567.9
0254-5071(2016)09-0072-05doi:10.11882/j.issn.0254-5071.2016.09.017
2016-04-01
陕西省教育厅专项科研计划(2013JK0680);陕西理工学院校级人才启动项目(SLGQD13-1)
杨海涛(1960-),男,教授,本科,研究方向为天然产物化学。
曹小燕(1982-),女,讲师,博士,研究方向为天然产物化学。
