红掌叶片愈伤组织诱导与植株再生的优化
2016-10-19陈彦霖
陈彦霖
摘要:以亚丽桑娜红掌(Anthurium andraeanum cv. Arizona)为研究对象,研究了不同激素配比对愈伤组织诱导、不定芽分化、芽增殖培养、生根培养等方面的影响。结果表明,培养基MS+6-BA 2.0 mg/L+2,4-D 0.2 mg/L为愈伤组织诱导的最适培养基;培养基MS+6-BA 1.0 mg/L+6-KT 1.5 mg/L为不定芽分化的最适培养基;培养基MS+6-BA 0.8 mg/L为继代培养的最佳培养基;培养基MS+NAA 0.3 mg/L+IBA 0.2 mg/L为诱导生根的最佳培养基。
关键词:亚丽桑娜红掌(Anthurium andraeanum cv. Arizona);诱导;植株再生;愈伤组织
中图分类号:S688.4 文献标识码:A 文章编号:0439-8114(2016)06-1572-03
DOI:10.14088/j.cnki.issn0439-8114.2016.06.053
亚丽桑娜是红掌(Anthurium andraeanum cv. Arizona)的盆栽品种之一,为天南星科花烛属多年生草本花卉,叶片绿色,长卵形,株高50~55 cm,冠幅40~50 cm,佛焰苞深红色,肉穗花序黄色,直径10 cm左右。亚丽桑娜红掌因其花色红艳,叶形独特,单花期可长达4~6个月,周年可开花,深受广大消费者的喜爱。因此,亚丽桑娜红掌成为花卉市场红掌品种中的主要栽培品种,在栽培中应用范围广[1]。但由于其生长慢、分蘖少,常采用组织培养的方式进行繁殖。本试验以亚丽桑娜红掌为研究对象,研究了不同激素配比對愈伤组织诱导、不定芽分化、芽增殖培养、生根培养等方面的影响。
1 材料与方法
1.1 试验材料
1.1.1 外植体 亚丽桑娜红掌购于武汉市某卉市场。外植体取材前2周内不再向母株浇水,选择生长健壮、无病、展叶两周的幼嫩叶片作为外植体,外植体采集回来后先用流水洗净,再用无菌蒸馏水冲洗2次,再用75%乙醇浸泡10 s,然后用无菌蒸馏水冲洗3次,再用0.1%的HgCl2浸泡8 min,再用无菌蒸馏水冲洗4次,然后在超净工作台上将幼叶切成带主叶脉的大小为1.5 cm×1.0 cm的长方块[2]。
1.1.2 培养基 MS作为基本培养基,在组培苗的不同培育阶段分别添加不同种类和浓度的植物激素以及其他附加物,按常规方法配制并分装,在121 ℃的条件下灭菌20 min,直至冷却后备用。
1.2 试验方法
1.2.1 愈伤组织诱导 用镊子将灭菌后的外植体接种到添加不同种类和浓度激素的MS培养基上进行培养[3],激素配比见表1。每瓶接种3个外植体,每个处理10瓶,重复3次,取平均值。培养时将温度为24~26 ℃,光照时间为12 h/d,光照度为1 000~1 500 lx[4]。
1.2.2 不定芽分化 愈伤组织长到0.5 cm时,切下接入诱导不定芽的培养基中培养。基本培养基选用MS,添加6-BA与6-KT、NAA不同浓度配比组成分化培养基[5],激素配比见表2。培养时温度为24~26 ℃,光照时间为12 h/d,光照度为1 000~2 000 lx。
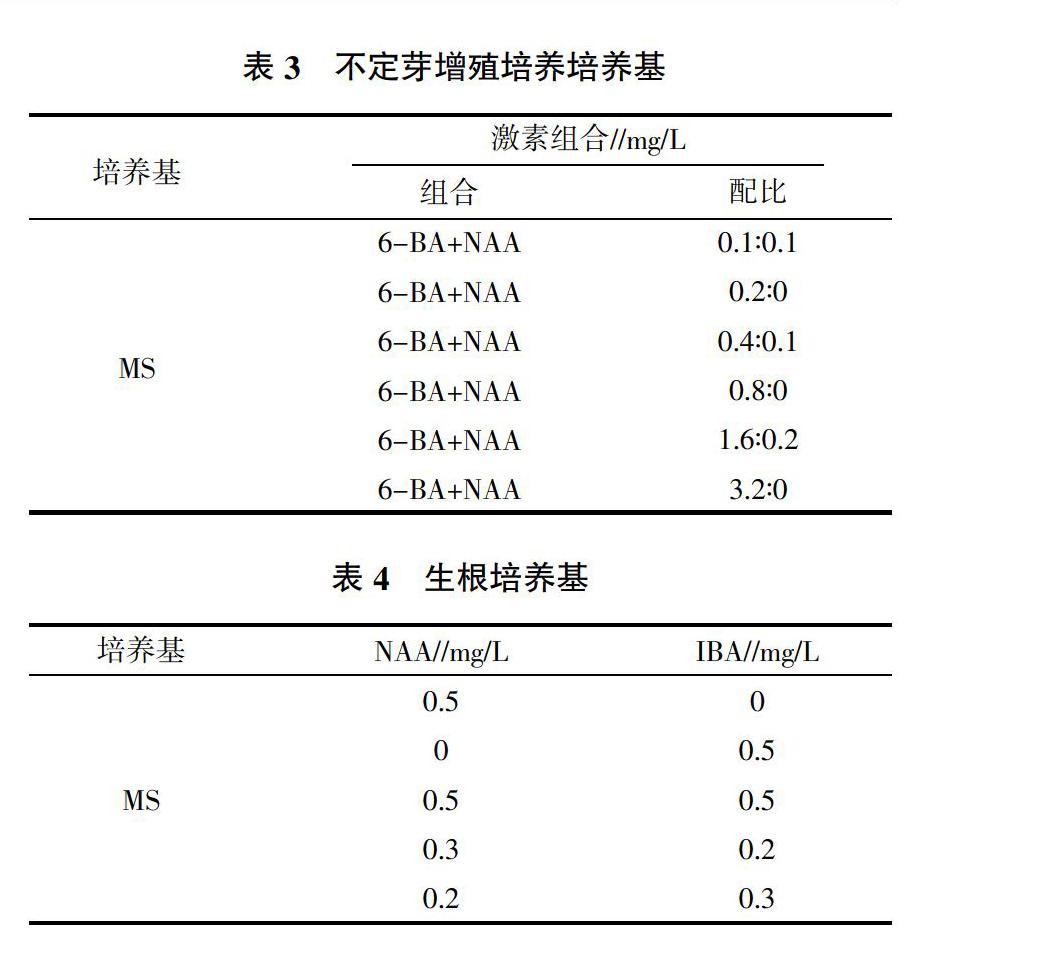
1.2.3 不定芽增殖培养 将诱导获得的无菌芽切下转至增殖培养基中进行培养(表3),适当增加光照时长和光照度,研究其不定芽的增殖情况。
1.2.4 生根培养 经过约7次增殖培养后,将高2 cm以上的芽由丛生芽上单个切下转至生根培养基上诱导生根(表4)[6],适当增加光照时间和光照度,研究其生根情况。
2 结果与分析
2.1 愈伤组织的诱导结果
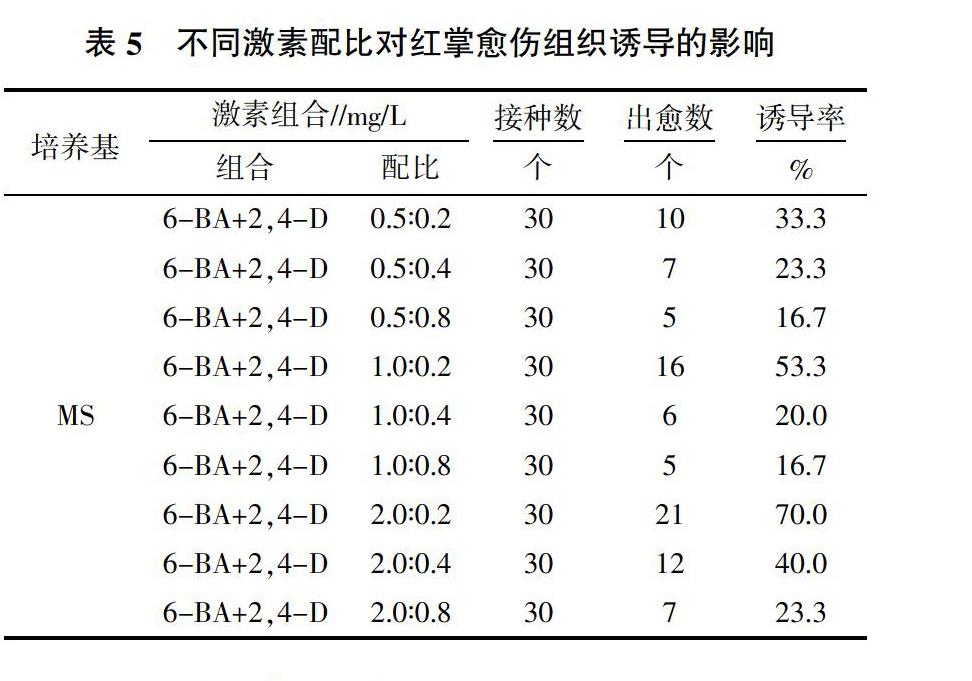
选用MS为基础培养基,将消毒切割后的叶片外植体接种到添加了不同浓度的6-BA和2,4-D的9种培养基中进行培养,30 d后观察结果。结果(表5)表明,培养基MS+6-BA 2.0 mg/L+2,4-D 0.2 mg/L的诱导率最高,为70.0%。
2.2 不定芽的分化结果
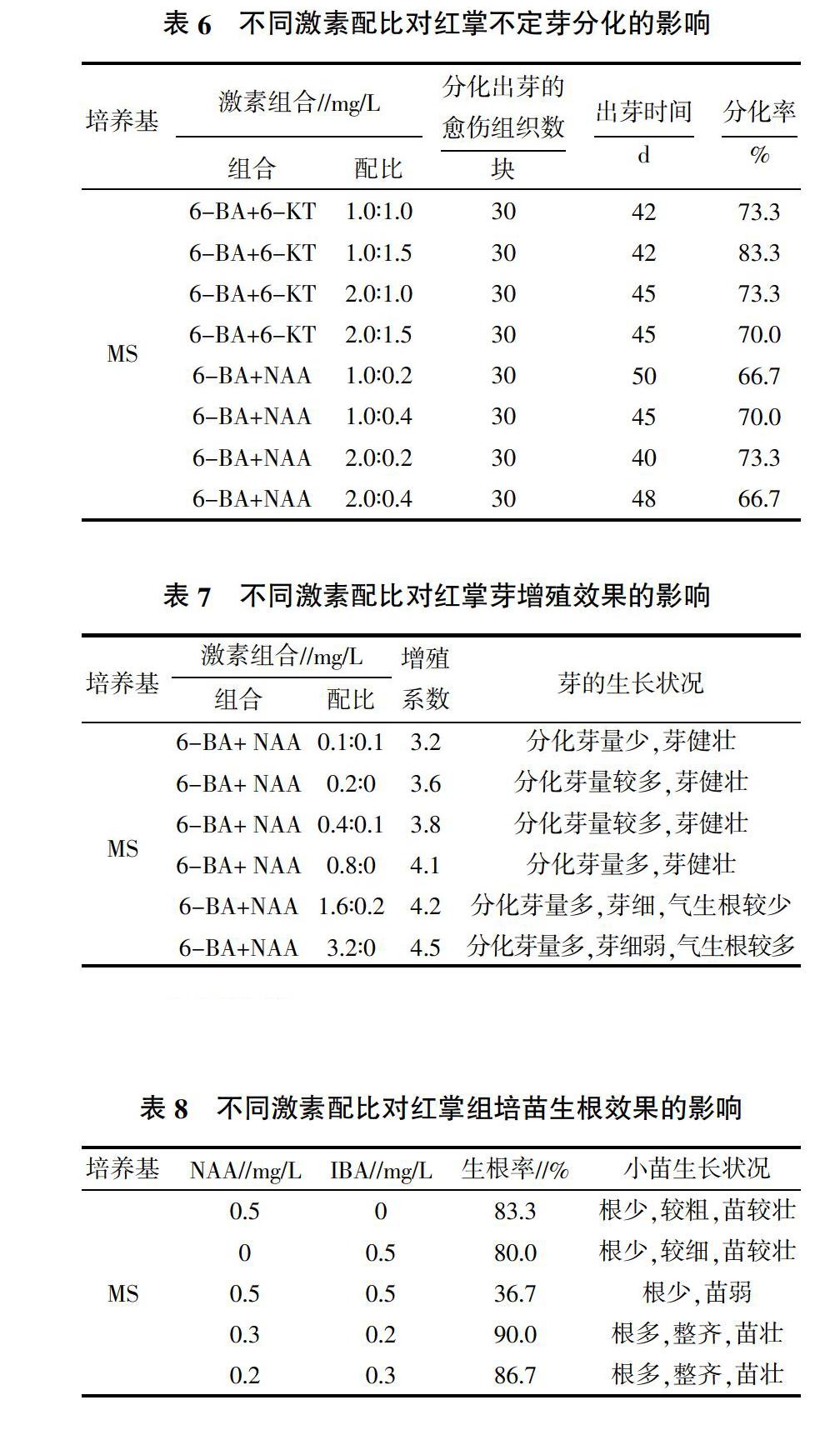
2.2.1 不同激素配比对不定芽分化率的影响 将诱导形成的愈伤组织切成大小为1~2 cm2的小块,接种到含有不同种类和浓度的培养基中培养,基础培养基为MS,每天观察并统计分化芽的愈伤组织数,计算分化率。结果(表6)表明,培养基MS+6-BA 1.0 mg/L+6-KT 1.5 mg/L的分化率最高,为83.3%。
2.2.2 不同激素配比对不定芽增殖的影响 随着继代培养次数的增加,植株出现生长不良,气生根增多,调整培养基如表7所示。结果表明,单纯使用6-BA有利于亚丽桑娜红掌继代增殖。综合考虑,最适宜不定芽继代增殖的培养基为MS+6-BA 0.8 mg/L,增殖系数在4.0以上。
2.3 生根培养
将高2 cm以上的芽由丛生芽上单个切下移入不同外源激素水平的生根培养基上培养,20 d后观察并统计生根情况。结果(表8)表明,在基本培养基中添加NAA和IBA对亚丽桑娜红掌组培苗生根均有促进作用,NAA对根的诱导效果明显优于IBA,两者的组合最佳配方为MS+NAA 0.3 mg/L+IBA 0.2 mg/L。
3 小结
3.1 愈伤组织诱导
在MS培养基中添加6-BA可诱导亚丽桑娜红掌外植体产生愈伤组织,但单纯添加6-BA诱导率低,在加入2,4-D后诱导率明显增加,但随着2,4-D浓度的增加,诱导率反而降低。MS+6-BA 2.0 mg/L+2,4-D 0.2 mg/L诱导率最高,且形成的愈伤组织生长状态良好,生长速度快。
3.2 不定芽分化
6-BA与6-KT、NAA不同浓度配比,均可诱导不定芽分化,6-KT对不定芽的分化效果比NAA要好,最适合亚丽桑娜红掌不定芽分化的培养基为MS+6-BA 1.0 mg/L+6-KT 1.5 mg/L,且出芽速度较快。随着继代培养次数的增加,植株出现生长不良,气生根增多,原因可能是6-BA、6-KT和NAA在植株体内不断积累所致,因此建议继代培养2代后调整培养基的激素配比,减少激素浓度,从试验结果来看,综合增殖系数和芽的长势,将6-BA的浓度控制在0.2~0.8 mg/L效果较好。
3.3 生根培养
NAA和IBA对亚丽桑娜红掌组培苗生根均有促进作用。单独使用NAA,根系粗短,单独使用IBA;根系细长,生根率前者也高于后者,因此,NAA对根的诱导效果明显优于IBA,但两者结合使用,效果更佳,其最佳组合配方为MS+NAA 0.3 mg/L+IBA 0.2 mg/L。
参考文献:
[1] 高安辉,韦 茜,陈家龙,等.盆栽红掌品种筛选试验[J].贵州农业科学,2005,33(5):58-59.
[2] 林 茂,王华新,唐遒冥,等.红掌组织培养研究进展[J].北方园艺,2012(24):192-196.
[3] 郭军战,费昭雪,成密红,等.红掌不同外植体愈伤组织诱导与不定芽分化的研究[J].西北林学院学报,2006,21(3):72-74.
[4] 杨利平,陈乃明,何贵整,等.“红国王”红掌愈伤组织的诱导与植株再生[J].林业科技通讯,2015(2):38-40.
[5] 何贵整,陈丽文,时 群,等.红掌组培快繁技术研究[J].北方园艺,2012(22):115-118.
[6] 关丽霞,谢永刚,彭世勇,等.红掌叶不同部位愈伤组织的诱导及植株再生[J].辽宁农业职业技术学院学报,2007,9(1):25-27.
