绵羊卵泡液高丰度白蛋白去除方法的比较
2016-10-17李晓林林嘉鹏吴阳升黄俊成
陈 莹,李晓林,林嘉鹏,吴阳升*,黄俊成*
(1.新疆农业大学 农学院,新疆 乌鲁木齐 830052;2.农业部 草食家畜遗传育种与繁殖重点开放实验室/新疆畜牧科学院 生物技术研究所,新疆 乌鲁木齐 830000)
绵羊卵泡液高丰度白蛋白去除方法的比较
陈 莹1,李晓林2,林嘉鹏2,吴阳升2*,黄俊成2*
(1.新疆农业大学 农学院,新疆 乌鲁木齐 830052;2.农业部 草食家畜遗传育种与繁殖重点开放实验室/新疆畜牧科学院 生物技术研究所,新疆 乌鲁木齐 830000)
比较了2种试剂盒去除绵羊卵泡液中高丰度白蛋白的效果。结果表明: PierceTMAlbumin Depletion Kit去除高丰度白蛋白的效率高,但特异性不好; ProteoExtract® Albumin/IgG Removal Kit对高丰度白蛋白的去除效率不如前者,且不能有效去除绵羊的IgG,但其去除ALB的特异性要好于前者;经两种试剂盒处理样品的2-DE电泳分离图谱显示白蛋白区域显色程度和面积均比绵羊卵泡液原液样品的小,但PierceTM试剂盒对大分子低丰度蛋白质的回收效率低,而ProteoExtract®对小分子低丰度蛋白质的回收率低;经PierceTM试剂盒处理后样品的蛋白质图谱中可检出点的数量更多。
绵羊;卵泡液;白蛋白;去除方法
卵泡液是在卵泡形成过程中生成的,是血浆组分跨过血-卵泡屏障转移和卵泡细胞新陈代谢共同的产物。卵泡液和颗粒细胞共同为卵母细胞的发育和成熟提供微环境。卵巢的颗粒细胞、卵泡内膜细胞及基质细胞均可产生调节因子,通过自分泌和(或)旁分泌作用,参与卵巢内局部调控。这些物质的含量变化和蛋白或肽的修饰都能够精确反映卵泡发育成熟的生理过程[1]。卵泡液的成分特征直接影响卵母细胞的质量和发育潜能[2]。因此研究卵泡液中蛋白质的组分及功能对研究卵泡发育进程及卵母细胞的生长发育具有重要作用。
双向电泳技术结合质谱技术是一种有效的蛋白质组学分析方法。利用该技术对人的成熟和未成熟卵泡液间差异蛋白进行研究,发现不同发育阶段的卵泡表现出不同的表达模式,这些差异表达蛋白质还可作为卵泡液成熟的标志物[3]。卵泡液的成分与血浆的成分类似,其血清白蛋白(Albumin, ALB)和免疫球蛋白(Immunoglobulin G, IgG)等高丰度蛋白质含量占总蛋白含量的60%~70%,严重干扰低丰度蛋白质的检出率。因此,去除卵泡液中高丰度蛋白质将有利于分离和鉴定具有重要生物学功能的低丰度蛋白质。学者们对绵羊[4]、猪[5]、水牛[6]、牦牛[7]、双峰驼[8]、马[9]和狗[10]等动物均开展了卵泡液蛋白质组学的研究。虽然前期有人对绵羊的卵泡液进行了双向电泳分析,但并没有去除高丰度蛋白[4]。因此筛选和建立适于绵羊的白蛋白去除方法在绵羊卵泡液蛋白质组学研究中显得尤为重要。
本研究采用ProteoExtract©Albumin/IgG Removal Kit和PierceTMAlbumin Depletion Kit对绵羊卵泡液中高丰度蛋白的去除效果进行了比较,以期筛选出适合绵羊卵泡液高丰度蛋白去除的方法,为绵羊卵泡液蛋白质组学的研究奠定技术基础。
1 材料与方法
1.1绵羊卵泡液的采集
绵羊卵巢采自乌鲁木齐市华凌屠宰场,在母羊被屠宰后立即剪取其卵巢并置于37 ℃生理盐水中(含青霉素、链霉素双抗),在1~2 h内运至实验室。用2 mL注射器抽取卵巢上直径为3~5 mm、光泽度和透明度好、表面毛细血管丰富的健康卵泡中的卵泡液。以12000 r/min离心10 min,取上清,以50 μL/管分装,于-80 ℃下保存备用。
1.2卵泡液蛋白质浓度的测定
使用Pierce® BCA Protein Assay Kit (Thermo Fisher Scientific Inc. U. S. A)分别测定卵泡液及两种去除高丰度蛋白试剂盒处理后样品的蛋白质含量及浓度。根据试剂盒使用说明书进行操作,简单地讲,就是利用试剂盒中的试剂配制标准品,使用酶标仪测定标准品和稀释一定倍数后的待测样品在562 nm波长下的OD值。以OD值为横坐标,标准品浓度为纵坐标,绘制标准曲线,依据标准曲线方程计算待测样品的浓度。
1.3PierceTMAlbumin Depletion Kit对白蛋白的去除
按照试剂盒说明书进行去除高丰度蛋白的操作。重悬琼脂糖树脂(Cibacron Blue dye agarose resin),取400 μL悬浮液(包含200 μL树脂颗粒)于离心柱中,瞬时离心,弃滤出液,加200 μL Wash buffer于离心柱中,瞬时离心,弃流出液。将离心柱置于新的离心管中;取1管分装冻存的绵羊卵泡液样品,用WB/BB进行10倍稀释,取200 μL加入离心柱中,使其与树脂颗粒完全混匀,在室温下孵育3 min;以12000 r/min离心1 min,将流出液重新加入离心柱中,在室温下孵育3 min;以12000 r/min离心1 min,收集流出液,将离心柱放于新的离心管中;加入50 μL WB/BB洗涤离心柱,以释放未结合的蛋白;以12000 r/min离心1 min,收集流出液,将离心柱置于一个新的离心管中;重复前两步4~5次,分别收集每次的流出液,测定蛋白质浓度;用洗脱液洗脱收集结合在树脂颗粒上的蛋白,测定其浓度。
1.4ProteoExtract® Albumin/IgG Removal Kit对高丰度蛋白的去除
按照试剂盒说明书进行去除高丰度蛋白的操作,简单地讲,取制备的绵羊卵泡液,用结合缓冲液对其进行10倍稀释。用结合缓冲液对吸附柱预处理两次,然后将稀释后的卵泡液样品300 μL上柱,利用重力流收集穿流液。然后再取600 μL结合缓冲液上柱,收集穿流液;重复1次。共收集过柱穿流液1500 μL。测定穿流液的蛋白质浓度。用0.5 mol/L NaCl洗脱亲和柱上的结合蛋白质,收集洗脱液,测定洗脱液中蛋白质浓度。
1.5电泳
1.5.1单向电泳配制10 cm×7 cm、厚0.75 mm的分离胶(12%)和浓缩胶(5%)。每孔上样量20 μL,以90 V电泳20 min,以120 V电泳2 h。
1.5.2双向电泳蛋白沉淀:根据蛋白质浓度测定结果,向经两种试剂盒处理后的300 μg蛋白样品各自加入3倍体积的预冷丙酮,混匀,-20 ℃静置2 h以上(或过夜),离心(12000 r/min,10 min,4 ℃),弃上清。再加200 μL预冷丙酮漂洗沉淀,离心(12000 r/min,10 min,4 ℃),弃丙酮。室温静置2~3 min,使残留丙酮挥发干净。蛋白水化:在水化开始前,按每2.5 mL水化储备液(8 mol/L尿素、2%CHAPS、2%IPG缓冲液、0.002%溴酚蓝)添加7 mg DTT的比例准备水化液,向每个沉淀的蛋白质样品中加入340 μL水化液溶解沉淀。取规格为18 cm、pH 3~10的IPG干胶条(GE Healthcare,美国),将其置于水化盘中,将经水化液溶解的蛋白质样品加注在干胶条槽内,盖好水化盘盖,过夜。等电聚焦:设置运行参数,其中温度20 ℃,电流50 μA/胶条,升压方式、时间及电压见表1。胶条平衡:将平衡缓冲液I [6 mol/L尿素、75 mmol/L Tris-HCl (pH 8.8)、29.3%甘油、2%SDS、0.002%溴酚蓝、1%DTT]在室温下平衡15 min;然后将胶条置于平衡缓冲液Ⅱ[6 mol/L尿素、75 mmol/L Tris-HCl (pH 8.8)、29.3%甘油、2%SDS、0.002%溴酚蓝、2.5%碘乙酰胺]中平衡15 min;最后将平衡后的胶条转移至第二向,以12.5%聚丙烯酰胺进行凝胶电泳(120 V,14 h,12 ℃)。

表1 等电聚焦的运行参数
1.6凝胶染色
对1-D PAGE和2-D PAGE凝胶均采用银染的方法。银染方法:用固定液(50%甲醇、12%乙酸、0.05%甲醛)固定2 h以上或过夜;用冲洗液(35%乙醇)冲洗20 min;用敏化液(0.025% Na2S2O3)敏化2~3 min;用去离子水冲洗3次,每次4~5 min;用银染液(0.2%AgNO3、0.072%甲醛)染色20 min;用去离子水冲洗2次,每次5~10 s;用显影液(6%Na2CO3、0.05%甲醛、2%敏化液)显影1~3 min;根据显色效果换终止液(50%甲醇、12%冰乙酸)终止反应。拍照凝胶图像并分析。
2 结果与分析
2.1两种试剂盒去除绵羊卵泡液中白蛋白后蛋白质浓度的变化
所采集卵泡液样品经BCA试剂盒测定,其蛋白质浓度为56.6 μg/μL。
在使用PierceTMAlbumin Depletion Kit去除ALB时,需将卵泡液蛋白质样品用Washing buffer进行10倍稀释。稀释后蛋白样品200 μL,经过柱吸附后穿流液蛋白浓度为2.09 μg/μL (200 μL)。经Washing buffer洗柱4次(50 μL/次),洗柱液蛋白浓度分别是0.96、0.64、0.48、0.55 μg/μL。穿流液总蛋白含量为549.5 μg。高丰度白蛋白去除效率为51.5%(582.5 μg/1132 μg)。
在使用ProteoExtract® Albumin/IgG Removal Kit去除高丰度蛋白质时,用结合缓冲液将卵泡液样品进行10倍稀释。取300 μL稀释的卵泡液样品上柱(1698 μg),收集穿流液,合并4次洗柱液,共1500 μL,其蛋白质浓度为0.82 μg/μL,蛋白质总量为1230 μg。高丰度蛋白质去除效率为27.5%(468 μg/1698 μg)。
结果表明,PierceTMAlbumin Depletion Kit去除绵羊卵泡液高丰度蛋白的效率高。
2.2去除绵羊卵泡液样品ALB的单向电泳结果
用两种试剂盒去除绵羊卵泡液样品高丰度ALB后对其进行单向(1-D)聚丙烯酰胺凝胶电泳(PAGE)分析。在1-D PAGE中,绵羊卵泡液中ALB和IgG的蛋白质含量超过总蛋白含量的70%(图1中的oFF)。绵羊ALB由607个氨基酸组成 (Genbank ID: NP_001009376.1),分子量预测为69.2 kDa。电泳图中含量最高的ALB蛋白质分子量约70 kDa,其含量超过总蛋白的50%(图1中的E1和E2)。IgG分子电泳显示为50 kDa和25 kDa的两条带(图1)。
用PierceTM试剂盒处理卵泡液样品后,其ALB含量显著下降,同时多个低丰度蛋白的条带浓度增加(图1中的D1)。将结合在树脂上的ALB洗脱后发现,还有多个非ALB被结合(图1中的E1)。而用ProteoExtract®处理卵泡液后,其对ALB的去除效率不如前者,但去除ALB的特异性要好于前者(图1中的E2)。虽然该试剂盒可有效去除人的IgG,但在本实验中不能有效去除绵羊的IgG(图1中的D2)。

M:蛋白质分子量标记; oFF:绵羊卵泡液; D1: PierceTM白蛋白去除试剂盒处理后样品; E1: PierceTM试剂盒实验组洗脱结合在树脂上的蛋白质组分; D2: ProteoExtract®试剂盒处理后样品; E2: ProteoExtract®试剂盒洗脱结合柱上蛋白质组分。
图1两种试剂盒去除绵羊卵泡液高丰度蛋白效果比较(SDS-PAGE图)
2.3去除绵羊卵泡液样品白蛋白的双向电泳结果
用两种试剂盒处理绵羊卵泡液后,分别用双向电泳分离蛋白质样品,所得图谱如图2所示。绵羊卵泡液中的高丰度白蛋白和IgG占总蛋白的比例高,颜色深(图2A)。经过两种试剂盒处理后,部分白蛋白被除去,部分蛋白点含量提高,其中PierceTM试剂盒的去除效率稍高于ProteoExtract®的(图2B、图2C)。但是这两种试剂盒在大分子和小分子回收效率上有差异,其中PierceTM试剂盒似乎对大分子有亲和性,对大分子的回收效率低(图2C);而ProteoExtract®似乎对小分子有亲和性,对小分子的回收率低(图2B)。虽然两种试剂盒均能去除部分高丰度白蛋白,但两者对大分子或小分子低丰度蛋白质的回收存在一定程度的差异。
3 讨论
随着后基因组时代的到来,对蛋白质组学的研究也受到越来越广泛的关注。近年来蛋白质的分离和鉴定技术发展迅速,其中双向电泳结合质谱技术是蛋白质组学研究中应用最为普遍的技术,其具有包含信息量大、分辨率高、稳定性强、高效灵敏准确的特点,但在具体实验过程中对于样品制备的要求较为严格,除应注意增加样品中总蛋白 (尤其是疏水性蛋白)的溶解度和减少制备过程中对蛋白的人为修饰外,还应该注意尽可能去除高丰度蛋白和无关蛋白,保证研究蛋白的可检出性不受干扰。卵泡液中含量较高的蛋白质组分包括ALB和IgG。去除高丰度蛋白是蛋白质组学相关实验样品制备过程中的首要任务,是实验成败的关键因素之一。
本实验使用的ProteoExtract® Albumin/IgG Removal Kit是利用免疫亲和层析的原理去除体液中的Albumin/IgG的。特异性强是抗体亲和层析方法的重要特点。即将抗高丰度蛋白(Albumin、IgG等)的抗体偶联到惰性介质(树脂、葡聚糖等)上,样品在穿流介质过程中,高丰度蛋白被吸附在介质上;低丰度蛋白穿流而下,再经过浓缩,使得低丰度蛋白在总蛋白中的含量增加,提高蛋白质的检出率[11-12]。人和绵羊的ALB在氨基酸序列上并不完全相同。本试验中所用的Albumin/IgG Removal Kit试剂盒所携带的抗体识别人的抗原特异性强,而识别绵羊的ALB能力弱,甚至不识别绵羊的IgG,故去除效率低。该类试剂盒对水牛[6]和狗[10]卵泡液高丰度蛋白的去除效果亦不理想,处理后高丰度蛋白含量仍然很高。因此这类基于抗体亲和层析人的体液高丰度蛋白去除试剂盒并不适合于家畜的卵泡液样品的处理。只有首先具有特异于绵羊的高丰度蛋白抗体才可以更加有效地使用该类试剂盒。
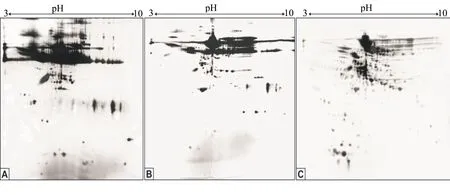
A:未处理的绵羊卵泡液样品; B:使用ProteoExtract®白蛋白/IgG去除试剂盒实验组处理后样品;C:使用PierceTM白蛋白去除试剂盒实验组处理后样品。
化学小分子染料卡巴斯兰(Cibacron Blue, CB)对人的ALB亲和吸附能力最强(90%),同时对绵羊和牛的ALB也具有一定的亲合性(分别为39%和22%),并且在低pH值下具有较高的吸附能力[13]。将蛋白样品与固化到惰性介质上的CB共孵育时,高丰度蛋白被结合上而被去除,从而提高低丰度蛋白质在总蛋白中的含量[14-15]。本试验使用的PierceTMAlbumin Depletion Kit是利用CB对ALB的亲和性特点去除该蛋白的。虽然其去除效率高于另一种试剂盒,但该方法的特异性不强,还有一些其它分子被去除。
综合比较这两种去除高丰度蛋白的试剂盒对绵羊卵泡液样品处理的结果,可以看出这两种方法均能去除绵羊卵泡液样品中的高丰度蛋白。PierceTM白蛋白去除试剂盒去除高丰度蛋白的效率比较高,可以达到富集小分子量低丰度蛋白的目的,但也会造成部分小分子量蛋白的损失。ProteoExtract®白蛋白/IgG去除试剂盒特异性好,但去除高丰度蛋白的效率不高。因此,相对而言, PierceTM白蛋白去除试剂盒更适用于绵羊卵泡液蛋白质组学研究中的样品处理,所得的双向电泳图谱能够较好地展现绵羊卵泡液的总蛋白信息,并且有利于后续质谱鉴定工作的开展。
本研究结果为进一步优化绵羊卵泡液双向电泳体系,寻找和鉴定绵羊卵泡发育过程中的关键蛋白奠定了基础。未来进行家畜体液蛋白质组学研究中,还有待于开发更加高效特异的去除高丰度蛋白的方法。
[1] Rodgers R J, Irving-Rodgers H F. Formation of the ovarian follicular antrum and follicular fluid [J]. Biol Reprod, 2010, 82(6): 1021-1029.
[2] Revelli A, Delle P L, Casano S, et al. Follicular fluid content and oocyte quality: from single biochemical markers to metabolomics [J]. Reprod Biol Endocrinol, 2009, 7: 40.
[3] Spitzer D, Murach K F, Lottspeich F, et al. Different protein patterns derived from follicular fluid of mature and immature human follicles [J]. Hum Reprod, 1996, 11(4): 798-807.
[4] 徐铁山,张勇,李鸿岩,等.绵羊卵泡液蛋白质组2-DE图谱的构建及初步分析[J].湖南农业科学,2010,13:149-151.
[5] 孙艳玲,周虚,李晓艳,等.猪卵泡液样品制备方法对双向电泳图谱的影响[J].生物技术通报,2010(5):149-157.
[6] 黄愉淋,付强,黄德伦,等.去除高丰度蛋白质后水牛卵泡液的双向电泳差异分析[J].畜牧兽医学报,2014,45(7):1113-1119.
[7] Zhao G S, Liu S S, Wu X H, et al. A proteomics study of Tianzhu white yak ovary during estrus and pregnancy [J]. Pak Vet J, 2014, 34(1): 87-91.
[8] 陶金忠,赵国顺,胡俊杰,等.双峰驼卵泡发育过程中卵泡液差异蛋白质组学[J].兽类学报,2014,34(1):80-86.
[9] Fahiminiya S, Labas V, Roche S, et al. Proteomic analysis of mare follicular fluid during late follicle development [J]. Proteome Sci, 2011, 9: 54.
[10] Fahiminiya S, Reynaud K, Labas V, et al. Steroid hormones content and proteomic analysis of canine follicular fluid during the preovulatory period [J]. Reprod Biol Endocrinol, 2010, 8: 132.
[11] Bjorhall K, Miliotis T, Davidsson P. Comparison of different depletion strategies for improved resolution in proteomic analysis of human serum samples [J]. Proteomics, 2005, 5(1): 307-317.
[12] Echan L A, Tang H Y, Ali-Khan N, et al. Depletion of multiple high-abundance proteins improves protein profiling capacities of human serum and plasma [J]. Proteomics, 2005, 5(13): 3292-3303.
[13] Leatherbarrow R J, Dean P D. Studies on the mechanism of binding of serum albumins to immobilized cibacron blue F3G A [J]. Biochem J, 1980, 189(1): 27-34.
[14] Aziz A, Zhang W, Li J, et al. Proteomic characterisation ofEchinococcusgranulosushydatid cyst fluid from sheep, cattle and humans [J]. J Proteomics, 2011, 74(9): 1560-1572.
[15] Altintas E B, Denizli A. Efficient removal of albumin from human serum by monosize dye-affinity beads [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2006, 832(2): 216-223.
(责任编辑:黄荣华)
Comparative Study on Effects of Removing High-abundance Albumin from Sheep Follicular Fluid by Two Different Kits
CHEN Ying1, LI Xiao-lin2, LIN Jia-peng2, WU Yang-sheng2*, HUANG Jun-cheng2*
(1. College of Agronomy, Xinjiang Agricultural University, Urumqi 830052, China; 2. Key Laboratory of Genetics, Breeding and Reproduction of Grass-feeding Livestock, Ministry of Agriculture / Institute of Biotechnology, Xinjiang Academy of Animal Sciences, Urumqi 830000, China)
We compared the effects of removing high-abundance albumin from sheep follicular fluid by two different kits. The results showed that PierceTMAlbumin Depletion Kit had a high efficiency of removing high-abundance albumin, but its specificity was poor. ProteoExtract® Albumin/IgG Removal Kit had a lower efficiency of removing high-abundance albumin than the former, and it could not effectively remove the IgG from sheep follicular fluid, but it had a better specificity in removing from albumin than the former. The 2-DE electrophoresis patterns showed that the coloration degree and area of albumin district of sheep follicular fluid samples treated with two kits were smaller than those of untreated samples. PierceTMkit had a low recovery efficiency to macromolecular and low-abundance proteins, while ProteoExtract® kit had a low recovery efficiency to small-molecular and low-abundance proteins. In the protein diagram of the samples treated with PierceTMkit, there were more detected points.
Sheep; Follicular fluid; Albumin; Removing method
2016-03-24
国家自然科学基金项目(U1203381);新疆维吾尔自治区重点实验室开放课题(2015KL007)。
陈莹,女,硕士研究生,主要从事家畜繁殖生物技术的研究。*通讯作者:吴阳升、黄俊成。
S826.89
A
1001-8581(2016)09-0005-04
