pH和还原双重敏感性超支化纳米胶束的制备及其释药性能
2016-10-17周亚敏吴鲁艳倪才华
周亚敏, 吴鲁艳, 白 雪, 何 飞, 石 刚, 倪才华
(江南大学化学与材料工程学院,食品胶体与生物技术教育部重点实验室,江苏 无锡 214122)
pH和还原双重敏感性超支化纳米胶束的制备及其释药性能
周亚敏,吴鲁艳,白雪,何飞,石刚,倪才华
(江南大学化学与材料工程学院,食品胶体与生物技术教育部重点实验室,江苏 无锡 214122)
将聚乙二醇二缩水甘油醚(PEGDGE)与胱胺(Cys)置于水溶液中,通过亲核开环反应制备出超支化聚合物,并自组装形成多核-壳结构的纳米胶束,再通过甲氨蝶呤(MTX)与纳米胶束间的疏水作用制备出载药胶束。用FT-IR、1H-NMR、DLS、SEM等方法对聚合物结构和胶束粒径与形貌进行表征,采用噻唑蓝(MTT)法测试纳米胶束和载药胶束的细胞毒性。结果表明:聚合物经过透析纯化后自组装形成纳米胶束,其粒径约为100 nm,呈均一球形;载药胶束对MTX的载药率为10.32%; 当载药胶束处于模拟肿瘤环境中时,酸性和还原性条件可刺激药物释放。细胞毒性实验表明,纳米胶束具有优良的生物相容性; 载药胶束具有较强的抗肿瘤活性。
超支化纳米胶束; 还原敏感性; pH敏感性; 甲氨蝶呤
纳米药物载体可以通过肿瘤组织的高渗透和滞留(EPR)效应实现药物对肿瘤组织的的被动靶向性[1-3],从而大大提高药物利用率并降低毒副作用。其中聚合物纳米胶束[4]作为药物载体具有增溶疏水性药物、提高药物稳定性、缓释药物等优势。超支化聚合物[5-7]具有新颖的结构和独特的性能,如高溶解性、低黏度、内部具有空腔三维球形结构等,结构中存在的大量空腔可以在疏水载药的过程中提高药物的载药量。
为了使药物在肿瘤组织处靶向释放,目前研究较多的是具有环境智能响应性(如pH[8]、还原电势[9]、酶等)的生物可降解载体。例如黄卫等[10]制备了一种由疏水性二硫键和亲水性磷酸酯链段交替分布于分子骨架中而形成的多核-壳结构的超支化纳米胶束,二硫键在10 mmol/L 谷胱甘肽(GSH)还原性条件下快速断裂,胶束结构遭到破坏从而实现药物的靶向释放。申有青等[11]合成了一种水溶性酸刺激可降解的聚酯类超支化聚合物,聚合物与药物甲氨蝶呤(MTX)形成的键合物在水中呈单分子胶束,在酸性环境中被降解为无毒性的小分子并释放出药物。然而,这些合成方法通常需要多步完成,且需要用到大量有机溶剂。
本文提出一种简单绿色制备超支化纳米胶束药物载体的方法。利用亲水性的聚乙二醇二缩水甘油醚(PEGDGE)与含二硫键的胱胺(Cys)发生亲核开环反应,制备出具有pH和还原双重敏感性的超支化纳米胶束。由于纳米胶束结构中存在大量的伯、仲、叔氨基团,使该纳米胶束具有很强的质子海绵效应[12],被溶酶体吞入后大量吸附质子氢,引起Cl-和水分子内流,导致溶酶体渗透性肿胀并最终破裂,载药胶束进入细胞质内,因此制备过程不需要使用有机溶剂。
1 实验部分
1.1试剂和仪器
胱胺二盐酸盐(Cys·2HCl,w=0.98)、MTX(w=0.98):阿拉丁试剂有限公司; PEGDGE(w=0.98,Mn=352):广州奥宝化工科技有限公司; 其他试剂均购于国药集团化学试剂有限公司。
采用美国Thermo Fisher Scientific公司Nicolet 6700型全反射傅里叶红外光谱仪测定冷冻干燥后聚合物的红外谱图; 采用瑞士Bruker BioSpin公司AVANCE Ⅲ HD 400 MHz型核磁共振谱仪测定聚合物的1H-NMR; 采用德国HOSIC LIMITED公司ALV/DLS/SLS-5022F型激光光散射仪测定纳米胶束在水溶液中的粒径(D)及其分布(PDI),测试温度为25 ℃; 采用美国布鲁克海文公司ZetaPALS型Zeta电位及纳米粒度分析仪测试纳米胶束的ζ电位(pH=5.0,测试温度为25 ℃); 采用日本东曹株式会社HLC-8320型凝胶渗透色谱仪测定纳米胶束的分子量(流动相:H2O,标样:聚乙二醇,测试温度为25 ℃); 采用美国瓦里安有限公司Cary Esclipse型荧光分光光度计测定临界胶束浓度(CMC),用芘作荧光探针; 采用日本日立株式会社S-4800(HR)型场发射扫描电子显微镜测定干燥状态下纳米胶束的形貌及粒径; 采用上海盛磁仪器有限公司PHS-3C型精密pH计测定纳米胶束的酸碱滴定曲线; 采用北京普析通用仪器有限责任公司TU-1950 紫外分光光度计测定纳米胶束和载药胶束溶液的吸光度。
1.2胱胺二盐酸盐的中和
参照文献[13]的方法,称取12.15 g粉末状Cys·2HCl溶于16 mL去离子水,再加入60 mL乙醚和24 mL四氢呋喃,搅拌均匀。冰浴下将w=40% 的NaOH溶液(66.7 mL)逐滴滴入上述混合液中,磁力搅拌1 h后萃取分离,取上层有机相。再用50 mL乙醚及18 mL四氢呋喃的混合溶剂萃取下层水相。合并有机相,称取4 g NaOH干燥2 h,过滤后真空旋蒸除去易挥发的乙醚和四氢呋喃,最终得到6.2 g无色油状胱胺,产率为75.5%。
1.3超支化纳米胶束的制备
将616 mg Cys溶入8 mL超纯水中,磁力搅拌使其完全溶解,向其中滴加PEGDGE(2.873 g)的水溶液(8 mL),在60 ℃下磁力搅拌反应24 h。将产物溶液倒入透析袋(截留分子量为3 500)中,在超纯水中透析3 d,每隔4 h换一次透析液,在透析的过程中形成超支化纳米胶束,记为CP12。通过调节Cys与PEGDGE的物质的量之比,可以制得一系列的超支化纳米胶束,如表1所示,再经冷冻干燥可得到相应固态超支化聚合物CP。
1.4载药胶束的制备
取0.5 mg/mL超支化纳米胶束溶液20 mL,向其中添加0.1 mg/mL的MTX溶液10 mL,室温下避光磁力搅拌24 h后转入透析袋(截留分子量为3 500)中透析24 h,每隔3 h换一次透析液,将载药胶束用0.45 μm微孔滤膜避光过滤,所得载药胶束为淡黄色,记为CP-MTX。
1.5酸碱滴定曲线的绘制
取10 mg/mL超支化纳米胶束溶液5 mL,向其中缓慢滴加1.0 mol/L的HCl溶液调节pH至2.0,接着用0.1 mol/L的NaOH溶液滴定,绘制滴定曲线。
1.6药物释放实验
取4份5 mL透析后的载药胶束装入透析袋(截留分子量为3 500)内,分别置于50 mL不同 pH(7.4和5.0)含10 mmol/L(或无)GSH的醋酸盐缓冲溶液中,在(37±0.5) ℃的恒温震荡器中回旋震荡,每隔一段时间取3 mL样品测试吸光度(A388),通过标准曲线计算释放液中MTX的质量浓度,同时补充相同体积的新鲜介质以维持缓冲溶液体积不变。
1.7体外细胞毒性实验
采用噻唑蓝(MTT)法分别检测纳米胶束和载药胶束对3T3和Hela细胞的毒性,实验步骤如下:用含10%胎牛血清(FBS)的RPMI-1640培养基将3T3细胞和Hela细胞分别种植于96孔板上(104cells/mL),37 ℃下培养24 h后弃去培养液,向孔中加入100 μL不同质量浓度的纳米胶束和载药胶束,每组设6个复孔,培养24 h后弃去培养基,每孔加入20 μL MTT溶液,继续培养4 h后,弃去培养板中的溶液,每孔加入150 μL二甲基亚砜(DMSO),摇匀,用酶标仪于570 nm处测定光学密度值(OD),并计算细胞存活率。
2 结果与讨论
2.1纳米胶束的制备
Cys中的双端氨基与PEGDGE中的双端环氧基容易发生亲核开环反应[13],聚合形成具有三维立体空腔结构的两亲性超支化聚合物,其中疏水的二硫键具有还原敏感性,使其可以实现药物在肿瘤部位的靶向释放,而亲水的PEG部分则具有优良的生物相容性。纳米胶束骨干柔韧性极好,在相分离阶段可以轻易地容纳构象改变。因此,在选择性溶剂中,分子内和分子间可以很快发生微相分离,进而形成多核-壳胶束结构[10]。纳米胶束在溶酶体pH(pH≈5.0)下显正电性,通过与负电性细胞膜间的静电相互作用使其具备轻松通过细胞膜的能力,从而使其进入癌细胞的倾向大大提高。其具体配方如表1所示。
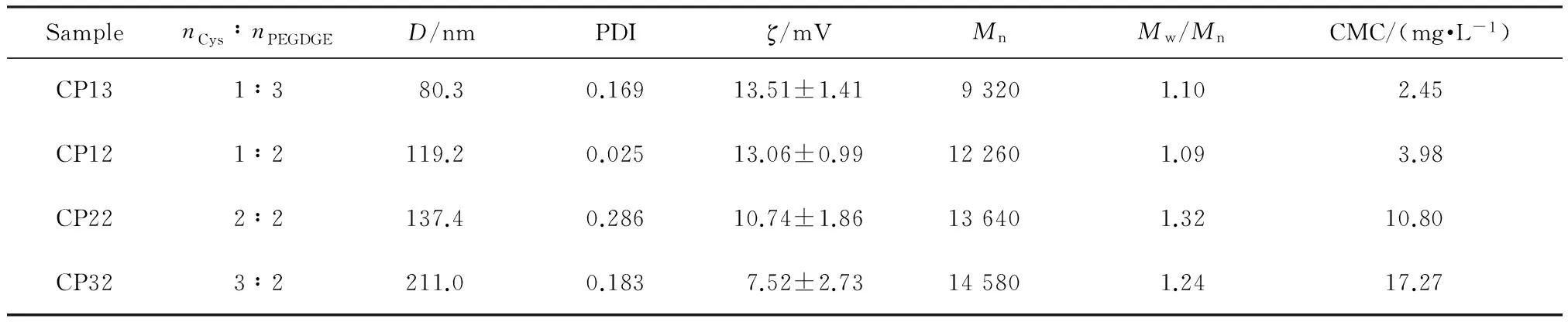
表1 超支化纳米胶束的配方及其性质
2.2超支化聚合物的结构表征
图1为各超支化聚合物的红外光谱图。Cys的端氨基与PEGDGE的环氧基团发生氨基开环反应后,在3 386 cm-1处为生成的羟基的伸缩振动峰,可能是因为生成的羟基与端氨基形成了氢键,因而此处峰型较宽。聚合物端—NH2在3 500~3 250 cm-1处本应有2个吸收峰,但被—OH峰覆盖住,故红外谱图上看不出此处—NH2的峰。在1 636 cm-1处为聚合物端—NH2的面内弯曲振动峰; 在1 093 cm-1处为脂肪族醚键的强伸缩振动峰。以上3个主要吸收峰说明反应物Cys和PEGDGE发生了氨基环氧开环反应。
图2为超支化聚合物CP12的核磁共振氢谱图。通过图2可知,胱胺亚甲基(-SS-CH2-CH2-)以及PEG中亚甲基(-O-CH2-)的特征质子峰分别在2.82和3.50处出现[14],证明超支化聚合物合成成功。
2.3纳米胶束的粒径形貌分析
图3为纳米胶束的扫描电镜图。可以看出:胶束CP12具有粒径小(约100 nm)、分布窄以及形貌规整均一的特点。随着Cys投料比的增加,粒径整体呈逐渐增大的趋势。
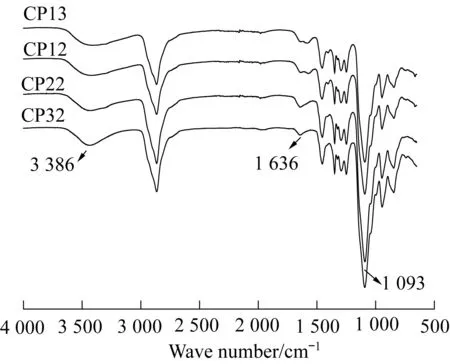
图1 超支化聚合物的红外光谱图
2.4纳米胶束的还原敏感性分析
图4反映了CP12纳米胶束在10 mmol/L GSH水溶液中孵育不同时间后的粒径变化情况。如图4所示,随着时间的推延,粒子的粒径不断减小。这是因为GSH分子中所含的巯基(—SH)具有较强的还原性,—SH能够与聚合物骨架中的二硫键(S—S)发生交换反应,使得聚合物的二硫键断裂,破坏纳米胶束结构。
2.5纳米胶束的pH敏感性分析
图5为纳米胶束溶液和对照组NaCl溶液的酸碱滴定曲线图。由图5可知,在NaCl溶液中无缓冲平台,而纳米胶束溶液在pH由7.4降至5.0期间缓冲能力按CP32、CP22、CP12、CP13依次下降,之所以具有缓冲作用是因为纳米胶束结构骨架中的氨基具有吸附质子氢的能力。这种缓冲能力有利于CP-MTX的溶酶体逃逸[12],从而使药物能够快速有效地进入细胞核发挥药效。
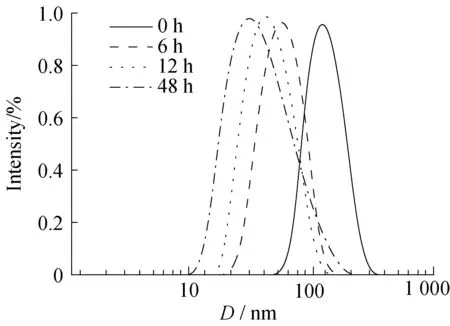
图4 CP12纳米胶束在37 ℃ GSH水溶液(10 mmol/L)中孵育不同时间后的粒径变化
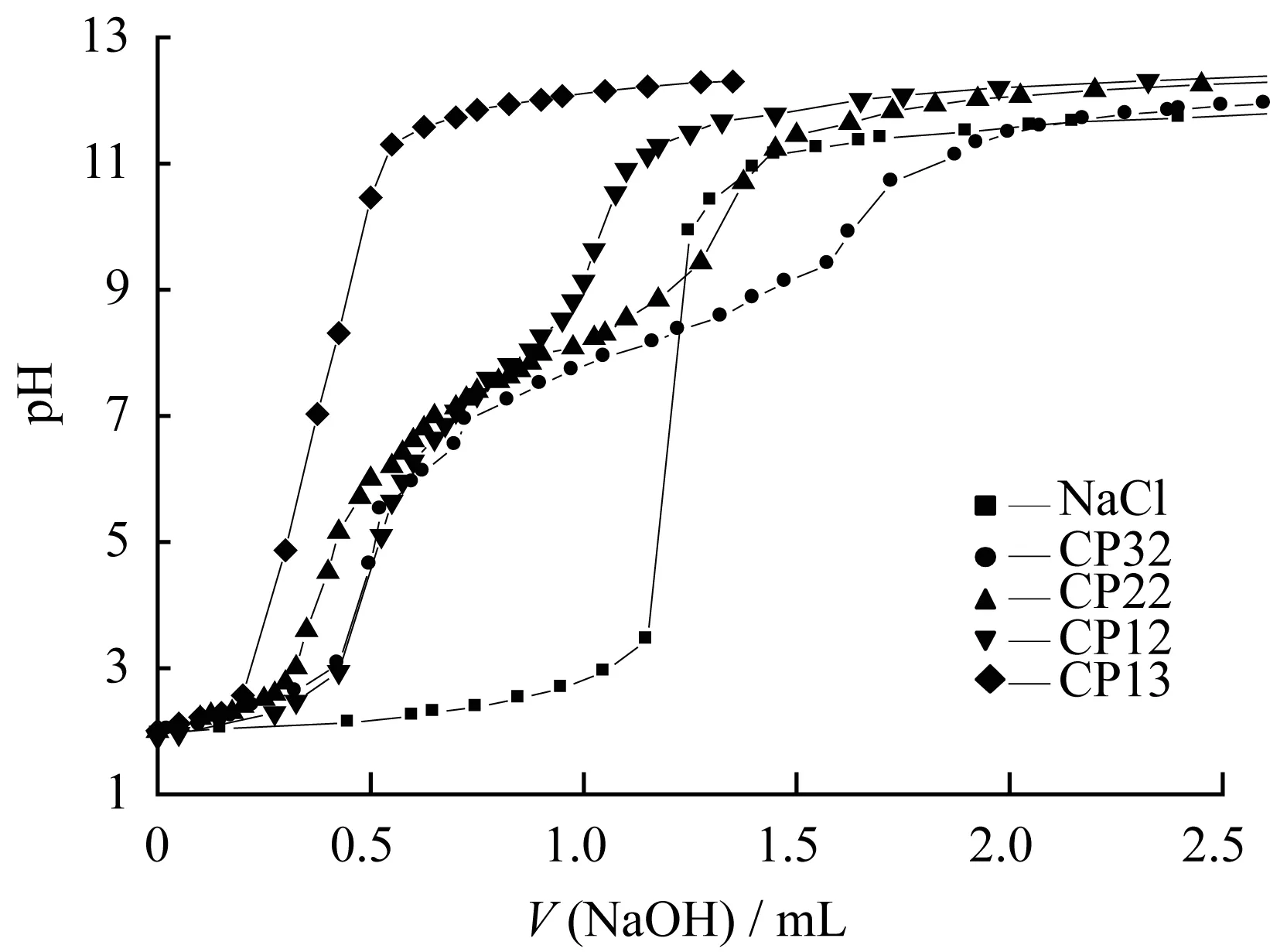
图5 纳米胶束的酸碱滴定曲线
2.6MTX的体外释放
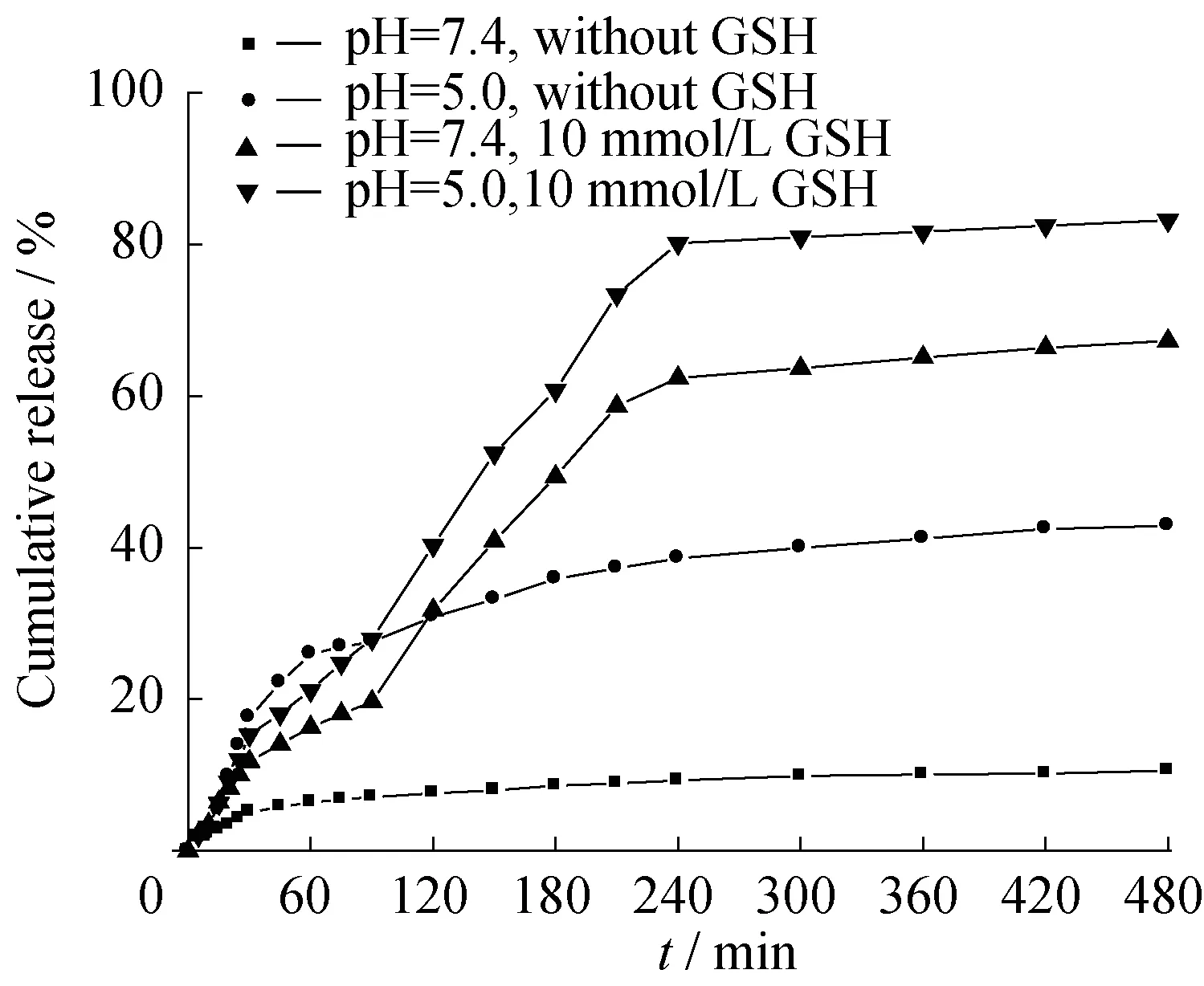
图6 载药胶束CP12-MTX在37 ℃不同介质下对MTX的体外释放曲线
图6为载药胶束CP12-MTX在不同介质下对MTX的体外释放曲线。可以看出,在还原性介质(10 mmol/L GSH)存在下,药物释放率普遍比在非还原性介质中高出50%左右,这是因为在GSH的作用下,还原敏感性的二硫键断裂,纳米胶束解体,所载的药物得以释放。
因为低氧的微环境及癌细胞的酸性细胞器,肿瘤病灶处较正常组织处呈明显酸性,纳米胶束在pH=5.0处比在pH=7.4下更有利于MTX的释放。这可能是因为CP12胶束的质子海绵效应,在酸性条件(pH=5.0)下,超支化纳米胶束结构中的氨基质子化,使得整个纳米胶束高度正电性,从而使结构内部产生高强度的静电斥力,使结构松散,从根本上使药物释放增强。
2.7细胞毒性分析
图7(a)为3T3细胞和Hela细胞经不同质量浓度纳米胶束CP12处理24 h后的细胞存活率图。可以看出,3T3和Hela的细胞存活率均在90%以上,说明纳米胶束对细胞几乎没有毒性,生物相容性很好。图7(b)为不同质量浓度游离药物和载药胶束对Hela细胞处理24 h后的抗肿瘤活性图。可以分析出,游离药物MTX和载药胶束CP12-MTX对Hela细胞的半抑制浓度(IC50)分别是0.024 μg/mL和0.07 μg/mL。相同药物浓度下,载药胶束较游离药物的毒性要略低一些,说明载药胶束对药物MTX具有缓释作用。
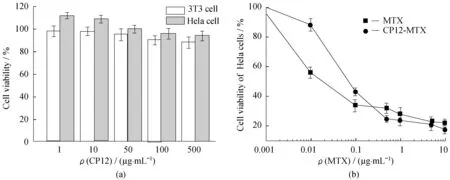
图7 3T3和Hela细胞在不同质量浓度纳米胶束CP12下的存活率(a); 相同药物浓度下游离药物和载药胶束CP12-MTX对Hela细胞的抗肿瘤活性(b)
3 结 论
通过PEGDGE与Cys的亲核开环反应,在水溶液中合成了具有pH和还原双重敏感性的纳米胶束; 利用疏水载药和超支化聚合物的内部空腔结构,可将药物的载药率提高至10.32%,体外释放显示了显著的pH和还原敏感性;该纳米胶束具有优良的生物相容性,具有作为抗癌药物载体的应用前景。
[1]JOSHI G,SULTANA R,TANGPONG J,etal.Free radical mediated oxidative stress and toxic side effects in brain induced by the anti cancer drug adriamycin:Insight into chemobrain[J].Free Radical Research,2005,39(11):1147-1154.
[2]WANG Xu,YANG Lily,CHEN Zhuo,etal.Application of nanotechnology in cancer therapy and imaging[J].CA:A Cancer Journal for Clinicians,2008,58(2):97-110.
[3]MAEDA H.Toward a full understanding of the EPR effect in primary and metastatic tumors as well as issues related to its heterogeneity[J].Advanced Drug Delivery Reviews,2015,91:3-6.
[4]KIM M S,HYUN H,KIM B S.Polymeric nano-micelles as drug carrier using polyethylene glycol and polytrimethylene carbonate linear and star-shaped block copolymer[J].Current Applied Physics,2008,8(6):646-650.
[5]侯志林,周永丰,颜德岳.超支化聚合物胶束自组装[J].高分子通报,2015(9):5-20.
[6]FAN Yujiao,ZHANG Dapeng,WANG Jie,etal.Preparation of anion-exchangeable polymer vesicles through the self-assembly of hyperbranched polymeric ionic liquids[J].Chemical Communications,2015,51(33):7234-7237.
[7]CHEN Chaojian,LIU Gongyan,LIU Xiangsheng,etal.Photo-responsive,biocompatible polymeric micelles self-assembled from hyperbranched polyphosphate-based polymers[J].Polymer Chemistry,2011,2(6):1389-1397.
[8]WANG Jixue,XU Weiguo,HUI Guo,etal.Selective intracellular drug delivery from pH-responsive polyion complex micelle for enhanced malignancy suppressioninvivo[J].Colloids and Surfaces B:Biointerfaces,2015,135:283-290.
[9]ZHAO Xubo,LIU Peng.Reduction-responsive core-shell-corona micelles based on triblock copolymers:Novel synthetic strategy,characterizatio,and application as a tumor microenvironment-responsive drug delivery system[J].ACS Applied Materials and Interfaces,2015,7(1):166-174.
[10]LIU Jinyao,HUANG Wei,PANG Yan,etal.Molecular self-assembly of a homopolymer:An alternative to fabricate drug-delivery platforms for cancer therapy[J].Angewandte Chemie,2011,50(39):9162-9166.
[11]WANG Xingping,TANG Jianbin,SUI Meihua,etal.Degradable water soluble hyperbranched polymers for drug delivery[J].Journal of Controlled Release,2011,152(suppl 1):e76-e78.
[12]PIEST M,LIN CHAO,MATEOS-TIMONEDA M A,etal.Novel poly(amido amine)s with bioreducible disulfide linkages in their diamino-units:Structure effects andinvitrogene transfer properties[J].Journal of Controlled Release,2008,130(1):38-45.
[13]HAMID Z A A,BLENCOWE A,OZCELIK B,etal.Epoxy-amine synthesised hydrogel scaffolds for soft-tissue engineering[J].Biomaterials,2010,31(25):6454-6467.
[14]XU Minghui,QIAN Junmin,SUO Aili,etal.Co-delivery of doxorubicin and P-glycoprotein siRNA by multifunctional triblock copolymers for enhanced anticancer efficacy in breast cancer cells[J].Journal of Materials Chemistry B,2015,3(10):2215-2228.
Preparation and Drug Release Properties of pH/Redox-Responsive Hyperbranched Nano Micelles
ZHOU Ya-min,WU Lu-yan,BAI Xue,HE Fei,SHI Gang,NI Cai-hua
(Key Laboratory of Food Colloids and Biotechnology of Ministry of Education,School of Chemical and Material Engineering,Jiangnan University,Wuxi 214122,Jiangsu,China)
Hyperbranched nano micelles with a multi-core-shell structure were prepared via the nucleophilic ring-opening reaction of poly(ethylene glycol) diglycidyl ether (PEGDGE) and cystamine (Cys) in aqueous solution.The drug methotrexate (MTX) was loaded into nano micelles through hydrophobic interactions between MTX and nano micelles to form drug-loaded micelles.The chemical structure and morphology of the micelles were characterized by FT-IR,1H-NMR,DLS and SEM.The cytotoxicity of nano and MTX-loaded micelles were studied by Methyl Thiazolyl Tetrazolium(MTT) assays.Results showed that the hyperbranched nano micelles had spheric morphology with an average diameter of 100 nm and narrow dispersity.MTX-loaded micelles had drug loading content of 10.32%.The release of MTX was stimuli-responsive under an acidic and reductive condition which simulated the intracellular environment of tumors.MTT assays demonstrated that nano micelles were highly biocompatibleinvivo,while MTX-loaded micelles caused pronounced cytotoxic effects to Hela tumor cells.
hyperbranched nano micelles; redox-responsive; pH-responsive; methotrexate
1008-9357(2016)03-0346-006
10.14133/j.cnki.1008-9357.2016.03.015
2015-12-08
国家自然科学基金(21401079); 江苏省科技支撑计划-工业部分(BE2012017)
周亚敏(1989-),女,安徽安庆人,硕士生,主要研究方向为生物医用材料。E-mail:1426842802@qq.com
倪才华,E-mail:nicaihua2000@163.com
O636.9
A
