多壁碳纳米管/十六烷基三甲基溴化铵修饰丝印电极的制备及大鼠血中雌二醇水平的测定
2016-10-16黄泓轲王玉婷祝晓庆
马 维,黄泓轲,王玉婷,闵 清,祝晓庆,王 诗*
(1.湖北科技学院药学院,湖北咸宁 437100;2.乐山职业技术学院药学系,四川乐山 614000;3.武汉市普爱医院,湖北武汉 430072)
雌二醇(E2)是育龄妇女体内卵巢或黄体分泌的受体水平活性最高的雌激素,其浓度的过高或过低都会导致生殖及内分泌系统紊乱,因此准确地测定E2浓度对于相关疾病的诊断和治疗具有极其重要的意义[1,2]。目前用于E2测定的方法以免疫分析法[3]和高效液相色谱[4]最为常用,但免疫法由于灵敏度、选择性以及试剂污染、假阳性等因素制约了其应用;而色谱法则对技术要求高,预处理繁琐。近年来研究者利用传感器对E2进行测定,如蛋白A与联硫基二(琥珀酰亚胺丙酸盐)修饰电化学免疫传感器[5]、蛋白A-纳米金-丝网印刷免疫传感器[5]、纳米金/巯基蛋白G修饰金电极免疫传感器[7],以及在丝印碳电极上固定抗体(兔抗小鼠IgG和单克隆小鼠抗-E2)[8]检测E2。然而免疫传感器制备工艺比较复杂,影响稳定性和一致性的因素较多,会影响检测导致测量结果不准确,临床使用面临重现性差的问题。
本研究采用丝网印刷技术制备丝印传感器,修饰多壁碳纳米管(MWCNTs)-十六烷基三甲基溴化铵(CTAB),用于大鼠血样中E2的直接测定。该电极能够满足生物样本中E2的测定,减少了前处理过程,能够实现快速、批量、连续、便捷的诊断目的,在临床诊断方面具有应用前景。
1 实验部分
1.1 主要仪器、试剂及受试动物
CHI660E电化学工作站(上海辰华仪器有限公司);实验室用多功能丝网印刷设备(珠海凯为电子元器件有限公司);pHS-3E酸度计(上海雷磁);KQ-100E超声波清洗器(昆山舒美);SPM-9500J3扫描探针显微镜(Japan,Shimadzu);Quanta200 扫描电镜(Holland,FEI);JFC1600精镀仪(Japan,JEOL)。
雌二醇(E2,阿拉丁);多壁碳纳米管(MWCNTs,中国科学院成都有机化学研究所);十六烷基三甲基溴化铵(CTAB,Amresco);血清雌二醇(E2)-放免试剂(RIA)(南京建成);丝印碳油墨(Acheson);银油墨(Acheson);Ag/AgCl油墨(徐州英剑纳米科技有限公司);绝缘油墨(JUJO);PVC片材(上海新立医疗器械有限公司),其他试剂均为分析纯。实验用水均为二次蒸馏水。
SPF级雌性KM小鼠,体重17~20 g;雌性SD大鼠,体重180~240 g,购自湖北省疾控中心。
1.2 MWCNTs-CTAB/SPE的制备
利用丝网印刷技术于PVC基材表面逐层套印导电银轨、工作电极、辅助电极、Ag/AgCl参比电极后,置温度70 ℃烘箱中烘干,最后印刷绝缘层,紫外烘干,得到丝印电极(SPE)[9]。
CTAB溶于蒸馏水中配制成CTAB溶液,再加入MWCNTs,多次超声分散后使MWCNTs/CTAB修饰液分散均匀。移液器吸取MWCNTs-CTAB修饰液滴涂于工作电极表面,于室温自然干燥得到MWCNTs-CTAB/SPE,储存于干燥器中,备用。
1.3 MWCNTs-CTAB/SPE在生物样本中的应用
1.3.1MWCNTs-CTAB/SPE特异性实验SD大鼠随机分为空白组(生理盐水),E2低剂量(0.18 mg/kg)、中剂量(0.9 mg/kg)及高剂量(4.5 mg/kg)组,每组6只,腹腔给药后,分别于6、12、18、21、22 、23、26、32及48 h采用眼底静脉采血,EP管采用EDTA-Na2抗凝处理。将100 μL血样加入到100 μL的0.1 mol/L的Na2CO3-硼砂缓冲液(pH=12)中,采用MWCNTs-CTAB/SPE测定血样中E2含量。48 h后处死大鼠,取出卵巢和子宫,称重脏器与体重并记录脏器指数。
1.3.2不同方法测定血样中E2KM小鼠摘眼球取血,SD大鼠眼底静脉采血,EP管采用EDTA-Na2抗凝处理。100 μL血样加入到100 μL的0.1 mol/L的Na2CO3-硼砂缓冲液(pH=12)中,采用MWCNTs-CTAB/SPE测定血样中E2含量。血样中分别加入1.0×10-10、3.0×10-10和5.0×10-10mol/L的E2,计算加标回收率。将E2标准品、血清样品、标记物和抗体按放免试剂盒规定依次加入试管中,混匀,37 ℃水浴1 h,待反应平衡后,加入分离剂,充分混匀,室温10 min,将各管插入γ放射免疫计数器上放置10 min,弃掉上清液,测各管沉淀的放射性计数(CPM)。
1.4 E2的电化学测定方法
采用电化学工作站,以MWCNTs-CTAB/SPE测定E2,电解液为含不同浓度E2的0.1 mol/L的Na2CO3-硼砂缓冲液(pH=12)。在-1.0~1.0 V(vs.Ag/AgCl)范围进行循环伏安法(CV)扫描,在-0.8~0.8 V(vs.Ag/AgCl)范围进行方波伏安法(SWV)扫描,测定不同浓度的E2,确定峰电流与其浓度的关系。
2 结果与讨论
2.1 SPE表征
通过扫描电镜(SEM)分别对未修饰电极和修饰电极(MWCNTs-CTAB/SPE)进行表征。未经过修饰的工作电极表面的碳墨颗粒相互间关联较少,整体结构疏松,凹凸不平(图2A);经过修饰后,工作电极表面布满MWCNTs,由于工作电极表面电化学特性得到改变,反应比表面积也增大,进而有利于电子在工作电极表面传递,有利于E2在电极表面富集(图2B)。MWCNTs-CTAB/SPE在原子力扫描电镜(AFM)下进行观察。由图2C可以看出,未修饰的工作电极表面起伏大,分布不均匀;经过修饰的工作电极表面变得平滑,MWCNTs-CTAB在其表面分散良好。
2.2 E2在MWCNTs-CTAB/SPE上的电化学特性
采用循环伏安法(CV)考察E2在裸SPE(bare SPE)、MWCNTs修饰SPE(MWCNTs/SPE)、CTAB修饰SPE(CTAB/SPE)和MWCNTs-CTAB修饰SPE(MWCNTs-CTAB/SPE)表面的电化学响应。如图3所示,未修饰的电极对E2电化学响应较小,在0.166 V附近出现氧化峰,未出现还原峰;相同条件下,MWCNTs修饰的电极,由于MWCNTs由于自身良好的导电性能,大的比表面积,显著提高了E2的峰电流,加速其电子转移,氧化峰电位移动至0.111 V,在-0.562 V出现还原峰;CTAB修饰的电极,由于CTAB与E2的疏水相互作用,虽然氧化峰电位移动至0.235 V,但E2在电极表面的氧化峰电流也明显增大;在CTAB的作用下MWCNTs分散均匀,并对MWCNTs起固定作用[10]。MWCNTs起到加快异相界面电子传递速率的作用[11],对E2的催化活性也逐渐增加,导致MWCNTs-CTAB修饰电极上E2的氧化峰电流得到了显著的提高。
2.3 实验条件的影响
2.3.1缓冲溶液的影响采用循环伏安法考察E2分别在NaH2PO4-柠檬酸、Na2CO3-NaHCO3、Na2HPO4-NaH2PO4、HAc-NaAc、NaOH-硼砂等不同种类缓冲液中在MWCNTs-CTAB/SPE表面的电化学响应。在0.1 mol/L 的Na2CO3-硼砂缓冲液中氧化峰峰形较好、峰电流较大。考察不同pH值0.1 mol/L Na2CO3-硼砂缓冲液中E2的电化学响应。结果表明,在碱性条件下,E2氧化峰峰形较好,且无杂峰干扰,当缓冲液pH值为7~12时,E2的峰电流随着缓冲液pH值的增大而增大,电位随pH升高而向负电位方向移动。当缓冲液pH值为12时,峰电流最大,灵敏度最高。故选择pH值为12的0.1 mol/L Na2CO3-硼砂缓冲液为测定介质。
2.3.2扫描速率对E2电化学响应的影响在不同扫描速率下用循环伏安法测定E2在MWCNTs-CTAB/SPE表面的电化学响应。由图4可以看出,随着扫描速度的增加,峰电流增加。在20~300 mV/s 范围内,峰电流与扫描速率成正比;随扫描速率的增加,峰电位正移,氧化峰电流ip与扫描速度平方根v1/2存在良好的线性关系,说明E2在电极上的氧化过程受扩散控制。
2.3.3修饰剂用量的影响实验表明随MWCNTs-CTAB的浓度逐渐增加,E2的峰电流逐渐增加,但浓度超过0.5 mg/mL时,峰电流反而变小,故本实验选择MWCNTs-CTAB的浓度为0.5 mg/mL。同时,0.5 mg/mL MWCNTs-CTAB修饰剂用量从1.0 μL增加到3.0 μL时,E2的峰电流随着修饰量增加而显著增大,这是基于电极表面催化活性位点增多。当修饰剂量再增加至5.0 μL时,峰电流反而降低。此时,电极表面的膜达到一定的厚度,已超过最佳负载量从而阻碍了E2在电极表面的氧化反应。故本实验的修饰剂选择为0.5 mg/mL MWCNTs-CTAB,用量2.0 μL。
2.3.4SWV测定条件优化采用SWV法进一步探讨E2在MWCNTs-CTAB/SPE表面的方波伏安特性。考察了不同扫描频率(10、15、20、25、30 Hz)下E2的SWV曲线。随着扫描频率的增加,E2的峰电流逐渐增大,超过20 Hz,峰电流减小(图5A);在不同电位增幅(8,10,12,14,16 mV)下,SWV测定E2,随着电位增幅的增加,E2峰电流逐渐增大,超过12 mV,峰电流减小(图5B)。因此SWV法的测定条件经过优化为起始电位:-0.8 V,终止电位:0.8 V,电位增量:12 mV,振幅:25 mV,频率:10 Hz。
2.4 工作曲线和检测限
在0.1 mol/L的Na2CO3-硼砂缓冲溶液(pH=12)中,采用SWV法制作E2的标准曲线,其曲线方程为:ip(μA)=2.147c(10-8mol/L)+0.0430,R=0.9968。E2的氧化峰电流与其浓度在5.0×10-10~1.0×10-8mol/L时呈现很好的线性关系,检测限为5.0×10-11mol/L。
2.5 干扰实验
E2在0.31 V附近产生一个氧化峰,通过在测定体系中逐步加入雌酮(E1)及雌三醇(E3),发现E1和E3均会在附近产生一个叠加的氧化峰,从而对E2的测定产生干扰。由于E1、E2和E3在结构上存在很大的相似性,因此E1和E3对生物样品中E2的测定产生一定的干扰。但是由于生物血样中雌激素主要以E2为主,E1和E3的含量相对较低,而且E1主要存在于绝经妇女体内,E3主要存在于妊娠期妇女体内,因而E1和E3对于常规的血样中E2的测定不会造成干扰。其他100倍的金属离子如Zn2+、Na+、K+、Ca2+、Mg2+、Fe3+无氧化还原峰,基本上不干扰E2的测定(误差<5%)。
2.6 精密度和稳定性
随机抽取同一批次与不同批次制备的MWCNTs-CTAB/SPE,分别测定1.0×10-10mol/L、5.0×10-10mol/L、10×10-10mol/L E2。同一批次相对标准偏差(RSD,n=5)分别为4.74%、4.43%、5.26%;不同批次的RSD分别为7.09%、6.35%、6.10%。将制备好的MWCNTs-CTAB/SPE置于干净无尘的塑料袋中,4 ℃干燥保存,3个月内进行测定,E2的测定基本不受影响。
2.7 MWCNTs-CTAB/SPE在生物样本中的应用
2.7.1MWCNTs-CTAB/SPE特异性实验给予大鼠注射外源性E2后,大鼠体内的E2含量呈现规律性变化,在22 h附近达到最大吸收峰。分别给予大鼠注射低、中、高剂量的E2后,大鼠体内的E2浓度表现出较好的量效关系,说明MWCNTs-CTAB/SPE能特异性地测定血样中的E2(图6A)。通过计算大鼠卵巢和子宫脏器指数,结果发现,同空白对照组大鼠卵巢和子宫脏器(图6B)相比,给予低剂量E2(0.18 mg/kg)的大鼠卵巢和子宫脏器指数出现明显增加,子宫壁明显增厚,这可能是E2促进了子宫细胞增生;给予中剂量E2(0.9 mg/kg)的大鼠卵巢和子宫脏器指数略微增长,和对照组无明显差异;给予高剂量E2(4.5 mg/kg)的大鼠卵巢和子宫脏器指数反而下降,子宫出现一定程度的萎缩,这可能是高浓度的E2抑制了子宫的机能(图6C)。
2.7.2MWCNTs/CTAB/SPE测定不同血样中E2的含量分别利用MWCNTs/CTAB/SPE测定大鼠及小鼠血样中E2含量,在上述基础上,继续增加E2浓度。随着E2浓度的升高,峰电流值与浓度呈线性关系,加样标准曲线相关系数分别为0.9941与0.9933。计算得到大鼠血中的E2含量为7.91×10-10mol/L,小鼠血中的雌二醇含量为2.24×10-9mol/L。
2.7.3不同方法测定小鼠血样中E2的含量采用MWCNTs/CTAB/SPE和RIA法分别测定小鼠血清中E2,再加入不同浓度 E2溶液测定加样回收率。回收率测定结果见表1。
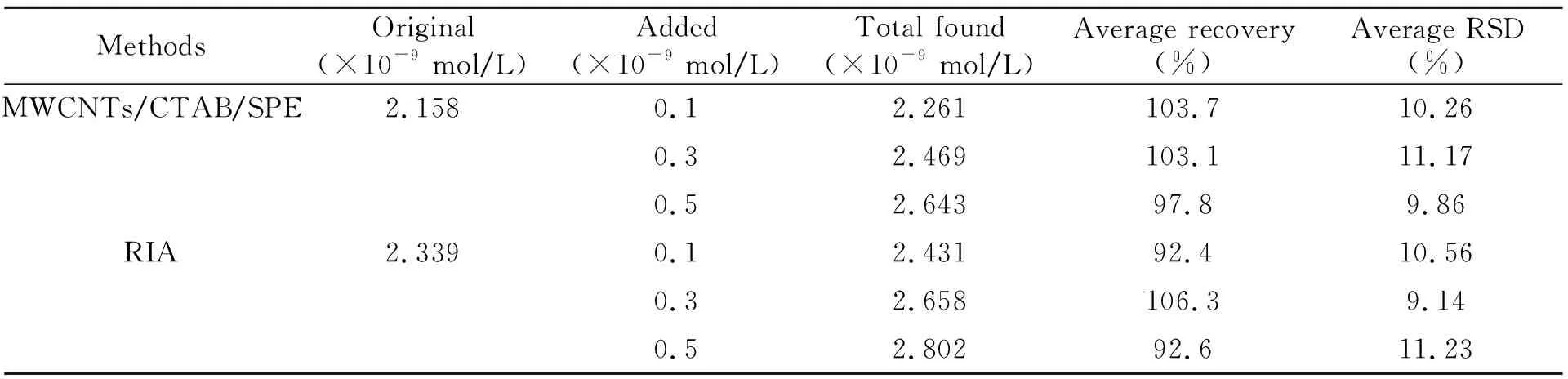
表1 小鼠血样中E2回收率测定(n=5)
3 结论
MWCNTs-CTAB/SPE制备简单,制备工艺容易标准化,便于进行质量控制以及长期保存。通过给予大鼠注射外源性E2后,在22 h附近达到最大吸收峰,并且浓度变化曲线与给药量表现出较好的量效关系。另外通过计算大鼠子宫和卵巢脏器指数,发现低剂量E2能促进子宫壁加厚,高剂量的E2反而导致子宫萎缩。以上结果表明MWCNTs-CTAB/SPE对生物样本中的E2具有足够的灵敏度,能够直接用于生物样本的测定,可以成为进行E2相关性研究和药物筛选及临床诊断辅助的有效工具。
