乙二胺四乙酸二酐对草酸脱羧酶的修饰改性
2016-10-13贺俊斌林日辉龙寒巫佳蔡杏华杨颖陈盛峰
贺俊斌,林日辉,龙寒,巫佳,蔡杏华,杨颖,陈盛峰
乙二胺四乙酸二酐对草酸脱羧酶的修饰改性
贺俊斌1,林日辉2,龙寒1,巫佳1,蔡杏华1,杨颖1,陈盛峰1
(1广西民族大学海洋与生物技术学院,广西高校微生物与植物资源利用重点实验室,广西南宁 530007;2广西民族大学化学化工学院,化学与生物转化过程新技术重点实验室,广西南宁 530007)
为提高草酸脱羧酶(Oxdc)在预防治疗泌尿系结石症方面的稳定性和应用性能,采用乙二胺四乙酸二酐(EDTAD)对Oxdc进行化学修饰,并初步优化了修饰条件:当修饰反应时间为8 h、EDTAD/Oxdc的摩尔比为50:1、反应pH为7.0、反应温度为37℃时,修饰率为71.91%,酶活回收率为75.42%。聚丙烯酰胺凝胶电泳(SDS-PAGE)和超高效液相色谱-质谱(UPLC-MS)联用分析证明Oxdc和EDTAD共价结合成功。紫外-可见吸收光谱(UV)和圆二色性光谱(CD)分析结果表明,修饰后Oxdc的空间结构发生了一定程度的改变。同时,部分酶学性质研究表明,经EDTAD修饰后的Oxdc较游离的Oxdc,最适pH向碱性方向偏移了约1.5个单位,耐热性和耐胰蛋白酶酶解的能力均显著增强。此外,修饰后的Oxdc在草酸钙上的吸附量明显提高。结果说明修饰后的Oxdc的稳定性显著增强,应用性能有所改善。
泌尿系结石;酶;草酸脱羧酶;纯化;乙二胺四乙酸二酐;化学修饰;吸附
引 言
泌尿系结石中70%~80%的结石为草酸钙结石[1-2]。目前,虽然可以通过体外冲击波碎石术、经皮肾镜取石术、输尿管镜碎石术、化学药物治疗等物理和化学方法对其进行治疗[3],并取得了一定的疗效;然而,物理、化学方法的治疗费用昂贵、对人体副作用较大,且草酸钙结石具有较高的复发率,这给患者带来了极大的痛苦和经济负担。生物酶具有高效性、专一性和温和性等作用特点,而人体内缺乏降解草酸 (草酸盐)的相关代谢途径是导致草酸钙结石的一个重要原因,因此,利用草酸代谢酶催化降解人体内的草酸(草酸盐),以预防和治疗草酸钙结石症已成为目前重要的研究方向。
目前,自然界中已发现有3种草酸降解酶:草酸脱羧酶(EC 4.1.1.2)、草酸氧化酶(EC 1.2.3.4)和草酰辅酶A脱羧酶(EC 4.1.1.8)[4-5]。草酸脱羧酶(oxalate decarboxylase,Oxdc,EC 4.1.1.2)能够催化裂解草酸的CC键,在没有辅因子的参与下即可催化降解草酸(草酸盐)生成甲酸(甲酸盐)和CO2,是植物及微生物中草酸代谢降解的主要催化酶。由于该酶在酶促反应过程中的高效性及对底物的高度特异性等特点,已被广泛应用于食品、工业生产、农业、医疗等领域中草酸(草酸盐)的降解[5-7]。尤其在防治草酸钙结石症方面,采用Oxdc降解人体内的草酸(草酸盐)成为了该领域的研究热点。Grujic等[8]以基因敲除小鼠为模型,通过口服交联Oxdc晶体(OxDc-CLEC),发现小鼠体内粪草酸和尿草酸分别降低了72%和44%。Jeong等[9]模拟高草酸尿症模型,给小鼠口服来源于.的重组Oxdc,发现小鼠尿液中草酸的水平有效地减少了。Cowley等[10]以狗和大鼠为实验动物,口服酶制剂Oxazyme(OC4)连续饲喂14 d,评价了用于催化降解动物消化道中草酸的酶制剂的毒性,结果表明,对狗使用剂量为187.2 mg·kg-1·d-1,对大鼠使用剂量为720.8 mg·kg-1·d-1均无可见有害作用水平。Shenoy等[11]运用交联酶晶体法(CLECs)制成Oxdc酶制剂用于治疗草酸盐结石症以及Sidhu等[12]运用喷雾干燥法制成重组Oxdc颗粒用于减少胃肠吸收的草酸含量,均取得了良好的效果。此外,本课题组前期研究也证明了Oxdc促进草酸钙结晶重新溶解的作用[13]。这些研究都表明,利用Oxdc制剂催化降解消化道内的草酸(草酸盐)以预防治疗草酸钙结石症的方法是可行的。然而,在实际应用中,尿液处于流动的状态,Oxdc制剂到达泌尿系统中则面临酶蛋白易被稀释和流失的问题。如果首先对Oxdc进行修饰改性,使其对草酸钙晶体具有较强的吸附能力,然后选择合适的方式给药,使修饰后的酶制剂到达泌尿系统后既可高效吸附固定于草酸钙晶体上,较长时间维持结合在草酸钙结石部位的酶制剂浓度,又可发挥酶催化降解草酸(草酸盐)促进草酸钙溶解的能力。
酶化学修饰是改进酶性能的有效方法。目前,常见的化学修饰剂包括烷基化试剂、酸酐、二羰基化合物等小分子修饰剂,戊二醛、羰二亚胺、葡萄糖二乙醛等双功能基团试剂以及如聚乙二醇、右旋糖酐、丙烯酸多聚物等大分子修饰剂[14]。本课题组前期采用单甲氧基聚乙二醇及右旋糖酐对Oxdc进行修饰改性,其稳定性得到了有效提高[15-17]。而采用酸酐对Oxdc进行修饰改性目前尚未有相关文献报道。本研究 采用乙二胺四乙酸二酐(ethylenediaminetetraacetic dianhydride,EDTAD)对Oxdc进行修饰改性,分析修饰后Oxdc的生物活性及结构变化,并探讨EDTAD修饰对Oxdc部分酶学性质和催化吸附性能的影响,为其应用于防治草酸钙结石症提供理论 参考。
1 材料与方法
1.1 材料、试剂与仪器
基因工程菌.BL21(DE3)/pET32a/YvrK,本实验室保存;LB培养基组成:1 L培养基含蛋白胨10 g、酵母提取物5 g、NaCl 10 g;LB固体培养基添加18 g琼脂粉。
草酸钾、甲酸脱氢酶(formate dehydrogenase,FDH)、2,4,6-三硝基苯磺酸(picrylsulfonic acid solution,TNBS)、-甲苯磺酰基-L-苯基丙氨酸氯甲基酮(-tosyl-L-phenylalanyl chloromethyl ketone,TPCK)-胰蛋白酶(测序级),美国Sigma公司;氨苄青霉素,美国Amresco公司;异丙基硫代-β-D-半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG),德国Merck公司;烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD),瑞士Roche公司;EDTAD,天津希恩思生化科技有限公司;乙腈(色谱级),美国Fisher Scientific公司;甲酸(色谱级),阿拉丁;其他试剂均为国产分析纯。
SDS-PAGE预制胶,上海伯楷安生物科技有限公司;HisTrapTMHP亲和柱、ÄKTAprime plus快速低压液相色谱系统,美国GE Healthcare集团;凝胶电泳成像分析仪,美国Bio-Rad公司;TU-1901双光束紫外-可见分光光度计,北京普析通用仪器公司;CR-22G高速冷冻离心机,日本日立公司;Sigma 1-13高速台式离心机,美国Sigma公司;超低温冰箱,美国Beckman公司;4℃冰箱,中国海尔集团;JY92-Ⅱ超声波细胞粉碎机,宁波新芝生物科技股份有限公司;HH-2数显恒温水浴锅,国华电器有限公司;电子天平,梅特勒-托利多仪器有限公司;MOS-450圆二色谱仪,法国BioLogic公司;Waters液质联用串联四极杆飞行时间质谱仪:ACQUITY UPLC I-Class系统和XEVO G2-S QTOF质谱仪,美国Waters公司。
1.2 实验方法
1.2.1 Oxdc的制备及酶活力检测 Oxdc的制备参考文献[18]。培养发酵基因工程菌.BL21(DE3)/pET32a/YvrK至OD600约0.6,将发酵物42℃热冲击5 min,添加IPTG至终浓度0.4 mmol·L-1诱导表达Oxdc,离心(4℃,8000 r·min-1,15 min)发酵液并收集菌体,然后以pH 8.0(50 mmol·L-1)的磷酸盐缓冲液(PBS)重悬菌体,重溶菌液在冰浴条件下进行超声破碎,离心,上清液即为粗酶液;用ÄKTAprime plus快速低压液相色谱系统对粗酶液进行纯化,所得纯化酶液转入预先处理好的透析袋(截留分子量8000~14000)中,于50 mmol·L-1pH 8.0的PBS中4℃下透析过夜,然后用超滤浓缩管浓缩至一定浓度,所得酶液为野生酶(Oxdc)供试酶液。
Oxdc的酶活力测定参考文献[19]。酶活力单位定义为:每分钟催化转化草酸产生1 μmol甲酸的酶量。蛋白质浓度的测定采用考马斯亮蓝法,以牛血清白蛋白作为标准。
1.2.2 EDTAD对Oxdc的修饰 将EDTAD和Oxdc按摩尔比0.5:1~100:1分别溶于50 mmol·L-1不同pH(pH 3.0~9.0)的PBS中,4~45℃搅拌反应1~24 h;在整个反应过程中用 0.1 mol·L-1NaOH溶液维持反应体系的 pH 至恒定值;反应结束后,将反应产物转入预先处理好的透析袋(截留分子量8000~14000)中,于50 mmol·L-1pH 8.0的PBS中4℃下透析过夜,以除掉残余的修饰剂等杂质,然后用超滤浓缩管浓缩至一定浓度,所得溶液作为修饰酶(EDTAD-Oxdc)供试酶液。
Oxdc的修饰程度的测定采用TNBS法[20]。TNBS与酶蛋白表面的游离氨基发生反应,生成三硝基苯衍生物,在420 nm有特征吸收峰。修饰率MR按式(1)计算
式中,0为Oxdc在420 nm下的光吸收值,1为EDTAD-Oxdc在420 nm下的光吸收值,0为修饰前Oxdc的浓度,1为修饰后经透析和浓缩所得酶的浓度。在检测时,TNBS用双蒸水稀释至1 g·L-1,以降低TNBS浓度过大对检测结果的影响。
酶活回收率RR按式(2)计算
式中,0为用于修饰反应的Oxdc的酶活,1为修饰后经透析浓缩所得酶的酶活,0为修饰前Oxdc的浓度,1为修饰后经透析和浓缩所得酶的浓度。
1.2.3 SDS-PAGE分析 采用梯度胶浓度为4%~20%的SDS-PAGE电泳分析Oxdc和EDTAD-Oxdc的分子量变化。
1.2.4 超高效液相色谱-质谱(UPLC-MS)分析 取TPCK-胰蛋白酶适量,用50 mmol·L-1Tris-HCl缓冲液(pH 8.5)溶解制成浓度为1 mg·ml-1的溶液,分装后放入-20℃冰箱冷冻,备用。
分别取蛋白浓度均为2 mg·ml-1的Oxdc和EDTAD-Oxdc125 μl,各加50 mmol·L-1Tris-HCl缓冲液(pH 8.5)1 ml,按50:1(质量比)的比例(酶液/TPCK-胰蛋白酶溶液)加入TPCK-胰蛋白酶溶液,混匀,37℃水浴保温酶解12 h,取出,100℃水浴加热15 min终止反应,12000 r·min-1离心5 min,收集上清液,4℃备用,进样前用0.45 μm的针头过滤器去除不溶物。另以不加Oxdc和EDTAD-Oxdc,其他同法操作,作为酶解空白。
UPLC条件:实验使用Waters ACQUITY UPLC I-Class系统;色谱柱为Waters ACQUITY UPLC HSS T3(1.8 µm,2.1×100 mm);柱温为35℃;进样体积为10 μl;梯度洗脱程序见表1[流动相A:0.1%(体积)甲酸/水;流动相B:0.1%(体积)甲酸/乙腈]。MS条件:联用的质谱仪为Waters XEVO G2-S QTOF;ESI+电离模式,毛细管电压为2.7 kV,锥孔电压为40 V,离子源温度为100℃,脱溶剂气温度为350℃,锥孔反吹气流量为20 L·h-1,脱溶剂气流量为800 L·h-1,碰撞能为6 V,检测器电压为2575 V,扫描范围为/100~7000。

表1 梯度洗脱程序
1.2.5 紫外-可见吸收光谱(UV)分析 采用TU-1901双光束紫外-可见分光光度计,样品扫描波长为200~600 nm,石英比色皿光程为 10 mm,酶蛋白浓度为0.2~1.0 mg·ml-1。
1.2.6 圆二色性光谱(CD)分析 采用MOS-450圆二色谱仪,波长扫描范围为180~250 nm,带宽1 nm;使用石英比色池的光程为1 mm。所得数据采用SELCON3算法[21-22]分析修饰前后Oxdc的二级结构含量变化。
1.2.7 部分酶学性质 酶最适反应pH的测定:在pH 3.0~6.5的柠檬酸盐缓冲体系(50 mmol·L-1)中,分别测定相同蛋白浓度的Oxdc和EDTAD-Oxdc的酶活力,以同组实验中酶活力最高数据为100%酶活力,计算相对酶活。
温度对酶活力的影响:在各自最适反应 pH下,分别测定相同蛋白浓度的Oxdc和EDTAD-Oxdc在不同温度(45~75℃)下热处理30 min的酶活力,观察热处理后酶活力的变化;分别将相同蛋白浓度的Oxdc和EDTAD-Oxdc在65℃条件下水浴,不同时间取样测定酶活力。以同组实验中酶活力最高数据为100%酶活力,计算相对酶活。
对胰蛋白酶的耐受性:取相同蛋白浓度的Oxdc和EDTAD-Oxdc各2.25 ml,分别加入0.25 ml胰蛋白酶溶液(2.5 mg·ml-1),37℃下水浴,定时取样,分别在各自最适反应 pH下测定残余酶活力,以起始活性数据为100%酶活力,计算相对酶活,分析胰蛋白酶消化对Oxdc和EDTAD-Oxdc的影响。
1.2.8 吸附实验 准确称取1.0 g一水草酸钙晶体于50 ml的具塞磨口锥形瓶中,分别加入一定体积的pH 7.0的一水草酸钙饱和溶液,再分别加入已灭活的Oxdc和EDTAD-Oxdc至终浓度均为2 mg·ml-1,使吸附体系总体积为20 ml;后在 (37.0±0.5)℃下恒温振荡进行吸附反应4 h,离心分离,测定上清液中的蛋白浓度,计算吸附量。吸附量(e,mg·m-2)按式(3)计算
式中,0为Oxdc和EDTAD-Oxdc的初始浓度,mg·ml-1;e为Oxdc和EDTAD-Oxdc的平衡浓 度,mg·ml-1;为溶液体积,ml;为一水草酸钙的比表面积(实验测得一水草酸钙的比表面积约为2.65 m2·g-1)。
2 结果与分析
2.1 Oxdc的诱导表达与纯化结果
经诱导表达并纯化后,实验测得野生酶酶活力为14.76 U·ml-1,蛋白质含量为8.79 mg·ml-1;亲和层析分离结果如图1所示。

图1 Oxdc粗提液亲和层析洗脱曲线
2.2 EDTAD修饰Oxdc的条件初步优化
2.2.1 反应时间对修饰的影响 考察反应时间对EDTAD修饰Oxdc的影响,结果如图2所示。随着反应时间的增加,修饰率增加,而酶活回收率随之下降。修饰反应进行1 h及2 h的酶活回收率分别为90.90%和86.10%,而修饰率仅为16.37%和38.99%;当修饰反应进行8 h时,修饰率为67.50%,酶活回收率为74.55%;继续修饰反应达24 h时,修饰率为76.95%,但酶活回收率比8 h降低20.99%,为58.90%。可见修饰反应时间过长会不同程度地降低酶活回收率,因此,本实验选择修饰反应时间为8 h。

图2 反应时间的影响
2.2.2 EDTAD/Oxdc摩尔比对修饰的影响 不同EDTAD/Oxdc摩尔比对修饰反应的影响结果如图3所示。当EDTAD/Oxdc摩尔比为1:1时,酶活回收率为85.10%,而修饰率仅为39.66%;当EDTAD/Oxdc摩尔比增加到100:1时,修饰率达88.77%,而酶活回收率降低到60.76%。EDTAD/Oxdc摩尔比为50:1时,修饰率为65.26%,酶活回收率为68.88%。考虑到EDTAD用量过大会对Oxdc的活性位点及空间结构产生影响,本实验选择EDTAD/Oxdc的摩尔比为50:1。

图3 EDTAD/Oxdc摩尔比的影响
2.2.3 pH对修饰的影响 如图4所示,在pH 3.0~7.0范围内,酶活回收率随着pH的增加而增大;而pH高于7.0后,酶活回收率随着pH的增大而减小。当pH 5.0时,达到最高修饰率68.42%,而酶活回收率为59.46%,推测由于Oxdc的等电点在5.1左右[23],当反应体系的pH接近5.1时,酶蛋白上的自由氨基增多,修饰反应活性增大。而当pH 7.0时,修饰率较pH 5.0时降低14.38%,但酶活回收率比pH 5.0时增加44.52%,为85.93%。为了获得较高的酶活回收率和较高的修饰率,修饰反应的最适pH选择为7.0。

图4 反应pH的影响
2.2.4 反应温度对修饰的影响 反应温度对EDTAD修饰Oxdc的影响结果如图5所示。在4~45℃范围内,随着反应温度的升高修饰率有一定程度的增加,而酶活回收率随之减小。当反应温度为4℃时,修饰率为46.54 %,酶活回收率达到最大值92.27%;而当反应温度为45℃时,修饰率达到最高值73.24%,但酶活损失近50%。当反应温度为37℃时,具有较高的修饰率(71.91%)和较高的酶活回收率(75.42%),本实验选择修饰反应的温度为37℃。

图5 反应温度的影响
2.3 SDS-PAGE分析结果
EDTAD是一种双功能团的试剂,其与Oxdc 中的氨基基团发生反应,反应历程可按以下两条路线
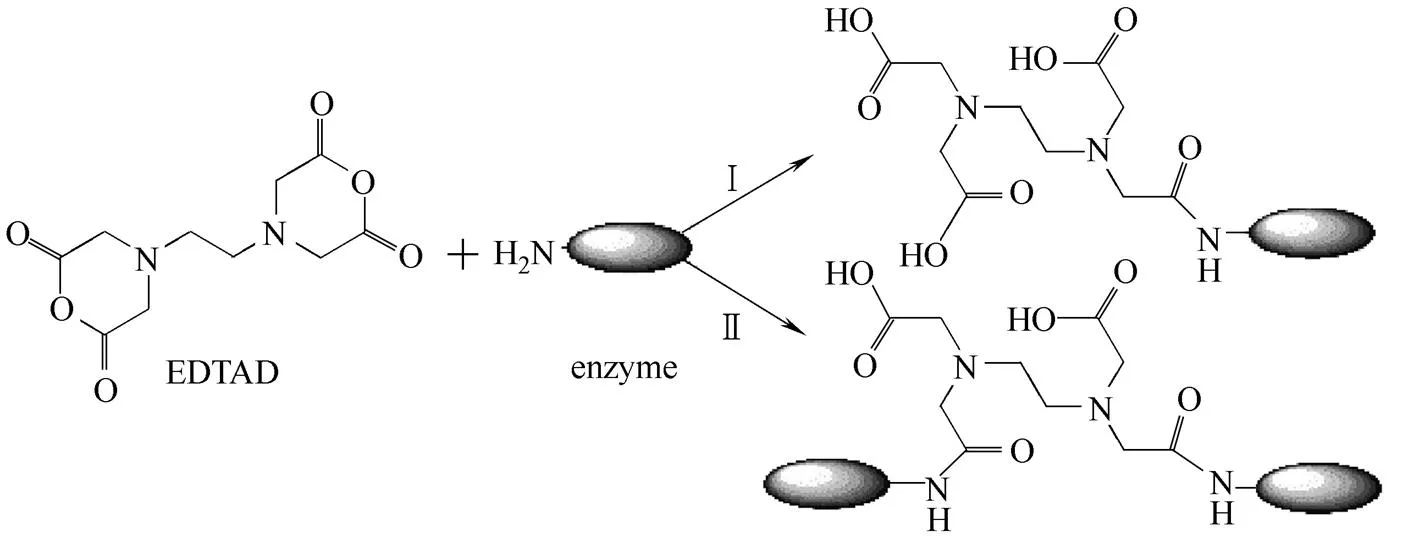
当反应按路线Ⅰ反应时,一分子EDTAD与Oxdc中的一个基团发生反应;而当反应按路线Ⅱ进行时,一分子EDTAD同时与两个Oxdc蛋白分子上的基团发生反应,生成结合两分子Oxdc的二聚体产物。SDS-PAGE分析结果见图6。Oxdc亚基的分子量约为43×103,根据条带谱型推测,EDTAD修饰Oxdc的反应路线按上述的路线Ⅰ进行,因为泳道未出现按路线Ⅱ反应的理论修饰产物的显色条带。此外,在实验过程中,EDTAD-Oxdc的条带迁移速度较Oxdc的缓慢,说明EDTAD-Oxdc的分子量高于Oxdc的。本实验还进行了EDTAD对牛血清白蛋白(BSA)的修饰反应,根据修饰产物的条带谱型,修饰后的BSA条带单一,说明EDTAD修饰BSA的反应也是按上述的路线Ⅰ进行。这可能是由于酶蛋白分子的空间立体结构阻碍了其与EDTAD反应的活性,使得反应向有利于进行的路线Ⅰ进行。

图6 SDS-PAGE分析结果
2.4 UPLC-MS分析结果
经TPCK处理过的胰蛋白酶可专一性地水解Oxdc中赖氨酸(Lys)和精氨酸(Arg)的羧基端。但在实际情况下得到的酶解肽段与理论肽段并不一致,因为不是所有的酶解位点都同时发生了酶解。Oxdc和EDTAD-Oxdc经TPCK-胰蛋白酶酶解,其酶解样品采用UPLC-MS联用技术分析,得到的总离子流图经Waters公司的BiopharmaLynx软件分析对比,结果表明:EDTAD修饰Oxdc的位点位于Oxdc侧链的自由氨基和N端的-氨基上,测定结果见表2,这与Gregg等[24]采用EDTAD修饰瘦素蛋白(rhu-met-leptin)得到的结果类似。

表2 UPLC-MS分析结果
2.5 UV分析结果
蛋白质在紫外线范围内有两个特征吸收峰,一是蛋白质分子中的酪氨酸(Tyr)、色氨酸(Trp)和苯丙氨酸(Phe)等残基在280 nm处有一个特征吸收峰;二是因蛋白质含有肽键,在200~220 nm处有一个特征吸收峰。由图7可知,Oxdc的最大吸收波长为209.8 nm,而EDTAD-Oxdc的最大吸收波长在212.6 nm处。经EDTAD修饰后,Oxdc的最大吸收波长发生了红移,这可能是因为EDTAD的引入改变了酶分子的微环境,n和轨道间的能量差减小,使得Oxdc的最大吸收波长向长波长移动[25]。最大吸收波长的微小变化说明Oxdc经EDTAD修饰后其分子构象发生了一定程度的变化。
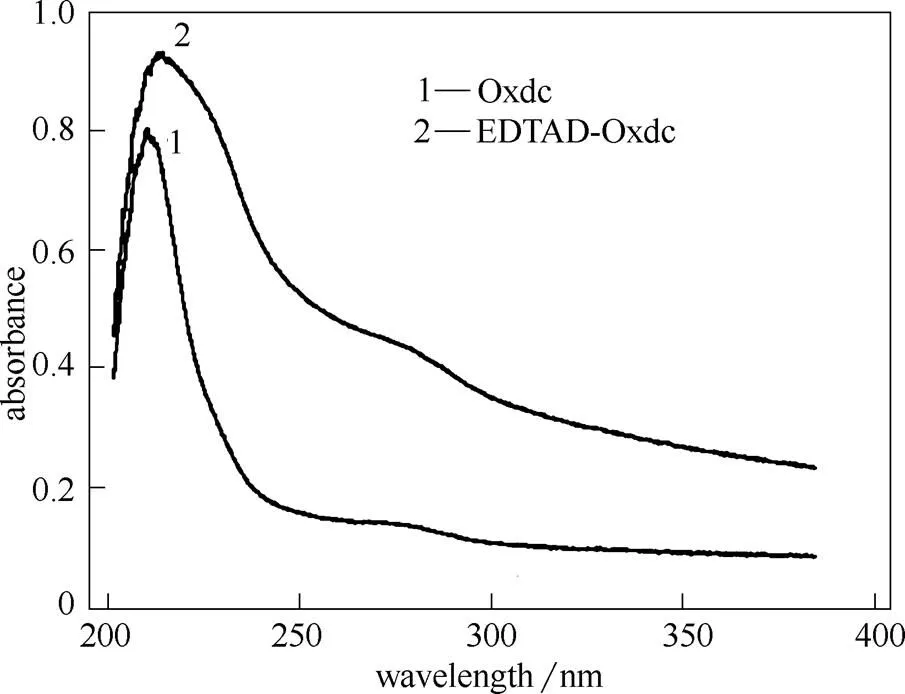
图7 UV分析结果
2.6 CD分析结果
蛋白质的二级结构主要有α-螺旋、β-折叠、β-转角和无规卷曲。由表3可知,Oxdc经EDTAD修饰后,α-螺旋、β-折叠的含量有所减少,β-转角和无规卷曲的含量有所增加。说明经EDTAD修饰后,Oxdc的二级结构发生了一定程度的变化。

表3 原酶液和修饰酶液的二级结构含量变化
2.7 部分酶学性质的研究
2.7.1 Oxdc和EDTAD-Oxdc的最适pH比较 由图8可知,Oxdc的最适pH为3.5,而EDTAD-Oxdc的最适pH为5.0。经EDTAD修饰后,Oxdc的最适pH向碱性方向偏移了约1.5个单位。这与Sangeetha等[26]采用不同酸酐(柠康酸酐、邻苯二甲酸酐、丁二酸酐、马来酸酐)修饰木瓜蛋白酶、熊亚红等[27]采用不同酸酐(邻苯二甲酸酐、丁二酸酐、马来酸酐)修饰漆酶以及张静等[25]采用丁二酸酐修饰枯草芽孢杆菌氨肽酶得到的修饰酶的最适pH向碱性方向偏移的结果类似。这可能是由于EDTAD与Oxdc分子中的赖氨酸(Lys)残基上带正电荷的氨基反应后,在Oxdc分子中引入了带负电荷的羧基,使得最适pH增加了[28]。

图8 Oxdc和EDTAD-Oxdc的最适pH比较
2.7.2 Oxdc和EDTAD-Oxdc的热稳定性比较 由图9(a)可知,Oxdc和EDTAD-Oxdc的酶活力随温度的变化其趋势基本相同,都在45℃时酶活力达到最高;但EDTAD-Oxdc较野生酶表现出较好的耐热性,修饰酶经75℃热处理30 min后,相对酶活仍保留一半以上,而Oxdc的相对酶活仅为24.41%。Oxdc和EDTAD-Oxdc在65℃水浴热处理的结果见图9(b)。随着时间的延长,Oxdc和EDTAD-Oxdc的酶活力均降低。65℃热处理0.5 h,EDTAD-Oxdc的相对酶活保留83.26%,而Oxdc的相对酶活降至62.11%;继续水浴至3.0 h时,Oxdc的相对酶活为24.80%,而EDTAD-Oxdc的相对酶活较野生酶高约9.36%。这些结果说明与Oxdc相比,经过EDTAD修饰后的Oxdc表现出较高的耐高温能力,具有较好的热稳定性。这与Sangeetha等[26]、熊亚红等[27]、张静等[25]的研究结果类似。这可能是因为修饰剂与酶分子共价连接后,使得Oxdc分子的结构变得更加紧密,其分子内的作用力增强,导致Oxdc的热稳定性提高[29]。

图9 Oxdc和EDTAD-Oxdc的热稳定性比较
2.7.3 Oxdc和EDTAD-Oxdc对胰蛋白酶的耐受性比较 如图10所示,随着胰蛋白酶处理时间的延长,Oxdc和EDTAD-Oxdc的酶活变化趋势相同。Oxdc经胰蛋白酶处理1.0 h,相对酶活降至68.88%,而EDTAD-Oxdc仍保留了80%以上的酶活;当处理24 h时,EDTAD-Oxdc较Oxdc保留了高约5%的相对酶活。结果表明,经EDTAD修饰后,Oxdc的抗胰蛋白酶水解能力显著增强。关于Oxdc经化学修饰后抗胰蛋白酶水解的研究有少量报道。梁跃等[15]采用无载体固定法交联Oxdc,发现经胰蛋白酶处理48 h,交联Oxdc的残余酶活力较游离Oxdc的高30%多。韦成昱等[16-17]采用右旋糖酐和单甲氧基聚乙二醇修饰Oxdc,发现修饰酶抗胰蛋白酶消化的能力明显提高。

图10 Oxdc和EDTAD-Oxdc对胰蛋白酶的耐受性比较
2.8 Oxdc和EDTAD-Oxdc在一水草酸钙上的吸附比较
由图11可知,Oxdc经EDTAD修饰后在一水草酸钙上的吸附能力显著提高。实验测得,经EDTAD修饰的Oxdc在一水草酸钙上的吸附量较未修饰的Oxdc约提高了42.42%。这可能与Oxdc经过EDTAD修饰后,酶分子中引入了较多的羧基,增加了其与一水草酸钙上的Ca2+的结合能力有关。上述结果说明采用EDTAD修饰Oxdc,使其有效吸附于一水草酸钙上,并维持酶催化降解草酸钙的能力是可行的。

图11 Oxdc和EDTAD-Oxdc在一水草酸钙上的吸附比较
3 结 论
本研究采用EDTAD对Oxdc进行了化学修饰,初步优化了修饰条件,分析了修饰后Oxdc的生物活性和结构变化,并探讨了酸酐修饰对部分酶学性质及催化吸附性能的影响。结果表明,当修饰反应时间为8 h、EDTAD/Oxdc的摩尔比为50:1、反应pH为7.0、反应温度为37℃时,修饰率为71.91%,酶活回收率为75.42%。SDS-PAGE和UPLC-MS分析证明Oxdc和EDTAD成功共价结合,并表明EDTAD修饰Oxdc的位点位于Oxdc侧链的自由氨基和N端的-氨基上。UV和CD分析结果表明修饰后Oxdc的空间结构发生了一定程度的改变。部分酶学性质研究表明,经EDTAD修饰后的Oxdc较游离的Oxdc,最适pH向碱性方向偏移了约1.5个单位,热稳定性和对胰蛋白酶的耐热性均显著增强。此外,在本实验条件下,修饰后的Oxdc在草酸钙上的吸附量较未修饰的Oxdc约提高了42.42%。这些结果说明Oxdc经化学修饰引入酸酐,使其既可高效吸附固定于草酸钙结晶上,又可发挥酶催化降解草酸促进草酸钙溶解的能力,从而改善应用性能的方法是可行的。本实验为获得缓解泌尿系草酸钙结石病症的酶制剂提供了理论参考。
References
[1] FINKIELSTEIN V A, GOLDFARB D S. Strategies for preventing calcium oxalate stones [J]. Canadian Medical Association Journal, 2006, 174 (10): 1407-1409.
[2] IVANOVSKI O, DRUEKE T B. A new era in the treatment of calcium oxalate stones? [J]. Kidney International, 2013, 83 (6): 998-1000.
[3] 杨寿佐. 泌尿系结石治疗新进展 [J]. 临床合理用药杂志, 2011, 4 (8X): 130-131. YANG S Z. New progress in the treatment of urinary calculi [J]. Clinical Rational Drug Use, 2011, 4 (8X): 130-131.
[4] SVEDRUŽIĆ D, JÓNSSON S, TOYOTA C G,. The enzymes of oxalate metabolism: unexpected structures and mechanisms [J]. Archives of Biochemistry and Biophysics, 2005, 433 (1): 176-192.
[5] MÄKELÄ M R, HILDÉN K, LUNDELL T K. Oxalate decarboxylase: biotechnological update and prevalence of the enzyme in filamentous fungi [J]. Applied Microbiology and Biotechnology, 2010, 87 (3): 801-814.
[6] 贺俊斌, 林日辉, 韦成昱, 等. 草酸脱羧酶的性质及应用研究进展 [J]. 食品科学, 2015, (1): 262-267. HE J B, LIN R H, WEI C Y,. Properties and applications of oxalate decarboxylase [J]. Food Science, 2015, (1): 262-267.
[7] 贺俊斌, 林日辉, 龙寒, 等. 草酸降解酶预防治疗草酸钙结石症的研究进展 [J].广东医学, 2015, (7): 1132-1136. HE J B, LIN R H, LONG H,. Research progress on oxalate-degrading enzyme preventing calcium oxalate stones [J]. Guangdong Medical Journal, 2015, (7): 1132-1136.
[8] GRUJIC D, SALIDO E C, SHENOY B C,. Hyperoxaluria is reduced and nephrocalcinosis prevented with an oxalate-degrading enzyme in mice with Hyperoxaluria [J]. American Journal of Nephrology, 2009, 29 (2): 86-93.
[9] JEONG B C, HAN D H, SEO S I,. Yvrk gene recombinant.reduce the concentration of urine oxalate in transient Hyperoxaluria rat model [J]. The Journal of Urology, 2009, 181 (4): 660.
[10] COWLEY A B, POAGE D W, DEAN R R,. 14-Day repeat-dose oral toxicity evaluation of oxazyme in rats and dogs [J]. International Journal of Toxicology, 2010, 29 (1): 20-31.
[11] SHENOY B C, CACHERO T G, SHIN J,. Crystallized oxalate decarboxylase and methods of use: WO, US8142775B2 [P]. 2012-03-27.
[12] SIDHU H, COWLEY A B, GOLANDER C,. Purification and isolation of recombinant oxalate degrading enzymes and spray-dried particles containing oxalate degrading enzymes: US8431122 [P]. 2013-4-30.
[13] 贺俊斌, 龙寒, 林日辉, 等. 草酸脱羧酶促进草酸钙结晶溶解的体外研究 [J]. 食品科学, 2015, (19): 159-162. HE J B, LONG H, LIN R H,. Oxalate decarboxylase promotes thedissolution of calcium oxalate crystals [J]. Food Science, 2015, (19): 159-162.
[14] 张永帅, 李元召, 孙俊良. 酶修饰研究进展 [J]. 食品工业科技, 2014, 35 (2): 350-353. ZHANG Y S, LI Y Z, SUN J,. Research progress in the enzymatic modification [J]. Science and Technology of Food Industry, 2014, 35 (2): 350-353.
[15] 梁跃, 林日辉, 黄文勤, 等. 交联草酸脱羧酶聚集体的制备及其性质 [J]. 食品科学, 2013, 34 (1): 215-219. LIANG Y, LIN R H, HUANG W Q,. Preparation and properties of cross-linked oxalate decarboxylase aggregates [J]. Food Science, 2013, 34 (1): 215-219.
[16] 韦成昱, 林日辉, 黄文勤, 等. 单甲氧基聚乙二醇-醛对草酸脱羧酶的修饰 [J]. 食品与发酵工业, 2014, 40 (3): 30-35. WEI C Y, LIN R H, HUANG W Q,. Research on modification of oxalate decarboxylase by methoxy polyethyleneglycol-aldehyde [J]. Food and Fermentation Industries, 2014, 40 (3): 30-35.
[17] 韦成昱, 林日辉, 龙寒, 等. 右旋糖酐对草酸脱羧酶的修饰研究 [J]. 食品工业科技, 2014, 35 (13): 195-199. WEI C Y, LIN R H, LONG H,. Study on chemical modification of oxalate decarboxylase by dextran [J]. Science and Technology of Food Industry, 2014, 35 (13): 195-199.
[18] 林日辉, 许丽莉, 农勉, 等. 重组草酸脱羧酶的表达及酶学性质研究 [J]. 食品与发酵工业, 2011, 37 (2): 57-61. LIN R H, XU L L, NONG M,. Expression and characterization of oxalate decarboxylase [J]. Food and Fermentation Industries, 2011, 37 (2): 57-61.
[19] SVEDRUZIC D, LIU Y, REINHARDT L A,. Investigating the roles of putative active site residues in the oxalate decarboxylase from[J]. Archives of Biochemistry and Biophysics, 2007, 464 (1): 36-47.
[20] HABEEB A F S A. Determination of free amino groups in proteins by trinitrobenzenesulfonic acid [J]. Analytical Biochemistry, 1966, 14 (3): 328-336.
[21] SREERAMA N, WOODY R W. A self-consistent method for the analysis of protein secondary structure from circular dichroism [J]. Analytical Biochemistry, 1993, 209 (1): 32-44.
[22] SREERAMA N, VENYAMINOV S Y, WOODY R W. Estimation of protein secondary structure from circular dichroism spectra: inclusion of denatured proteins with native proteins in the analysis. [J]. Analytical Biochemistry, 2000, 287 (2): 243-251.
[23] TANNER A, BORNEMANN S.YvrK is an acid-induced oxalate decarboxylase [J]. Journal of Bacteriology, 2000, 182 (18): 5271-5273.
[24] GREGG C, KINSTLER O. Chemical modification of proteins to improve biocompatibility and bioactivity: US6770746B2 [P]. 2004-8-3.
[25] 张静, 田亚平. 丁二酸酐修饰对枯草芽孢杆菌氨肽酶结构及酶学特性的影响 [J]. 食品与生物技术学报, 2013, 32 (6): 622-627. ZHANG J,TIAN Y P. Chemical modification of theaminopeptidase by succinic anhydride and its enzyme properties [J]. Journal of Food Science and Biotechnology, 2013, 32 (6): 622-627.
[26] SANGEETHA K, ABRAHAM T E. Chemical modification of papain for use in alkaline medium [J]. Journal of Molecular Catalysis B: Enzymatic, 2006, 38 (3/4/5/6): 171-177.
[27] 熊亚红, 高敬忠, 郑坚鹏. 提高漆酶稳定性的化学修饰方法的研究 [J]. 化学研究与应用, 2011, 23 (8): 985-990. XIONG Y H, GAO J Z, ZHEN J P. Study on the chemical modification of laccase with stability enhancement [J]. Chemical Research and Application, 2011, 23 (8): 985-990.
[28] KHAPARDE S S, SINGHAL R S. Chemically modified papain for applications in detergent formulations [J]. Bioresour. Technol., 2001, 78 (1): 1-4.
[29] GOUDA M D, SINGH S A, RAO A G A,. Thermal inactivation of glucose oxidase [J]. Journal of Biological Chemistry, 2003, 278 (27): 24324-24333.
Chemical modification of oxalate decarboxylase with ethylenediaminetetraacetic dianhydride
HE Junbin1, LIN Rihui2, LONG Han1, WU Jia1, CAI Xinghua1, YANG Ying1, CHEN Shengfeng1
(1Guangxi Colleges and Universities Key Laboratory of Utilization of Microbial and Botanical Resources, School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning 530007, Guangxi, China;2Key Laboratory of New Techniques for Chemical and Biological Conversion Process, School of Chemistry and Chemical Engineering, Guangxi University for Nationalities, Nanning 530007, Guangxi, China)
In order to improve the stability and application performance of oxalate decarboxylase (Oxdc) in the prevention and treatment of urinary calculi, chemical modification of Oxdc with ethylenediaminetetraacetic dianhydride (EDTAD) was investigated. The results of single-factor experiment showed that the extent of modification and the recovery rate of the enzymatic activity were 71.91% and 75.42%, respectively, when the reaction time was 8 h, the molar ratio of EDTAD/Oxdc was 50:1, pH 7.0, and the temperature was 37℃. The analysis results of sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) and ultra-performance liquid chromatography tandem mass spectrometry (UPLC-MS) indicated that Oxdc and EDTAD have been covalently bound. The ultraviolet-visible spectrum (UV) and circular dichroic (CD) measurement showed that the structure and conformation of Oxdc were tinily altered after modification by EDTAD. The enzymology changes of Oxdc were also analyzed, the results showed the optimum pH of EDTAD-modified Oxdc was shifted to the alkaline side about 1.5 unit and it had a higher thermostability. Moreover, through modification the adsorption capacity of Oxdc onto calcium oxalate monohydrate crystals was increased by 42.42%. These results suggested that the stability and application performance of Oxdc were significantly improved under this experiment.
urinary calculi; enzyme; oxalate decarboxylase; purification; ethylenediaminetetraacetic dianhydride; chemical modification; adsorption
2016-03-28.
Prof. LIN Rihui, rihuilin@aliyun.com
10.11949/j.issn.0438-1157.20160355
Q 814; TQ 033
A
0438—1157(2016)10—4389—10
国家教育部留学回国人员科研启动基金项目(教外司留[2012]1707号);广西自然科学基金项目(2014GXNSFAA118045);广西民族大学研究生教育创新计划项目(gxun-chxs2015089)。
2016-03-28收到初稿,2016-08-01收到修改稿。
联系人:林日辉。第一作者:贺俊斌(1992—),男,硕士研究生。
supported by the Scientific Research Foundation for the Returned Overseas Chinese Scholars, Ministry of Education ([2012]1707), the Natural Science Foundation of Guangxi (2014GXNSFAA118045) and the Innovation Project of Guangxi University for Nationalities (gxun-chxs2015089).
