PAN-H1.6Mn1.6O4锂离子筛膜的制备及在卤水中吸附性能
2016-10-13王俊贾庆源郭瑞丽张建树
王俊,贾庆源,郭瑞丽,张建树
PAN-H1.6Mn1.6O4锂离子筛膜的制备及在卤水中吸附性能
王俊,贾庆源,郭瑞丽,张建树
(石河子大学化学化工学院,新疆兵团化工绿色过程重点实验室,新疆石河子832003)
采用亲水的PAN为成膜材料,制备了掺杂H1.6Mn1.6O4的PAN-H1.6Mn1.6O4锂离子筛膜。通过SEM、Li+静态吸附实验、(NH4)2S2O8对锂的洗脱实验和卤水中吸附实验,研究了锂离子筛的添加量对PAN-H1.6Mn1.6O4锂离子筛膜结构、Li+吸附-洗脱性能的影响。结果表明,PAN浓度为10%(质量),H1.6Mn1.6O4的添加量为50%(质量)时,PAN-H1.6Mn1.6O4离子筛膜的吸附量为17.45 mg·g-1,达到粉末状吸附量的88.0%。以(NH4)2S2O8为洗脱剂,当浓度为0.3 mol·L-1、液固比为600:1、时间为12 h时,锂洗脱量为17.23 mg·g-1,锰溶损率仅为1.14%。在含有Na+、K+、Mg2+和Ca2+的罗布泊老卤卤水中,锂离子筛膜对Li+有很高的选择性。在卤水中进行10次吸附与解吸循环,吸附量从11.64 mg·g-1下降到10.94 mg·g-1,吸附容量仅损失6.0%。总体结果表明亲水性载体对H1.6Mn1.6O4吸附容量影响较小,温和的洗脱剂对锂离子筛膜的化学稳定性有利。
锂离子筛;吸附;聚丙烯腈;多孔膜;分离;回收
引 言
锂是自然界最轻的金属元素,同时也是极其重要的能源金属;其单质、合金以及化合物具有独特的优异性能,因此广泛应用于高能锂电池、润滑脂、陶瓷与玻璃、航空航天、核能、冶金、医药及空气处理等领域[1]。近年来,随着便携式电子设备和新能源汽车的普及,其核心组件——锂离子电池逐渐成为锂资源需求量快速增长的主要推动力[2]。锂资源主要储存于锂矿石、海水和盐湖卤水中;从盐湖卤水中提锂由于工艺简单、成本低、污染小等特点,已经成为世界锂生产的主要来源。我国具有丰富的卤水锂资源,但是大部分盐湖卤水镁锂比较高,锂和镁的性质非常相近,分离困难,给我国卤水锂资源的开发带来一定的难度。吸附法是目前已知的从海水和卤水中提取锂最具经济效益和环境友好型的方法之一[3]。利用高选择性的吸附剂对锂进行分离和富集,有望实现高镁锂比盐湖卤水中锂资源的利用。
锂离子筛吸附速率快、选择性高、吸附量高、成本低和化学稳定性好,是极具发展前景的绿色吸附剂[4]。在锂离子筛中,H1.6Mn1.6O4[5-6]是目前对Li+性能最好的锂离子筛且性能稳定。然而,H1.6Mn1.6O4为超细粉末状,不能采取传统的填料塔进行连续和大规模的工业化应用。许多研究人员已经尝试把离子筛粉末掺杂在不同材料上,制备球状[7-10]、泡沫状[11]、膜状[12-17]和纤维状[18]吸附剂。其中锂离子筛膜由于制备工艺简单、易于工业化生产、可适用各种设备等特点,成为锂离子筛成型的研究热点。锂离子筛膜分为共混膜[12-15]和膜储存器[16-17],使用的载体材料为PVC、PVDF等强疏水性材料,对锂离子筛的吸附量影响较大,多数锂离子筛膜的吸附量仅有粉末状的一半左右;Zhu等[15]以PVC为载体制备锂离子筛膜,其吸附量达到粉末的86.5%,是目前吸附量损失最小的锂离子筛膜。聚丙烯腈(PAN)具有优良的亲水性、耐污染性和耐候性,是一种优良的膜材料,广泛应用于水处理[19]。因此,把锂离子筛粉末掺杂在PAN膜中,利用PAN的亲水性,降低锂离子筛与吸附液接触的阻力,减少载体对锂离子筛吸附性能的影响。
本文通过水热法合成锂离子筛前体Li1.6Mn1.6O4,经酸处理得到锂离子筛H1.6Mn1.6O4。以PAN为膜材料,结合PAN超滤膜的制备工艺,把H1.6Mn1.6O4掺杂到铸膜液中制备PAN-H1.6Mn1.6O4锂离子筛膜,通过锂离子筛膜的吸附实验确定合适的H1.6Mn1.6O4添加量,并研究了锂离子筛膜结构和吸附性能。以(NH4)2S2O8为洗脱剂,考察其对锂离子筛膜的洗脱条件;最后应用在模拟罗布泊老卤卤水中提锂,为锂离子筛膜的工业化应用提供一定的基础。
1 实 验
1.1 试剂
聚丙烯腈(PAN,w90000,上海斯百全试剂);聚乙烯吡咯烷酮(PVP K30, 美国Fluka);,-二甲基甲酰胺(DMF,天津富宇精细化工有限公司);氢氧化锂(LiOH·H2O, AR, 阿拉丁试剂);氯化锰(MnCl2·4H2O)、高锰酸钾、盐酸购自成都科龙化学试剂厂;氯化锂(LiCl·H2O)、过硫酸铵购自天津盛奥化学试剂有限公司;以上试剂均为分析纯。
1.2 H1.6Mn1.6O4的制备
把0.3 mol·L-1的KMnO4溶液和2.0 mol·L-1的LiOH溶液在搅拌下缓慢加入到3.0 mol·L-1的MnCl2溶液中,其中原料摩尔比:MnCl2/KMnO44,Li/Mn4;将得到的褐色悬浮液转移到250 ml聚四氟乙烯水热反应釜中,填料比为70%,150℃反应10 h,得到中间产物LiMnO2。将产物过滤,去离子水洗涤,滤饼在60℃干燥6 h,研磨后在空气氛围中于350℃焙烧12 h后得到锂离子筛前体Li1.6Mn1.6O4。最后用0.5 mol·L-1的HCl洗脱Li1.6Mn1.6O4中的Li+,制备锂离子筛H1.6Mn1.6O4。
1.3 PAN-H1.6Mn1.6O4锂离子筛膜的制备
准确称取不同质量的H1.6Mn1.6O4,在DMF溶液中超声分散4 h,然后加入一定质量的PAN和致孔剂PVP,在60℃水浴中搅拌至充分溶解,配制10% PAN(8% PVP,均为质量分数)铸膜液,继续搅拌冷却至室温。用刮刀在光滑洁净的玻璃板上刮制一层0.25 mm厚度的液膜,连同玻璃板一块浸入去离子水;待膜固化剥离玻璃板,用去离子水浸泡12 h;随后把制备的膜浸泡在无水乙醇中5 h,再用正己烷浸泡5 h,在空气中自然晾干,即得到PAN-H1.6Mn1.6O4锂离子筛膜。定义PAN- H1.6Mn1.6O4为M,H1.6Mn1.6O4的添加量分别为0、10%、20%、30%、40%、50%、60%和70%的膜记为M-(0,10,20,30,40,50,60,70)。PAN和PVP的添加量用式(1)计算,H1.6Mn1.6O4的添加量用式(2)计算。
1.4 锂离子筛及锂离子筛膜的表征
锂离子筛粉末的X射线衍射分析采用D8 ADVANCE型X射线衍射仪(德国Bruker),其分析条件为Cu-Kα靶,扫描电压40 kV,电流40 mA,扫描范围10°~80°;锂离子筛和锂离子筛膜的形貌表征使用su-8010型场发射扫描电子显微镜(日本日立);锂、锰、钙和镁离子的检测使用AA-6300F原子吸收光谱仪(日本岛津),钠和钾离子检测使用PF640火焰光度计(上海精科)。
1.5 PAN-H1.6Mn1.6O4锂离子筛膜的吸附解吸性能研究
以下所有的吸附和洗脱实验均在30℃(303 K),100 r·min-1的摇床中进行。
Li+吸附实验:分别称取0.05 g的H1.6Mn1.6O4粉末和0.10 g的PAN-H1.6Mn1.6O4膜,浸入一定体积Li+浓度为50 mg·L-1的LiCl水溶液中(pH9.2,0.1 mol·L-1的NH4Cl和NH3·H2O水溶液按摩尔比2:1混合),分别在不同时间取上清液检测锂的浓度。吸附容量按式(3)计算
式中,Q为时刻每克H1.6Mn1.6O4的吸附量,mg·g-1;0为溶液中初始Li+的浓度,mg·L-1;C为时刻溶液中Li+的浓度,mg·L-1;1为吸附液体积,L;为H1.6Mn1.6O4的质量,g。
Li+洗脱实验:取吸附后的锂离子筛膜,在过硫酸铵溶液中洗脱,在不同时间取上清液检测锂和锰的浓度,锂的洗脱量和锰的溶损率分别按式(4)和式(5)计算。
选择性实验:吸附液为模拟的罗布泊老卤卤水,其中主要金属离子和物理性质见表1。由于罗布泊卤水成分复杂,在模拟卤水中主要金属离子大致相近,密度和黏度略低于真实的卤水,但是都比纯水大很多。
取0.10 g锂离子筛膜放入20 ml模拟卤水中,吸附24 h后,检测其中Li+、Na+、K+、Ca2+和Mg2+的浓度,平衡吸附量e、分配系数d、分离因子、浓度因子F分别通过式(6)~式(9)计算。

表1 真实和模拟罗布泊盐湖老卤卤水主要成分和物理性质
式中,0为卤水中各离子的浓度,mmol·L-1;e为吸附平衡后各离子的浓度,mmol·L-1;3为卤水的体积,L。
2 结果与讨论
2.1 锂离子筛和锂离子筛膜XRD和SEM表征
图1是所制备的锂离子筛前体(Li1.6Mn1.6O4)和锂离子筛(H1.6Mn1.6O4)的XRD谱图。从图中可知,Li1.6Mn1.6O4和H1.6Mn1.6O4都具有尖晶石的特征峰,酸洗前后没有改变锂离子筛晶体的结构。只是与Li1.6Mn1.6O4相比,H1.6Mn1.6O4的各个特征峰都向高角度发生轻微偏移,这是因为晶格中的Li+被 H+取代后,由于H+半径小于Li+半径,导致晶胞缩小。

图1 锂离子筛前体和锂离子筛的XRD谱图
图2是不同H1.6Mn1.6O4添加量锂离子筛膜的XRD谱图。PAN纯膜(M-0)在17°左右有一个结晶峰,没有H1.6Mn1.6O4的特征峰;随着H1.6Mn1.6O4添加量的增加,PAN结晶峰强度降低直至消失,而锂离子筛的特征峰出现在锂离子筛膜中。由此可知,H1.6Mn1.6O4掺杂到PAN膜中,且保持好的尖晶石晶型结构。PAN膜的结晶度降低是因为添加的H1.6Mn1.6O4打乱了PAN的链结构,PAN膜的结晶度降低使膜的脆性降低,对锂离子筛膜的应用有利。

图2 不同H1.6Mn1.6O4量的锂离子筛膜的XRD谱图
图3为锂离子筛H1.6Mn1.6O4和不同添加量的锂离子筛膜表面SEM图。从图中可以看出,H1.6Mn1.6O4粉末呈片状,颗粒直径<0.2 μm,与文献[6]相同。对比不同添加量的锂离子筛膜的SEM图,可以发现纳米级H1.6Mn1.6O4粉末被成功地掺杂在PAN膜中,且分布比较均匀。在锂离子筛添加量较低时,膜表面单位面积颗粒分布较少,且多被包埋在膜中。M-60和M-70 膜由于添加量过大,膜表面颗粒团聚。但是添加量的增加并没有使膜表面出现明显的缺陷;用纸张刮擦所有的膜表面,几乎没有颗粒从膜上刮掉,说明H1.6Mn1.6O4与PAN共混结合良好。

图3 H1.6Mn1.6O4添加量对膜表面形貌的影响
2.2 PAN-H1.6Mn1.6O4锂离子筛膜锂吸附时间的确定
图4是M-50膜的吸附容量与吸附时间的关系。从图中可以看出,在开始的0~1 h内,对Li+吸附速率很快;在1~12 h内吸附速率缓慢增加,12 h后对Li+的吸附容量基本没有变化,为此优选吸附时间为12 h。

图4 PAN-H1.6Mn1.6O4膜的吸附容量与吸附时间的关系
2.3 H1.6Mn1.6O4添加量对锂离子筛膜的影响
图5示出了不同H1.6Mn1.6O4添加量对铸膜液黏度的影响。可知当H1.6Mn1.6O4添加量较低时,铸膜液黏度随着添加量的增加而增大;当添加量为30%~50%时,铸膜液黏度降低;继续增大H1.6Mn1.6O4添加量,黏度增加。结合图2可知:添加量低时,由于PAN分子链之间有很强的作用力(结晶度高),此时随着锂离子筛的量增加,铸膜液中固含量增大,使得黏度增加。在添加量大于30%时,大量的粉末破坏了PAN高分子之间的作用力,使铸膜液黏度降低;锂离子筛添加量过大时,铸膜液固含量增加,黏度又随之增加。

图5 不同H1.6Mn1.6O4添加量对铸膜液黏度的影响
图6示出了不同H1.6Mn1.6O4添加量的膜对锂的吸附容量的影响。由图可知,H1.6Mn1.6O4添加量在10%~50%时,吸附容量随着添加量的增加而增加,在50%时达到最大,此时吸附容量为17.45 mg·g-1。结合图3和图5可知,锂离子筛含添加量较少时,PAN分子作用力强,颗粒被膜材料包埋,吸附液与锂离子筛接触的传质阻力大,吸附量低;同时随着添加量的增大,暴露在PAN表面的锂离子筛增多,所以吸附容量呈上升趋势。在添加量为50%时,铸膜液黏度适宜,颗粒能够更好地分散在膜中,吸附量最大。当添加量继续增大时,铸膜液黏度又会增加,使得颗粒分散度变差,从而在膜中出现严重团聚,降低锂离子筛的吸附量。

图6 不同H1.6Mn1.6O4添加量的膜对锂的吸附容量的影响
为了确定锂离子筛膜内部结构对吸附性能的影响,对PAN-H1.6Mn1.6O4膜断面进行观察。图7是M-50膜的断面图及断面放大的SEM图,可见当H1.6Mn1.6O4添加量为50%时,膜总体呈现指状孔结构,表面及支撑部分为海绵状孔结构,且膜内微孔都是互通的。检测确定H1.6Mn1.6O4粉末和PAN-H1.6Mn1.6O4膜锂吸附容量分别为19.85 mg·g-1和17.46 mg·g-1。可知成膜后,虽然锂离子筛被PAN包埋一部分,但是由于PAN的相对亲水性和膜的多孔性,锂离子筛膜仍具有较高的锂吸附量(为粉末状锂离子筛吸附量的88.0 %)。说明亲水性的PAN作为膜材料有利于锂的吸附。

图7 M-50膜的横断面结构
2.4 (NH4)2S2O8为洗脱剂洗脱条件的选择
对吸附后的膜进行洗脱锂实验,分别用0.1、0.2、0.3、0.4和0.5 mol·L-1的(NH4)2S2O8处理吸附后的M-50膜,12 h后检测洗脱液中锂和锰的浓度,计算锂的洗脱量和锰溶损率。
(NH4)2S2O8是一种氧化剂,同时也是弱酸,其水解产生H+,可以用于洗脱锂离子筛膜,水解反应过程如下
图8示出了(NH4)2S2O8浓度对锂离子筛膜洗脱效果的影响,锂的洗脱量和锰的溶损率随着(NH4)2S2O8浓度增加而增大。0.1 mol·L-1的(NH4)2S2O8洗脱量最低,锰溶损也最低,只有0.20%;当浓度增加到0.3 mol·L-1时,锂洗脱量达到17.23 mg·g-1,与吸附量几乎相同;再增加(NH4)2S2O8浓度,洗脱量增加不明显,锰溶损略有增加。这是因为:①离子交换需要一个临界浓度,只有供Li+交换的H+浓度越大、总量越多,离子交换反应才能持续进行;②(NH4)2S2O8浓度低,其水解后产生的H+浓度也低,洗脱的Li+就少,锰溶损低;浓度过大时,受水解平衡的限制,水解产生的H+浓度增加并不明显。综上,并考虑到洗脱过程中不断消耗H+,(NH4)2S2O8在0.3 mol·L-1最合适。
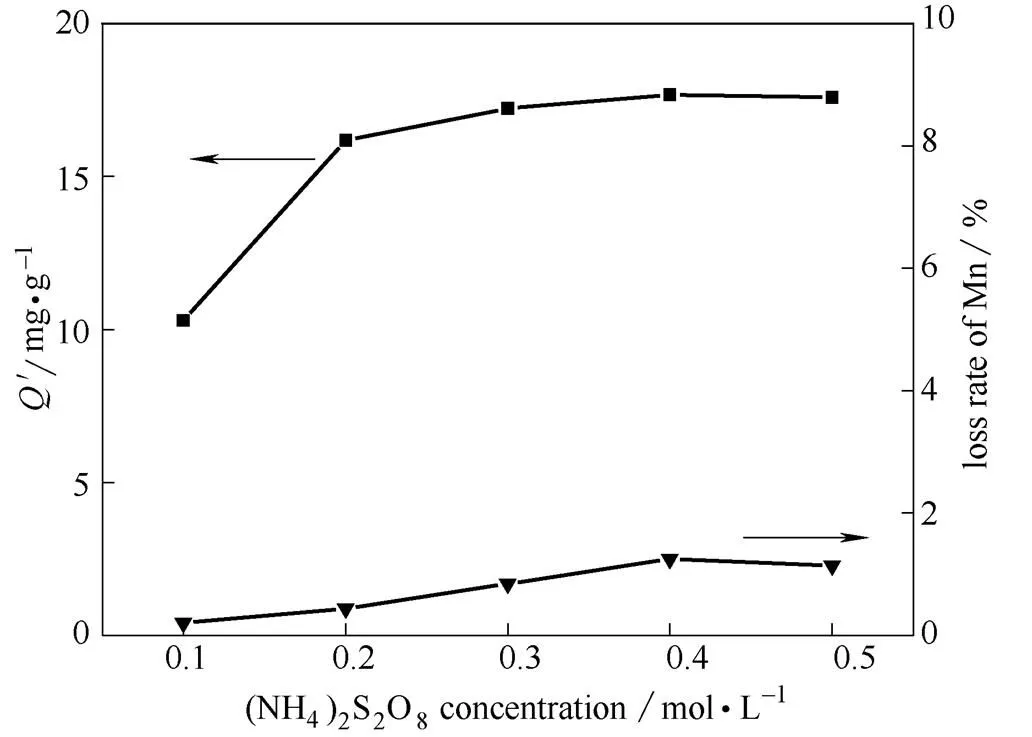
图8 (NH4)2S2O8浓度对洗脱效果的影响
图9示出了液固比对洗脱效果的影响,可见用0.3 mol·L-1的(NH4)2S2O8洗脱锂,液固比的影响并不大。这主要是因为此时水解的H+浓度相比临界浓度已经很大,洗脱过程中消耗掉的H+,也会不断水解补充。不过为了达到最佳洗脱效果,选取液固比为600:1。

图9 液固比对洗脱效果的影响
图10是锂离子筛膜的洗脱性能随时间的变化曲线。从图中可知,过硫酸铵溶液洗脱锂是一个先快后慢的过程;洗脱主要集中在前12 h,12 h后洗脱量增加缓慢,这里优选的洗脱时间为12 h。锰的溶损则出现一个最大值后逐渐降低,这可能是锂离子筛中锰溶出后留下对Mn4+有吸附作用的位点,而溶出的Mn2+在被过硫酸铵氧化成Mn4+,又重新吸附到锂离子筛的晶格中。

图10 洗脱时间对洗脱性能的影响
2.5 PAN-H1.6Mn1.6O4膜在卤水中的选择性和循环性能
取0.20 g锂离子筛膜加入30 ml模拟卤水中,吸附24 h,检测模拟卤水中各离子的变化。从表2可知,PAN- H1.6Mn1.6O4膜对锂的平衡分配系数远大于其他金属离子,其中Ca2+浓度很低,几乎没有吸附量,表明锂离子筛膜对锂具有很高的选择性。从平衡吸附量可以看出,M-50膜对Li+的吸附量为11.64 mg·g-1(1.678 mmol·g-1),吸附量比在纯锂溶液中下降了34.4 %,主要来自Mg2+的竞争作用。M-50膜对吸附量Mg2+达到16.62 mg·g-1(0.684 mmol·g-1),这是因为Mg2+浓度太大,是Li+浓度的100多倍,对锂的吸附有很大的竞争性。

表2 M-50膜在模拟罗布泊老卤卤水中的分离性能
取在模拟卤水中吸附后的M-50膜在适量0.3 mol·L-1的(NH4)2S2O8溶液中洗脱,随后进行多次吸附-解吸实验。如图11所示,经过10次循环实验后,其吸附量从11.64 mg·g-1下降到10.94 mg·g-1,吸附容量仅下降6.0%。另外吸附容量在前几次下降较快,后期趋于稳定,可见锂离子筛膜能够长期稳定使用。由于 (NH4)2S2O8溶液酸性较弱,比较温和,对锂离子筛的破坏较小,因此有利于吸附剂的长期使用。

图11 M-50膜在卤水中的循环性能
3 结 论
(1)自制锂离子筛H1.6Mn1.6O4,通过共混法制备PAN-H1.6Mn1.6O4膜状吸附剂。经过吸附实验确定H1.6Mn1.6O4的最佳添加量为50%,膜状吸附剂的吸附量达到17.45 mg·g-1,是粉末状吸附量的
88.0%。同时膜内部结构的多孔性和微孔互通性有利于吸附液与锂离子筛的接触。
(2)使用(NH4)2S2O8溶液为洗脱剂,最佳浓度是0.3 mol·L-1,液固比为600:1,时间为12 h,此时洗脱量为17.23 mg·g-1,锰溶损为1.14 %。
(3)采用M-50膜在模拟罗布泊老卤卤水中提取Li+,其对Na+、K+、Mg2+和Ca2+具有很好的分离性能。经过10次吸附-解吸循环,吸附量从11.64 mg·g-1降到10.94 mg·g-1,吸附容量仅下降6.0 %。
(4)亲水性高分子材料对H1.6Mn1.6O4的吸附容量影响小,温和的洗脱剂有利于锂离子筛膜的长期稳定性。
References
[1] KESLER S E, GRUBER P W, MEDIA P A,. Global lithium resources: relative importance of pegmatite, brine and other deposits [J]. Ore Geology Reviews, 2012, 48: 55-69.
[2] 李冰心. 2013年全球锂资源开发现状 [J]. 新材料产业, 2013, (7): 32-36. LI B X. Development situation of global lithium resources in 2013 [J]. Advanced Materials Industry, 2013, (7): 32-36.
[3] ABE M, CHITRAKAR R. Recovery of lithium from seawater and hydrothermal water by titanium (Ⅳ) antimonate cation exchanger [J]. Hydrometallurgy, 1987, 19: 117-128.
[4] 张梦华, 聂骁垚, 胡潘辉, 等. 吸附法从盐湖卤水中提锂研究进展 [J]. 广州化工, 2012,40 (15): 27-29. ZHANG M H, NIE X Y, HU P H,. The progress of extracting lithium from brines by absorption method [J]. Guangzhou Chemical Industry, 2012,40 (15): 27-29.
[5] CHITRAKAR R, KANOH H, MIYAI Y,. A new type of manganese oxide (MnO2·0.5H2O) derived from Li1.6Mn1.6O4and its lithium ion-sieve properties [J]. Chemistry of Materials, 2000, 12 (10): 3151-3157.
[6] XIAO J L, SUN S Y, WANG J,. Synthesis and adsorption properties of Li1.6Mn1.6O4spinel [J]. Industrial & Engineering Chemistry Research, 2013, 52 (34): 11967-11973.
[7] 李超, 肖伽励, 孙淑英, 等. 球形离子筛吸附剂的制备及其锂吸附性能评价 [J]. 化工学报, 2014, 65(1): 220-226. DOI: 10.3969/j.issn.0438-1157.2014.01.028. LI C, XIAO J L, SUN S Y,. Preparation and lithium adsorption evaluation for spherical ion-sieve granulated by agarose [J]. CIESC Journal, 2014, 65 (1): 220-226. DOI: 10.3969/j.issn.0438-1157.2014.01.028.
[8] HONG H J, PARK I S, RYU T,.Granulation of Li1.33Mn1.67O4(LMO) through the use of cross-linked chitosan for the effective recovery of Li+from seawater [J]. Chemical Engineering Journal, 2013, 234: 16-22.
[9] XIAO G P, TONG K F, ZHOU L S,. Adsorption and desorption behavior of lithium ion in spherical PVC-MnO2ion sieve [J]. Industrial & Engineering Chemistry Research, 2012, 51 (33): 10921-10929.
[10] MA L W, CHEN B Z, CHEN Y,. Preparation, characterization and adsorptive properties of foam-type lithium adsorbent [J]. Microporous Mesoporous Mater., 2011, 142 (1): 147-153.
[11] HAN Y, KIM H, PARK J. Millimeter-sized spherical ion-sieve foams with hierarchical pore structure for recovery of lithium from seawater [J]. Chemical Engineering Journal, 2012, 210: 482-489.
[12] UMENO A, MIYAI Y, TAKAGI N,. Preparation and adsorptive properties of membrane-type adsorbents for lithium recovery from seawater [J].Industrial & Engineering Chemistry Research, 2002, 41 (17): 4281-4287.
[13] 王盼, 朱桂茹, 綦鹏飞. PVDF为成膜材料制备锂离子筛膜的性能研究 [J]. 功能材料, 2012, 43 (22): 3139-3142. WANG P, ZHU G R, QI P F. Preparation and adsorption properties of lithium-ion sieve membrane [J]. Journal of Functional Materials, 2012, 43 (22): 3139-3142.
[14] 解利昕, 陈小棉. Li1.6Mn1.6O4/PVDF多孔膜的制备及提锂性能 [J]. 化工学报, 2014, 65 (1): 237-243. DOI: 10.3969/j.issn.0438- 1157.2014.01.030. XIE L X, CHEN X M. Preparation of Li1.6Mn1.6O4/PVDF membrane and its lithium uptaking [J]. CIESC Journal, 2014, 65 (1): 237-243. DOI: 10.3969/j.issn.0438- 1157.2014.01.030.
[15] ZHU G R, WANG P, QI P F,. Adsorption and desorption properties of Li+on PVC-H1.6Mn1.6O4lithium ion-sieve membrane [J]. Chemical Engineering Journal, 2014, 235: 340-348.
[16] CHUNG K S, LEE J C, KIM W K,. Inorganic adsorbent containing polymeric membrane reservoir for the recovery of lithium from seawater [J]. Journal of Membrane Science, 2008, 325 (2): 503-508.
[17] CHOI J Y, PARK J I, KIM D U,. Fabrication of pore size controllable polymeric composite membrane using phase change material [J]. Desalination, 2012, 299: 129-132.
[18] PARK M J, NISOLA G M, BELTRAN A B,. Recyclable composite nanofiber adsorbent for Li+recovery from seawater desalination retentate [J]. Chemical Engineering Journal, 2014, 254: 73-81.
[19] 方超平, 苏仪, 万印华. 聚丙烯腈超滤膜的制备 [J]. 化学工程, 2011, (7): 65-68. FANG C P, SU Y, WAN Y H. Preparation of polyacrylonitrile ultrafiltration membranes [J].Chemical Engineering (China), 2011, (7): 65-68.
[20] YUAN J S, YIN H B, JI Z Y,. Effective recycling performance of Li+extraction from spinel-type LiMn2O4with persulfate [J]. Industrial & Engineering Chemistry Research, 2014, 52 (23): 11967-11973.
Preparation of PAN-H1.6Mn1.6O4membrane and its adsorption properties in brine
WANG Jun, JIA Qingyuan, GUO Ruili, ZHANG Jianshu
(Key Laboratory for Green Process of Chemical Engineering of Xinjiang Bingtuan, School of Chemistry and Chemical Engineering, Shihezi University, Shihezi 832003, Xinjiang, China)
PAN-H1.6Mn1.6O4lithium ion-sieve membrane was prepared by blend of lithium ion sieve (H1.6Mn1.6O4) with hydrophilic polymer poly(acrylonitrile) (PAN). The effects of adding amount of lithium ion sieve for PAN-H1.6Mn1.6O4membrane structure and Li+adsorption-desorption properties were investigated by SEM, Li+static adsorption, (NH4)2S2O8elution and adsorption experiments in brine. The results showed that the adsorption capacity of PAN-H1.6Mn1.6O4membrane (17.45 mg·g-1) achieved to 88.0% of H1.6Mn1.6O4powder when the concentration of PAN was 10% (mass) and the amount of loading of H1.6Mn1.6O4was 50% (mass). In addition, when (NH4)2S2O8solution was used as eluent with the eluent concentration, liquid-solid ratio and time of 0.3 mol·L-1, 600:1 and 12 h, respectively, the amount of lithium ion elution was 17.23 mg·g-1and the manganese loss of ratio was only 1.14%. The PAN-H1.6Mn1.6O4membrane showed good selectivity for Li+in Lop Nor brine containing other cations such as Na+, K+, Mg2+and Ca2+. After ten times adsorption-desorption cycles in brine, the adsorption capacity of lithium ion was lost only 6.0% (from 11.64 mg·g-1to 10.94 mg·g-1). Overall results demonstrated that using hydrophilic PAN carrier material had little effect on the adsorption capacity of H1.6Mn1.6O4for lithium ion, and the mild eluent was favorable to chemical stability of lithium-ion sieve membrane.
lithium ion-sieve; adsorption; poly(acrylonitrile); porous membrane; separation; recovery
2015-12-15.
10.11949/j.issn.0438-1157.20151871
TQ 028.8;TQ 425.22
A
0438—1157(2016)10—4282—08
2015-12-15收到初稿,2016-05-15收到修改稿。
联系人:郭瑞丽。第一作者:王俊(1990—),男,硕士研究生。
Prof. GUO Ruili, grli@shzu.edu.cn
