立枯丝核菌对马铃薯的致病机理研究Ⅱ:病原菌毒素对幼苗活性氧代谢及细胞超微结构的影响
2016-09-26张君拓宁邱慧珍张文明张春红刘星朱静
张君,拓宁,邱慧珍,张文明,张春红,刘星,朱静
(甘肃农业大学资源与环境学院,甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070)
立枯丝核菌对马铃薯的致病机理研究Ⅱ:病原菌毒素对幼苗活性氧代谢及细胞超微结构的影响
张君,拓宁,邱慧珍,张文明,张春红,刘星,朱静
(甘肃农业大学资源与环境学院,甘肃省干旱生境作物学重点实验室,甘肃 兰州730070)
【目的】 探讨马铃薯茎溃疡病的病原菌立枯丝核菌的致病机理.【方法】 采用毒素处理组培苗及透射电镜观察相结合的方法,研究了不同浓度的病原菌菌毒素(T2:低浓度,T3:中浓度,T4:高浓度)对马铃薯幼苗体内活性氧代谢及细胞超微结构的影响.【结果】 病原菌毒素处理24 h后,中、高浓度处理(T3和T4)的马铃薯幼苗体内超氧阴离子(O2-)的产生速率和丙二醛(MDA)的含量显著高于对照CK(T1),至120 h时达到峰值,T3和T4处理的O2-产生速率分别是T1的3.3倍和4.1倍,MDA分别是T1的3倍和5.4倍;毒素处理后马铃薯幼苗体内H2O2含量的变化与O2-和MDA含量相似,处理96 h时即可达到峰值;电镜下马铃薯茎基部组织细胞的超微结构显示,毒素处理24~48h后,马铃薯茎基部组织细胞的质体开始变形肿胀,内质网变形;毒素处理72 h后,细胞膜消失,细胞线粒体变形,基质外流,细胞壁不再光滑,质膜断裂;毒素处理96~120 h后,细胞质溶解,逐渐衰老.【结论】 中、高浓度的病原菌毒素处理引起了马铃薯幼苗体内活性氧的积累与膜脂过氧化反应,由此造成的细胞质膜断裂,细胞器受损和细胞质溶解等一系列细胞超微结构的变化是溃疡病最终导致植株死亡的可能机理.
马铃薯;病原菌毒素;活性氧;膜伤害;细胞超微结构
of Aridland Crop Science,Lanzhou 730070,China)
马铃薯茎溃疡病又称立枯丝核菌病、黑痣病、茎基腐病、黑色粗皮病,是由立枯丝核菌(RhizoctoniasolaniKühn )侵染引起的一种土传病害[1],已成为世界各国马铃薯主产区影响马铃薯块茎产量及商品价值的重要病害[2-3],也是影响我国马铃薯产业健康发展的主要限制因子.马铃薯主产区内蒙[4-6]、黑龙江和辽宁等省[7]对马铃薯茎溃疡病均有报道,发病严重地块的植株死亡率高达70%~80%,块茎发病率达到100%[4,6].甘肃省2010~2011年中部主产区和干旱灌区因茎溃疡病引起的植株幼苗死亡率高达60%[8].这一病害对马铃薯的出苗、产量和商品性以及窖藏品质造成了很大影响,已成为限制我省马铃薯产业持续发展的主要土传病害[9].然而,有关这一病害发病规律和病原菌致病机理方面的研究鲜见报道.
立枯丝核菌在致病和培养过程中可产生毒素,是其菌致病的关键因子[10-13].立枯丝核菌粗毒素可显著抑制水稻胚根和胚芽生长[14],破坏水稻幼苗细胞膜的完整性和细胞的超微结构[12],菌株致病力越强,产生的毒素越多[15].然而,目前国内的相关研究主要集中在水稻上[14,16],尚未见马铃薯立枯丝核菌产毒和致病机理的研究.
前期研究发现,用毒素处理马铃薯植株,对根系的形态和生理、植株抗逆生理以及根系细胞膜的膜质过氧化造成了显著影响,而且在植株和块茎上产生的症状与病原菌回接的一致,说明马铃薯立枯丝核菌毒素的作用可能是其致病的主要原因之一.
植物病原真菌毒素的作用机理相当复杂[17],病原菌侵染会诱发寄主防卫反应的启动,其中氧爆(oxidative burst,OB)为第一即时反应.有研究指出[18],立枯丝核菌侵染后,寄主植物体内能否快速启动并有效运转对ROS的清除系统决定着寄主的病情程度,立枯丝核菌侵染马铃薯后是否会引起体内活性氧的产生及清除系统的启动尚未见报道,阐明这一过程对探明立枯丝核菌对马铃薯的致病机理具有重要意义.本研究采用课题组分离提取的粗毒素处理马铃薯幼苗,研究不同浓度的毒素对马铃薯幼苗体内活性氧代谢及细胞超微结构的影响,以探明马铃薯茎溃疡病可能的致病机理,对这一病害的有效防控具有重要意义.
1 材料与方法
1.1试验材料
供试病原菌:马铃薯立枯丝核菌(R.solani)JT-18,由本课题组分离、鉴定,经致病性测定对马铃薯具有强致病性[19].
供试组培苗:马铃薯‘大西洋’,由甘肃农业大学马铃薯遗传育种研究室茎尖脱毒,RT-PCR 检测并保存.
供试培养基:MS 培养基;马铃薯蔗糖琼脂培养基( potato dextrose agar,PSA)[20];改良的Richard培养基:KNO310 g、KH2PO45 g、MgSO4·7H2O 5 g、Fe2(SO4)30.02 g、蔗糖50 g、蒸馏水1 000 mL,pH 7.0;水琼脂:琼脂粉4 g、蒸馏水1 000 mL.
1.2试验方法
1.2.1粗毒素的制备粗毒素的制备采用敖世恩等[21]的方法并稍作改动.将立枯丝核菌在PSA 培养基上培养4d,用打孔器取直径0.5 cm 的菌饼,接种到盛有50 mL 改良的Richard 培养基的三角瓶中,每个三角瓶接种5个菌饼.于25 ℃恒温培养箱内黑暗培养,每日人工手动振荡1次.培养20 d后,将培养液8 000 r/min 离心15 min,用定性滤纸过滤.滤液按0.4%的比例加入琼脂粉,分装于12 cm×3 cm 的50 mL离心管中,每管15 mL,115 ℃灭菌20 min,即为粗毒素,简称毒素.
1.2.2试验设计试验设4个处理,每个处理3次重复.T1:对照(CK),水琼脂;T2:低浓度毒素,稀释至毒素原液浓度的1/3;T3:中浓度毒素,稀释至毒素原液浓度的2/3 ;T4:高浓度毒素,毒素原液.
将‘大西洋’马铃薯脱毒组培苗在MS培养基中培养25 d,无菌条件下将长势一致的幼苗取出移入不同处理的试管中,每管5株,于4 000 lx、25 ℃、L∶D = 16∶8 条件下培养.每隔24 h 取样进行超氧阴离子(O2-)、H2O2、MDA的测定,以及光学电镜样品的制备与观察.
1.2.3活性氧和膜质过氧化的测定超氧阴离子(O2-)产生速率的测定:参照王爱国,罗广华等[22]的方法进行测定.H2O2含量的测定:参照Patterson等[23]的方法进行.膜脂过氧化程度测定:参照植物生理学实验指导[24]方法.
1.2.4透射电镜样品制备与观察在高浓度毒素处理(T4)中取样,分别于处理后的24、36、48、72、96、120 h在植株茎基部取样:茎基部用无菌水洗涤3遍后切成1 mm3大小的组织块,用3%的戊二醛于4 ℃下固定,系列丙酮脱水,Epoin812树胶包埋,
切片染色后用JEM-1230型透射电镜观察[25-26].
1.3数据处理
采用SPSS 18.0 统计分析软件,按照单因素随机设计的方差分析模型,用Duncan氏新复极差法对同一时间不同处理的数据进行差异显著性分析.
2 结果与分析
2.1病原菌毒素对马铃薯幼苗体内超氧阴离子产生速率的影响
病原菌毒素处理对马铃薯幼苗体内超氧阴离子O2-的产生速率造成了显著影响.
从表1结果看出,病原菌毒素处理24 h后,中浓度(T3)和高浓度处理(T4)的马铃薯幼苗体内超氧阴离子O2-的产生速率显著高于对照(T1),至处理后120 h时,幼苗体内超氧阴离子O2-的产生速率达到峰值,T3和T4处理的O2-产生速率达为22.0和27.3 μ mol/g/min,分别是对照T1的3.3倍和4.1倍.低浓度的病原菌毒素处理对马铃薯幼苗未造成影响.由于毒素胁迫先后激发氧爆和马铃薯幼苗的防卫反应,随着毒素效应加剧,最终打破活性氧产生与清除之间的动态平衡,所以T3和T4处理马铃薯体内超氧阴离子O2-产生速率的变化呈先上升后下降再上升的规律.
表1毒素处理后马铃薯幼苗体内超氧阴离子产生速率的变化
Tab.1Production rate of O2-after treating with toxin ofRhizoctoniasolani(μ mol·g-1·min-1)

处理处理时间/h24487296120T11.7±0.7b2.7±1.1b2.0±1.0a5.1±0.8b6.7±1.0bT21.6±0.4b2.7±0.6b2.0±0.4a9.6±1.9b10.2±2.9bT34.4±0.6ab1.8±0.4b2.0±0.8a21.0±6.0a22.0±4.8aT45.7±0.8a7.5±1.7a3.9±1.1a26.0±1.7a27.3±3.2a

2.2病原菌毒素对幼苗体内H2O2含量的影响
毒素处理后马铃薯幼苗体内H2O2含量的变化与O2-的产生速率相似,但是峰值的到达时间提前至处理96 h(表2).
从表2结果可以看出,病原菌毒素处理对马铃薯幼苗体内H2O2的含量造成了显著影响, 病原菌毒素处理24 h后,T3和T4处理的马铃薯幼苗体内H2O2的含量显著高于对照T1,至处理后96 h时幼苗体内H2O2的含量达到峰值,为2.5、2.6 μmol/g,分别是对照CK的2.5倍和2.6倍.由于H2O2是O2-转化后的产物,它们的含量有一定的相关性,同样呈现先上升后下降再上升的变化趋势.
2.3病原菌毒素对幼苗体内丙二醛含量的影响
研究结果表明,毒素处理对马铃薯幼苗体内丙二醛(MDA)的含量造成了显著影响,趋势与O2-的产生速率完全相同(表3).
表3结果显示, 病原菌毒素处理24 h后,T3和T4处理的马铃薯幼苗体内MDA的含量显著高于对照T1,至处理后120 h时幼苗体内MDA的含量达到峰值,T3和T4处理下MDA为26.7、48.3 μmol/g,分别是对照CK的3倍和5.4倍,MDA是O2-和H2O2在细胞质膜积累引起膜质过氧化的产物,因此T3和T4处理中马铃薯幼苗体内MDA含量的变化同样呈先上升后下降再上升的规律.

表2 毒素处理后马铃薯幼苗体内H2O2含量的变化Tab.2 H2O2 accumulation level after treating with toxin of Rhizoctonia solani (μmol·g-1)
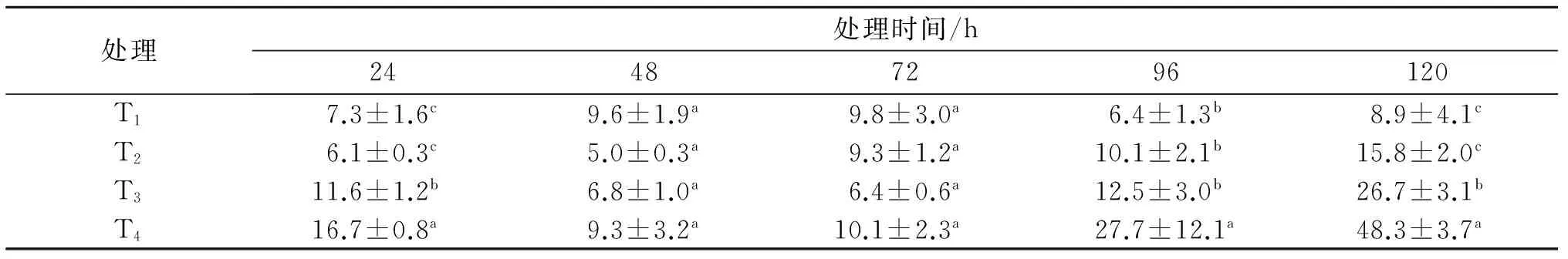
表3 毒素处理后马铃薯幼苗体内丙二醛含量的变化Tab.3 Changes of MDA after treating with toxin of Rhizoctonia solani (μmol·g-1)
2.4病原菌毒素对马铃薯茎基部细胞超微结构的破坏作用
透射电镜的结果显示,与正常细胞的结构完整(图1-A)相比,用毒素处理24 h后,由于活性氧的迅速积累,马铃薯细胞的质体开始变形肿胀(图1-B);毒素处理48 h后虽然活性氧的含量有所下降,但对细胞结构的损伤是不可逆的,内质网出现变形,肿胀(图1-C);毒素处理72 h后,细胞内含物消解(图1-D),膜质过氧化加剧导致细胞膜消失,细胞线粒体变形,基质外流粒(图1-E),细胞壁不再光滑,质膜断裂(图1-F).毒素处理96~120 h后,细胞质溶解.

A:对照马铃薯茎基部细胞结构完整(×10 000);B:毒素处理24 h后质体肿胀(×5 000);C:毒素处理48 h后内质网肿胀(×10 000);D:毒素处理72 h后细胞内含物消失(×10 000);E:毒素处理后线粒体变形(×20 000);F:毒素处理后细胞质膜断裂(×5 000). 图1 毒素对马铃薯茎基部组织和细胞的损伤作用Fig.1 Destructive effects of Rhizoctonia solani on tissue and cell
3 讨论与结论
3.1病原菌毒素导致幼苗活性氧代谢发生变化
活性氧在健康植株体内不存在或很少,当植物被病原菌侵染或被其它因素诱导时,能迅速产生和激发防卫反应的启动,其中氧爆(oxidative burst,OB)为第一即时反应,超氧阴离子、H2O2是主要活性氧类型,氧爆过程产生高浓度活性氧(reactive oxygen species,ROS)既可作为信号物质调控和激活寄主的防卫反应[18],又可对病原物起直接毒杀作用,引起膜质过氧化,形成MDA.立枯丝核菌侵染后,寄主植物体内能否快速启动对ROS的清除系统决定着寄主的病情程度,且作物对不同浓度毒素胁迫的响应不同.纪兆林等[27]研究表明小麦纹枯病菌毒素能干扰寄主生长代谢,是重要的致病因子,同时在低浓度时又有诱导寄主进行抗病性代谢的作用.本研究结果也表明,茎溃疡病菌毒素可诱导马铃薯幼苗体内活性氧的产生积累,最终导致膜脂过氧化是其致病性的内在机制,但是,活性氧对各浓度毒素的响应各异.中高浓度毒素活性氧的升高幅度明显大于低浓度毒素,低浓度毒素对活性氧的产生和膜脂过氧化程度与对照相比始终差异不显著,基本保持相同水平,这是由于低浓度毒素不足以对马铃薯幼苗造成胁迫;中高浓度毒素处理24 h后活性氧含量迅速升高,同时又是是马铃薯受毒素胁迫后,防卫反应最活跃、生理代谢最旺盛的阶段,氧爆反应激发马铃薯幼苗的防卫反应导致活性氧在72 h时有所下降,随着毒素效应的加剧,寄主植物体内活性氧产生与清除之间的动态平衡被打破,超氧阴离子和H2O2大量积累,导致膜脂过氧化,形成MDA,各指标分别在96~120 h左右达到峰值,出现受害症状.这与张献龙、朱龙付在棉花黄萎病SSN基因表达被抑制后转基因棉花茎杆和叶片中活性氧水平明显上升,病程相关蛋白大量积累并产生类病斑的最新研究结果基本一致[28].
3.2病原菌毒素导致细胞超微结构发生变化
大多数死体营养型病原真菌产生的毒素均为非寄主专化性的,大量研究结果表明,大多数病菌毒素都能不同程度地对植物细胞超微结构造成伤害,且来源不同的毒素,其作用位点可能不同.Xu等[ 29]用烟草野火病菌毒素处理烟草叶片,导致叶绿体内膜系统破坏,基粒片层解体,叶绿体形成泡囊,但淀粉粒增多并膨大,李秀琴等[30]研究发现,玉米全蚀病菌毒素能使玉米根组织线粒体变形,外膜扭曲脊粒模糊发生空泡化,叶绿体膜瓦解,基粒片层减少扭曲并膨胀,中间出现空泡.杨树溃疡病菌毒素处理杨树树皮愈伤组织的结果表明,细胞变形消解,中胶层分解,质膜内陷,质壁分离,线粒体局部破裂,分解成颗粒甚至空泡化,细胞核在处理的后期核膜破裂,核仁部分分解[31]黄萎病菌毒素处理亲和与不亲和棉花品种的愈伤组织,电子显微镜下观察到亲和种寄主细胞膜在VD毒素处理6h后即开始出现细胞膜的内陷现象,随时间增加细胞核的染色质向核边缘聚集,末期细胞质凝集,细胞膜部分结构消失,而不亲和品种的细胞并未发生明显的结构变化,而且出现的时间晚[21].陈夕军等[32]研究表明立枯丝核菌粗毒素能显著破坏水稻细胞结构,处理24 h,后引起水稻组织电解质渗透和磷素外渗,叶绿体膜被破坏,薄片化空泡化,处理72 h后,叶绿体降解,其他细胞器变得不清晰或消失,例如线粒体,一部分细胞壁变薄消失.本研究结果表明,对照细胞结构清晰可见,细胞质膜完整光滑,核质丰富,线粒体结构完整,形态规则正常;毒素处理24 h后,马铃薯幼苗茎基部组织细胞的质体开始变形肿胀,毒素处理36 h后,内质网变形,毒素处理48~72 h后,细胞线粒体变形,基质外流粒,细胞壁不再光滑,质膜断裂,毒素处理96~120 h后,细胞质溶解,细胞核染色质增多,逐渐衰老.这可能都与活性氧积累最终导致膜质过氧化细胞衰老死亡有关,但具体毒素如何作用于细胞膜的受体、信号识别及传导机制等,以及如何触发对马铃薯的一系列致病反应还有待进一步研究.
[1]霍茂林.要注意防治马铃薯丝核菌病[J].现代农业,1988(4):26
[2]Todd C A.Rhizoctoniadisease on potatoes:the effect of anastomosis groups,fungicides and zinc on disease[D].Adelaide:University of Adelaide,2009
[3]Tsror L.Biology,epidemiology and management ofRhizoctoniasolanion potato[J].Journal of Phytopathology,2010,158:649-658
[4]张笑宇,于肖夏,高翔,等.铃薯黑痣病菌毒素诱导马铃薯幼苗丙二醛含量、细胞膜透性及PAL 活性的变化[J].内蒙古农业大学学报,2012,33(2):16-20
[5]刘宝玉,胡俊,蒙美莲,等.马铃薯黑痣病病原菌分子鉴定及其生物学特性[J].植物保护学报2011,38(4):379-382
[6]曹春梅,李文刚,张建平,等.马铃薯黑痣病的研究现状[J].中国马铃薯,2009,23(3):171-173
[7]陈万利.马铃薯黑痣病的研究进展[J].中国马铃薯,2012,26(1):49-51
[8]孟品品,刘 星,邱慧珍,等.连作马铃薯根际土壤真菌种群结构及其生物效应[J].应用生态学报,2012,23(11):3079-3086.
[9]余斌,沈宝云,王文,等.连作障碍对干旱地区不同马铃薯品种的影响[J].甘肃农业大学学报,2012,47(4):43-47
[10]Frank J A,Francis S K.The effect of aRhizoctoniasolaniphytotoxin on potatoes[J].Canadian Journal of Botany,1976,54:2536-2540
[11]Huang W W,Xiang Z,Gong L,et al.Preliminary study on the extraction of crude toxin ofRhizoctoniasolaniand its activity[J].Agricultural Science and Technology,2009,10:132-136
[12]陈夕军,潘存红,孟令军,等.水稻纹枯病菌毒素提纯及其组分初步分析[J].扬州大学学报:农业与生命科学版,2011,32(1):44-48
[13]徐敬友,张华东,张红,等.立枯丝核菌毒素的产生及与致病力的关系[J].扬州大学学报:农业与生命科学版,2004,25(2):61-64
[14]康霄文,龙晓波,陈捷,等.水稻纹枯病菌粗毒素的初步研究[J].沈阳农业大学学报,1992,23(1):19-22
[15]Vidhyasekaran P,Ponmalar T R,Samiyappan R,et al.Host-specific toxin production byRhizoctoniasolani,the rice sheath blight pathogen[J].Phytopathology,1997,87:1258-1263
[16]Betancourt O,Ciampi L.Contribution to the study and control ofRhizoctoniasolaniⅠ:extraction and bioassay of phenylacetic acid phytotoxicity produced in vitro byR.solaniAG-3[J].Fitopatologia,2000,35:119-125
[17]张华东.立枯丝核菌毒素的产生及与致病力的关系[D].扬州:扬州大学,2003
[18]Hemissi I,Mabrouk Y,Mejri S,et al.Enhanced defence responses of chickpea plants againstRhizoctoniasolaniby Pre-inoculation withRhizobia[J].Journal of Phytopathology,2013.DOI:10.1111/jph.12071
[19]路小琴,李亚娟,邱慧珍,等.甘肃省中部沿黄灌区马铃薯茎溃疡病病原菌生物学特性研究[J].甘肃农业大学学报,2015,50(1):84-88
[20]方中达.植病研究方法[M].3版.北京:中国农业出版社,1998
[21]敖世恩,杨媚,周而勋,等.水稻抗纹枯病突变体的离体筛选[J].华南农业大学学报,2006,27(1):47-50
[22]王爱国,罗广华.植物的超氧物自由基与羟胺反应的定量关系[J].植物生理学通讯,1990(6):55-57
[23]Patterson B D,Mackae E A,Fergusen I B.Estimation of hydrogen peroxide in plant extracts using Titanium(Ⅳ)[J].Anal Biochem,1984,139:487-492
[24]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000
[25]甘习华,韩素芬.刺槐根瘤菌侵入线研究中的电镜制样方法[J].南京林业大学学报,1997,21(4):90-92
[26]陈健辉,李荣华,郭培国.干旱胁迫对不同耐旱性大麦品种叶片超微结构的影响[J].植物学报,2011,46(1):28-36
[27]纪兆林,陈景鹏,徐敬友,等.小麦纹枯病菌毒素对小麦植株的作用[J].扬州大学学报,2011,32(3):55-59
[28]Lian X,Zhang X L,Zhu L F.Functional characterization of cotton genes responsive toVerticilliumdahliathrough bioinformatics and reverse genetics strategies[J].Jouranl of Experimental Botany,2014,65(22)6679-6692
[29]Xu L,Zhang S G.Research prospect of the tabtoxin's pathogenicity(in Chinese)[J].Journal of Yunnan Agricultural University,2005,20(5):651-654
[30]宋蒙娜,李秀琴,姚建民,等.玉米全蚀病病菌侵染过程及其毒素的初步研究[J].玉米科学,1995(S1):64-67
[31]赵仕光,朱玮,岳红艳,等.杨树溃疡病菌毒素对杨树树皮愈伤组织超微结构的影响[J].林业科学研究,1998,11(3):253-259
[32]陈夕军,徐艳.童蕴慧,等.水稻纹枯病菌毒素致病机理研究[J].植物病理学报,2009,39(4):439-443
(责任编辑李辛)
Pathogenesis mechanism ofRhizoctoniasolanion potato Ⅱ:Effects ofRhizoctoniasolanitoxin on active oxygen metabolism and cell ultrastructure of potato plantlets
ZHANG Jun,TUO Ning,QIU Hui-zhen,ZHANG Wen-ming,ZHANG Chun-hong,LIU Xing,ZHU Jing
(College of Resources and Environmental Sciences,Gansu Agricultural University,Gansu Provincial Key Lab
【Objective】 To explore the pathogenesis mechanism of stem canker of potato virus-free plantlets treated withR.solanitoxin.【Method】 Treating the potato tissue culture seedlings withR.solanitoxin at different concentrations (T2:low concentration,T3:medium concentration,T4: high concentration),observing the cell ultrasturcture by transmission electron microscopy (TEM) to research the effects ofR.solanitoxin on active oxygen metabolism and cell ultrastructure.【Result】 O2-generation rate and MDA content in potato seedlings were significantly higher than those of CK after being treated for 24 h withR.solanitoxin at high concentration treatment (T3and T4),reached the maximum at 120 h.O2-generation rate of T3and T4was 3.3 and 4.1 times as that of CK,respectively and MDA content reached 3 and 5.4 times as that of CK,respectively.The changing trend of H2O2content was similar to that of O2-generation rate and MDA content,reaching the maximum at 96 h.When being treated for 24~48 h,the plastid of histocyte at potato stem base began to swell and endoplasmic reticulum deformed.After being treated for 72 h,cell membrane disappeared,plastochondria deformed,cell wall was no longer smooth,matrix outflowed,plasma membrane fractured.After 96~120 h,cytoplasm dissolved,more chromatin can be seen in the nucleus and appeared cell aging.【Conclusion】 Medium and high concentration toxin caused accumulation of active oxygen species as well as lipid peroxidation,resulting in cell plasma membrane fracture,organelle damage,cytoplasmolysis,which was the possible pathogentic mechanism of canker causing plantlet death.
potato;pathogen toxin;active oxygen;membrane damage;cell ultrastructure
张君(1989-),男,硕士研究生,研究方向为植物营养.E-mail:18893704728@163.com
邱慧珍,女,教授,博士生导师,主要从事植物营养及营养生态的教学与科研工作, E-mail:hzqiu@gsau.edu.cn
2015-04-17;
2015-05-06
S 532
A
1003-4315(2016)04-0020-06
