西瓜果实发育过程中番茄红素积累变化及相关酶基因表达
2016-09-21王学征张雅楠陈克农朱子成栾非时东北农业大学园艺学院哈尔滨150030农业部东北地区园艺作物生物学与种质创制重点实验室哈尔滨150030
王学征,张雅楠,肖 琪,陈克农,朱子成,赵 亮,栾非时(1.东北农业大学园艺学院,哈尔滨 150030;2.农业部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨 150030)
西瓜果实发育过程中番茄红素积累变化及相关酶基因表达
王学征1,2,张雅楠1,2,肖琪1,2,陈克农1,2,朱子成1,2,赵亮1,2,栾非时1,2
(1.东北农业大学园艺学院,哈尔滨150030;2.农业部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨150030)
为研究西瓜果实发育过程番茄红素含量变化与相关酶基因表达关系,以LSW-177(红瓤)和COS(浅黄瓤)为材料,通过高效液相色谱法(HPLC)测定从坐果到过熟7个不同时间点果肉组织番茄红素变化,利用荧光定量PCR测定相应时期相关酶基因表达量变化。结果表明,LSW-177(红瓤)授粉后16 d,番茄红素开始逐渐积累,果实转色期(授粉后24 d)番茄红素迅速积累,成熟期(授粉后40 d)达到峰值,随后下降。而COS(浅黄瓤)整个发育过程均未检测到番茄红素积累。四种相关酶基因表达量两品种间存在差异。番茄红素积累与Psy1基因表达呈显著正相关,与Lcyb基因表达呈显著负相关。结合Psy1和Lcyb基因两品种间表达差异,特别是果肉转色期差异分析,推测Psy1和Lcyb基因是西瓜形成番茄红素关键基因。通过基因序列分析,浅黄瓤西瓜中Psy1基因内含子有缺失;两品种Lycb基因间有3个SNP位点,存在两个蛋白差异。
西瓜;番茄红素;酶基因;HPLC;荧光定量PCR
王学征,张雅楠,肖琪,等.西瓜果实发育过程中番茄红素积累变化及相关酶基因表达[J].东北农业大学学报,2016,47(4):40-48.
Wang Xuezheng,Zhang Yanan,Xiao Qi,et al.Lycopene accumulation and related enzyme gene expression of watermelon varieties during the process of development[J].Journal of Northeast Agricultural University,2016,47(4):40-48.(in Chinese with English abstract)
网络出版时间2016-4-22 10:00:50[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160422.1000.006.html
番茄红素(Lycopene)是开链式不饱和类胡萝卜素,西瓜中含量很高,使西瓜瓤呈鲜艳红色[1-2]。西瓜果实中番茄红素发现较晚,1930年从欧洲西瓜瓤中分离得到,是瓜瓤呈红色的主要物质[1]。番茄红素是抗氧化剂,在预防人类前列腺癌、乳腺癌、皮肤癌等慢性病发生方面具有重要作用[3]。提高西瓜番茄红素含量、调控西瓜果实番茄红素含量差异是选育功能性西瓜品种关键。
西瓜果肉颜色主要有白色、浅黄色、亮黄色、橙色、粉色、桃红色、红色及深红色等[4-7]。研究表明,西瓜不同品种间番茄红素含量差异显著,不同瓤色西瓜番茄红素含量不同[8-11]。番茄红素是类胡萝卜素生物合成中间产物,通过类异戊二烯代谢途径合成[12]。番茄红素整个合成过程涉及酶主要有牻牛儿牻牛儿基焦磷酸合成酶(Ggps)、八氢番茄红素合成酶(Psy)、八氢番茄红素脱氢酶(Pds)、番茄红素环化酶(Lcyb)等[13]。万学闪等研究表明,红瓤西瓜果实番茄红素在果实发育过程中的积累呈“S”型曲线变化;幼果番茄红素含量较低,着色期急剧增加,完熟期达到峰值,过熟期降低,番茄红素含量与基因型有关,在西瓜整个发育过程中受多个酶调控[14]。袁平丽研究显示,不同倍性西瓜果实中番茄红素含量均随果实发育不断增加,发育前期,番茄红素随Psy1和Lcyb基因表达而积累,发育后期,两基因表达量下降,番茄红素大量积累[15]。Kang等分析五种瓤色(红、粉、黄、橙、白)西瓜番茄红素积累和相关酶基因表达活性,结果表明,Lcyb和Chyb基因表达与红瓤和粉瓤西瓜发育后期番茄红素积累有关,黄瓤西瓜随果实成熟,基因表达量增加却没有番茄红素积累,而在白瓤西瓜中,所有基因均随果实成熟表达下降,西瓜材料番茄红素调控途径复杂[16]。
本研究以西瓜品系LSW-177(红瓤)和Cream of Saskatchewan(浅黄瓤)为试验材料,通过高效液相色谱法测定从坐果到过熟期7个不同时间点西瓜果肉番茄红素含量,利用荧光定量PCR测定相应时期相关酶基因表达量变化,明确西瓜番茄红素积累关键代谢酶基因,并比较两种西瓜关键酶基因序列,明确浅黄瓤西瓜番茄红素调控途径,为改良西瓜瓤色奠定基础。
1材料与方法
1.1材料
供试两种西瓜材料均来自美国农业部农业研究署南部西瓜育种中心。LSW-177,成熟期40 d左右,高代自交系,果肉红色;Cream of Saskatch⁃ewan(简称“COS”),成熟期45 d左右,商用品种,已高代提纯,果肉浅黄色。
1.2方法
将西瓜材料定植于大棚内,膜下软管滴灌,株行距80 cm×70 cm。完全随机区组排列,每个材料3次重复,每次重复30株,东蜜002作保护行。采用双蔓整枝,即保留主蔓和一个生长健壮侧蔓,其余侧蔓全部打掉,12~16节位留瓜,人工自花授粉,每株留1个瓜。常规方式田间管理及水肥供给。
授粉当天开始,每8 d取两种材料果肉组织,共取7次,3次重复。采集果实中央部位果肉去籽锡箔纸包裹后迅速液氮预冷,-80℃备用。
1.2.1番茄红素提取
番茄红素提取参照文献[17]方法。
1.2.2番茄红素HPLC测定
番茄红素HPLC测定参照文献[17]方法,略加改进。利用Waters高效液相色谱系统(配1525二元泵、二极管震裂检测器等)外标法定量。其中色谱柱为Wonda SilC18柱(250mm×4.6mm,5 μm),流动相为甲醇-乙腈-二氯甲烷(2 ϑ 5 ϑ 3),流速1.0mL·min-1,检测波长472 nm;柱温室温;进样量10 μL,出峰时间8.1min。番茄红素标样为Sigma公司产品。
1.2.3西瓜果肉总RNA提取
采用原平皓(天津)生物技术有限公司生产EASY spin植物RNA快速提取试剂盒提取西瓜果肉总RNA,以提取RNA为模板,按照RevertAidTMFirst Strand cDNA Synthesis Kit(Fermentas)说明书合成cDNA,-20℃保存备用。
1.2.4相关酶基因荧光定量PCR分析
番茄红素合成相关酶八氢番茄红素合成酶(Psy1)、八氢番茄红素脱氢酶(Pds)、ζ-胡萝卜素脱氢酶(Zds)、番茄红素环化酶(Lcyb)酶基因根据NCBI公布序列(GenBank登录号分别为DQ494 214.1、EF159942.1、GQ140241.1、EF014290.1),Primer 5.0软件设计荧光定量PCR引物,由博仕生物公司合成,以18S核糖体RNA为内参基因[16],引物序列如表1所示。
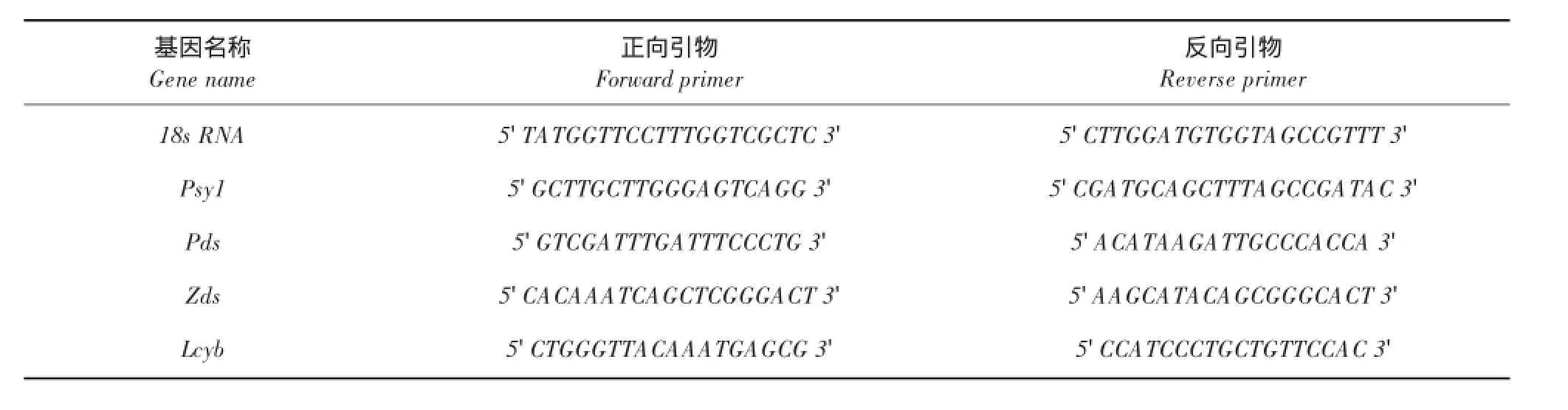
表1 荧光定量PCR引物序列Table 1 Fluorescence quantitative PCR primer sequence
荧光定量PCR反应体系25 μL,含cDNA 1 μL,上下游引物各0.5 μL,SYBR Premix Ex Taq 10 μL,ddH2O 8 μL。反应条件为:94℃预变性5min;94℃变性1min,55℃退火1min,72℃延伸 1min,35个循环;72℃延伸10min。
1.2.5数据分析
采用2-ΔΔCT法分析基因表达相对变化[16],软件Excel 2003和DPS 7.05作差异显著性测验和相关分析。
2 结果与分析
2.1西瓜果肉总RNA检测
西瓜不同时期果肉总RNA提取琼脂糖凝胶电泳检测结果见图1。
图1 LSW-177和COS果实不同时期果肉总RNA提取检测结果Fig.1 LSW-177 and COS fruit pulp total RNA extraction result in different periods
2.2西瓜果肉中番茄红素积累变化
由图2可知,LSW-177(红瓤)授粉后16 d,番茄红素开始逐渐积累,果实转色期(授粉后24 d)番茄红素迅速积累,成熟期(授粉后40 d)达峰值,番茄红素含量为35.485mg·kg-1FW,随后缓慢降低,过熟期(授粉后56 d)降为32.799mg·kg-1FW。整个果实发育过程中,从授粉后24 d到40 d为番茄红素急剧积累期。而COS(浅黄瓤)整个发育过程均未检测到番茄红素积累。
2.2西瓜果肉中相关酶基因表达量变化
2.2.1八氢番茄红素合成酶基因Psy1表达量变化
由图3可知,两种瓤色西瓜中八氢番茄红素合成酶基因(Psy1)均有不同程度表达,在红瓤西瓜LSW-177中,Psy1表达量随西瓜果实成熟逐渐增加,至授粉后40 d,即成熟期达到峰值,随后迅速下降。浅黄瓤西瓜COS整个果实发育过程中,除授粉后32和 40 d,Psy1基因相对表达量均极显著高于LSW-177;Psy1基因相对表达量在COS果实成熟前先升后降,果实成熟期达到最高峰,而后逐渐降低。
2.2.2八氢番茄红素脱氢酶基因Pds表达量变化
由图4可知,两品种间八氢番茄红素脱氢酶基因Pds相对表达量趋势一致,均为西瓜果实发育初期最高,随后逐渐降低,果实近成熟期(果实授粉后32 d)最低,随后逐渐增加;除授粉后8和32 d,COS中八氢番茄红素脱氢酶基因Pds相对表达量均极显著高于LSW-177。
2.2.3ζ-胡萝卜素脱氢酶基因Zds表达量变化
由图5可知,西瓜果实发育过程中ζ-胡萝卜素脱氢酶基因Zds表达量均呈先升高,授粉后32和40 d时降低,过熟期表达量增强趋势。ζ-胡萝卜素脱氢酶Zds表达量在两品种近成熟期,特别是红瓤西瓜转色期差异极显著。
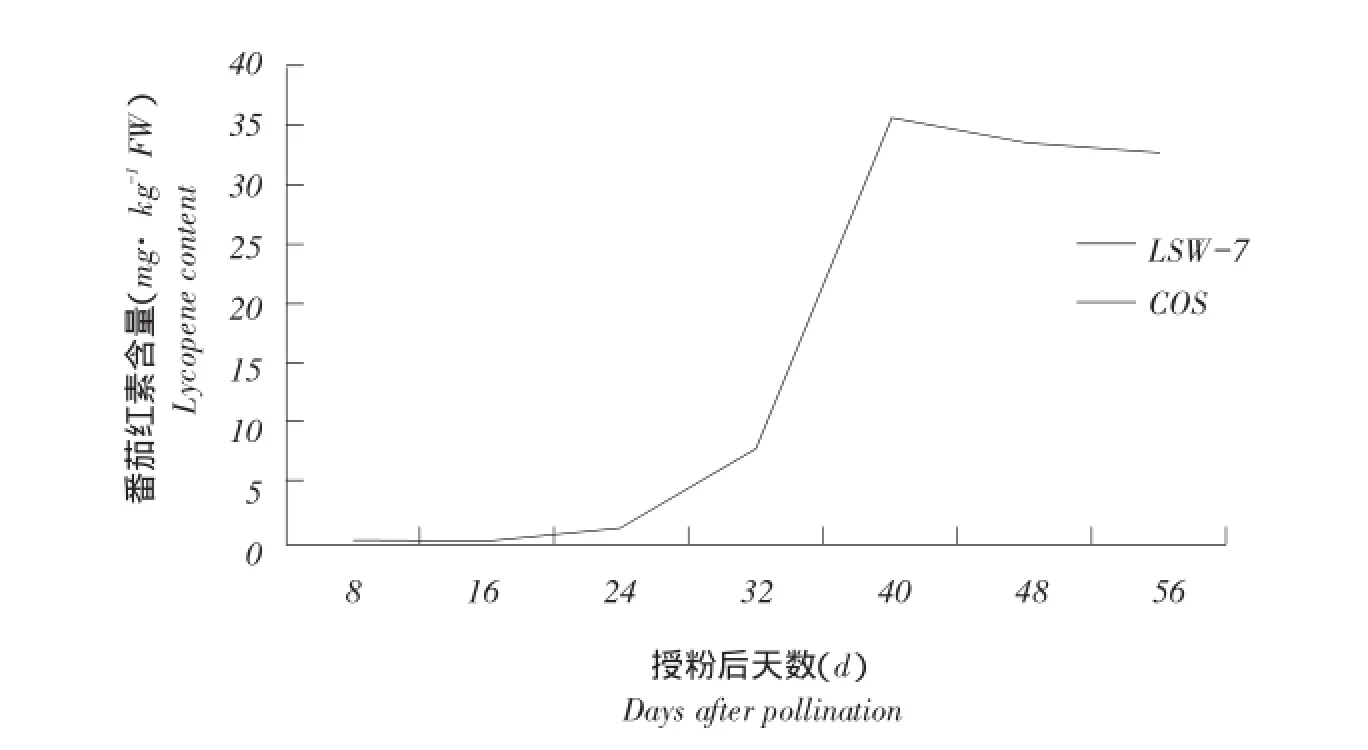
图2 LSW-177、COS不同时期番茄红素积累量变化Fig.2 Changes of lycopene accumulation in different stages of LSW-177,COS
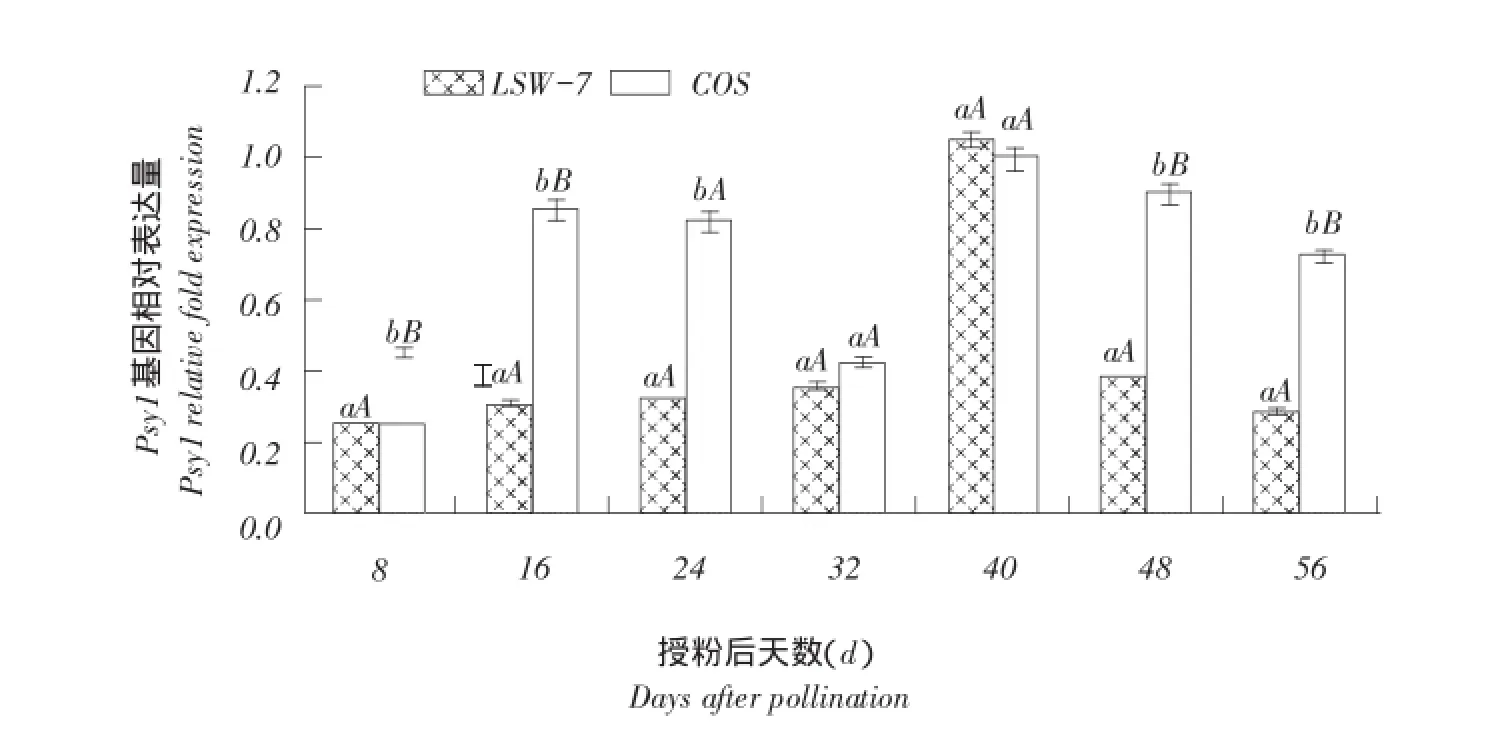
图3 西瓜果实成熟过程中八氢番茄红素合成酶Psy1基因相对表达量分析Fig.3 Psy1 relative expression quantity analysis during watermelon fruit ripening
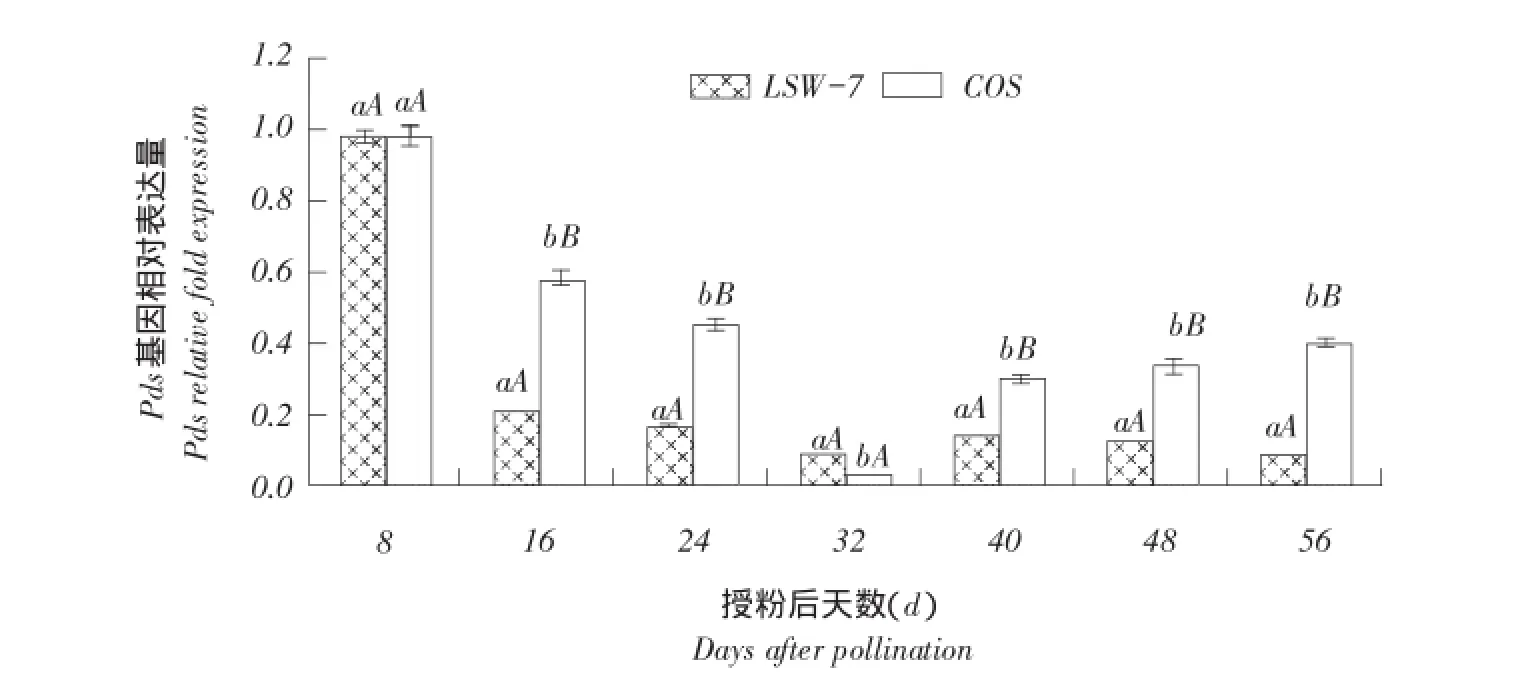
图4 西瓜果实成熟过程中八氢番茄红素脱氢酶Pds基因相对表达量分析Fig.4 Pds relative expression quantity analysis during two watermelon cultivars fruit ripening
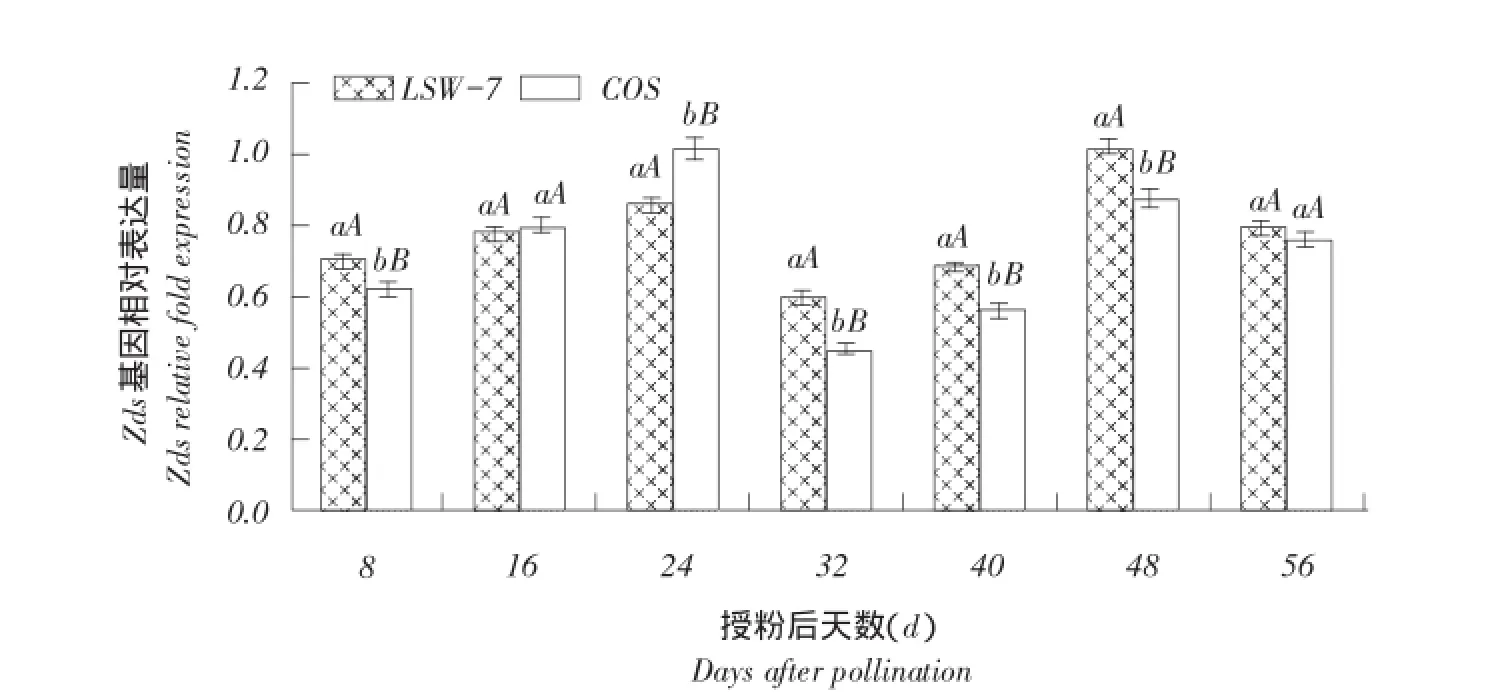
图5 西瓜果实成熟过程中ζ-胡萝卜素脱氢酶基因Zds相对表达量分析Fig.5 Zds relative expression quantity analysis during watermelon fruit ripening
2.2.4番茄红素环化酶基因Lcyb表达量变化
由图6可知,Lcyb基因在浅黄瓤西瓜COS中相对表达量除果实发育初期和授粉后56 d外,均极显著高于LSW-177中表达量,其中,授粉后32和40 d,该基因相对表达量分别是红瓤西瓜2.60倍和2.88倍。Lcyb基因相对表达量在红瓤西瓜LSW-177果实发育初期最高,而后逐渐降低,果实转色期和成熟期最低,过熟期又逐渐升高。白瓤西瓜COS中,该基因相对表达量变化趋势基本与红瓤西瓜一致。
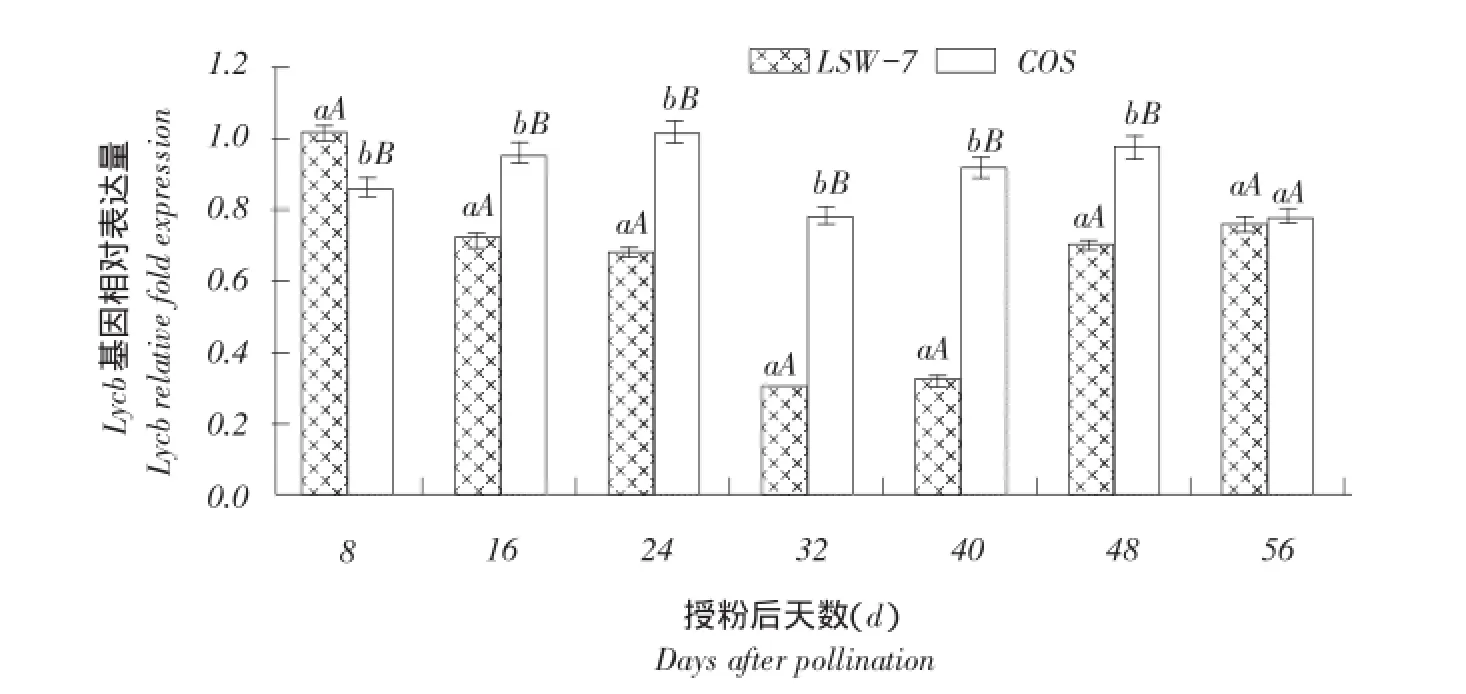
图6 西瓜果实成熟过程中番茄红素环化酶基因Lcyb相对表达量分析Fig.6 Lcyb relative expression quantity analysis during watermelon fruit ripening
2.3红瓤西瓜番茄红素积累关键酶基因分析
红瓤西瓜LSW-177果实发育过程番茄红素积累量与各基因相对表达量相关关系如表2所示,番茄红素积累与Psy1和Zds基因相对表达量呈正相关,其中与Psy1基因表达呈显著正相关。番茄红素积累与Pds和Lcyb基因相对表达量呈负相关,其中与Lcyb基因表达呈显著负相关。结合Psy基因和Lcyb基因在两品种间的表达差异,特别是果肉转色期的差异分析,推测Psy和Lcyb基因是西瓜形成番茄红素关键基因。
2.4番茄红素环化酶基因Lcyb在两西瓜品种间序列分析
根据两西瓜材料基因组重测序结果和GenBank已登录Lcyb基因序列,分析比对该基因DNA和蛋白序列差异,结果见表2。通过两品种间番茄红素环化酶Lcyb基因序列比对结果,可知两品种间Lycb基因间有3个SNP位点(见图7),Lcyb基因所转录蛋白质序列中,有两个蛋白存在差异(见图8)。
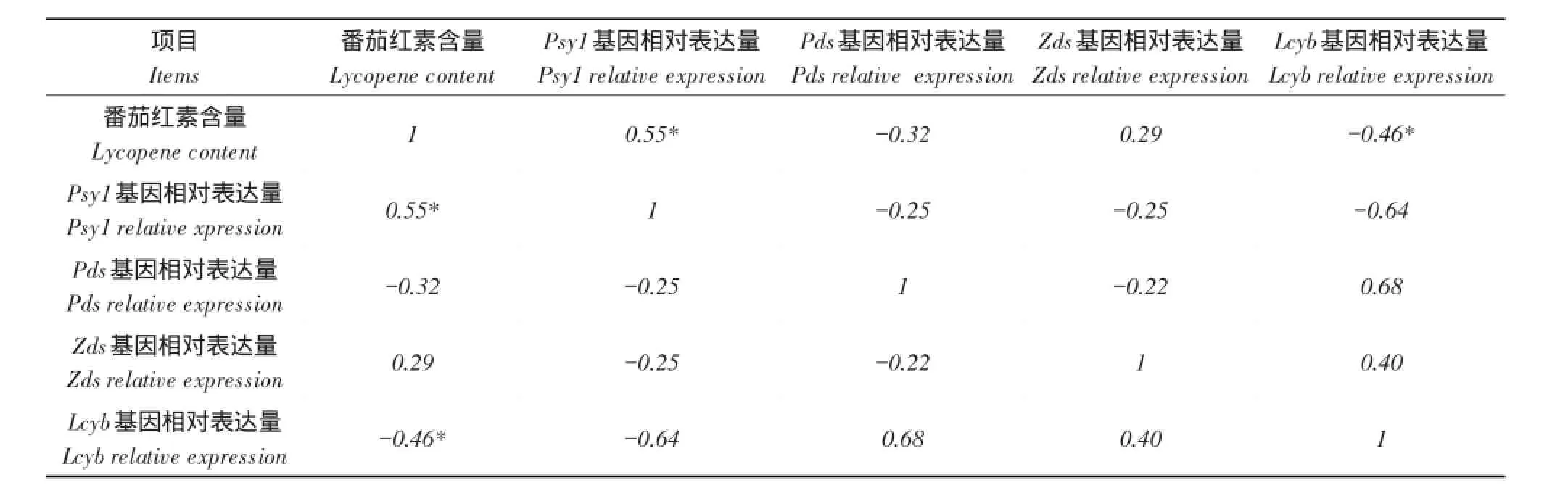
表2 红瓤西瓜LSW-177果实发育过程中番茄红素含量与基因表达相关性分析Table 2 Correlation analysis of lycopene content and gene expression during LSW-177 fruit development

图7 两品种间番茄红素环化酶Lcyb基因序列比对结果Fig.7 Between the two varieties of Lcyb sequence alignment results
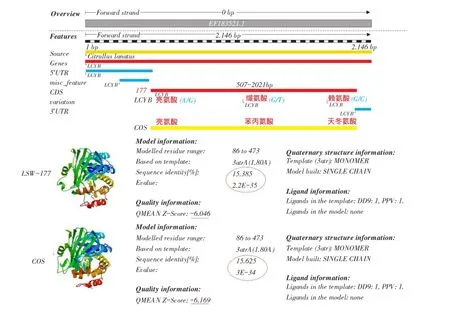
图8 两品种间番茄红素环化酶LCYB蛋白比对结果Fig.8 LCYB protein comparison results between the two varieties
2.5八氢番茄红素合成酶基因Psy1在两西瓜品种间序列分析
根据两西瓜材料基因组重测序结果和GenBank已登录Psy1基因序列,分析比对基因DNA序列差异,结果见图9,两西瓜品种Psy1基因一致性为99.31%,西瓜品种COS的Psy1基因内含子缺失一部分。
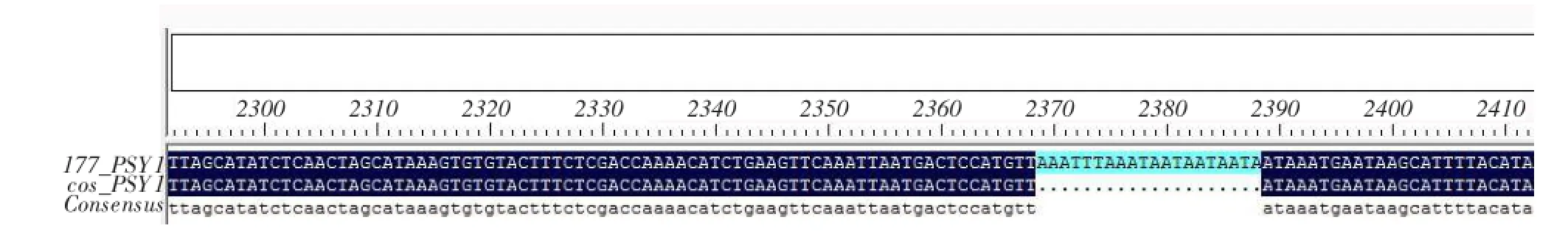
图9 两品种间八氢番茄红素合成酶基因Psy1 DNA序列比对结果Fig.9 Psy1 gene comparison results between the two varieties
3 讨论与结论
番茄红素作为重要天然类胡萝卜素,其抗癌保健方面功效受到关注,西瓜高番茄红素调控与应用已成为西瓜育种研究热点[19]。Bang从成熟西瓜中分离出类胡萝卜素合成途径七种酶的cDNA全长,并研究基因表达模式。结果表明,Psy1、 Pds、Zds、Lcyb、CHYb和Zep基因在五种颜色西瓜(白、浅黄、亮黄、橙黄、红)瓜瓤以及不同组织中均有表达,通过亮黄与红色两种瓤色西瓜色素合成途径分析,从Psy到Pds积累红色番茄红素早期酶促反应步骤活跃,颜色决定候选基因途径为下游基因Lcyb突变导致番茄红素积累β-胡萝卜素减少,而在转录水平上未发现Lcyb差异表达[13]。本研究以红瓤和白瓤西瓜为材料,发现Lcyb基因相对表达量差异显著。
已有研究表明,西瓜果实发育过程中,Psy是调控番茄红素合成上游基因,是类胡萝卜素合成途径重要限速酶[20]。类胡萝卜素生物合成基因表达量随果实成熟而增加,转录水平调控是控制类胡萝卜素合成重要方式[21-22]。Bramley认为Psy是番茄果实类胡萝卜素合成途径限速酶基因[23]。刘英明等研究表明,Psy1是红果番茄和粉果番茄番茄红素积累关键基因,表达量与果肉中番茄红素含量呈显著正相关[12]。张立志研究表明,Psy基因是橙色大白菜类胡萝卜素积累的关键酶基因,而Pds和Zds基因起协同作用[24]。本研究结果表明,红瓤西瓜番茄红素积累与Psy基因相对表达量呈显著正相关,与前人研究一致。
控制番茄红素降解的Lcyb基因在番茄中有2个拷贝,Lcyb和Lyce表达量在果实成熟时降低减少番茄红素降解,使番茄红素大量积累[25];将Lcyb基因正义导入番茄植株会导致番茄红素降解,β-胡萝卜素含量增加,但类胡萝卜素总量不变[26-27]。
Kang等分析不同瓤色西瓜发育过程基因表达,发现红瓤和粉红瓤西瓜Psy1和Lcyb基因表达量在发育过程中先升后降,认为Lcyb在番茄红素积累中起关键作用[16]。袁平丽利用荧光定量PCR技术,分析四倍体西瓜品种Psy1和Lcyb基因时空表达,发现西瓜不同组织器官中均有Psy1和Lcyb基因表达,差异明显[15]。Psy1和Lcyb基因雄花表达量均最高,与雄花色泽鲜艳相符。果实发育过程中,两个基因表达量均先升后降,后期Lcyb表达量急剧降低,番茄红素大量积累。表明Psy1和Lcyb基因在西瓜番茄红素积累过程起重要调控作用。本研究以西瓜品系LSW-177(红瓤)和Cream of Saskatchewan(浅黄瓤)为材料,利用荧光定量PCR,分析两西瓜品系不同发育时期Psy1、Pds、Zds、Lcyb四种酶基因表达量变化,推测Psy和Lcyb基因是西瓜形成番茄红素关键基因,浅黄瓤西瓜中Psy1基因内含子缺失一部分;两品种Lycb基因间有3个SNP位点,存在两个蛋白差异。
综上,西瓜积累番茄红素是多个基因共同作用结果,为探明西瓜番茄红素积累机理,后续研究应进一步明确关键酶基因功能,测定不同瓤色西瓜类胡萝卜素种类、相关酶活,并关注关键酶基因SNP分析。
[1]Zechmeister L,Tuzson P.Der farbst off der wasser-melone[J]. Berdeutsch Chem Ges,1930,63(10):2881-2883.
[2]Tomesm L,Johnson K W.Carotene pigments of an orange-fleshed watermelon[J].Proc Am Soc Hort Sci,1965,87:438-442.
[3]Olson JA.Provitamin-A function of carotenoids:The conversion of β-carotenoid into vitamin-A[J].JNutr,1989,119:105-108.
[4]Davis A R,Fish W W,Perkins-veazie P.A rapid hexanefreemeth⁃od for analyzing lycopene content in watermelon[J].J Food Sci, 2003,68:326-332.
[5]Leskovar D I,Bang H,Crosby Km,et al.Lycopene,carbohy⁃drates,ascorbic acid and yield components of diploid and triploid watermelon cultivars and affected by deficit irrigation[J].J Hortic Sci Biotechnol,2004,79:75-81.
[6]Perkins-veazie P,Collins J K,Pair S D,et al.Lycopene content differs among red-fleshed watermelon cultivars[J].J Sci Food Ag⁃ric,2001,81:983-987.
[7]Perkins-veazie P,Collins J K.Flesh quality and lycopene stabili⁃ty of fresh-cut watermelon[J].Postharvest Biol Technol,2004,31: 159-166.
[8]Perkins-veazie P,Roberts W,Collins J K,et al.Lycopene varia⁃tion among watermelons:Culivars,potassium,and ripeness[J]. Hort Science,2003,38:1295.
[9]Perkins-veazie P,Zhang X.Grafting increases lycopene in seed⁃less watermelon[J].Hort Science,2007,42:959.
[10]Perkins-veazie P,Collins J K,Davis A R,et al.Carotenoid con⁃tent of 50 watermelon cultivars[J].J Agric Food Chem,2006,54: 2593-2597.
[11]Perkins-veazie P,Collins J K,Pair S D.Watermelon lycopene content varies with cultivar andmaturity stage[J].Hort Science, 2000,35:412.
[12]刘英明,姜晶,王晶,等.番茄果实成熟过程中番茄红素含量及合成相关基因表达的分析[J].植物生理学报,2013,49(1):47-52.
[13]Bang H.Environmental and genetic strategies to improve carot⁃enoids and quality in watermelon[D].Canyon:Texas A&M Univer⁃sity,2005.
[14]万学闪,刘文革,阎志红,等.西瓜果实发育过程中番茄红素、瓜氨酸和VC等功能物质含量的变化[J].中国农业科学,2011, 44(13):2738-2747.
[15]袁平丽.多倍体西瓜发育过程中番茄红素变化及关键酶基因表达[D].郑州:中国农业科学院,2012.
[16]Kang B S,Zhao W E,Hou Y B,et al.Expression of carotenogenic genes during the development and ripening of watermelon fruit[J]. ScientiaHorticulturae,2010,124:368-375.
[17]袁平丽,路绪强,刘文革,等.西瓜番茄红素测定方法的研究[J].中国瓜菜,2012,25(3):1-4.
[18]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].methods,2001,25:402-408.
[19]康保珊,赵文恩.西瓜八氢番茄红素合成酶基因片段的克隆和序列分析[J].西北植物学报,2007,27(5):859-863.
[20]Fraser P D,Romer S,Shipton C A,et al.Biochemical evaluation of transgenic tomato plants expressing an addition phytoene syn⁃thase in a fruit-specificmanner[J].Procedings of the National Academy of Sciences of the United States,2002,99:1092-1097.
[21]Römer S,Hugueney P,Bouvier F,et al.Expression of the genes encoding the early carotenoid biosynthetic enzymes in Capsicum annuum[J].Biochemical and Biophysical Research Communica⁃tions,1993,196:1414-1421.
[22]Ronen G,Carmel-goren L,Zamir D,et al.An alternative pathway to beta-carotene formation in plant chromoplasts discovered bymap-based cloning of beta and old-gold colormutations in tomato [J].Procedings of the National Academy of Sciences of the Uni ted States,2000,97:11102-11107.
[23]Bramley Pm.Regulation of carotenoid formation during tomato fruit ripening and development[J].Journal of Experimental Bota⁃ny,2002,53:2107-2113.
[24]张立志.橙色大白菜球叶中类胡萝卜素积累机理及其合成途径中相关酶基因的表达研究[D].杨凌:西北农林科技大学, 2010.
[25]Ronen G,Cohenm,Zamir D,et al.Regulation of carotenoid bio⁃synthesis during tomato fruit development:Expression of the gene for1ycopene epsilon-cyclase is down-regulated during ripening and is elevated in themutant delta[J].Plant J,1999,17(4):341-351.
[26]Katom,Ikoma Y,Matsumoto H,et al.Accumulation of carot⁃enoids and expression of carotenoid biosynthetic genes duringmaturation in citrus fruit[J].Plant Physiol,2004,134(2):824-837.
[27]Rosati C,Aquilani R,Dharmapuri S,et al.Metabolic engineering of beta-carotene and lycopene content in tomato fruit[J].Plant J, 2000,24(3):413-420.
Lycopene accumulation and related enzyme gene expression of watermelon varieties during the process of development
WANG Xuezheng1,2, ZHANG Yanan1,2,XIAO Qi1,2,CHEN Kenong1,2,ZHU Zicheng1,2,ZHAO Liang1,2,LUAN Feishi1,2(1.School of Horticulture,Northeast Agricultural University,Harbin 150030,China;2.Ministry of Agriculture Key Laboratory of Biology and Germplasm Enhancement of Horticultural Crops in Northeast China, Harbin 150030,China)
Two watermelon cultivars red flesh LSW-177 and pale-yellow flesh COS with significant difference in lycopene content were used in the test and used HPLC and q-PCR in order to study lycopene content and the gene expression ofPsy1,Pds,Zds,Lcybat seven development stages of fruits.The results showed that the content of lycopene gradually increased in LSW-177 fruit ripening process and was the highest in the ripe stage(40 d after pollination),then decline.In the development process of COS(pale-yellow flesh)were not detected lycopene accumulation.Four genes were expressed in different levels of two watermelon varieties fruits development.Lycopene accumulation was significantly positively correlated with Psy1 gene expression,and was significantly negatively correlated withLcybgene expression.According to two genes expression differences between the two species,especially flesh color change stage,Lcyband Psy1 were suggested key genes of watermelon lycopene accumulation.The results of gene sequence analysis showed pale-yellow flesh watermelon inPsy1 gene intron deletion;between the two varieties of Lycbgene had three SNP loci and two proteins difference.
watermelon;lycopene;enzyme gene;HPLC;quantitative PCR
S651;Q786
A
1005-9369(2016)04-0040-09
2016-01-14
国家自然科学基金项目(31272186);国家西甜瓜现代产业技术体系项目(CARS-026-02)
王学征(1978-),女,教授,博士,研究方向为西瓜甜瓜遗传育种。E-mail:xz6206815@163.com
