肾病一号方总皂苷对肾纤维化大鼠的治疗作用*
2016-09-21木林洁程锦国姜程曦温州医科大学浙江温州325000浙江中医药大学附属温州市中医院浙江温州325000
木林洁程锦国△姜程曦(.温州医科大学,浙江 温州 325000;2.浙江中医药大学附属温州市中医院,浙江 温州325000)
肾病一号方总皂苷对肾纤维化大鼠的治疗作用*
木林洁1,2程锦国1,2△姜程曦1
(1.温州医科大学,浙江 温州 325000;2.浙江中医药大学附属温州市中医院,浙江 温州325000)
目的 观察肾病一号方及其总皂苷对肾纤维化大鼠的治疗作用。方法 雄性SD大鼠30只,随机分为假手术组、UUO模型组、洛丁新组、肾病一号方组、总皂苷组。采用单侧输尿管结扎制作UUO大鼠模型,造模14 d后收集24 h尿液,采用双缩脲法测定24 h尿蛋白含量(24 h UP)。处死大鼠取血清检测尿素氮(BUN)和血肌酐(Scr),取肾组织行HE染色评价肾小管间质纤维化损伤程度,免疫组化方法观察转化生长因子-β1 (TGF-β1)的表达情况。结果 肾病一号方组和总皂苷组大鼠肾纤维化明显改善,TGF-β1表达水平降低,与模型组差异有统计学意义(P<0.05)。结论 肾病一号方及其总皂苷能明显改善肾纤维化,其作用机制可能是通过下调TGF-β1的表达,从而达到肾脏保护的作用。肾病一号方总皂苷可能是肾病一号方防治肾纤维化的药效学物质基础之一。
肾纤维化 单侧输尿管结扎 转化生长因子-β1
【Abstract】Objective:To observe the therapeutic effect of Nephropathy 1st decoction and saponin in renal fibrosis rats.Methods:30 male SD rats were randomly divided into the sham operation group,UUO model group,Lotensin group,Nephropathy 1st decoction group and saponin group.A rat model of renal fibrosis was induced by unilateral ureteral ligation.Rats were executed after 14 days.24 h urinary protein(24h UP),serum blood urea nitrogen(BUN)and serum creatitine(Scr)were tested.Renal tubular interstitial fibrosis was evaluated by Hematoxylin and eosin staining(HE).The expression of transforming growth factor-beta 1(TGF-β1)was observed with immunohistochemical method.Results:The improvement of renal fibrosis in Nephropathy 1st decoction group and saponin group was obvious;the expression level of TGF-β1 decreased and compared with the model group,there were significant differences(P<0.05).Conclusion:Nephropathy 1st decoction and saponin may ameliorate renal interstitial fibrosis by down-regulating the expression levels of TGF-β1.Saponin may be one of the pharmacodynamic material bases of Nephropathy 1st decoction.
【Key words】Renal fibrosis;Unilateral ureteral obstruction;Transforming growth factor-beta 1
随着我国人口老龄化以及糖尿病、高血压患病人数的增加,慢性肾脏病的发病率正在逐年上升[1],给家庭和社会带来了巨大压力。慢性肾脏病在人类死亡的主要原因中仍然居于第5位至9位之间。因此,慢性肾功能衰竭仍然是人类生存的重要威胁之一[2]。研究表明肾纤维化是各种慢性肾脏疾病进展至终末期的共同通路[3]。中医药对防治肾纤维化具有独特的优势,肾病一号方是温州市中医院肾病科长期临床经验总结得出的抗肾纤维化的基本方,具有较好的临床疗效[4-5]。为了进一步探讨其药用价值,对其有效部位进行分离,总皂苷是其主要有效部位之一。已有研究表明中草药皂苷类有效成分具有一定的免疫调节和抗肾小球硬化的作用[6-7]。在此笔者将探讨肾病一号方总皂苷对UUO大鼠模型肾纤维化及转化生长因子-β1的影响。现报告如下。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠30只,普通级,体质量(185±10)g,由上海斯莱克实验动物有限责任公司提供[许可证号SCXK(沪)2012-0002]。
1.2 药物与试剂 肾病一号方由柴胡6 g,黄芩12 g,半夏12 g,白芍30 g,土茯苓30 g,半枝莲30 g,菝葜30 g,漏芦30 g等组成,由温州市中医院提供。洛丁新(编号12294563,盐酸贝那普利片,北京诺华制药)。抗TGF-β1抗体(abcam,产品编号ab92486);一抗稀释液(A1810,北京索莱宝生物科技公司);浓缩型DAB显色试剂盒(北京中杉金桥公司);免疫组化一步法聚合物检测系统(PV6001,北京中杉金桥公司);苏木精-伊红染色(HE)试剂盒(北京索莱宝生物科技公司)。超低温冰箱,中国海尔 DW-86L626;光学显微镜,日本Olympus BX51;微量加样枪,德国Eppendorf公司;病理切片机,德国Leica RM2235;组织脱水机,郑州南北仪器设备有限公司,KD-TS3A;全自动生化分析仪,美国Beckman Coulter AU5800。肾病一号方经水提醇沉法得到初提药液,然后采用乙醚、乙酸乙酯、正丁醇等提取分离,得到含70%总皂苷成分的肾病一号方制剂[8]。
1.3 造模与分组 实验大鼠适应性喂养1周后随机分为假手术组、模型组、洛丁新组、肾病一号方组和总皂苷组,各6只。本实验采用单侧输尿管结扎(UUO)实验动物模型[9],10%水合氯醛3.5 mL/kg腹腔注射麻醉下行左侧输尿管结扎,从背部距左侧脊肋角1.5 cm处做一斜向切口,逐层切开后暴露左侧肾脏,寻找左侧输尿管并游离,于约肾盂处和输尿管上1/3处双重结扎,回纳肾脏并逐层缝合。假手术组开腹后只游离左侧输尿管不进行结扎[10]。30只大鼠随机分为假手术组、模型组、洛丁新组、肾病一号方组、总皂苷组各6只。
1.4 给药方法 根据动物与人体的每千克体质量剂量折算系数表计算给药剂量[11],洛丁新组按1.67 mg/ (kg·d)灌胃,肾病一号方组以相当于生药18.75 g/(kg·d)灌胃,皂苷组按160 mg/(kg·d)灌胃,假手术组、模型组予等量0.9%氯化钠注射液灌胃,造模后第2日开始灌胃,每日1次,连续14 d。给药14 d后处死大鼠,留取血、尿样本和肾组织样本。
1.5 标本采集与检测 1)血尿生化指标。给药14 d后将大鼠放在干净的代谢笼中收集24 h尿液,采用双缩脲法测定24 h尿蛋白含量。采用10%水合氯醛3.5 mL/kg腹腔注射麻醉大鼠,固定大鼠后心脏取血3~5 mL,离心后取血清保存于-20℃冰箱,通过全自动生化分析仪检测血肌酐和血尿素氮 (温州市中医院检验科提供)。2)肾脏病理学检查方法。肾脏组织经4%多聚甲醛溶液固定24 h,常规脱水、透明、浸蜡、包埋,制成3.0 μm薄片,行HE染色,光学显微镜下观察肾脏组织病理学改变。每张切片随机选取5个视野连续不重复视野(×400),依据每个视野肾小管病变累及的小管数目评定肾小管间质损伤指数[12]。肾小管间质损伤评分:0分为肾小管结构正常,未见病变;l分为小管病变数目<3个;2分为肾小管病变累及数目3~5个;3分为小管病变数目>5个或肾小管结构消失。3)免疫组织化学检查方法。石蜡切片常规脱蜡水化,pH6.0柠檬酸盐缓冲液高压修复抗原,滴加抗TGF-β1抗体 (1∶200),4℃孵育18 h,根据免疫组化一步法聚合物检测系统滴加二抗,室温孵育30 min。DAB处理1 min,显微镜下控制着色时间,苏木素复染2 min后脱水、透明、封片[13]。光学显微镜下观察,400倍视野下,每张切片随机选取6个非重叠视野,采用Image Pro Plus 6.0软件测量每个视野下平均积分光密度值 (IOD),以IOD值反映组织切片中阳性物质的表达程度。
1.6 统计学处理 应用SPSS19.0统计软件处理。计量资料以(±s)表示,多个样本均数比较采用单因素方差分析,两两比较采用LSD检验,方差不齐时采用Dunnett T3检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠血、尿生化指标比较 见表1。与假手术组相比,模型组和各处理组大鼠血肌酐、血尿素氮明显上升(P<0.05)。与模型组对比,洛丁新组、肾病一号方组和总皂苷组大鼠血肌酐、血尿素氮明显降低 (P<0.05)。而24 h尿蛋白定量各组间差异无统计学意义(P>0.05),
表1 各组大鼠血、尿生化指标比较(±s)
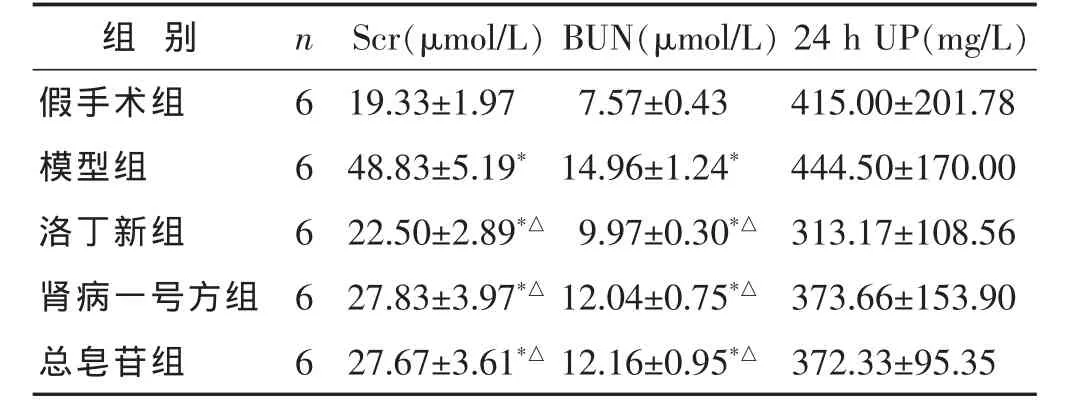
表1 各组大鼠血、尿生化指标比较(±s)
与假手术组比较,*P<0.05;与模型组比较,△P<0.05。下同。
组别 n 24 h UP(mg/L)假手术组 6 415.00±201.78模型组 6 444.50±170.00洛丁新组 6 313.17±108.56 Scr(μmol/L)BUN(μmol/L)19.33±1.97 7.57±0.43 48.83±5.19*14.96±1.24*22.50±2.89*△9.97±0.30*△肾病一号方组 6 373.66±153.90 27.83±3.97*△12.04±0.75*△总皂苷组 6 27.67±3.61*△12.16±0.95*△372.33±95.35
2.2 各组肾脏组织病理改变 见图1,表2。HE染色结果显示,假手术组未见明显的病理改变,肾小球、肾小管结构正常,肾间质无明显炎症细胞浸润。模型组肾小管上皮细胞出现大量变性和坏死,管腔扩张,间质增宽,大量炎症细胞浸润,肾间质纤维化程度严重;洛丁新组、肾病一号方组和总皂苷组的肾小管损伤程度较模型组明显减轻,但3组之间肾小管损伤程度对比不明显。肾小管间质损伤指数比较:与假手术组比较,其他各组肾间质损伤指数显著增加(P<0.05);与模型组比较,洛丁新组、肾病一号方组和总皂苷组的肾间质损伤程度下降(P<0.05),但3个治疗组之间差异不明显(P>0.05)。
2.3 各组TGF-β1的表达比较 见图2,表3。免疫组化染色显示,与假手术对比,假手术组肾脏几乎不表达或者低表达TGF-β1;其他各组大鼠肾小管中TGF-β1均有不同程度的表达(P<0.05);与模型组对比,模型组阳性表达强,肾间质中可见大量棕黄色显色,洛丁新组、肾病一号方组和总皂苷组的阳性表达则相对减弱(P<0.05)。洛丁新组、肾病一号方组和总皂苷组之间差异无统计学意义(P>0.05)。
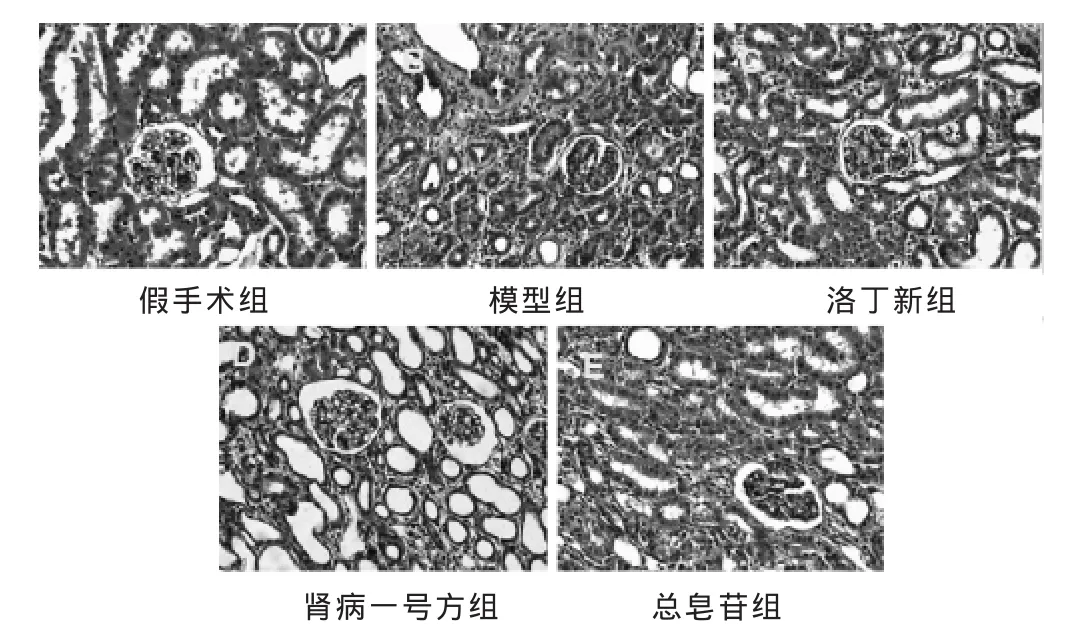
图1 各组大鼠肾组织病理学改变(HE染色,400倍)
表2 各组大鼠肾小管间质损伤指数比较(分,±s)
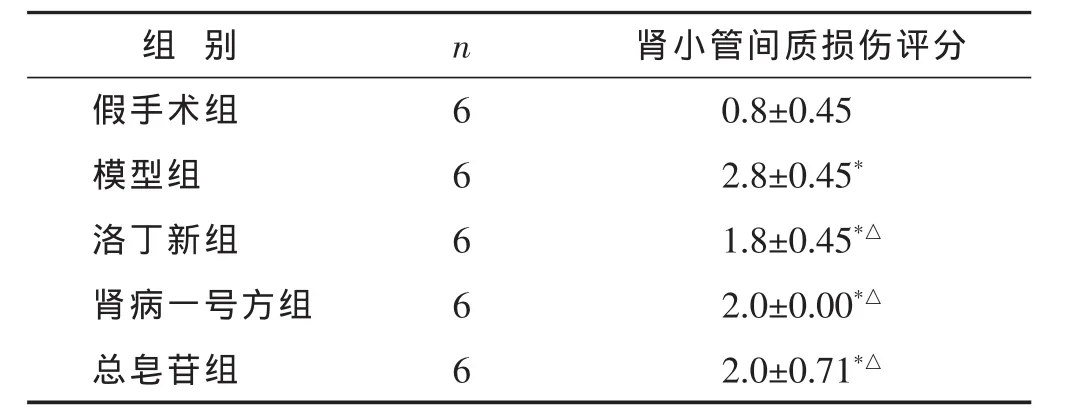
表2 各组大鼠肾小管间质损伤指数比较(分,±s)
?
表3 各组大鼠肾间质TGF-β1表达比较(±s)
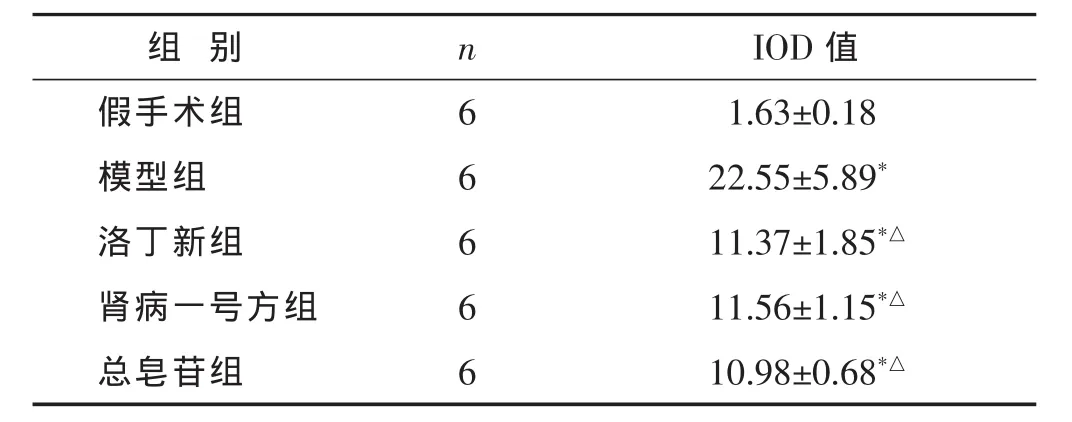
表3 各组大鼠肾间质TGF-β1表达比较(±s)
组别 n假手术组 6模型组 6洛丁新组 6 IOD值1.63±0.18 22.55±5.89*11.37±1.85*△肾病一号方组 6 11.56±1.15*△总皂苷组 6 10.98±0.68*△

图2 各组大鼠肾间质中TGF-β1的表达(HE染色,400倍)
3 讨 论
大量研究表明各种慢性肾脏疾病进展至终末期的共同通路都是肾间质纤维化[1]。目前认为肾脏纤维化形成的分子机制主要分4个阶段:第1阶段是细胞的活化和受损。第2阶段是促纤维化因子的释放。第3阶段是纤维化的形成。第4阶段是肾脏结构和功能受损[14]。在生理状态下,TGF-β1在肾小管上皮细胞微表达。病理状态下,活化的肾间质细胞大量分泌TGF-β1促进肾间质纤维化的进展。TGF-β1被认为是促进肾间质纤维化的最重要作用因子[15]。因此TGF-β1的表达对于肾间质纤维化进展及预后具有重要意义。
中医学认为各种肾脏疾病的根本病机是本虚标实,虚实夹杂。本虚为脾肾两虚,而标实则以湿浊、湿热、瘀血、毒邪、风邪为主,各方面相互交织,最终导致肾纤维化。肾病一号方是温州市中医院肾病科在临床长期应用的经验方。本方根据病机特点,将小柴胡汤作为君药,主入三焦,使三焦枢机调畅,加上土茯苓、半枝莲清热除湿解毒,菝葜解毒化瘀,从而调畅三焦气机,祛除三焦浊邪。课题组前期研究已经证实肾病一号方可能通过减少GMC(系膜细胞)和FN(纤维连接蛋白)的分泌,下调IL-6 mRNA表达,抑制大鼠肾小球系膜细胞增殖,从而发挥抗肾脏纤维化的作用[3]。然而,以上研究没有揭示肾病一号方抗肾纤维化的药效学物质基础,因此,我们对其有效部位进行分离,得到纯化的肾病一号方总皂苷成分,通过动物实验检测大鼠肾脏TGF-β1的表达,进一步探讨肾病一号方及其总皂苷防治肾纤维化的可能机制和肾病一号方抗肾纤维化的药效学物质基础。
该研究结果显示,肾病一号方及其总皂苷能够有效降低肾纤维化大鼠肾脏血肌酐和血尿素氮,同时能下调UUO大鼠肾间质TGF-β1蛋白表达水平。综上,第一,肾病一号方及其总皂苷具有延缓肾纤维化发生发展的作用,其作用机制可能是下调肾间质TGF-β1蛋白表达水平,从而抑制细胞外基质沉积,达到抗肾纤维化的作用。第二,肾病一号方总皂苷成分可能是其发挥抗纤维化作用的药效学物质基础之一。中医药在防治肾纤维化中具有独特优势,然而其药效学物质基础十分复杂,无论是肾病一号方还是其他中药复方,其发挥作用的药效学机制都有待进一步探索。
[1] 沈会,陶汉华,张诏,等.慢性肾功能衰竭中医临床研究进展[J].辽宁中医杂志,2014,41(3):597-600.
[2] 叶任高,李幼姬,刘冠贤.临床肾脏病学[M].北京:人民卫生出版社,2007:589.
[3] 郑春霞,秦卫松,王金泉.肾脏纤维化的发生机制及治疗新观点 [J].肾脏病与透析肾移植杂志,2006,15(4):360-165.
[4] 胡振奋,程锦国,董飞侠,等.肾病Ⅰ号方对大鼠系膜细胞增殖及表达的影响[J].中华中医药学刊,2010,28(4):863-865.
[5] 胡振奋,程锦国,董飞侠,等.肾病Ⅰ号方对大鼠系膜细胞增殖及IL-6和FN表达的影响[J].中国中西医结合肾病杂志,2010,11(1):21-24.
[6] 樊永蓉,廖庆文.中草药中皂苷类有效成分药理作用研究现状[J].湖南中医药导报,2003,9(11):52-53.
[7] 李平,巩跃文,赵世萍.柴胡皂苷-d防止大鼠肾小球硬化的实验研究[J].科技导报,2006,24(10):37-41.
[8] 陈齐.中药药理研究方法学[M].北京:人民卫生出版社,1993:69-71.
[9] 刘克剑,张悦,李靖,等.单侧输尿管梗阻法制作大鼠肾间质纤维化模型的改进[J].中国实验动物学报,2007,15 (6):410-412.
[10]罗婷,程锦国,简怡娟,等.清化固肾排毒方对UUO大鼠上皮细胞转分化的影响[J].上海中医药杂志,2015,49(11):71-78.
[11]黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算 [J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[12] Solez K,Axelsen RA,Benediktssen H,et al.International sandardizationof criteria for the histologic diagnosis of renal allograft rejection:the Banff working classification of kidney transplant pathology[J].Kidney Int,1993,44(2):411-415.
[13]韩惦梅.免疫组化的关键步骤、常见问题和解决方案[J].医药前沿,2015,5(32):337-338.
[14]黎凤仪.肾纤维化的中西医治疗进展[J].山西中医,2013,29(5):55-58.
[15]王颖航,潘志,南红梅,等.肾纤维化的分子病理机制探讨[J].中国中西医结合肾病杂志,2006,7(1):34-37.
The Therapeutic Effect of Nephropathy 1st Decoction and Saponin in Renal Fibrosis Rats
MU Linjie,CHENG Jinguo,JIANG Chengxi.Wenzhou Medical University,Zhejiang,Wenzhou 325000,China.
·研究报告·
R285.5 文献标志码:A
1004-745X(2016)08-1493-04
10.3969/j.issn.1004-745X.2016.08.011
浙江省药学重中之重一级学科开放基金(YKFJ005);2015年温州市中医药建设资助项目
(电子邮箱:wsjcjg@126.com)
2016-04-10)
