外感清热解毒方对发热大鼠血清炎症因子与下丘脑环氧化酶1和2蛋白表达的影响*
2016-09-21键成麦静愔奚安陈建杰上海浦东新区传染病医院上海20299上海中医药大学附属曙光医院上海2020上海浦东新区中医医院上海20299
平 键成 扬△麦静愔奚 安陈建杰(.上海浦东新区传染病医院,上海 20299;2.上海中医药大学附属曙光医院,上海 2020;.上海浦东新区中医医院,上海 20299)
·研究报告·
外感清热解毒方对发热大鼠血清炎症因子与下丘脑环氧化酶1和2蛋白表达的影响*
平 键1,2成 扬1,2△麦静愔3奚 安3陈建杰1
(1.上海浦东新区传染病医院,上海 201299;2.上海中医药大学附属曙光医院,上海 201203;3.上海浦东新区中医医院,上海 201299)
目的 观察外感清热解毒方对发热大鼠血清中炎症因子和下丘脑环氧化酶1和2蛋白表达的影响。方法 雄性SD大鼠46只随机分为正常对照组8只和造模组38只;造模组予干酵母混悬液皮下注射,正常组注射0.9%氯化钠注射液。注射6 h后,造模组剔除6只升温<0.8℃的大鼠,剩余32只大鼠随机分成模型对照组、阳性对照组、中药低剂量组和高剂量组,各8只。正常对照组和模型对照组予蒸馏水,阳性对照组予阿司匹林混悬液,中药组予相应剂量的中药灌胃。4 h后处死大鼠,分离血清,ELISA法检测炎症因子含量;取下丘脑组织,Western blot法检测环氧化酶1和2蛋白表达水平。结果 阳性对照药物和中药干预均降低了发热大鼠的体温,下降幅度由大到小依次为阳性对照组、高剂量组和低剂量组。与模型组相比较,阳性对照组、低剂量组和高剂量组差异均有统计学意义(P<0.01),高、低剂量组差异有统计学意义(P<0.05)。与模型组比较,阳性对照组和中药组血清白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、IL-1β水平均显著下降(P<0.01),高和低剂量组差异有统计学意义(P<0.05)。与模型组相比较,阳性对照组和中药组显著抑制了下丘脑组织中环氧化酶2的蛋白水平表达(P<0.01),低剂量和和高剂量之间的差异无统计学意义(P>0.05)。各组下丘脑组织中环氧化酶1表达则没有明显变化。结论 外感清热解毒方能有效降低发热大鼠的体温,其机制与降低血清IL-6、TNF-α和IL-1β水平、抑制下丘脑组织中环氧化酶2的表达有关。
外感清热解毒方 发热 炎症因子 环氧化酶1和2
【Abstract】Objective:To study the effect of Waigan Qingre Jiedu decoction on serum inflammatory factors and protein expression of COX-1 and COX-2 in Hypothalamus in fever rats.Methods:Body temperature of 50 male SD rats was measured once per hour,continuous twice;taking the average as the basic body temperature.After removing 4 rats with the temperature difference>0.3℃,the rest 46 rats were randomly divided into the normal control group(8 rats)and the model group(38 rats).The model was reproduced with subcutaneous injection of dry yeast suspension,and normal saline was injected in the normal group.6 h after injection,6 rats that heated up<0.8℃was removed from the model group.The remaining 32 rats were randomly divided into the model control group,the positive control group,low-dose group and high-dose group,8 rats in each group.The normal control group and the model control group were given distilled water;the positive control group were given aspirin suspension,and low and high-dose groups were given Waigan Qingre Jiedu decoction.4h after drug administration,the rats were killed;serum was separated.ELISA was used to detect inflammatory factors;hypothalamus was collected to detect Cyclooxygenase 1 and 2 by Western blot.Results:Both positive drug and Waigan Qingre Jiedu decoction decreased the temperature of fever rats,and decrease magnitude was the positive control group,highdose group and low-dose group.Compared with the model group,the difference among the positive control group,low-dose group and high-dose group was statistically significant(P<0.01).There was significant difference between high-dose and low-dose groups(P<0.05).Compared with the model group,the levels of IL6,IL6,TNF and IL1 dropped obviously in the positive control group and TCM group(P<0.01).There was significant difference between high-dose and low-dose groups(P<0.05).Compared with the model group,Waigan Qingre Jiedu decoction significantly inhibited Cyclooxygenase 2 expression in the hypothalamus(P<0.01),and there was no significant difference between the low-dose and high-dose groups(P>0.05).There was no significant change in Cyclooxygenase 1 expression in the hypothalamus of all groups.Conclusion:Waigan Qingre Jiedu decoction can effectively reduce the body temperature of fever rats,which associated with reduction of serum IL-6,TNF alpha and IL-1 beta level,and inhibition of expression of cyclooxygenase-2 in hypothalamic tissue.
【Key words】Waigan Qingre Jiedu decoction;Fever;Inflammatory factors;Cyclooxygenase 1 and 2
发热是指体温高于正常值范围,既是患者的主观症状,也是可以客观检测到的体征。外感发热常见于感冒和时行感冒,作为对人体危害较大的多发病,受到历代医家的重视[1]。外感清热解毒方系上海市浦东新区传染病医院从 2003年开始在防治 SARS、H1N1、H5N1、H7N9等几次疾病过程中,结合中医理论和临床实践拟定的经验方,在历次疫情发热患者中大量使用,取得了良好的疗效[2-3]。本研究以干酵母皮下注射诱导大鼠发热模型,观察该方对外周血中炎症因子和下丘脑组织中环氧化酶1和2表达的影响,探讨其退热的作用机制,为进一步开发安全有效的中药制剂提供依据。现报告如下。
1 材料与方法
1.1 动物 清洁级雄性SD大鼠50只,6~8周龄,体质量(170±10)g,购自上海西普尔-必凯公司提供,饲养于上海中医药大学实验动物中心。
1.2 药物 参考文献[2],外感清热解毒方由黄芩、桔梗、芦根、炙款冬、苍术等组成。按比例称取单味中药在蒸馏水中浸泡30 min,并加入100 mL蒸馏水(液面浸没中药饮片2~3 cm)武火煮沸,待其沸腾后文火慢煎30 min,得滤液50 mL左右;再向生药中继续加入蒸馏水至药材表面再次进行煮沸,得滤液50 mL左右,将2次滤液合并后浓缩至50 mL左右,并将其放入4℃冰箱冷却,静置过夜,次日继续浓缩至25 mL,2000×g离心,取上清液制备药液(含生药量1 g/mL),低温冷藏备用。阿司匹林泡腾片购自阿斯利康制药有限公司,配成0.5%的混悬液(含药量0.005 g/mL)。干酵母购自安琪酵母有限公司,制备20%干酵母混悬液备用。
1.3 试剂与仪器 BCA试剂盒购自碧云天生物公司。抗环氧化酶1和2多克隆抗体购自美国EPITOMICS公司。抗GAPDH抗体购自康成生物。Odyssey IRDye 680 conjugated山羊抗兔IgG、Odyssey Blocking Buffer均产自美国Li-Cor公司。Nonidet P40产于美国SIGMA-ALDRICH公司,PMSF购自美国Fluka公司。完全性蛋白酶抑制剂混合物为德国Roche公司产品;40% Acrylamide/bis Solution[N,N’-Methylenbis-acrylamid, Mix,Ratio 37.5∶1(2.6%C)]和Tween-20购自美国Bio-Rad公司。预染蛋白标准品产于加拿大Fermentas公司。硝酸纤维薄膜、甘氨酸、Tris、TEMED、EDTA、SDS为美国Amresco产品。异丙醇、溴酚蓝购自上海试剂三厂。过硫酸铵、甲醇、浓盐酸均为分析纯,购自中国国药集团化学试剂有限公司。Odyssey红外扫描系统为Li-Cor公司产品。IL-6、TNF-α和IL-1β试剂盒购自丰恒生物科技公司。
1.4 造模与给药 参考文献 [4],50只大鼠适应环境3 d后,每日上午8点开始用电子体温计测大鼠肛内温度2次,连续7 d。实验前禁食不禁水12 h,实验日上午8时开始每小时测体温1次,连续2次,选取2次体温的平均值作为正常大鼠基础体温,剔除4只温差>0.3℃者,剩余体温合格大鼠46只,随机分为正常组8只和造模组38只。参考文献[4],造模组大鼠于背部注射20%干酵母混悬液 (1 mL/100 g)制备发热模型,正常组注射等量0.9%氯化钠注射液,剔除6只6 h后升温<0.8℃者。剩余32只大鼠随机分成模型对照组、阳性对照组、低剂量中药组和高剂量中药组,各组8只。造模6 h后,大鼠灌胃给药,中药组予外感清热解毒方灌胃给药 (高剂量和低剂量分别为60 kg成人体质量用量的16倍和8倍)。阳性对照组予阿司匹林(0.005 g/100 g)灌胃,正常对照组和模型对照组予等量蒸馏水灌胃。
1.5 标本采集与检测 1)大鼠体温变化。从造模开始,每1小时测量大鼠肛温1次直至实验结束。计算体温变化(体温变化值Δ℃=各时点体温-基础体温)。2)标本采集。灌胃给药4 h后,最后1次测量体温,用3%戊巴比妥钠2 mL/kg体质量的剂量腹腔注射,麻醉后的大鼠打开腹腔,经腹主动脉采血,分离血清,放置-80℃冰箱内储存。用铡刀将大鼠头部铡下,左手将大鼠头部固定好,随后用右手持手术剪将大鼠头部的皮剪开,再用手术剪将大鼠头顶的骨盖沿中线剪开,再用手术剪撬至中线两边,将鼠脑翻转,以大鼠脑灰结节和视交叉的中心点为界定部分,取出下丘脑组织于液氮中保存待测。3)血清细胞因子检测。按照试剂盒提供的操作说明,检测大鼠血清中白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、IL-1β和IFN的含量。4)Western blot检测。参考文献[5-6],采用RIPA试剂分离下丘脑总蛋白,BCA试剂盒测定蛋白浓度。10%SDS聚丙烯酰胺凝胶电泳,将凝胶中蛋白电转移至硝酸纤维素膜上,加Odyssey blocking buffer封闭,加入1抗(环氧化酶1或2,工作浓度1∶1000),4℃下摇床振荡过夜,洗涤后加入2抗反应。洗涤后将膜置于Odyssey仪器上扫描、分析,使用内参照GAPDH校正目标蛋白表达量。
1.6 统计学处理 应用SPSS17.0统计软件处理。计量资料以(±s)表示,采用ANOVA程序进行单因素方差分析,并用LSD程序进行两两比较。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠体温变化 见表1。在给予干酵母皮下注射6 h后,与正常组相比,各组大鼠体温显著升高,差异均有统计学意义(P<0.01);除正常组外,其余各组之间体温差异均无统计学意义(P>0.05)。说明造模成功,各干预组具有可比性。给药4 h后,正常组体温无明显波动,模型组体温维持较高水平。阳性对照药物和中药干预均降低了发热大鼠的体温,下降幅度大小依次为阳性对照组、高剂量组和低剂量组。与模型组相比较,阳性对照组、低剂量组和高剂量组均有统计学意义(P<0.01)。高剂量组与低剂量组相比差异有统计学意义(P<0.05)。
表1 各组大鼠体温比较(Δ℃,±s)
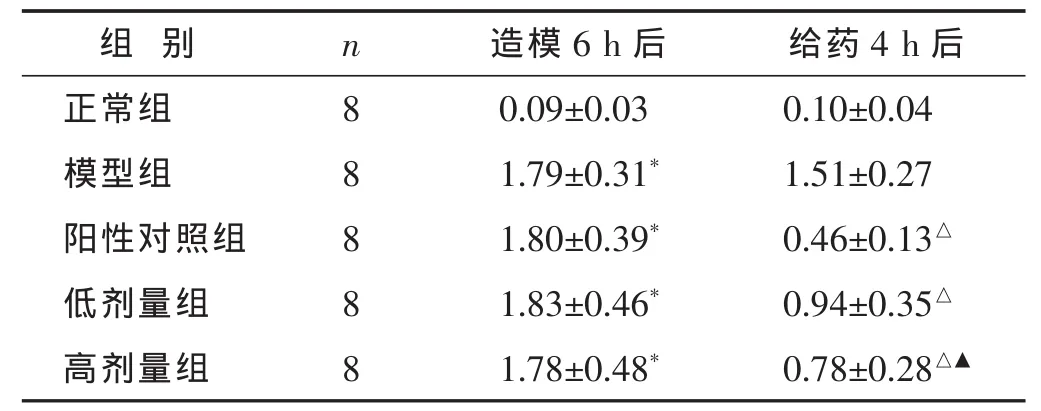
表1 各组大鼠体温比较(Δ℃,±s)
与正常组相比较,*P<0.01。与模型组相比较,△P<0.01。与低剂量组相比较,▲P<0.05。
?
2.2 各组大鼠血清炎症细胞因子水平比较 见表2。与正常组比较,模型组大鼠血清中IL-6、TNF-α、IL-1β水平均显著升高(P<0.01)。与模型组比较,阳性对照组和中药组上述细胞因子水平均显著下降 (P<0.01),高和低剂量组差异有显著性(P<0.05)。
2.3 各组大鼠下丘脑组织中环氧化酶1和2的表达水平 见图1和表3。Western blot检测结果显示,与正常组相比较,模型组大鼠下丘脑组织中环氧化酶2蛋白表达量显著上升(P<0.01)。与模型组相比较,阳性药物对该蛋白表达无影响(P>0.05)。中药干预则显著抑制了该蛋白的表达(P<0.01),高剂量和低剂量组之间的差异无统计学意义(P>0.05)。各组大鼠下丘脑组织中环氧化酶1表达则没有明显变化。
表2 各组大鼠血清炎症细胞因子水平比较(pg/mL,±s)
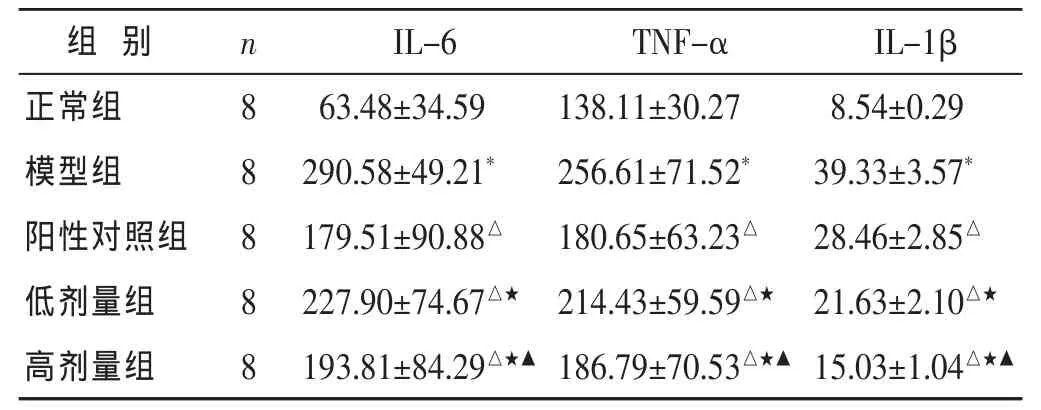
表2 各组大鼠血清炎症细胞因子水平比较(pg/mL,±s)
与正常组相比较,*P<0.01;与模型组相比较,△P<0.01;与阳性对照组比较,★P<0.05;与低剂量组相比较,▲P<0.05。下同。
?
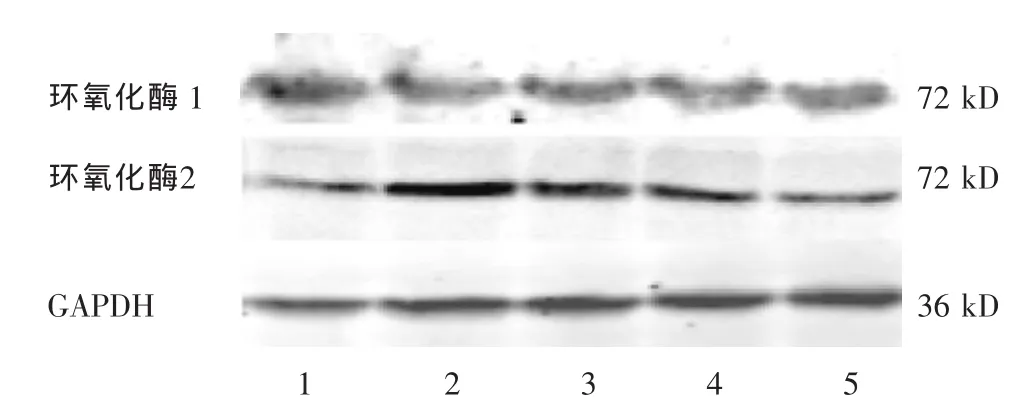
图1 各组大鼠下丘脑组织环氧化酶1和2的表达水平
表3 各组大鼠下丘脑环氧化酶1和2表达水平比较(±s)
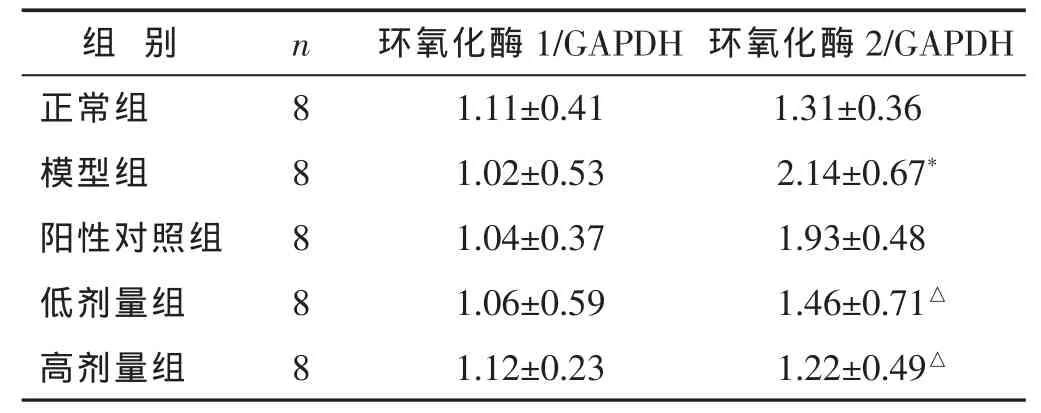
表3 各组大鼠下丘脑环氧化酶1和2表达水平比较(±s)
?
3 讨 论
中医药在防治外感热病方面有着悠久的历史,明代《瘟疫论》对瘟疫的病因病机、诊断和治疗做了全面论述,认为瘟疫是感受“疠气”所致,治疗重在祛邪,以“在卫汗之可也”“治上焦如羽,非轻莫举”为原则。对于外感病的治疗着眼于整体,而不是单纯抗病毒,遵循“整体观念、辨证论治”的原则,寻求病毒侵袭机体后患者表现出的共性规律[7]。
外感清热解毒方系本单位从2003年开始在防治历次新发(发热)呼吸道传染病的过程中,结合中医理论和临床实践拟定的经验方。本课题组认为外感发热主因外感时行邪气所致,邪气由皮毛而入,侵袭气道,营卫不和,固见发热、咽红不适,郁热熏蒸于肺卫、灼伤肺阴,以致轻咳少痰,身热无汗。故宜清热解毒、解表宣肺。方中诸药相合,共奏清热解毒、疏散上焦之风热、解表宣肺、除烦利咽之功。
在前期临床研究证实,该方可以有效地提高外感发热患者4 h即刻退热疗效,起效时间和退热时间均显著缩短,临床痊愈率得到了显著提高,在治疗过程中没有观察到明显不良反应[3]。为了进一步验证该方的解热作用,本实验采用经典的干酵母皮下注射的方法复制大鼠实验性发热模型,该模型具有操作简便,重复性好,持续时间长等诸多优点[8]。
本研究观察到大鼠造模6 h后,大鼠体温升温1.79℃左右,与报道相符[9]。经中药和阿司匹林干预后,大鼠体温均明显下降,且高剂量组下降程度优于低剂量组,提示该方解热作用有剂量依赖性趋势。
IL-1β、IL-6和TNF-α均是与炎症密切相关的细胞因子,致病刺激因素可作用于巨噬细胞等,从而产生此类细胞因子,参与机体的免疫调节,细胞的增殖与凋亡,介导炎症反应等。在机体的发热反应中,这些细胞因子经过血液循环进入宿主下丘脑影响体温调节中枢,然后经一系列信号转导,使产热增多,从而促使体温升高[10-12]。本实验观察到经干酵母皮下注射刺激,可明显诱导大鼠血清中TNF-α和IL-1β、IL-6含量增加,经中药干预,这些细胞因子均明显下降,提示该方的解热作用与降低血清中这些炎症细胞因子含量有关。
环氧化酶又称前列腺素H合成酶,是一种膜结合蛋白,是花生四烯酸代谢途径中合成各种前列腺素和血栓素的关键限速酶,兼有环氧化酶和过氧化氢酶的双重功能[13]。该酶广泛参与机体的多种生理及病理过程,如炎症、发热、出凝血机制、免疫调节及肿瘤的发生发展等[14]。环氧化酶有3种异构体,其中环氧化酶1是参与正常生理功能酶,环氧化酶3主要功能是产生前列腺素家族中的抗炎成分[15]。而环氧化酶2是诱导酶,在炎症因子的刺激下可以大量表达,继而促进前列腺素的合成增多,介导发热、炎症和疼痛等反应,是调控发热过程的关键蛋白,研究表明环氧化酶是解热药物的重要靶点[16-17]。
本研究采用Western blot方法检测了大鼠下丘脑组织中环氧化酶和2的表达水平,显示各组大鼠下丘脑组织中环氧化酶1表达无明显变化,而干酵母造模大鼠的环氧化酶2表达明显增高,而外感清热解毒方干预后,其表达水平显著降低,提示该复方可以通过降低其表达而发挥抗炎解热作用。
采用有效的中药方治疗外感发热,既对感染控制有积极意义,又可以调节人体免疫机能,比单一抗病毒或者退热药物更具有优势[18]。本研究实验结果显示,外感清热解毒方能明显抑制发热大鼠的体温上升,降低体内炎症因子,抑制下丘脑中组织中环氧合酶2蛋白的表达,其机制值得进一步深入研究。
[1] 陈光,杨浩婕,张乙,等.从中医发热理论的发展谈中医的创新[J].世界中医药,2015,10(8):1250-1253.
[2] 成扬,陈建杰,麦静愔,等.一种用于治疗外感发热的中药组合物及其用途[P].申请号:201510890605.7.
[3] 成扬,麦静愔,薛建华,等.外感清热解毒方治疗急性上呼吸道感染发热临床评价[J].上海中医药大学学报,2016,30(4):22-25.
[4] 陈奇.中药药理研究方法学[M].北京:人民卫生出版社,2006:294.
[5] Cheng Y,Hou T,Ping J,et al.Quantitative succinylome analysis in the liver of non-alcoholic fatty liver disease rat model[J].Proteome Sci,2016,14:3.doi:10.1186/s12953-016-0092-y.
[6] Cheng Y,Mai J,Hou T,et al.MicroRNA-421 induces hepatic mitochondrial dysfunction in non-alcoholic fatty liver disease mice by inhibiting sirtuin 3[J].Biochem Biophys Res Commun,2016,474(1):57-63.
[7] 王镓,董竞成.中医药防治呼吸道病毒感染研究综述[J].中国中西医结合杂志,2014,34(5):633-636.
[8] 贺秀云,宋捷民,李越兰.寒热因素共同作用对大鼠血清NO、MDA、SOD含量的影响[J].中国中医急症,2013,22(11):1825-1826.
[9] 左泽平,王志斌,郭玉东,等.常用大鼠发热模型研究[J].中国比较医学杂志,2012,22(2):52-57.
[10]Liedtke C,Trautwein C.The role of TNF and Fas dependent signaling in animal models of inflammatory liver injury and liver cancer[J].Eur J Cell Biol,2012,91(6-7):582-589.
[11]Dzhndoian ZT,Martirosian NG.The role of aldosterone and IL-6 in the pathogenesis of inflammation in familial Mediterranean fever[J].Georgian Med News,2012,12(206):44-48.
[12]Heida JG,Moshe SL,Pittman QJ.The role of interleukin-1beta in febrile seizures[J].Brain Dev,2009,31(5):388-393.
[13]Liedtke AJ,Crews BC,Daniel CM,et al.Cyclooxygenase-1-selective inhibitors based on the (E)-2′-des-methyl-sulindac sulfide scaffold[J].J Med Chem,2012,55(5):2287-2300.
[14]刘华钢,阳洁,杨斌,等.环氧化酶与发热[J].时珍国医国药,2006,17(10):1933-1935.
[15]Chandrasekharan NV,Dai H,Roos KL,et al.COX-3,a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs:cloning,structure,and expression[J].Proc Natl Acad Sci USA,2002,99(21):13926-13931.
[16] Engstrom Ruud L,Wilhelms DB,Eskilsson A,et al.Acetaminophen reduces lipopolysaccharide-induced fever by inhibiting cyclooxygenase-2[J].Neuropharmacology,2013,71:124-129.
[17]Simmons DL,D Wagner,and K Westover.Nonsteroidal antiinflammatory drugs,acetaminophen,cyclooxygenase 2,and fever[J].Clin Infect Dis,2000,31 Suppl 5:p.S211-218.
[18]樊亚巍.中医药治疗外感发热疗效分析[J].中国中医急症,2005,14(6):507-508.
Effects of Waigan Qingre Jiedu Decoction on Serum Inflammatory Factors and Protein Expression of COX-1 and COX-2 in Hypothalamus in Fever Rats
PING Jian,CHENG Yang,MAI Jingyin,et al.Infectious Disease Hospital of Pudong,Shanghai 201299,China.
R285.5 文献标志码:A
1004-745X(2016)08-1496-04
10.3969/j.issn.1004-745X.2016.08.012
上海市中医药事业三年行动计划项目(ZY3-JSFC-1-1011);上海市中医药领军人才建设项目学术共同体项目 (ZY3-RCPY-1-1001);上海市浦东新区中医药事业发展专项资金项目(PDYNZJ2014-08);陈建杰上海市名中医工作室项目(ZYSNXD-CC-MZY003)
(电子邮箱:drchengyang@126.com)
2016-04-11)
