兔蛛网膜下腔出血后基底动脉平滑肌细胞的分离方法研究*
2016-09-16郑丽蓉施贤清
郑丽蓉,施贤清
(1.贵阳医学院研究生学院,贵阳 550004;2.贵州省人民医院重症医学科,贵阳 550002)
兔蛛网膜下腔出血后基底动脉平滑肌细胞的分离方法研究*
郑丽蓉1,施贤清2△
(1.贵阳医学院研究生学院,贵阳 550004;2.贵州省人民医院重症医学科,贵阳 550002)
目的建立一种快速、有效的分离兔蛛网膜下腔出血(SAH)后基底动脉平滑肌细胞(BASMCs)的方法。方法采用木瓜蛋白酶、二硫赤藓糖醇(DTE)、胶原酶(Ⅺ型)两步法急性分离兔SAH后BASMCs。利用倒置显微镜观察细胞数量及形态,台盼蓝法测定BASMCs成活率。结果分离出BASMCs的数量(40.33±10.18)个/200倍视野,镜下观察绝大多数平滑肌细胞呈长梭形,包膜完整光滑,细胞成活率为80%。结论该方法能快速、有效地分离BASMCs,并获得足够数量的细胞,为SAH后脑血管痉挛(CVS)BASMCs上离子通道的膜片钳研究创建了条件。
兔;蛛网膜下腔出血;基底动脉平滑肌细胞;分离方法
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)后脑血管痉挛(cerebral vasospasm,CVS)的发病率高达30%~90%,是导致患者高伤残率和高病死率的主要原因之一[1]。随着电生理技术的发展,膜片钳逐渐运用于CVS发生机制中离子通道的研究,而获取单个理想的基底动脉平滑肌细胞(basilar artery smooth muscle cells,BASMCs)对单细胞膜片钳研究极为重要[2-5]。本实验观察木瓜蛋白酶、二硫赤藓糖醇(DTE)、胶原酶(Ⅺ型)两步酶消化法能否快速有效地分离BASMCs,从而为单细胞膜片钳研究创造条件。
1 材料与方法
1.1材料
1.1.1实验动物新西兰大白兔,体质量2.5~3.0 kg,雌雄不拘,由四川大学华西基础医学院动物中心提供。
1.1.2主要实验仪器倒置显微镜(OLYMPUS,型号IX70);解剖显微镜(Olympus,型号SZX7);恒温水浴箱(ATAGO,型号60-C4);电子天平(流阳龙腾电子称量仪器有限公司,型号ESJ120-4)。
1.1.3实验试剂和配置方法木瓜蛋白酶、DTE、胶原酶(Ⅺ型)均购自SIGMA。生理盐溶液(PSS液)成分:NaCl 140 mmol/L,KCl 5.0 mmol/L,MgCl21.3 mmol/L,Hepes 10 mmol/L,Glucose 10 mmol/L,用NaOH调溶液pH为7.4。灌流液成分:NaCl 125 mmol/L,BaCl210 mmol/L,Hepes 10 mmol/L,Glucose 10 mmol/L,TEA-Cl 4 mmol/L,MgCl21 mmol/L,用NaOH 调溶液pH为7.3。酶溶液Ⅰ:1 mL PSS液中加入0.3 mg/mL木瓜蛋白酶和1 mg/mL DTE。酶溶液Ⅱ:1 mL PSS液中加入1 mg/mL胶原酶(Ⅺ型)。PSS、灌流液配置后4 ℃保存备用,酶溶液Ⅰ、酶溶液Ⅱ配置后-20 ℃保存备用。
1.2方法
1.2.1SAH模型制作通过枕大池注入非抗凝自体动脉血复制SAH模型[6],具体步骤如下:麻醉后马上使兔俯卧头低位固定在动物实验台上,用头皮针经枕骨下间隙轻轻刺入,有突破感后见清亮脑脊液流出,然后取耳中动脉非抗凝血按1 mL/kg注入,局部按压1 min,注射完后取30°头低位30 min,然后侧卧位观察,待自然苏醒抬头后放入兔笼,完全苏醒后送回动物饲养室观察,给予正常喂养。
1.2.2取材[7-8]正常喂养48 h后,3%戊巴比妥钠麻醉后迅速断头取出脑组织,放在4 ℃、在充予95%O2/5%CO2混合气体的PSS液中分离基底动脉,并在解剖显微镜下剪去小的血管分支和清除其周围组织,纵向切开血管,清洗掉血红蛋白,刮除血管内皮,将血管剪成细块状。
1.2.3BASMCs的分离按下列步骤进行酶消化:先将基底动脉移入酶溶液Ⅰ中并放在37 ℃恒温水浴箱中消化20 min,移去酶溶液Ⅰ,加入酶溶液Ⅱ并放在37 ℃恒温水浴箱中继续消化30 min,然后终止消化,用4 ℃的PSS液冲洗3次,最后用尖端钝的吸管反复吹打直到有足够数量的单个血管平滑肌细胞释放出来。分离好的细胞悬液置4 ℃冰箱保存。
1.2.4细胞数量、形态学观察及细胞成活率检测吸取适量BASMCs溶液在倒置显微镜下观察平滑肌细胞形态。吸取0.4 mL BASMCs溶液,加入0.1 mL 0.4%台盼蓝染液,吹打混匀,室温下染色3~5 min,吸取适量在显微镜下观察细胞计数。计算细胞存活率:存活率=(细胞总数-死细胞数)/细胞总数×100%。
2 结 果
2.1SAH模型注血后,兔出现烦躁,呼吸、心率加快,麻醉苏醒后精神萎靡、嗜睡,饮水及进食减少,体质量减轻。断头开颅取脑组织,见兔后颅窝各脑池内残留大小不等的暗红色血凝块,以基底池较重,周围蛛网膜部分粘连,见图1。
2.2细胞数量、形态观察及细胞成活率检测分离出BASMCs数量(40.33±10.18)个/200倍视野,在倒置相差显微镜下绝大多数呈长梭形或椭圆形,长梭形的平滑肌细胞数量最多,胞膜完整、光滑、折光度高、胞质均匀,见图2。健康的正常细胞能够排斥台盼蓝,而死亡的细胞膜的完整性丧失,通透性增加,可被台盼蓝染成蓝色。显微镜下计数300个平滑肌细胞,80%以上的细胞胞质未被染色,细胞存活率80%以上,见图3。
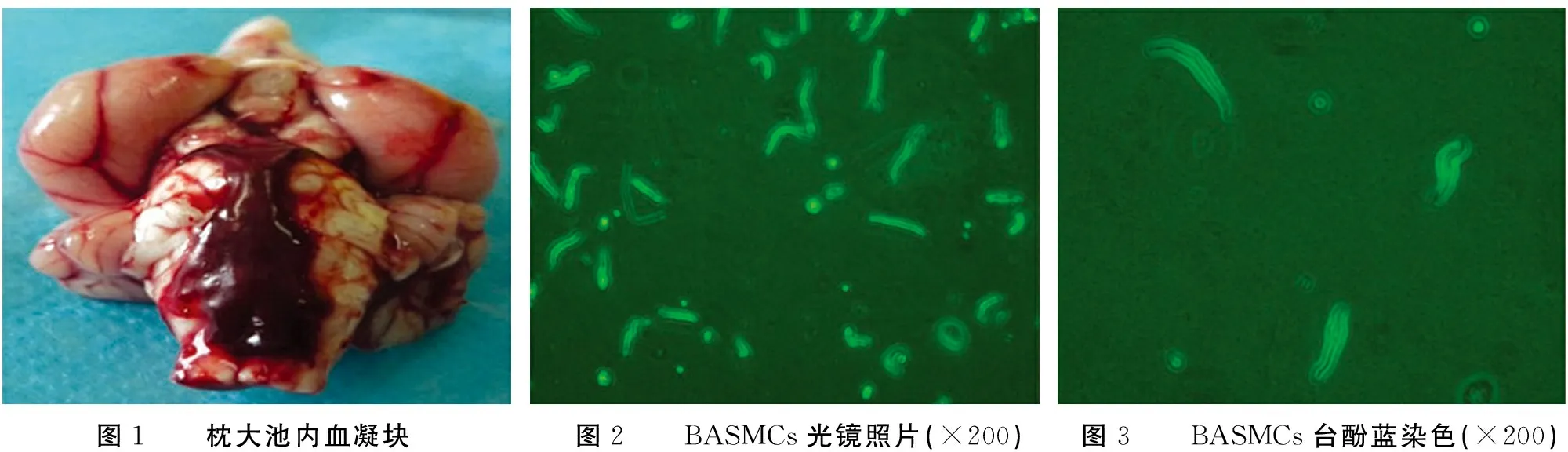
图1 枕大池内血凝块图2 BASMCs光镜照片(×200)图3 BASMCs台酚蓝染色(×200)
3 讨 论
实体组织材料的细胞分离常用方法有机械分散法、酶消化分离法和细胞培养。机械分散法仅适用于处理纤维成分少的软组织,此法虽然简便、快速,但对组织机械损伤大,而且细胞分散效果差。由于兔基底动脉纤维成分相对较多,管径细小,单纯的机械分散法不足以高效的分离BASMCs。而细胞培养耗时长,受生长过程中的多因素影响,较难满足膜片钳的需要[9-11]。本实验采用木瓜蛋白酶、DTE、胶原酶(Ⅺ型)两步酶消化,胶原酶(Ⅸ型)适用于消化纤维多的组织,分离效果较好,即使有钙、镁离子存在仍有活性,故可用PSS和含血清的培养液配制,即操作简便又可提高细胞成活率。通常,传统的单一胶原酶消化法存在着明显的不足,组织经过胶原酶处理后会释放出大量的胶原蛋白,胶原蛋白呈絮状,使上清很难分离开,妨碍细胞从组织中释放出来,而木瓜蛋白酶是一种半胱氨酸蛋白酶,将肌纤维组织中连接的细胞外基质解离,使细胞更容易游离出组织。
影响分离细胞成功率的关键因素包括消化酶的种类及浓度、消化的时间、环境的温度、pH、血管的来源和实验动物的种属及状态等诸多因素。在消化过程中,酶消化时间太短时,组织没有被分解,细胞分离数目不多;而消化时间过长,易损伤膜表面的蛋白质,使细胞产生破损,所有消化酶的用量和时间较难掌握,很难判断消化的程度是否达到需要,需探索最适宜酶浓度及酶解时间,并保证酶的最佳活性温度及最适pH值[4-5,8,12]。本实验联合使用胶原酶(Ⅸ型)和木瓜蛋白酶,并在酶解液中加入DTE,用以保护细胞,经多次探索发现在含木瓜蛋白酶0.3 mg/mL 37 ℃水浴消化20 min、胶原酶(Ⅺ型)1 mg/mL 37 ℃水浴消化30 min,酶解液pH 7.3,能防止酶解过度或不全的情况发生。
操作过程注意事项[2,9,12-15]:由于基底动脉平滑肌对各种机械和理化刺激十分敏感,故在分离血管的过程中动作一定要轻柔,避免机械牵拉血管,可在解剖显微镜下取材。分离血管和细胞的液体最好新鲜配制,或配好后分装,放置在-20 ℃冰箱内保存,使用前再调一次pH值,以确保pH值在7.2~7.4。在分离血管的整个过程中将脑组织置于4 ℃的PSS溶液中,可降低整个脑组织的代谢,从而保护血管组织活性。另外,在分离过程中溶液始终要充氧,对细胞有保护作用。本实验所采取的急性酶解法能成功得到单个的BASMC,数量满意,自血管分离到消化成单个细胞的整个过程大约只需60 min,而且消化后所得到的单个血管平滑肌细胞状态良好,存活率高,为SAH后CVS的BASMCs上离子通道的电研究提供了理想的单个平滑肌细胞。
[1]Crowley RW,Medel R,Kassell NF,et al.New insights into the causes and therapy of cerebral vasospasm following subarachnoid hemorrhage[J].Drug Dis Today,2008,13(5/6):254-260.
[2]李洁,王睿,武冬梅,等.大鼠冠状动脉平滑肌细胞离子通道研究中的急性酶分离技术[J].中西医结合心脑血管病杂志,2009,31(12):1441-1443.
[3]韩莲花,郑冬冬,林佳,等.大鼠冠状动脉平滑肌细胞急性分离以及在离子通道研究中的应用[J].
实用医学杂志,2010,21(16):2916-2918.
[4]程俊,曾晓荣,李鹏云,等.三种实用而简单的急性酶分离动脉平滑肌细胞的方法[J].四川生理科学杂志,2010,15(4):148-150.
[5]陈蕊,刘培晶,严金川.大鼠肺动脉平滑肌细胞的分离及钾电流的记录[J].江苏医药,2014,30(1):7-9.
[6]Jahromi BS,Aihara Y,Ai J,et al.Temporal profile of potassium channel dysfunction in cerebrovascular smooth muscle after experimental subarachnoid haemorrhage[J].Neur Lett,2008,440(1):81-86.
[7]Ko EA,Han J,Jung ID,et al.Physiological roles of K+channels in vascular smooth muscle cells[J].J Smooth Muscle Res,2008,44(2):65-81.
[8]Aihara Y,Jahromi BS,Yassari R,et al.Molecular profile of vascular ion channels after experimental subarachnoid hemorrhage[J].J Cereb Blood Flow Metab,2004,24(1):75-83.
[9]郭悦劼.大鼠颅内外动脉血管平滑肌细胞的体外培养与鉴定[D].大连:大连医科大学,2011.
[10]李世,侯雪芹,陈云波,等.乳鼠脑血管平滑肌细胞的分离培养与鉴定[J].中华老年心脑血管病杂志,2014,36(12):1316-1318.
[11]郑辉,薛松,连锋,等.兔血管平滑肌细胞体外培养及生长特性研究[J].上海交通大学学报(医学版),2010,34(9):1095-1100.
[12]林佳,韩莲花,郑冬冬,等.大鼠冠状动脉平滑肌细胞的分离及电压依赖性钾通道电流特性的初步研究[J].中国心脏起搏与心电生理杂志,2013,27(1):56-59.
[13]赵岩,吴中海,赵桂玲.大鼠肠系膜细动脉血管平滑肌细胞的分离及其生理特性[J].南方医科大学学报,2006,26(7):954-958.
[14]牛朝诗,罗其中,徐纪文,等.脑血管平滑肌细胞分离培养与鉴定[J].中国临床神经科学,2000,8(3):228-230.
[15]李宪伟,姜维良.酶消化法分离培养大鼠血管平滑肌细胞方法的改良[J].哈尔滨医科大学学报,2011,29(1):58-60,63.
Isolation of smooth muscle cells from rabbit basilar artery after subarachnoid hemorrhage*
Zheng Lirong1,Shi Xianqing2△
(1.Graduate School,Guiyang Medical University,Guiyang,Guizhou 550004,China;2.Department of Intensive Care Unit,GuiZhouProvincial People′s Hospital,Guiyang,Guizhou 550002,China)
ObjectiveTo establish a fast and efficient method to isolate basilar artery smooth muscle cells (BASMCs) form rabbit after subarachnoid hemorrhage (SAH).MethodsSingle BASMCs were obtained by sequential two-step enzyme digestion with papain,DTE and collagenase type Ⅺ.The cell count and cellular morphology were observed by inverted microscope.The survival ratio was measured by trypan blue method.ResultsThe number of isolated smooth muscle cells was 40.33±10.18 per 200 times of field of vision.Under the microscope,most smooth muscle cells showed a long spindle shape,the film was smooth,and the survival rate was 80%.ConclusionThe method can separate BASMCs rapidly and effectively,and obtain a sufficient number of cells,it may be provide enough cells for the research of ion channels on BASMCs with cerebral vasospasm (CVS) after SAH.
rabbit;subarachnoid hemorrhage;basilar artery smooth muscle cells;isolation method
贵州省科学技术基金项目(黔科合J字[2010]2155号)。作者简介:郑丽蓉(1988-),住院医师,硕士,主要从事脑保护研究。△
,E-mail:364888849@qq.com。
·技术与方法·10.3969/j.issn.1671-8348.2016.22.028
R743.35
A
1671-8348(2016)22-3107-02
2016-02-12
2016-03-15)
