国产胶原酶在小鼠胰岛分离中的效果研究
2019-11-07宋佳文徐福远蒋煊吴国娣蒋必颖傅红兴
宋佳文,徐福远,蒋煊,吴国娣,蒋必颖,傅红兴
(1.丽水市人民医院 药学部,浙江 丽水 323000;2.温州医科大学 药学院,浙江 温州 325035)
胰岛移植是目前微创并能达到患者血糖精确控制的外科治疗方法,近几年来在同种异体和异种胰岛移植领域都取得了长足的进展[1-3]。分离得到大量高纯度和高活性的胰岛是胰岛移植的首要工作,其中胶原酶在胰腺消化和胰岛分离中起着重要作用。目前国内胰岛分离的胶原酶大多为国外进口,产品价格高,到货时间慢,批次间质量很难保证一致,这对国内胰岛移植工作的开展造成了较大的影响[4]。本实验使用一种国产胶原酶,并结合中性蛋白酶,进行了小鼠胰岛分离,对分离得到的胰岛进行了数量、活性和体内移植效果的研究,对比进口Sigma V型胶原酶,摸索出该国产胶原酶在小鼠胰岛分离中使用的条件和分离效果,为后续该胶原酶用于大动物胰岛分离和移植研究提供参考。
1 材料和方法
1.1 实验材料
1.1.1 实验动物:正常Balb/c小鼠,10周龄左右,体重20~23 g,由温州医科大学实验动物中心提供。
1.1.2 试剂材料:胶原酶冻干粗品(批号:JCA160101,规格:1 288 U/mg,上海乔源生物制药有限公司);中性蛋白酶(批号:20180109,规格:2 726 U/mg,上海乔源生物制药有限公司);血糖仪(苏州施莱医疗器械有限公司);Ⅴ型胶原酶、二乙酸荧光素(FDA)、碘化吡啶(PI)、链脲佐菌素(STZ) (Sigma公司,美国);异氟烷(Baxter公司,美国);Ficoll-1077、Ficoll-1119、CMRL 1066(温州市怡康细胞移植技术开发有限公司);倒置荧光显微镜(Eclipse Ti-S,尼康映像仪器销售(中国)有限公司);体视显微镜(SDT-TL2,上海光泉光科仪器有限公司)。
1.2 实验方法
1.2.1 胶原酶溶液的配制:(1)国产胶原酶溶液的配制:根据前期预实验结果,按照实验所用小鼠数量,精密称取胶原酶冻干粗品,用Hank’s液完全溶解,且分别稀释成浓度为1.0、1.5、2.0 mg/mL的胶原酶冻干粗品溶液。(2)含中性蛋白酶的胶原酶溶液的配制:根据前期预实验结果,用Hank’s液完全溶解分别稀释成浓度为1.0 mg/mL胶原酶+1 363 U/mL中性蛋白酶、1.0 mg/mL胶原酶+2 726 U/mL中性蛋白酶的混合胶原酶溶液。(3)对照组Sigma V型胶原酶溶液的配制:用Hank’s液溶解V型胶原酶冻干粉制成1.0 mg/mL的胶原酶液。所有溶液均采用4 ℃保存备用。
1.2.2 小鼠糖尿病模型的建立:造模前正常Balb/c小鼠禁食不禁水12~16 h,测定空腹血糖和称重,腹腔快速注射STZ柠檬酸缓冲溶液(200 mg/kg),72 h后测血糖≥11.0 mmol/L为糖尿病造模成功,模型稳定1周后选取血糖20~30 mmol/L的小鼠行肾被膜下胰岛移植[5]。
1.2.3 胰岛的分离纯化:参考前期研究基础[5-7],简述如下,取小鼠,颈椎脱臼处死后开腹,动脉夹夹闭胆总管至十二指肠入口,用30 G针头逆行胆总管插管,灌注配制好的胶原酶或含中性蛋白酶的胶原酶溶液2 mL,膨胀的胰腺在(37±0.5)℃恒温水浴中振摇消化至乳糜和泥沙状,加冷的Hanks液中止消化;将组织离心洗涤后,用Ficoll-1119和Ficoll 1077液进行不连续密度梯度胰岛纯化。将得到的高纯度胰岛洗涤后用CMRL 1066(含10%胎牛血清和青链霉素)在37 ℃ 5% CO2培养箱中培养。
1.2.4 胰岛计数及当量计算:将胰岛细胞团移至一底部带500 μm格子的培养皿中,显微镜下对每个格中的胰岛细胞团进行计数和直径估算,并换算为直径相当于150 μm的胰岛量,得到胰岛的数量和当量(IEQ)[8]。
1.2.5 胰岛活性检测:以二乙酸荧光素(FDA)和碘化吡啶(PI)溶液双染色鉴定小鼠胰岛细胞团的活性,方法如下。取培养6 h后的胰岛细胞团,加入PI、FDA溶液各8 μL,在倒置荧光显微镜下,以绿色激发光下胰岛中显红色的细胞(死亡细胞)占整个胰岛细胞团的比例,估算胰岛活性大小,50个胰岛细胞团的平均活性数据即为胰岛活性。
1.2.6 糖尿病小鼠肾被膜下胰岛移植:参考本实验室的方法[6],简述如下。取糖尿病Balb/c小鼠,异氟烷持续吸入麻醉后,用眼科剪小心剪开背面右肾部位腹膜,用棉签挤压出肾脏,再用一套有加长头枪头的1 mL注射器将培养6 h后的350~400 IEQ胰岛细胞团缓慢注入至肾被膜下。注入完毕后将肾脏放回并缝合,再用红霉素软膏涂抹伤口;以Sigma胶原酶V分离的胰岛移植做对照。
1.2.7 胰岛移植术后护理:小鼠胰岛移植完成后1周内每天皮下注射头孢唑林钠溶液100 μL,并每天观察小鼠状态,定期在上午9点半左右测量和记录小鼠30日内血糖值。非空腹血糖连续2天≥16.7 mmol/L则视作移植失效[9]。术后14 d,各取移植组小鼠一只,获取含胰岛的肾脏,用4%多聚甲醛液固定24 h后,进行苏木精-伊红染色(HE染色)和胰岛素免疫组化染色(Insulin免疫组化染色),观察移植后胰岛的组织学结果。
1.3 统计学方法
2 结果
2.1 胰岛分离的结果
采用本批次国产胶原酶、含中性蛋白酶的国产胶原酶和Sigma V型胶原酶溶液作为小鼠胰腺的灌注和消化液,均可分离得到外形圆整、大小不一的小鼠胰岛细胞团,如图1所示。各组胶原酶进行胰岛分离过程中的消化时间、获得的胰岛量,以及培养6 h后的胰岛活性结果如表1所示。由表1可知,本批次国产胶原酶在小鼠胰腺消化时间上均比Sigma胶原酶V(浓度1.0 mg/mL)的长;在添加中性蛋白酶后,可使小鼠胰腺消化的时间缩短,但仍长于Sigma胶原酶V(P<0.01);单纯国产胶原酶在胰岛获得量上也少于胶原酶V组(P<0.01);国产胶原酶消化的胰腺组织偶尔有少量组织消化不完全,需要二次消化;2.0 mg/mL胶原酶易使部分胰腺组织过度消化,导致获得的胰岛量最少;加入高浓度中性蛋白酶后,分离得到的胰岛数量有所增加,与进口胶原酶V组分离的胰岛在数量和当量上无统计学差异(P>0.05)。分离的胰岛经体外培养6 h后,FDA-PI染色显示小鼠胰岛平均活性均>80%。
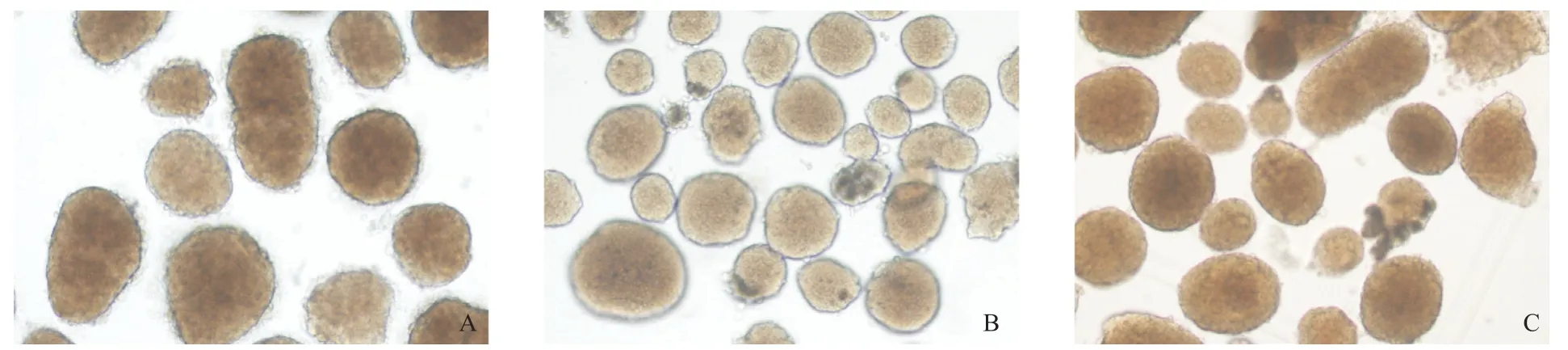
图1 分离得到的小鼠胰岛细胞团(×100)

表1 国产胶原酶和Sigma胶原酶分离的小鼠胰岛细胞团的结果(n=6)
2.2 移植后小鼠的血糖变化结果
本次胰岛移植采用1.0 mg/mL国产胶原酶+2 726 U/mL中性蛋白酶为消化液分离的小鼠胰岛,和进口胶原酶V分离的小鼠胰岛进行同系糖尿病小鼠胰岛肾被膜下胰岛移植。由图2可见,国产胶原酶分离的小鼠胰岛移植后,糖尿病小鼠的血糖可在24 h内降至正常,48 h内部分小鼠的血糖值有波动。移植成功后的小鼠血糖控制稳定,并可长时间维持血糖在正常水平(>30 d),与进口Sigma胶原酶分离的小鼠胰岛肾被膜下移植的结果无统计学差异(P>0.05)。
2.3 移植后胰岛的组织学检查结果
胰岛移植后第14天,取含胰岛的小鼠肾组织,经固定、包埋、切片后,进行HE染色和胰岛素免疫组化染色。由图3结果可知,糖尿病小鼠胰岛移植14 d后,Insulin免疫组化染色显示肾被膜下较多阳性组织,说明该含中性蛋白酶的国产胶原酶组和Sigma胶原酶V组的胰岛细胞团在小鼠肾被膜下形态均较完整,活性良好,胰岛素分泌旺盛。
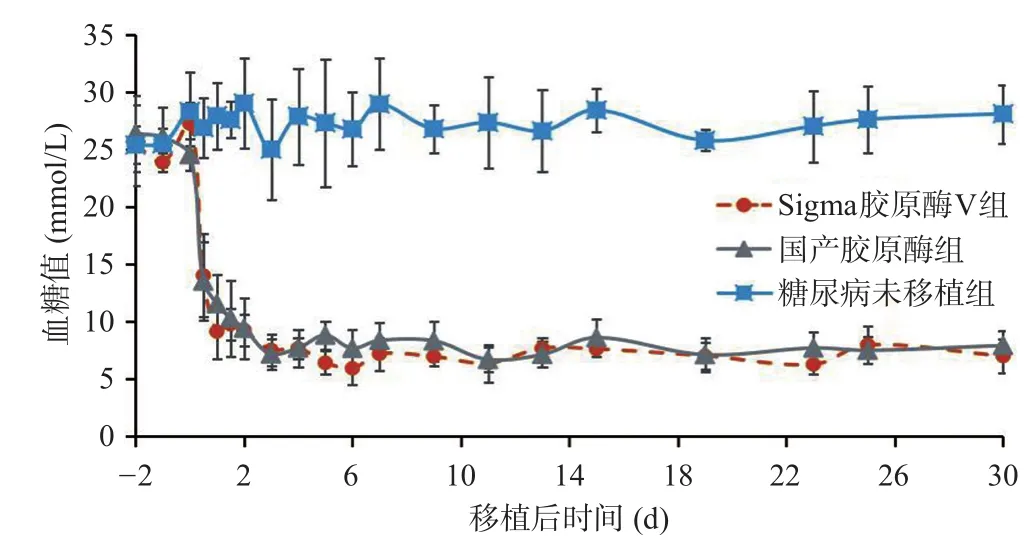
图2 胰岛移植后小鼠的血糖变化结果
3 讨论
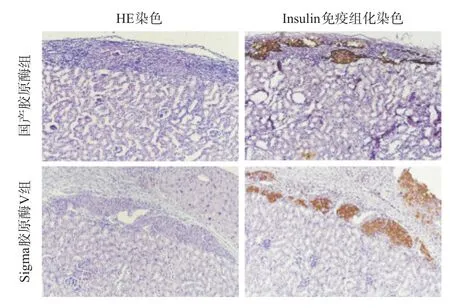
图3 肾被膜下胰岛HE染色(×100)与免疫组化染色(×100)结果
胶原酶是溶组织梭菌的发酵产物,基于底物特异性和氨基酸分析,胶原酶的主要成分包括Col G和Col H,但两种酶成分在胰岛分离中的最佳比例仍存在一些不确定性[10-11]。现已知Sigma胶原酶V的主要成分为Col H[12],本批次的国产胶原酶中Col G/Col H的比例约为1.2(数据未发表),因此在小鼠胰腺组织消化速度上的差异原因可能为主要成分比例的差异。中性蛋白酶也可用于消化组织或器官中的细胞外基质,作用迅速且温和,可保护细胞膜完整[13],本次国产胶原酶中添加中性蛋白酶后,小鼠胰腺消化时间明显缩短,所得胰岛量和细胞活性也有增加。
目前,动物胰岛分离领域主要使用的胶原酶仍是Sigma公司的胶原酶V,但胶原酶的生产和在胰岛分离领域的应用研究进展迅速,如对溶组织梭菌的培养采用人血清白蛋白、植物蛋白,代替原有的牛血清白蛋白[14];将胶原酶主要成分先分离、纯化后再进一步按比例混合,结合中性蛋白酶用于进行人胰岛的分离等,在胰岛分离的数量和完整度上均取得了很好的结果[15]。本实验研究了一种国产胶原酶,并结合中性蛋白酶,获得了数量较多、活性较好的小鼠胰岛细胞团,且体内移植的降血糖结果与Sigma胶原酶V的结果无差异。本研究可为该国产胶原酶的质量提升和替代进口胶原酶用于后续大动物胰岛分离的研究提供参考。
