水稻端粒长度测定及其遗传特性研究
2016-09-15叶聪莹马国兴林高强曹佳薇刘小川
叶聪莹,黄 倩,马国兴,林高强,曹佳薇,刘小川
(浙江理工大学生命科学学院,杭州 310018)
水稻端粒长度测定及其遗传特性研究
叶聪莹,黄倩,马国兴,林高强,曹佳薇,刘小川
(浙江理工大学生命科学学院,杭州 310018)
端粒在保护和维持染色体完整性方面发挥了重要作用,且与细胞衰老、癌变密切相关。由于同一细胞内,不同染色体端粒长度存在差异,研究单个端粒长度的遗传特性对于深入了解端粒的作用,阐明端粒与细胞周期间的关系具有重要意义。本研究利用水稻籼亚种和粳亚种之间平均端粒长度存在明显差异的特点,结合它们的杂种F1、F2代群体,采用改良的单个端粒长度测定技术(STELA),对T02p、T02q、T04q、T09p、T10q、T11p等6个端粒长度进行了分析。结果表明:单个端粒长度与相关染色体长度存在相关性,且具有数量性状遗传特征。更重要是F1代与亲本之间有5个端粒没有显著差异,仅有T04q一个端粒呈现出超显性遗传效应,且超过极显著的水平。因此,推测调控细胞周期的端粒长度并非是整个细胞平均端粒长度,而是某些或极少数关键端粒的长度。
水稻;端粒长度;STELA;遗传
0 引 言
端粒是真核生物染色体末端的特殊结构,由富含GC的DNA重复序列和端粒结合蛋白组成,能维持染色体的稳定性,避免染色体末端融合[1]。不同生物有其特定的端粒长度[2],端粒能与端粒结合蛋白共同作用在染色体末端形成T-loop、D-loop、G-四链体等特殊结构[3-5],发挥保护染色体的作用。
端粒的DNA由两部分组成,单链DNA和双链DNA。双链DNA由几十到几千个碱基组成,单链DNA部分包含几十到上百个碱基,不同生物差异很大[3, 6]。随着细胞的分裂,因DNA末端复制问题,端粒逐渐缩短[7],最终导致细胞衰老和死亡。有些细胞中,端粒酶具有生物活性,能以自身的RNA为模板,在端粒酶逆转录酶催化下延长端粒,克服了端粒DNA缩短的问题[8]。正常组织细胞中,端粒酶活性受到抑制,在一些具有增殖潜能的细胞中,端粒酶有低水平表达。但在癌变的细胞中,端粒酶活性较高[9],因此端粒酶常被作为肿瘤抑制剂的靶标[10]。小鼠的实验表明,端粒酶的缺失将导致端粒平均长度的缩短[11],与细胞的生命周期及生物个体寿命密切相关。端粒酶功能障碍会导致先天性角化不良等退行性疾病[12]。与动物不同,植物中端粒酶的活性较高,能够修复基因损伤,因此保持端粒酶活性对植物非常重要[13]。
在端粒酶的作用下,端粒长度得到了延伸,但是同一个细胞中具有相同细胞周期的染色体端粒长度却有很大差异。显然,端粒长度受到了除端粒酶以外其它因子的影响。研究表明,端粒长度受到端粒酶活性、端粒相关蛋白、端粒模板RNA等因素的共同调控[14]。端粒长度是否受到遗传因素的影响目前并不十分清楚。
与动物相比,植物容易构建遗传群体,且端粒长度较短,适合PCR,因此选择植物进行实验研究更合适。水稻作为模式生物,容易构建遗传群体,且全基因组测序已经完成,方便获取基因组信息进行分析。
到目前为止,测定端粒长度的方法已有多种。端粒限制片段分析(telomere restriction fragment analysis,TRF)最早用于测定端粒平均长度,但是分辨率太低[15]。荧光原位杂交技术(fluorescence in situ hybridization,FISH),包括定量荧光原位杂交技术(quantitative fluorescence in situ hybridization,Q-FISH)和流式-荧光原位杂交技术(flow FISH),通过特异性的荧光标记探针与细胞分裂中期的染色体末端杂交的方式提高了分辨率[16-17]。而单个端粒长度测定技术(single telomere length analysis,STELA)[18]和Q-PCR[19]都是基于特殊的接头扩增端粒重复序列,与其它方法相比操作简单方便,且STELA的精确性比Q-PCR更高。因此在本实验中用了STELA,而且为了克服下游引物在3′悬突的滑动问题,本文对STELA进行了改进[20]。
1 实验材料和方法
1.1实验材料
水稻:从中国水稻研究所获取两个水稻品种,粳稻长粒粳,籼稻粤B,两者的遗传背景和端粒的平均长度都有很大差异。
其它实验材料有:T4 DNA Ligase(350 U/μL,TaKaRa);T4 DNA Ligase Buffer(TaKaRa);10×PCR Buffer(Mg2+plus,TaKaRa);dNTP Mixture(2.5mM,TaKaRa);rTaq酶(5 U/μL,TaKaRa);250bp DNA Ladder Marker(TaKaRa);琼脂糖凝胶(Agrose HRBTM,Biotech);液氮;引物由上海生工生物技术有限公司合成。
1.2仪器
CR22G高速离心机(天美(上海)贸易有限公司);NanoDrop 2000 Spectrophotometer分光光度计(Thermo Fisher Scientific);S1000 PCR仪(BIO-RAD);Powerpac电泳仪(BIO-RAD);Tanon-1600凝胶成像仪(上海天能科技有限公司)。
1.3实验方法
1.3.1水稻遗传群体的构建
取水稻种子,浸种、播种、插秧,开花后,将长粒粳向粤B授粉,成熟后得到F1代。F1代自交,收获一定数量F2代的种子。F2代种子播种后得到植株。
1.3.2水稻基因组提取
取两亲本、F1代、F2代植株幼嫩的叶片,用试剂盒(TaKaRa Mini BEST Universal Genomic DNA Extraction Kit Ver.5.0)提取基因组。配置0.8%的琼脂糖凝胶,电泳检测基因组DNA样品的品质,利用NanoDrop2000测定样品的浓度。
1.3.3接头的制备及连接反应
由于3′悬突的特殊性,无法正常设计端粒下游引物,实验中制备了特殊的接头T0(5′ -ACACTCA GGATTCATC-3′),T1(5′-GATGAATCCTGAG TGTCCCTAAA-3′)。
反应体系(40 μL):10 μL(20 μM)T0;10 μL(20 μM)T1;2 μL 10×接头Buffer(100 mM Tris-acetate (pH = 7.5);100 mM Mg-acetate;500 mM K-acetate);18 μL ddH2O。3000 r/m,离心15 s;94 ℃变性3 min;冷却至室温,静置30 min。重复后两个步骤两次,制得的接头于4 ℃保存。
将制得的接头与水稻端粒末端连接,连接体系(20 μL):2000 ng基因组DNA;3 μL(5 μM)接头;2 μL 10×T4 DNA Ligase Buffer;1 μL T4 DNA Ligase(350 U/μL);加ddH2O补足20 μL。16℃反应2h。65 ℃灭活10 min,加ddH2O将连接产物稀释到200 mL,4 ℃保存。
1.3.4PCR扩增端粒
PCR反应体系:模板DNA 50 ng;2μL10×PCR Buffer(Mg2+Plus);1.6 μL dNTP Mixture(2.5 mM);4μM上游引物(见表1);4μMT1;0.25 μL rTaq(5 U/μL,TaKaRa);加ddH2O到2 0μL。PCR反应程序:95 ℃,3 min;(94 ℃,30 s;52 ℃,40 s;72 ℃,45 s)×36个循环;72 ℃,10 min。

表1 水稻端粒上游特异性引物
注:引物根据亚端粒序列设计。
1.3.5端粒长度测定
PCR产物用琼脂糖凝胶电泳分离分析。配置1.2%的琼脂糖凝胶(Agrose HRBTM,Biotech),0.1%TAE(40 mmol/L Tris碱;20 mmol/L冰醋酸;2 mmol/L EDTA(pH=8)),电泳40 min,在0.1%溴化乙锭中染色30 min,流水中脱色10 min。通过SynGene成像系统进行成像,用Gene Tools分析软件,对PCR产物结果进行定量分析。由于端粒长度的差异,PCR产物呈弥散状,总体呈正态分布。因此,测得的平均分子量就可看作单个端粒的长度。当然,实际的端粒长度还必需减去亚端粒部分的长度,包括上游引物到端粒起始位置的距离、上游引物的长度以及T0的长度。
2 实验结果
端粒能够维持染色体的稳定性,但是在同一细胞中,不同染色体端粒长度不同。早期研究发现端粒长度与染色体的长度相关[21-22],但这并不能很好解释端粒长度差异的问题。为了研究这个问题,需要测定每条染色体上的端粒长度,并对其进行深入分析。
2.1水稻遗传群体构建
利用水稻长期进化过程中形成的籼亚种和粳亚种之间端粒长度显著差异的特点,构建遗传群体,具体选择了粤B(母本)和长粒粳(父本)为亲本材料杂交获得F1代,F1代自交得到F2代,将F2代种子播种70 d后,各植株间株高、发育期、叶片形态等表型出现了明显的差异,说明F2代具有很好的性状分离,构建的F2代自交系能满足本实验的要求。
2.2水稻端粒长度的测定
基于之前的报道,已有多种测端粒长度的方法[15-17, 19],但是只有STELA适用于本实验。此外,为了解决下游引物在3’悬突上滑动的问题,设计了特殊的接头,也使实验结果更精确。在PCR反应中,相较于长片段,短片段更容易被扩增。从实验结果也可以看出,实际测得的端粒长度比理论值短。但是实验得到的数据中,亲本、F1代中单个端粒长度都有相当的变化(如表2),因此PCR反应中存在的问题并不影响实验结果的分析。
2.3水稻端粒长度遗传特性
水稻12对姐妹染色体,有24对姐妹端粒,每条染色体都有特异的近端粒序列,但是在已知的水稻染色体信息中,只有6对姐妹近端粒序列是已知的,
基于此,设计了6条特异性引物,T02p、T02q、T04q、T09p、T10q和T11p(见表1),扩增了6个端粒并测定了长度。实验结果表明,粳稻和籼稻T02p、T02q平均端粒长度无显著差异;T04q、T09p、T10q、T11p的平均端粒长度籼稻要长于粳稻,且差异较为明显(见表2),这与之前报道的结果是一致的[23]。

表2 亲本与F1代6个端粒的单个端粒长度
同一品种中,不同染色体端粒长度相差较大。理论上,同一细胞中端粒酶活性相同、遗传背景一致、细胞周期相同,端粒长度应是相近的,差异很可能是进化过程中染色体长度的不同导致的。为了深入探讨两者的关系,从Rice GenomeAnnotation Project和华大基因的数据库中获取了对应染色体的特性包括染色体的长度、染色体臂的长度、染色体臂上基因的数量等,然后分析了端粒长度与这些特性之间的相关性。分析结果表明,籼稻中染色体的长度与端粒长度的相关系数为-0.438,粳稻中的相关系数为-0.636(见表3、表4),表明端粒长度与染色体长度存在相关性,且呈负相关。这可能与染色体螺旋化有关,需要进一步地研究。

表3 籼稻中染色体单个端粒长度性状与染色体性状相关性分析

表4 粳稻中染色体单个端粒长度性状与染色体性状相关性分析
对比F1代与亲本染色体的平均端粒长度(图1),F1代中T02p、T02q和T09p长度接近两亲本,表现为加性效应;T10q、T11p的长度比两亲本都长且更接近亲本中端粒长度较长者,表现为显性效应;T04q的长度比两亲本都长,表现为超显性效应。
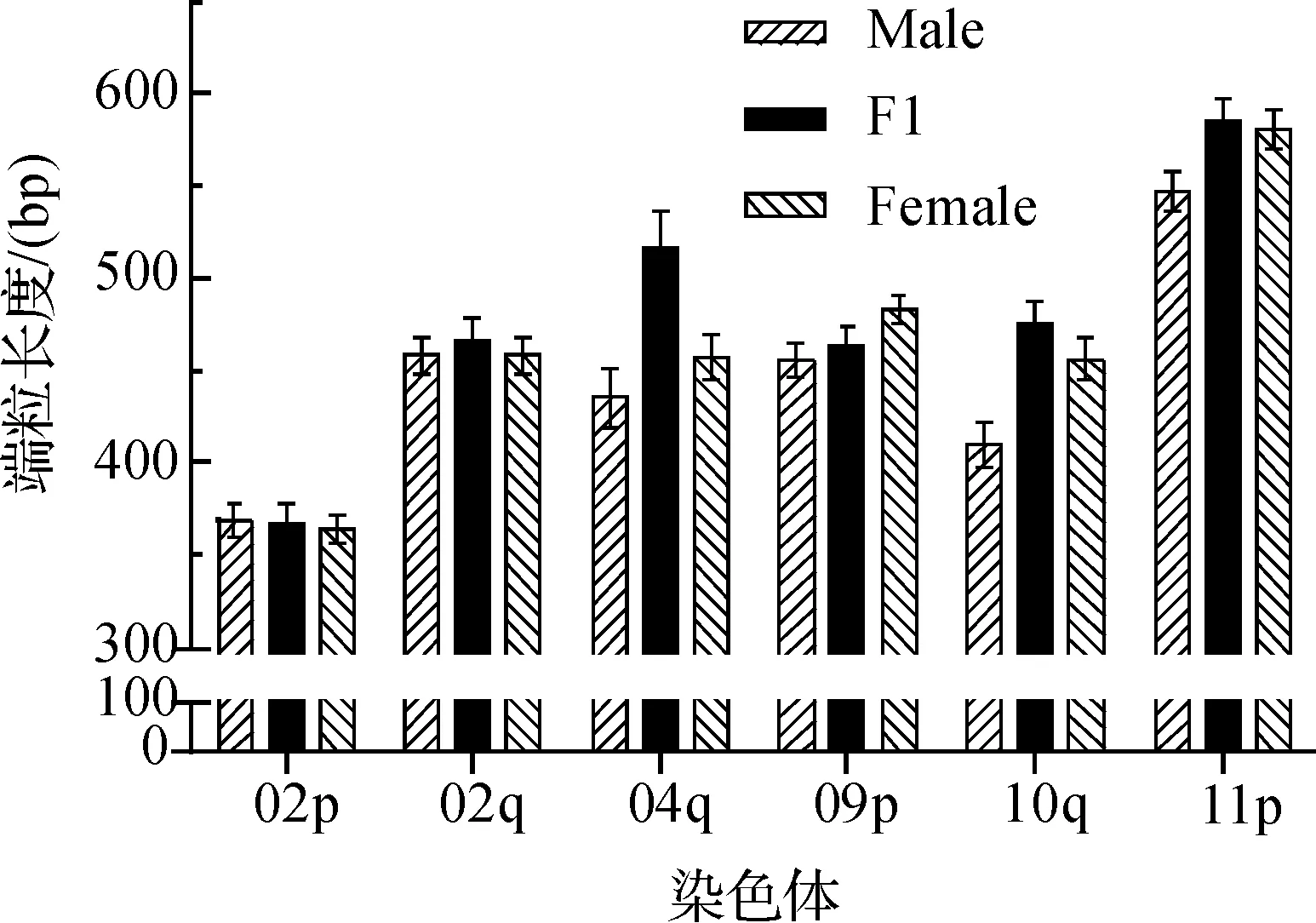
Male:父本,F1:F1代,Female:母本图1 亲本与F1代单个端粒长度比较
F1代6个端粒长度中,T04q的长度变化最显著,因此详细分析了T04q端粒的遗传特性(如图2)。由图2可知,F1代的平均端粒长度比父本即粳稻品种长34bp,比母本籼稻品种长12bp。F2代70个个体T04q的平均端粒长度表现出明显的性状分离,且呈连续分布(如图3),说明水稻端粒长度遗传上表现为一定的数量性状特性,且F2代平均长度远小于F1代,这可能与姐妹染色体端粒之间的长度改变有关,有待进一步研究。

M:父本,F1:F1代,F:母本,F2:F2代图2 亲本、F1代、F2代T04q端粒长度对比
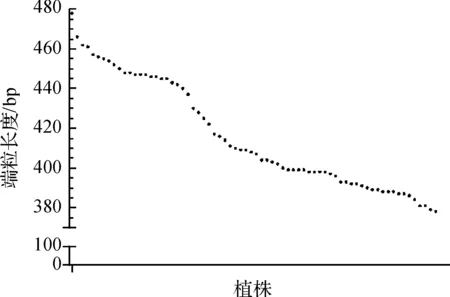
图3 F2代70个个体T04q端粒长度
3 讨 论
细胞中端粒长度的差异是一个很复杂的问题,端粒酶的活性、染色体及其长度、细胞周期等多方面原因共同导致了差异的产生。本实验用改良的STELA测定单个端粒的长度,对比分析了亲本、F1代、F2代端粒长度的关系,研究了染色体长度、染色体两臂长度与端粒长度的相关性,得到以下结果:
a)水稻染色体端粒长度分析表明,T02p、T02q两个端粒平均长度在两亲本中无显著差异,而T04q、T09p、T10q、T11p的平均端粒长度粤B长于长粒粳,说明籼稻的平均端粒长度比粳稻长。
b)分析染色体信息与端粒长度的关系可知,与染色体的其他特性相比,染色体的长度与端粒长度呈负相关,且端粒长度表现为一定的数量性状遗传特性。
c)对比亲本、F1代平均端粒长度,发现F1代与亲本中5个端粒长度没有明显的差异,仅表现为加性效应或显性效应,但是T04q F1代的端粒长度远大于亲本,表现为超显性效应。因此推测,染色体端粒长度还受到了某些遗传因素的调控。
综合以上分析,研究认为在水稻细胞中,某些关键端粒的长度影响了整个细胞周期。此外,本实验中T04q的端粒长度在F2代呈连续分布且有明显的性状分离,这为分析定位与水稻端粒长度相关基因打下了坚实的基础,也对进一步分析水稻端粒长度遗传规律及相关基因定位研究具有重要意义。
[1] ZHENRONG Z, XINGHUA P, LIN L, et al. Telomere length maintenance, shortening, and lengthening[J]. Journal of Cellular Physiology,2014,229(10):1323-1329.
[2] PALM W, DE LT. How shelterin protects mammalian telomeres[J]. Annual Review of Genetics, 2008, 42 (1): 301-334.
[3] GRIFFITH J D, COMEAU L, ROSENFIELD S, et al. Mammalian telomeres end in a large duplex loop[J]. Cell,1999,97(4):503-514.
[4] YAN X, SATO H, SHINOHARA K I, et al. T-loop formation by human telomeric G-quadruplex[J]. Nucleic Acids Symposium, 2007,51(51):243-244.
[5] LANGE T D. T-loops and the origin of telomeres[J]. Nature Reviews Molecular Cell Biology, 2004, 5 (4): 323-329.
[6] BIESSMANN H, MASON J M. Telomeric repeat sequences[J]. Chromosoma,1994,103(3):154-161.
[7] MALYAVKO A N, PARFENOVA Y Y, ZVEREVA M I, et al. Telomere length regulation in budding yeasts[J]. FEBS Letters,2014,588(15):2530-2536.
[8] NAKAMURA T M, MORIN G B, CHAPMAN K B, et al. Telomerase catalytic subunit homologs from fission yeast and human[J]. Science,1997,277(5328):955-959.
[9] SARETZKI G. Extra-telomeric functions of human telomerase: cancer, mitochondria and oxidative stress[J]. Political Communication,2014,20(41):6386-6403.
[10]HARLEY CB. Telomerase and cancer therapeutics[J]. Nature Reviews Cancer,2008,8(3):167-179.
[11] STRONG M A, VIDAL-CARDENAS S L, KARIM B, et al. Phenotypes in mTERT+/-and mTERT-/-mice are due to short telomeres, not telomere-independent functions of TERT [J]. Molecular and Cellular Biology,2011,31(12):2369-2379.
[12] HEISS N S, KNIGHT S W, VULLIAMY T J, et al. X-linked dyskeratosis congenita is caused by mutations in a highly conserved gene with putative nucleolar functions[J]. Nature Genetics,1998,19(1):32-38.
[13] AMIARD S, DA I O, GALLEGO M E, et al. Responses to telomere erosion in plants[J]. PloS One, 2014, 9(1):e86220.
[14] XU D, WANG Q, GRUBER A, et al. Downregulation of telomerase reverse transcriptase mRNA expression by wild type p53 in human tumor cells[J]. Oncogene,2000,19(45):5123-5133.
[15] HARLEY C B, FUTCHER A B, GREIDER C W. Telomeres shorten during ageing of human fibroblasts[J]. Nature,1990,345(6274):458-460.
[16] POON S S S, LANSDORP P M. Measurements of telomere length on individual chromosomes by image cytometry[J]. Methods in Cell Biology,2001,64(64):69-96.
[17] BAERLOCHER G M, VULTO I, JONG G D, et al. Flow cytometry and FISH to measure the average length of telomeres (flow FISH)[J]. Nature Protocol,2006,1(5):2365-2376.
[18] BAIRD D M, ROWSON J, WYNFORD-THOMAS D, et al. Extensive allelic variation and ultrashort telomeres in senescent human cells[J]. Nature Genetics,2003,33(2):203-207.
[19] CAWTHON R M. Telomere measurement by quantitative PCR[J]. Nucleic Acids Research, 2002, 30(10): e47-e47.
[20] 马国兴,马登旭,杨力媛,等.水稻单个端粒长度定量测定及分析[J].浙江理工大学学报,2013,30(4): 585-589.
[21] WISE J L, CROUT R J, MCNEIL D W, et al. Human Telomere Length Correlates to the Size of the Associated Chromosome Arm[J]. PloS One,2009,4(6):e6013.
[22] TAKESHI S, ASAO F, MITSUHIRO T, et al. Interchromosomal telomere length variation[J]. Biochemical and Biophysical Research Communications,2002,291(2):210-214.
[23] OHMIDO N, KIJIMA K, AKIYAMA Y, et al. Quantification of total genomic DNA and selected repetitive sequences reveals concurrent changes in different DNA families in indica and japonica rice[J]. Molecular & General Genetics Mgg,2000,263(3):388-394.
(责任编辑: 许惠儿)
Measurement of Telomeric Length and Hereditary Character of Oryza Sativa
YECongying,HUANGQian,MAGuoxing,LINGaoqiang,CAOJiawei,LIUXiaochuan
(College of Life Science, Zhejiang Sci-Tech University, Hangzhou 310018, China)
Telomere performs an important function of protecting and maintaining chromosome integrity and is closely related to cell senescence and cancerization. Since there are differences in lengths of different chromosome telomere within a cell, to study the hereditary character of the length of a single telomere in cells could help to further understand telomere functions and illuminates the relation between the telomere and cell cycle. In this study, according to the significantly different average telomere lengths of rice indica and japonica subspecies, in combination with hybrid F1 and F2 generation groups, analyses on the telomere lengths of T02p, T02q, T04q, T09p, T10q and T11p were carried by using the improved single telomere length analysis (STELA). The results show that the single telomere length is correlated to the relevant chromosome length and is characterized by quantitative character inheritance. What’s more, between F1 hybrid and the parents, there was no significant difference in 5 telomeres except T04q, which shows over-dominance inheritance and highly significantly exceeds t he level. Therefore, it is presumed that the telomere length of cell cycle is not the average telomere length of the whole cell but the length of some or very few telomeres are regulated.
rice; telomere length; STELA; inheritance
10.3969/j.issn.1673-3851.2016.05.024
2015-12-04
叶聪莹(1991-),女,浙江绍兴人,硕士研究生,主要从事水稻端粒方面的研究。
刘小川,E-mail:xcliu@zstu.edu.cn
Q943
A
1673- 3851 (2016) 03- 0463- 06 引用页码: 050706
