GP73联合其他肿瘤标志物检测对 AFP阴性原发性肝细胞癌临床诊断价值
2016-09-15黄祥磊
李 慧,黄祥磊,刘 妍
(徐州市中心医院检验科,江苏 徐州 221009)
GP73联合其他肿瘤标志物检测对AFP阴性原发性肝细胞癌临床诊断价值
李 慧,黄祥磊,刘 妍
(徐州市中心医院检验科,江苏徐州221009)
目的 早期原发性肝细胞癌患者中80%患者的AFP肿瘤标志物检测结果为阴性,本研究探讨对于AFP阴性的原发性肝细胞癌患者采用联合检查血清高尔基体糖蛋白73(GP73)、扁豆凝集素结合型甲胎蛋白异质体(AFP-L3)、磷脂酰肌醇蛋白聚糖3(GPC3)、脱-γ-羧基凝血酶原(DCP)、CA19-9、铁蛋白(FER)以及癌胚抗原(CEA)的临床意义。方法 选取50例原发性肝细胞癌患者(A组)、60例消化系统异常的非原发性肝细胞癌患者(B组)和40例健康人群(C组)纳入本研究。采用酶联免疫分析方法测定血清中GP73、GPC3和DCP含量,采用微量离心柱分离血清AFP-L3,采用电化学发光免疫分析检测血清CA19-9、FER、CEA、AFP-L3以及总AFP,计算AFP-L3所占比例(AFP-L3/总AFP)。结果 三组中除FER以外的各项指标差异均极显著(P<0.01),原发性肝细胞癌组患者的7种肿瘤标志物的阳性率均显著高于其他两组(P<0.01),各单项检测中,GP73的灵敏度、准确度以及ROC曲线面积最大,分别为72.0%、86.7%和0.826,GPC3的检测特异性最高为98.0%。结合7种肿瘤标志物检测的临床敏感性、特异性、准确性和ROC曲线面积分别为82.0%、95. 0%、90.1%和0.884。结论 GP73和AFP-L3是AFP阴性原发性肝细胞癌患者临床诊断的首选肿瘤标志物,临床上采用多种肿瘤标志物检测能显著提高诊断准确率。
原发性肝细胞癌; 肿瘤标志物; 联合检测; 临床诊断
DOI:10.11748/bjmy.issn.1006-1703.2016.04.012
收稿日期:2015-10-20;修回日期:2015-11-23
原发性肝细胞癌(primary hepatocellular carcinoma,PHC)的发病率在常见癌症中排第五,在全球癌症导致死亡的各种疾病中死亡率排第三,并且其发病率在世界不同地区都呈现出增加的趋势[1-2]。早期诊断是治疗的关键在临床上已形成其诊治的基本共识。甲胎蛋白(alpha feto protein,AFP)是肝癌诊断最实用的血清标志物,然而,由于其检测的灵敏性和特异性较低,导致临床诊断的准确率不能令人满意,特别是对于肿瘤病灶较小的患者[3-4]。近些年来,研究表明高尔基体糖蛋白73(golgi glycoprotein 73,GP73)、扁豆凝集素结合型甲胎蛋白异质体(AFPL3)、磷脂酰肌醇蛋白聚糖3(GPC3)、脱-γ-羧基凝血酶原(DCP)是原发性肝细胞癌患者早期诊断的潜在癌症生物标志物[5-6]。原发性肝细胞癌患者血清GP73显著升高,可能超越AFP成为该疾病早期诊断的标志物[7]。然而,有报道显示与AFP相比,GP73作为肿瘤标志物在原发性肝细胞癌临床检测的敏感性和特异性方面差异并不显著[8]。AFP-L3仅存在于肝癌细胞中,先前的研究表明采用AFP-L3进行原发性肝细胞癌诊断时,敏感性和特异性分别为72.3%和97.2%[9],AFP-L3可以作为临床疾病恶性程度、临床治疗效果以及疾病发展进行判断的生物标志物,尤其是疾病早期、AFP含量低以及肿瘤病灶较小的原发性肝细胞癌患者[10]。DCP和GPC3在肝癌的早期诊断和肝内转移和预后的诊断方面具有明确意义,但其效果并不优于AFP[11]。显然,上述各种血清标志物在原发性肝细胞癌的诊断中,都存在各种不同的局限性。本研究探讨对于AFP阴性的原发性肝细胞癌患者采用联合检查血清GP73、AFP-L3、GPC3、DCP、CA19-9、FER以及CEA的临床意义。
材料和方法
1 一般资料
本研究共采集150份样品(来自我院消化内科2010年03月至2015年08月就诊患者或体检人员),其中原发性肝细胞癌患者50例(A组),消化系统异常的非原发性肝细胞癌患者60例(B组)和健康人群40例(C组),A组中男性36例,女性14例,年龄在32至81岁,平均年龄为56.0±5.2岁,诊断结果均为单一病灶,且直径≤3cm,未表现出血管侵入或转移,AFP水平均低于8.98μg/L(即AFP阴性)。B组中男性40例,女性20例,年龄在36至81岁,平均年龄为57.0±5.0岁,其中肝炎患者20例,慢性间质性肝炎患者20例,消化系统恶性肿瘤(非肝癌)患者20例。此外,C组中男性22例,女性18例,年龄在35至80岁,平均年龄为54.0±5.1岁,均采用通用的生物化学或免疫学方法检测排除肝炎、肝硬化、肝或胆囊囊肿、良性和恶性肿瘤或者其他临床疾病。三组在性别、年龄等方面差异不显著(P>0.05)。
2 主要仪器与试剂
本研究均采用CODA公司的全自动酶标分析仪和罗氏公司的2010型电化学发光分析仪进行检测,GP73、GPC3和DCP的ELISA试剂盒购自上海瑞奇科技有限公司,CA19-9、FER、CEA和AFP检测试剂盒购自罗氏公司,AFP-L3分离纯化试剂盒购自北京热景生物技术有限公司。
3 样本采集及检测
采用由血液采集管采集的3组空腹静脉血,4000r/min离心20min,分离血清,置于-80℃备用。根据试剂盒的操作说明采用ELISA方法检测3组GP73、GPC3和DCP,采用微量离心柱分离AFP-L3、CA19-9、FER、CEA、AFP-L3以及总AFP,采用电化学发光免疫分析进行定量检测,计算AFP-L3所占比例(AFP-L3/总 AFP)。通过 ROC曲线,分析各种标志物的95%置信区间的曲线下面积(AUC)和临界值,通过单一和联合检测进行原发性肝细胞癌的诊断。根据最大敏感性值加特异性值计算临界值。
4 诊断结果验证
根据以下方法对诊断结果进行验证:根据各种肿瘤标志物的检测水平对各组检测者进行排序,10例患者为1组。每次每种肿瘤标志物随机抽取3例作为样本,即抽去30%的样本进行验证,其余70%样本进行ROC曲线分析。对每一个生物标志物或组合的样本随机重复抽取5次;所有数据采用x±s进行敏感性、特异性分析。
5 统计学处理
本研究所有数据均采用SPSS13.0软件进行分析,采集的数据符合偏态分布,故采用四分位数表示,组间数据采用Kruskal-Wallis检测,两组间比较采用Nemenyi检测,计数资料采用卡方检验,采用Logistic回归分析,联合检测的模型根据样本的ROC分析和线下面积(AUC)建立,用于评估诊断的敏感性和特异性,P<0.05为有统计学意义。
结 果
1 单一血清肿瘤标志物比较
除FER以外,各组间血清GP73、AFP-L3(%)、GPC3、DCP、CA19-9和CEA水平差异有统计学意义(P<0.01),其中A组的水平明显高于其他两组(P<0.01),且B组的各种肿瘤标志物水平显著高于C组(P<0.05)(见表1)。

表1 三组GP73、AFP-L3(%)、GPC3、DCP、CA19-9、FER和CEA血清水平
2 单一或联合肿瘤标志物诊断结果
采用ROC曲线分析单一或联合肿瘤标志物的诊断价值(图1、表2)。肿瘤标志物GP73、AFP-L3 (%)、GPC3、DCP、CA19-9、FER和CEA的临界值分别设定为75.2μg/L、15.1%、30.1μg/L、40.0μg/L、67.7 U/mL、277.3μg/L和2.8μg/L。
A组的GP73、AFP-L3(%)、GPC3、DCP、CA19-9、FER和CEA的阳性率高于B组和C组(P<0.01)(见表3),各单项检测中,GP73的灵敏度、准确度以及ROC曲线面积最大,分别为72.0%、86.7%和0.826,GPC3的检测特异性最高为98.0%。结合7种肿瘤标志物检测的临床敏感性、特异性、准确性和ROC曲线面积分别为82.0%、95.0%、90.1%和0.884(见表2和4)。

表2 单一或联合肿瘤标志物原发性肝细胞癌患者 ROC分析
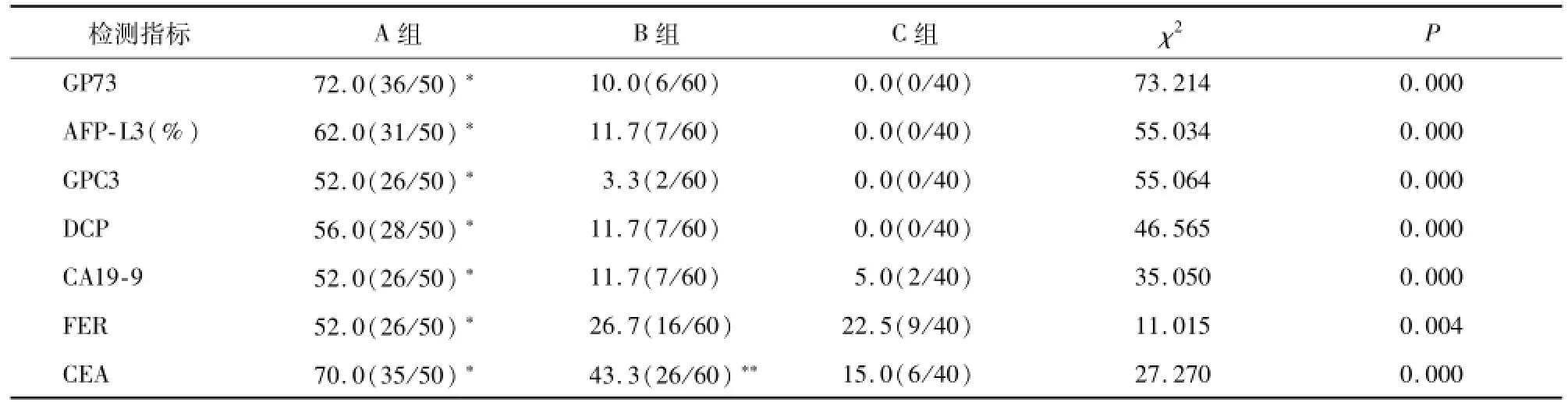
表3 各组间GP73、AFP-L3(%)、GPC3、DCP、CA19-9、FER和CEA阳性率比较

表4 单一或联合GP73、AFP-L3(%)、GPC3、DCP、CA19-9、FER和CEA作为原发性肝细胞癌患者临床检查价值比较
3 原发性肝细胞癌患者单一和联合肿瘤标志物诊断验证结果
结果表明单一和联合检测各肿瘤标志物的样本值与验证值一致(见表5)。

表5 原发性肝细胞癌患者单一和联合GP73、AFP-L3(%)、GPC3、DCP、CA19-9、FER和CEA诊断验证结果
讨 论
临床上早期诊断对于原发性肝细胞癌的治疗十分重要。AFP作为该疾病的常用血清肿瘤标志物在灵敏性和特异性方面不尽人意。特别是对于肿瘤病灶较小的原发性肝细胞癌患者,其血清AFP的增加不明显,对于肿瘤直径大于3cm和小于3cm的原发性肝细胞癌患者的临床敏感性分别为52%和25%[3-4]。总之,联合采用多种肿瘤标志物进行临床检测,其诊断结果更为准确。因此,本研究采用新的肿瘤标志物并将其联合,评价其对于原发性肝细胞癌患者临床诊断价值。
最近几年,研究发现GP73、AFP-L3、GPC3和DCP具备作为原发性肝细胞癌早期诊断的肿瘤标志物潜力[10]。GP73是一种具有400个氨基酸残基的穿膜高尔基体糖蛋白[12]。尽管文献报道肝炎和脂肪肝患者体内GP73的水平远低于原发性肝细胞癌患者,多个学者文献指出GP73是原发性肝细胞癌最具潜力的几个肿瘤标志物之一[13-15]。然而,与AFP相比,在原发性肝细胞癌诊断方面GP73并未表现出更多的优势[16]。本研究结果表明,原发性肝细胞癌患者的GP73水平和阳性率显著高于其他疾病患者和健康人群。此外,单独采用GP73进行疾病诊断的AUC值为0.826,其敏感性和特异性高于其他几种单一肿瘤标志物检测结果。这些结果表明,血清GP73在原发性肝细胞癌患者诊断中具有十分重要的意义,且在作为AFP低水平原发性肝细胞癌和/或病灶较小的肝癌患者辅助诊断方面具有潜在价值。
AFP-L3是AFP的一种亚型,并且其所占总AFP的比例已经被用于原发性肝细胞癌患者的诊断,一些研究表明,原发性肝细胞癌患者血清AFP-L3含量远高于其他慢性肝脏疾病患者,其用于诊断原发性肝细胞癌的敏感性和特异性分别为 72.3%和97.2%[9]。另一些研究表明,AFP-L3与肝脏疾病的进展、肿瘤的分化程度以及肿瘤的恶性测定密切相关[7,17]。本研究表明,原发性肝细胞癌组患者AFPL3(%)水平和阳性率明显高于其他两组,具有较高的敏感性和特异性,其AUC值为0.816。因此,对于原发性肝细胞癌患者的诊断,AFP-L3是一种比 AFP更具有潜力的肿瘤标志物,特别是对于AFP含量较低或肿瘤病灶较小的原发性肝细胞癌。
此外,我们研究发现,原发性肝细胞癌组患者的DCP和GPC3的含量和阳性率显著高于其他两组,表明这两个指标在该疾病的临床诊断方面有重要的指示作用。但是,这两种肿瘤标志物检测的敏感性仅分别为56%和52%,低于AFP。目前,对于采用DCP和GPC3作为原发性肝细胞癌患者的诊断指标仍具有争议。有报道称DCP作为原发性肝细胞癌患者的肿瘤标志物检测的敏感性高达87%[18],特别适用于患者疾病肝内转移及预后评价。GPC3在原发性肝细胞癌患者体内具有较高的特异性和高表达率(80%)[19],然而在良性肝脏疾病患者体内则相反。CA19-9是消化道系统恶性肿瘤诊断的常用血清肿瘤标志物,然而其在原发性肝细胞癌患者疾病诊断中的特异性较差[20]。单一检测CEA或FER对于原发性肝细胞癌患者疾病的诊断都具有十分重要的临床意义,但是这两种标志物的特异性均较低。
由于上述肿瘤标志物在单独进行原发性肝细胞癌疾病诊断过程中存在灵敏性或者特异性的限制,因此需要开展多种肿瘤标志物的联合检测。正如本研究所设想的,通过联合检测7种肿瘤标志物,其灵敏性、特异性、准确率以及AUC高达82.0%、95.0%、90.1%和0.884。虽然7种标志物联合检测的特异性并不是最高,但是已经满足临床检查需要,并且诊断结果也通过交叉验证。本研究采用的临床样本容量有限,想要得出更多更加确切的结论还需要更多的临床数据,对敏感性和特异性进行校正。
[1]Bosetti C,Levi F,Boffetta P,et al.Trends in mortality from hepatocellular carcinoma in Europe,1980-2004.Hepatology,2008,48(1):137-145.
[2]Chong R J,Abdullah M S,Hossain M M,et al.Rising incidence of primary liver cancer in Brunei Darussalam.Asian Pac J Cancer Prev,2013,14(6):3473-3477.
[3]Peng S Y,Chen W J,Lai P L,et al.High alpha-fetoprotein level correlates with high stage,early recurrence and poor prognosis of hepatocellular carcinoma:significance of hepatitis virus infection,age,p53 and beta-catenin mutations.Int J Cancer,2004,112(1):44-50.
[4]Saffroy R,Pham P,Reffas M,et al.New perspectives and strategy research biomarkers for hepatocellular carcinoma.Clin Chem Lab Med,2007,45(9):1169-1179.
[5]Gomaa A I,Khan S A,Leen E L,et al.Diagnosis of hepatocellular carcinoma.World J Gastroenterol,2009,15(11):1301-1314.
[6]Hu B,Tian X,Sun J,et al.Evaluation of individual and combined applications of serum biomarkers for diagnosis of hepatocellular carcinoma:A meta-analysis.Int J Mol Sci,2013,14(12):23559-23580.
[7]Block T M,Comunale M A,Lowman M,et al.Use of targeted glycoproteomics to identify serum glycoproteins that correlate with liver cancer in woodchucks and human.Proc Natl Acad Sci USA,2005,102(3):779-784.
[8]Cao F F,Yu S,Jiang Z Y,et al.Diagnostic accuracy of Golgi protein 73 in primary hepatic carcinoma using ELISA:A systematic review and meta-analysis.Clin Lab,2014,60(4):587-597.
[9]Wang Y Z,Luo L B,Wu G X,et al.Clinical significance of AFP-L3 variants determined by micro centrifugal column.Chinese J Exp Clin Virol,2007,21(2):135-137.
[10]Wang N Y,Wang C,Li W,et al.Prognostic value of serum AFP,AFP-L3,and GP73 in monitoring short-term treatment response and recurrenceofhepatocellularcarcinomaafterradiofrequency ablation.Asian Pac J Cancer Prev,2014,15(4):1539-1544.
[11]Bertino G,Ardiri A M,Calvagno G S,et al.Prognostic and diagnostic value of des-γ-carboxy prothrombin in liver cancer.Drug News Perspect,2010,23(8):498-508.
[12]Kladney R D,Bulla G A,Guo L,et al.GP73,a novel Golgi-localized protein upregulated by viral infection.Gene,2000,249(1-2):53-65.
[13]Wei H S,Kang Y F,Hao X H,et al.Serum GP73 were increased in patients with fatty liver disease.Chinese J Exp Clin Virol,2013,27 (4):244-246.
[14]Hu L,Yao W,Wang F,et al.GP73 is upregulated by hepatitis C virus(HCV)infection and enhances HCV secretion.PLoS One,2014,9(3):e90553.
[15]Morota K,Nakagawa M,Sekiya R,et al.A comparative evaluation of Golgiprotein-73,fucosylatedhemopexin,α-fetoprotein,and PIVKA-II in the serum of patients with chronic hepatitis,cirrhosis,and hepatocellular carcinoma.Clin Chem Lab Med,2011,49(4):711-718.
[16]Shan S G,Gao Y T,Xu Y J,et al.Gradually increased Golgi protein 73 expression in the progression of benign liver diseases to precancerous lesions and hepatocellular carcinoma correlates with prognosis of patients.Hepatol Res,2013,43(11):1199-1210.
[17]Kinoshita Y,Tajiri T,Souzaki R,et al.Diagnostic value of lectin reactive alpha-fetoproteinforneoinfantilehepatictumorsand malignant germ cell tumors:preliminary study.J Pediatr Hematol Oncol,2008,30(6):447-450.
[18]Durazo F A,BlattLM,CoreyWG,etal.Des-gammacarboxyprothrombin,alpha-fetoprotein and AFP-L3 in patients with chronichepatitis,cirrhosisandhepatocellularcarcinoma.J Gastroenterol Hepatol,2008,23(10):1541-1548.
[19]Nassar A,Cohen C,Siddiqui M T.Utility of glypican-3 and survivin indifferentiatinghepatocellularcarcinomafrombenignand preneoplastic hepatic lesions and metastatic carcinomas in liver fineneedle aspirationbiopsies.DiagnCytopathol,2009,37(9):629-635.
[20]Yamashiki N,Sugawara Y,Tamura S,et al.Diagnostic accuracy ofα -fetoprotein anddes-γ-carboxyprothrombininscreeningfor hepatocellular carcinoma in liver transplant candidates.Hepatol Res,2011,41(12):1199-1207.
(潘子昂编辑)
Significance of Combined Tests of Serum Golgi Glycoprotein 73 and Other Biomarkers in Diagnosis of Small Primary Hepatocellular Carcinoma
LI Hui,HUANG Xiang-lei,LIU Yan
(Clinical Lab Xuzhou Central Hospital,Xuzhou 221009,China)
Objective The most commonly used biomarker AFP is negative in 80%patients with small tumor in the early stage of primary hepatocellular carcinoma(PHC).To investigate the significance of combined tests of serum golgi glycoprotein 73(GP73),lens culinarisagglutininreactive alpha-fetoprotein(AFP-L3),glypican 3 (GPC3),des-gamma-carboxyprothrombin(DCP),CA19-9,ferritin(FER)and carcinoembryonic antigen(CEA)in diagnosis of small PHC with negative AFP.Methods A total of 50 cases of small PHC,60 cases of non-PHC digestive system disorders and 40 cases of healthy controls were collected.Serum GP73,GPC3 and DCP were analyzed by enzyme-1inked immunosorbent assay(ELISA).AFP-L3 was separated by microspincolumn;the levels of CA19-9,FER,CEA,AFP-L3andtotalAFPwerequantifiedbyelectrochemiluminescence immunoassays;percentage of AFP-L3 to total AFP was calculated.Results Levels of all of these biomarkers except FER were significantly different among three groups(P<0.01).Positive detection rates of seven biomarkers in PHC were higher than other groups(P<0.01).In individual detection,the highest sensitivity,accuracy rate and area under ROC curve were 72.0%,86.7%and 0.826 by GP73.The biomarker with the highest specificity was GPC3,98.0%.In combined detection with these seven biomarkers,the sensitivity,specificity,accuracy rate and area under ROC curve were 82.0%,95.0%,90.1%and 0.884.Conclusion GP73 and AFP-L3 are the better biomarkers to aid the diagnosis of small PHC with negative AFP.The combined detection of biomarkers might improvethe accuracy in diagnosis of small primary hepatocellular carcinoma.
Primary hepatocellular carcinoma; Biomarkers; Combined detection; Diagnosis
